博文
共价RNA复合物工程的新化学
||
共价RNA复合物工程的新化学
诸平
据奥地利因斯布鲁克大学(University of Innsbruck)网站2025年1月7日报道,共价RNA复合物工程的新化学(New chemistry for the engineering of covalent RNA complexes)。
因斯布鲁克大学和因斯布鲁克医科大学的研究人员合作,已经开发出一种新的方法来共价标记细胞中的RNA。在《自然化学生物学》(Nature Chemical Biology)杂志上,他们展示了如何使用它来绘制细胞中的RNA运动。原文详见:Raphael Bereiter, Laurin Flemmich, Kamila Nykiel, Sarah Heel, Stephan Geley, Malou Hanisch, Clemens Eichler, Kathrin Breuker, Alexandra Lusser, Ronald Micura. Engineering covalent small molecule-RNA complexes in living cells. Nature Chemical Biology, 2025. DOI: 10.1038/s41589-024-01801-3. Published: 06 January 2025. https://www.nature.com/articles/s41589-024-01801-3
参与此项研究的有来自奥地利因斯布鲁克大学有机化学研究所和分子生物科学中心{University of Innsbruck, Institute of Organic Chemistry and Center for Molecular Biosciences (CMBI), Innsbruck, Austria}、奥地利因斯布鲁克医科大学生物中心分子生物学研究所(Institute of Molecular Biology, Biocenter, Medical University of Innsbruck, Innsbruck, Austria)以及奥地利因斯布鲁克医科大学生物中心病理生理学研究所(Institute of Pathophysiology, Biocenter, Medical University of Innsbruck, Innsbruck, Austria)的研究人员。
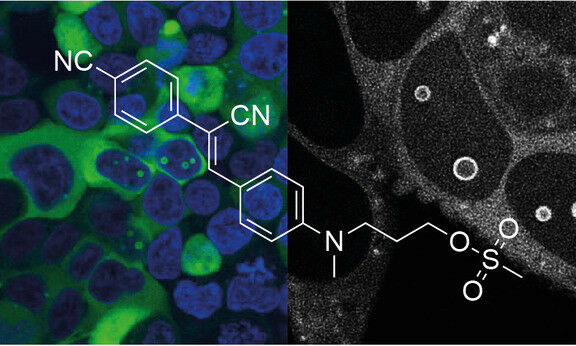
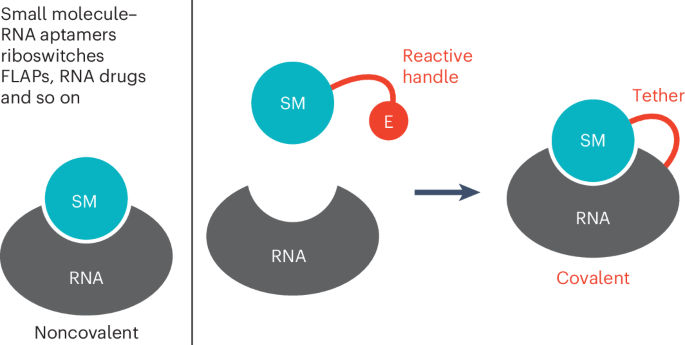
RNA在活细胞中的特异性标记提出了许多挑战。在《自然化学生物学》(Nature Chemical Biology)杂志上,来自因斯布鲁克大学和因斯布鲁克医科大学的研究人员,描述了一种结构导向的方法来形成共价RNA配体复合物(RNA-ligand complexes)。关键是用一个反应性“手柄”对原始配体进行修饰,使其能够与RNA结合位点的核碱基(nucleobase)发生反应。这首先在体外和体内用RNA核糖开关(RNA riboswitch)的例子得到证明。
第一个共价“荧光发光RNA适配体”(covalent "fluorescent light-up RNA aptamer" 简称coFLAP)突出了该方法的多功能性。该系统在活细胞中成像时即使在洗涤后也能保持其强烈的荧光,可用于高分辨率显微镜,特别适合用于光漂白后荧光恢复(fluorescence recovery after photobleaching简称FRAP)监测细胞内RNA动力学。
来自因斯布鲁克大学有机化学系和分子生物科学中心{Department of Organic Chemistry and the Center for Molecular Biosciences Innsbruck (CMBI) at the University of Innsbruck}的化学家罗纳德·米库拉(Ronald Micura)解释说:“此外,我们能够开发出一种具有生物正交化学(bioorthogonal chemistry)第二个手柄的荧光团(fluorophore),它可以简单地拉下共价结合的靶RNA(通过荧光光谱可追踪)。”最后,我们已经证明了这种策略对于开发与RNA靶标共价结合的潜在药物先导结构的适用性。
合作是成功的关键(Joint success)
研究成功的一个关键在于愿意用互补的方法克服看似不可逾越的实验障碍。来自因斯布鲁克大学和因斯布鲁克医科大学的4个工作组,共同设在化学和生物医学中心(Center for Chemistry and Biomedicine),为将荧光团和RNA的化学合成(Ronald Micura领导的团队)、质谱测序(Kathrin Breuker领导的团队)、关键的体内应用(Alexandra Lusser领导的团队)以及最后必要的高分辨率显微镜分析结合在一起做出了决定性的贡献。
来自因斯布鲁克医科大学生物中心分子生物学研究所(Institute of Molecular Biology am Biocenter at the Medical Universityt Innsbruck)的亚历山德拉·卢塞尔(Alexandra Lusser)说:“我们在一个联合研究中心的合作中受益匪浅,在那里我们可以在工作组之间交换想法,而不考虑机构的隶属关系,并迅速尝试新的方法。”
本研究得到了奥地利科学基金会{Austrian Science Fund FWF (grant nos. P31691 (10.55776/P31691), F8011-B (10.55776/F80), F8009-B (10.55776/F80), P33936 (10.55776/P33936), P36011 (10.55776/P36011)}、奥地利研究促进机构{Austrian Research Promotion Agency FFG (grant no. West Austrian Bio NMR 858017)}的资助。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
Covalent labeling of RNA in living cells poses many challenges. Here we describe a structure-guided approach to engineer covalent RNA aptamer–ligand complexes. The key is to modify the cognate ligand with an electrophilic handle that allows it to react with a guanine at the RNA binding site. We illustrate this for the preQ1-I riboswitch, in vitro and in vivo. Further, we demonstrate the versatility of the approach with a covalent fluorescent light-up aptamer. The coPepper system maintains strong fluorescence in live-cell imaging even after washing, can be used for super-resolution microscopy and, most notably, is uniquely suited for fluorescence recovery after photobleaching to monitor intracellular RNA dynamics. In addition, we have generated a Pepper ligand with a second handle for bioorthogonal chemistry to allow easily traceable pull-down of the covalently linked target RNA. Finally, we provide evidence for the suitability of this tethering strategy for drug targeting.
https://blog.sciencenet.cn/blog-212210-1467795.html
上一篇:睡眠革命:磁脉冲如何治疗失眠
下一篇:甜的危险:含糖饮料如何在全球范围内引发数百万新的糖尿病和心脏病病例