博文
小鱼能治癌吗?斑马鱼研究揭示了新的曙光  精选
精选
||
小鱼能治癌吗?斑马鱼研究揭示了新的曙光
诸平
因为2024年7月16-19日宝鸡(秦岭)连降暴雨,使宝鸡文理学院石鼓校区遭遇了建院40余年来罕见的水灾,雨水经教育西路北口涌入校园,导致网络中断十余日,经过积极抢修,终于在近日恢复正常,笔者才有条件又继续开始介绍一些新科技信息。在此衷心感谢假期为此而努力工作的抢修工作者,你们辛苦了,谢谢!
据葡萄牙尚帕利莫未知中心(Champalimaud Centre For The Unknown)2024年8月8日提供的消息,斑马鱼研究为小鱼治癌揭示了新的曙光(Can Tiny Fish Cure Cancer? Zebrafish Research Sheds New Light)。
斑马鱼化身(Zebrafish avatars)为膀胱癌治疗提供了新的线索,揭示了由卡介苗(BCG vaccine)触发的巨噬细胞如何摧毁癌细胞。这种创新的方法为个性化癌症治疗提供了一种更快的方法。
利用由丽塔·菲奥尔(Rita Fior)领导的尚帕利莫基金会(Champalimaud Foundation简称CF, Av. Brasilia, Lisbon, Portugal)癌症发展和先天免疫逃避实验室{Cancer Development and Innate Immune Evasion lab at the Champalimaud Foundation (CF)}开发的斑马鱼化身动物模型,该实验室的前博士生梅娜· 费尔南达·马丁内斯- 洛佩斯(Mayra Fernanda Martínez-López,)及其同事参与研究了卡介苗对膀胱癌细胞作用的最初步骤。他们的研究结果于2024年8月8日已经在《疾病模型与机制》(Disease Models and Mechanisms)杂志网站在线发表——Mayra Fernanda Martínez-López, Cátia Rebelo de Almeida, Márcia Fontes, Raquel Valente Mendes, Stefan H E Kaufmann, Rita Fior. Macrophages directly kill bladder cancer cells through TNF signaling as an early response to BCG therapy. Disease Models & Mechanisms, 2024, 17(8): dmm050693. DOI: 10.1242/dmm.050693. Epub 2024 Aug 8. https://pubmed.ncbi.nlm.nih.gov/39114912/
梅娜· 费尔南达·马丁内斯- 洛佩斯是癌症发展和先天免疫逃避实验室的前博士生,现在在厄瓜多尔基多的美洲大学工作{Cancer Research Group (CRG), Faculty of Medicine, Universidad de las Américas, Quito, Ecuador}。参与此项研究的还有来自德国柏林的马克斯·普朗克感染生物学研究所(Max Planck Institute for Infection Biology, Berlin, Germany)、德国哥廷根的马克斯·普朗克多学科科学研究所(Max Planck Institute for Multidisciplinary Sciences, Göttingen, Germany)以及美国德州农工大学(Texas A&M University, College Station, TX, USA)的研究人员。
研究结果表明,巨噬细胞是感染后激活的第一道免疫细胞,它会诱导癌细胞自杀,然后迅速吞噬死亡的癌细胞。
斑马鱼化身(zebrafish Avatars简称zAvatars)仍处于实验阶段,但非常有前景,其背后的想法相当简单:从癌症患者身上提取肿瘤细胞,并将其注射到斑马鱼胚胎中。然后,肿瘤将在胚胎内生长,有效地将它们变成特定癌症患者的化身。然后,可以在zAvatars上对该患者的各种治疗方案进行测试,只需几天,而不是在老鼠身上进行传统测试所需的几周甚至几个月,就可以确定对该患者的最佳治疗。该测试是用结直肠癌患者的样本开发和研究的(developed and studied)。
癌症免疫治疗的历史见解(Historical Insights on Cancer Immunotherapy)
上述研究论文的通讯作者丽塔·菲奥尔有了一个应用该模型的新想法。梅娜· 费尔南达·马丁内斯- 洛佩斯回忆说:“当我2019年作为博士生加入到丽塔·菲奥尔的实验室时,我们正在讨论我可以承担的几个项目,丽塔·菲奥尔提到卡介苗正在用于膀胱癌患者。”梅娜· 费尔南达·马丁内斯- 洛佩斯还记得小时候在南美打过卡介苗,后来就开始研究这种疾病。“但这是我第一次听说结核病疫苗(TB vaccine)可以作为一种癌症治疗方法,”她指出。这立刻引起了她的注意。
卡介苗在20世纪20年代首次用于结核病,然后在1976年左右开始作为第一个癌症免疫疗法(cancer immunotherapy)使用。但在此之前的几十年,即19世纪90年代,纽约医院(New York Hospital)即现为威尔·康奈尔医学中心(Weill Cornell Medical Center)的外科医生威廉·科利(William Coley)已经测试了一种不同细菌的混合物,称为“科利毒素(Coley’s toxins)”,作为一种癌症免疫疗法!
威廉·科利注意到,在医院里,有几个几乎没有希望的癌症患者在切除肿瘤的手术后感染了细菌,他们的癌症似乎奇迹般地得到了缓解(当时手术的无菌条件并不理想)。他的想法是,这样的恢复,远非奇迹,实际上是由患者对感染的免疫反应引起的。
威廉·科利开始尝试在一些肉瘤患者中诱导细菌感染,并能够重现一些癌症缓解。然而,当时他的方法还远未被证实和安全,同时,其他治疗方法也在发展,比如放疗,所以他的研究没有继续下去。但近年来,免疫治疗领域获得了巨大的动力,带来了新的、更科学的、更强大的方法来增强免疫系统,以对抗癌症。更多信息详见相关的研究报道(https://fchampalimaud.org/news/check-up-19-cancer-immunotherapy)。
梅娜· 费尔南达·马丁内斯- 洛佩斯说:“卡介苗免疫疗法仍然是相当经验性的。然而,由于它对许多人都有效,它已经成为一种黄金标准治疗方法。令人惊讶的是,这是一种非常有效的免疫疗法,即使与许多正在开发的奇特免疫疗法相比也是如此。”
巨噬细胞在癌症治疗中的作用(The Role of Macrophages in Cancer Treatment)
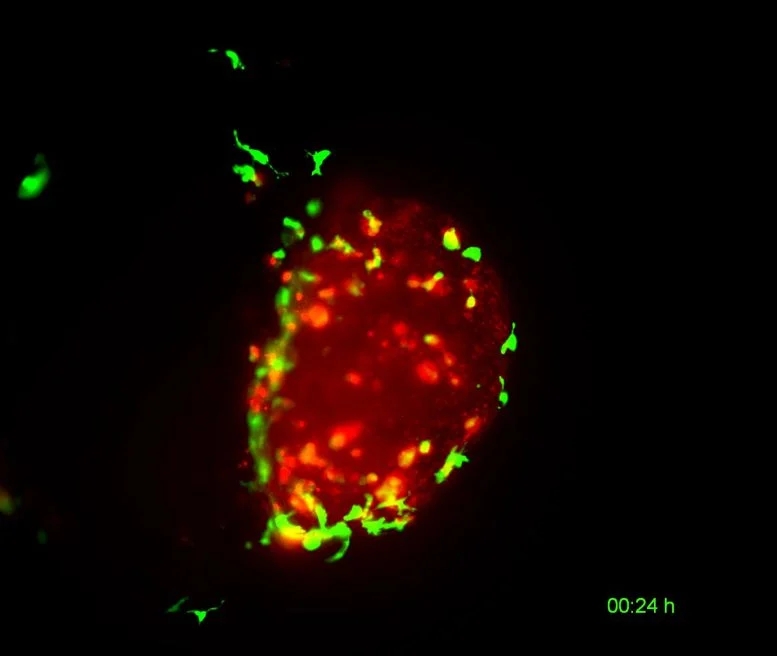
治疗方法包括将卡介苗直接注入膀胱。如果治疗有效,所谓的非肌肉侵袭性(早期)膀胱癌{“non-muscle-invasive” (early-stage) bladder cancer}患者的15年生存率为60%~70%。然而,在30%~50%的病例中,膀胱肿瘤对卡介苗治疗无反应。在这种情况下,整个膀胱必须被切除。到目前为止,卡介苗作为免疫调节剂清除膀胱肿瘤的方式尚不完全清楚。但是,梅娜· 费尔南达·马丁内斯- 洛佩斯提供的人膀胱肿瘤(红色)被斑马鱼巨噬细胞(绿色)清除的视频,详见:Human bladder tumor (red) being cleared by zebrafish macrophages (green). Credit: Mayra Martinez-López
免疫反应的微观观察(Microscopic Insights into Immune Response)
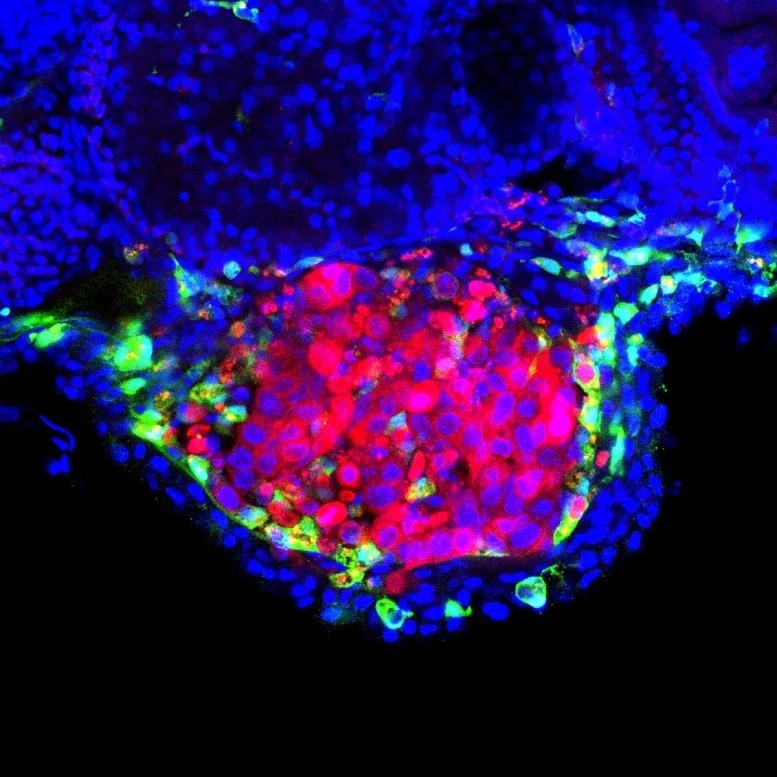
研究小组的想法是,免疫细胞,特别是居住在膀胱中的巨噬细胞参与了这一过程。他们能够确定将卡介苗注射到zAvatar体内后会发生什么。为了做到这一点,他们使用了所谓的光片显微镜(light sheet microscopy)和共聚焦成像(confocal imaging),这使他们能够在单细胞分辨率和实时看到巨噬细胞与肿瘤细胞的相互作用。
他们获得的疫苗触发过程的彩色影像(其中巨噬细胞和癌细胞用不同的荧光染料标记)显示,注射卡介苗后,巨噬细胞被大量招募到肿瘤部位,通过细胞自杀(凋亡)过程直接杀死人膀胱癌细胞,这一过程依赖于巨噬细胞分泌的一种叫做肿瘤坏死因子(tumor necrosis factor简称TNF)的物质,这种物质是免疫系统的一种有效的信号分子。
他们进一步表明,当zAvatar中的巨噬细胞被耗尽时,卡介苗的抗肿瘤作用被完全阻断,从而表明巨噬细胞确实对初始的抗肿瘤反应至关重要。
丽塔·菲奥尔说:“梅娜· 费尔南达·马丁内斯- 洛佩斯所看到的是,如果注射卡介苗,进入肿瘤的巨噬细胞数量会显著增加。”在卡介苗的存在下,免疫细胞的颜色从红色变为黄色,这意味着它们表达了肿瘤坏死因子(TNF)。
梅娜· 费尔南达·马丁内斯- 洛佩斯总结道,“我们不仅揭示了疫苗抗肿瘤作用的第一步所涉及的机制,还证明了斑马鱼化身模型是肿瘤药物发现的强大临床前工具。”
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
The Bacillus Calmette-Guérin (BCG) vaccine is the oldest cancer immunotherapeutic agent in use. Despite its effectiveness, its initial mechanisms of action remain largely unknown. Here, we elucidate the earliest cellular mechanisms involved in BCG-induced tumor clearance. We developed a fast preclinical in vivo assay to visualize in real time and at single-cell resolution the initial interactions among bladder cancer cells, BCG and innate immunity using the zebrafish xenograft model. We show that BCG induced the recruitment and polarization of macrophages towards a pro-inflammatory phenotype, accompanied by induction of the inflammatory cytokines tnfa, il1b and il6 in the tumor microenvironment. Macrophages directly induced apoptosis of human cancer cells through zebrafish TNF signaling. Macrophages were crucial for this response as their depletion completely abrogated the BCG-induced phenotype. Contrary to the general concept that macrophage anti-tumoral activities mostly rely on stimulating an effective adaptive response, we demonstrate that macrophages alone can induce tumor apoptosis and clearance. Thus, our results revealed an additional step to the BCG-induced tumor immunity model, while providing proof-of-concept experiments demonstrating the potential of this unique model to test innate immunomodulators.
https://blog.sciencenet.cn/blog-212210-1445821.html
上一篇:生活方式的改变有助于降低患痴呆症的风险
下一篇:长寿突破:新疗法延长寿命,增强身体机能