博文
癌症研究:DNA修复机制进一步阐明  精选
精选
||
癌症研究:DNA修复机制进一步阐明
诸平
据德国维尔茨堡大学(University of Würzburg / Julius-Maximilians-Universität Würzburg简称JMU, Würzburg, Germany)2024年5月28日提供的消息,该校研究人员对于癌症研究,进一步阐明了DNA的修复机制(Cancer Research: DNA Repair Mechanism Further Elucidated)。相关研究结果于2024年5月28日已经在《自然·结构与分子生物学》(Nature Structural and Molecular Biology)杂志网站发表——Jochen Kuper, Tamsanqa Hove, Sarah Maidl, Hermann Neitz, Florian Sauer, Maximilian Kempf, Till Schroeder, Elke Greiter, Claudia Höbartner, Caroline Kisker. XPD stalled on crosslinked DNA provides insight into damage verification. Nature Structural and Molecular Biology, 2024. DOI: 10.1038/s41594-024-01323-5. Published online: 28 May 2024. https://www.nature.com/articles/s41594-024-01323-5
由卡罗琳·基斯克(Caroline Kisker)和克劳迪娅·霍巴特内尔(Claudia Höbartner)领导的维尔茨堡大学的研究人员发现了XPD蛋白是如何检测严重的DNA损伤并控制其修复的。
XPD蛋白是我们身体自身DNA修复团队的核心组成部分,被称为核苷酸切除修复(nucleotide excision repair简称NER)。像嗅探犬一样,NER检测出受损的标记区域,追踪受损的DNA,并招募其他修复蛋白来切除和替换有缺陷的部分。例如,在健康人群中,XPD通过检测和修复紫外线损伤的DNA来预防皮肤癌的发展。
德国维尔茨堡大学(JMU)的一组研究人员首次准确地发现了XPD蛋白是如何检测和验证DNA损伤的存在的。该团队由生物化学家、维尔茨堡的鲁道夫·维尔肖中心(Rudolf Virchow Centre in Würzburg)结构生物学的主席卡罗琳·基斯克和有机化学系的化学家克劳迪娅·霍巴特内尔共同领导。
严重DNA损伤的研究(Study of Severe DNA Damage)
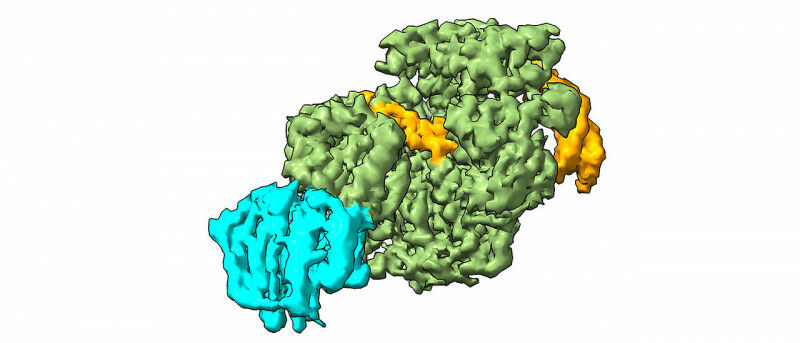
维尔茨堡大学团队关注的是XPD蛋白如何在链间交联中起作用——这是已知的最严重的DNA损伤形式之一。例如,它是由环境毒素和工业化学品引起的。卡洛琳·基斯克解释说:“在细胞分裂过程中,链间交联导致DNA被错误地复制和读取。这会导致基因损伤,从而引发癌症。”
在他们的研究中,科学家们使用冷冻电子显微镜(cryo-electron microscopy)分析了XPD如何解开DNA的双螺旋结构,以揭示链间交联的缺陷位点,并创建了一个如何检测和去除损伤的模型。卡罗琳·基斯克团队的员工约亨·库珀(Jochen Kuper)说:“我们的研究结果为治疗各种癌症的新方法提供了基础。通过特异性地削弱癌细胞中的修复机制,如NER,我们可以显著提高药物的有效性。”
在进一步的研究中,研究小组计划研究XPD如何检测各种其他类型的DNA损伤。
维尔茨堡的鲁道夫-维尔肖中心(The Rudolf-Virchow-Centre in Würzburg)
鲁道夫·维尔肖综合和转化成像中心{Rudolf Virchow Centre (RVZ) for Integrative and Translational Imaging}是一个跨学科的研究中心,专注于从亚纳米到宏观尺度的基本生命过程的可视化。作为维尔茨堡大学的中心机构,该中心目前拥有13个转化研究小组和大约100名研究人员,研究健康和疾病的分子原因。
这项工作使用了ESRF的冷冻电镜波束线CM01(cryo-EM beamline CM01)和德国研究基金会{German Research Foundation (359471283, 456578072 and 525040890)}资助的维尔茨堡大学冷冻电镜设备。本研究得到了德国研究基金会{German Research Foundation(KI 562 11-1, HO4436/4-1)}和德国癌症援助会(German Cancer Aid 70114277)的支持。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
The superfamily 2 helicase XPD is a central component of the general transcription factor II H (TFIIH), which is essential for transcription and nucleotide excision DNA repair (NER). Within these two processes, the helicase function of XPD is vital for NER but not for transcription initiation, where XPD acts only as a scaffold for other factors. Using cryo-EM, we deciphered one of the most enigmatic steps in XPD helicase action: the active separation of double-stranded DNA (dsDNA) and its stalling upon approaching a DNA interstrand cross-link, a highly toxic form of DNA damage. The structure shows how dsDNA is separated and reveals a highly unusual involvement of the Arch domain in active dsDNA separation. Combined with mutagenesis and biochemical analyses, we identified distinct functional regions important for helicase activity. Surprisingly, those areas also affect core TFIIH translocase activity, revealing a yet unencountered function of XPD within the TFIIH scaffold. In summary, our data provide a universal basis for NER bubble formation, XPD damage verification and XPG incision.
https://blog.sciencenet.cn/blog-212210-1435994.html
上一篇:芭芭拉·约瑟夫及2024勒什青年研究奖
下一篇:挑战经典物理学:发现弹性湍流的惊人特性