博文
精准医学:癌症治疗的新时代
||
精准医学:癌症治疗的新时代
诸平

Fig. 1 Precision medicine can offer improved clinical outcomes by assessing the unique characteristics of tumors, such as their likelihood of developing resistance to chemotherapy. ARTEMISDIANA
据《科学家》(The Scientist)杂志网站2023年12月15日报道,精准医学(Precision Medicine)已经成为癌症治疗的新时代(Precision Medicine: A New Era in Cancer Therapy)。精准医学帮助临床医生定制个性化治疗,解决基因突变、肿瘤微环境变化和治疗耐药性。精准医学可以通过评估肿瘤的独特特征,比如它们对化疗产生耐药性的可能性,来改善临床结果。通过总结来了解精准医学的最新科学知识。
癌症精准医疗(Precision Medicine in Cancer)
癌症治疗的精准医学(Precision medicine for cancer)包括根据个体患者的遗传和生活方式,以及肿瘤的细胞和分子特征及其微环境1来定制治疗方法。科学家和临床医生通常将精准医学称为个性化医学(personalized medicine, or individualized medicine)或靶向治疗(targeted therapy)。精准医疗是目前标准治疗如化疗和放疗(chemotherapy and radiation)的关键替代方案,这些治疗只对一小部分患者有效,而且对健康组织和癌细胞都是有毒的2。
癌症是一种异质性极强的疾病(Cancer is an extremely heterogeneous disease);有数百种不同类型的癌症,其中许多癌症根据其分子特征有亚型2。临床医生使用精准医学,通过分析驱动肿瘤发生的基因突变(genetic mutations)或肿瘤的其他分子特征,例如通过下一代测序(next generation sequencing)3,来确定哪种治疗方法对个体患者有效。
精准医疗何时用于癌症治疗?
当肿瘤对目前的标准治疗(如化疗和放疗)无效时,医生可能会在肿瘤学中使用精准医学。他们可以对肿瘤的基因组进行测序(sequence the tumor’s genome),以确定驱动肿瘤生长或导致治疗耐药性的基因突变,然后利用这些信息将肿瘤与合适的治疗相匹配。3
医生们还使用精准医学来评估一个人患癌症的风险。例如,如果一个人有已知的癌症家族史,基因组测序可以确定他们是否携带遗传突变,使他们在未来患癌症的风险很高(high risk of developing cancer)。高风险的人可以定期检查癌症的迹象,并在疾病的早期阶段进行治疗,以获得更好的预后。4
表1:肿瘤精准医学的例子,包括它们针对的生物标志物或基因以及相关的癌症类型
治疗(Treatment) | 目标(Target) | 癌症类型(Cancer Type) |
伊马替尼(Imatinib)5 | BCR—ABL1融合癌基因 (BCR—ABL1 fusion oncogene) | 慢性髓系白血病 Chronic myeloid leukemia |
PARP抑制剂 {奥拉帕尼(olaparib), 卢卡帕尼(rucaparib), 尼诺帕尼(niroparib), 他拉唑帕尼(talazoparib) } 6 | BRCA1和BRCA2突变 (BRCA1 and BRCA2 mutations) | 乳腺癌等(Breast cancer, among others) |
帕博利珠单抗(Pembrolizumab), 纳武利尤单抗(nivolumab)7 | 林奇综合征基因(种系错配修复变异){Lynch syndrome genes (germline mismatch repair variants)} | 结直肠癌和子宫内膜癌(Colorectal and endometrial cancers) |
曲妥单抗(Trastuzumab)8 | HER2/neu ERBB2 | 乳腺癌(Breast cancer) |
BRAF抑制剂(BRAF inhibitors)9 | BRAF V600E | 转移性黑色素瘤(Metastatic melanoma) |
癌症精准医疗的例子(Examples of Precision Medicine in Cancer)
针对特定癌症突变的个性化治疗(Personalized treatments for specific cancer mutations)
癌症精准医疗的第一个主要例子是慢性髓性白血病(chronic myeloid leukemia简称CML)的治疗。CML的主要驱动因素是一种被称为BCR-ABL的融合癌基因,这是染色体易位的结果。5在20世纪90年代末,科学家开发了一种名为伊马替尼(imatinib)的药物,可以抑制产生的融合蛋白,从而大大改善了临床结果(improved clinical outcomes);它现在通常是CML患者的第一线治疗,而不是化疗。9此后,研究人员发现了许多其他突变,并针对不同类型的癌症进行了靶向治疗。
癌症诊断、治疗疗效和耐药性的生物标志物(Biomarkers for cancer diagnosis, treatment efficacy, and resistance)
临床医生现在可以诊断癌症,进行分子肿瘤分析(molecular tumor profiling),评估癌症治疗效果,并使用无细胞DNA检测{cell-free DNA (cfDNA) testing}监测疾病进展和肿瘤负担,这是个性化医疗的另一种形式。10通过一种被称为液体活检(liquid biopsy)的程序,医生收集患者外周血中的循环肿瘤DNA (circulating tumor DNA简称ctDNA),并通过血液测试分析样本,从而消除了侵入性组织活检技术的需要。11
参见“无细胞DNA的基础知识和应用”(THE BASICS AND APPLICATIONS OF CELL-FREE DNA)
科学家们还在癌症治疗中使用精准医学来寻找治疗耐药性的生物标志物。例如,对化疗的内在和获得性耐药(acquired resistance to chemotherapy)在三阴性乳腺癌(triple negative breast cancer简称TNBC)患者中很常见,这是成功治疗这种疾病的主要障碍。12现在有几种生物标志物(several biomarkers)可以预测TNBC肿瘤对化疗的耐药性,帮助提供更好的治疗方案。12类似的放治(radiation therapy)耐药生物标志物正在出现。13
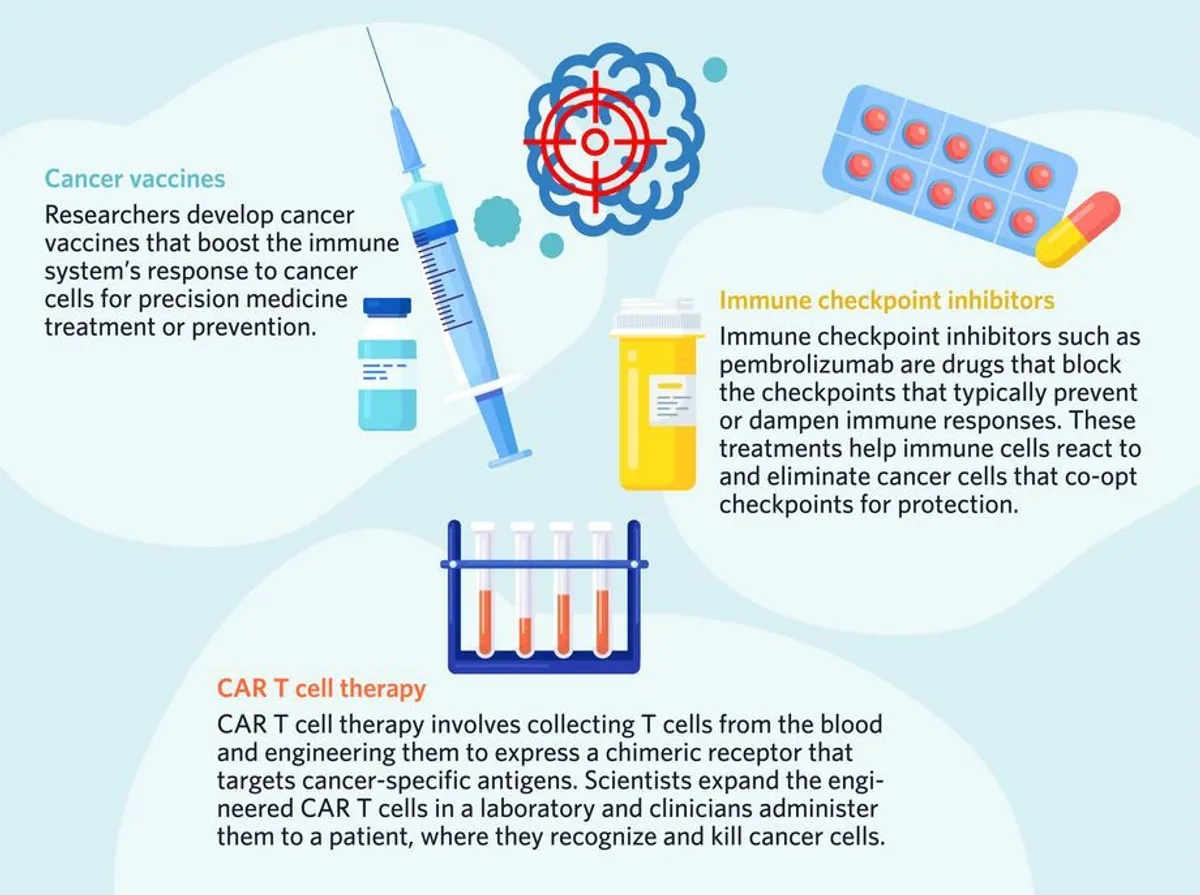
科学家们通过靶向免疫疗法,如疫苗(vaccines)、CAR - T细胞疗法(CAR T cell therapies)和免疫检查点抑制剂(immune checkpoint inhibitors),在癌症治疗中利用精准医学的力量(Fig. 2)。
癌症免疫治疗中的精准医学(Precision medicine in cancer immunotherapy)
科学家们在癌症治疗中利用精准医学力量的另一种方法是通过靶向免疫疗法(targeted immunotherapy)。嵌合抗原受体(Chimeric antigen receptor简称CAR) T细胞疗法(CAR T cell therapy)包括从患者或健康供体收集T细胞,并对其进行改造,使其表达针对不同癌细胞上表达的独特和特定抗原的受体。14这些经过改造的T细胞随后被扩增并注入病人体内,在那里它们能更有效地识别并杀死癌细胞( kill cancer cells)。14
参见“肿瘤微环境的基础知识”(THE BASICS OF THE TUMOR MICROENVIRONMENT)
其他精准医学免疫疗法包括癌症疫苗和单克隆抗体(monoclonal antibodies),如帕博利珠单抗(Pembrolizumab)。该药是一种免疫检查点抑制剂(immune checkpoint inhibitor),靶向免疫细胞表达的程序性死亡蛋白1 (programmed death protein 1简称PD-1)及其配体,某些癌细胞表达的程序性死亡配体1 (programmed death ligand 1简称PD-L1)。癌细胞经常劫持PD-1/PD-L1通路(hijack the PD-1/PD-L1 pathway)以逃避免疫系统;通过上调其表面PD-L1的表达,癌细胞触发肿瘤微环境内的免疫衰竭。帕博利珠单抗(Pembrolizumab)阻断PD-1以预防这种情况。16临床医生还使用PD-1本身作为精准医学中的生物标志物(PD-1 itself as a biomarker),以识别将从这种治疗中受益的患者。15
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
References
1. Habeeb NW-A, et al. The use of targeted therapies for precision medicine in oncology. Clin Chem. 2016;62(12):1556-1564.
2. Krzyszczyk P, et al. The growing role of precision and personalized medicine for cancer treatment. Technology. 2018;6(3-4):79-100.
3. Morash M, et al. The role of next-generation sequencing in precision medicine: a review of outcomes in oncology. J Pers Med. 2018;8(3).
4. Yang J, et al. An overview of the use of precision population medicine in cancer care: first of a series. Cureus. 2023;15(4):e37889.
5. Iqbal N, Iqbal N. Imatinib: a breakthrough of targeted therapy in cancer. Chemother Res Pract. 2014;2014:357027.
6. Imyanitov EN. Cytotoxic and targeted therapy for BRCA1/2-driven cancers. Hered Cancer Clin Pract. 2021;19(1):36.
7. Yurgelun MB, Hampel H. Recent advances in Lynch syndrome: diagnosis, treatment, and cancer prevention. Am Soc Clin Oncol Educ B. 2018;(38):101-109.
8. Wang J, Xu B. Targeted therapeutic options and future perspectives for HER2-positive breast cancer. Signal Transduct Target Ther. 2019;4(1):34.
9. Schwartzberg L, et al. Precision oncology: who, how, what, when, and when not? Am Soc Clin Oncol Educ B. 2017;(37):160-169.
10. Wan JCM, et al. Liquid biopsies come of age: towards implementation of circulating tumour DNA. Nat Rev Cancer. 2017;17(4):223-238.
11. Mouliere F, et al. Multi-marker analysis of circulating cell-free DNA toward personalized medicine for colorectal cancer. Mol Oncol. 2014;8(5):927-941.
12. Ferrari P, et al. Molecular mechanisms, biomarkers and emerging therapies for chemotherapy resistant TNBC. Int J Mol Sci. 2022;23(3).
13. Baumann M, et al. Radiation oncology in the era of precision medicine. Nat Rev Cancer. 2016;16(4):234-249.
14. Chen L, et al. CAR-T cell therapy for lung cancer: Potential and perspective. Thorac cancer. 2022;13(7):889-899.
15. Liu X, Cho WC. Precision medicine in immune checkpoint blockade therapy for non-small cell lung cancer. Clin Transl Med. 2017;6(1):7.
16. Collins LHC, Moutasim KA. Current concepts in PD-L1 testing in head and neck squamous cell carcinoma: overview, developments and challenges. Diagnostic Histopathol. 2023;29(4):225-231.
https://blog.sciencenet.cn/blog-212210-1414365.html
上一篇:重新定义健康:饮食、糖尿病和心理健康之间的惊人联系
下一篇:乌得勒支化学家发现了设计更可持续的分子催化剂的机制