博文
热力学常见三大类可逆过程解析
|
本文拟结合具体实例解析热力学常见三大类可逆过程,供参考.
理想气体恒温可逆膨胀
理想气体恒温可逆膨胀(或压缩)是最常见的热力学可逆过程.
[例1]. 25℃、100kPa下1摩尔氮气, 恒温可逆膨胀至氮气压强为60kPa,试解析该热力学过程.
析:恒温可逆膨胀,要求热力学过程的任意瞬间,系统压强与环境压强恒相等;即:p≡pe.
此时体积功δWT=-pe·dV=-p·dV (1)
由上可知,理想气体恒温可逆膨胀过程,要求环境压强pe随系统压强变化而变化;表明这类可逆过程是理想化热力学过程.
解:由式(1)可知,恒温条件下,
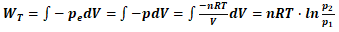 (2)
(2)
将已知条件代入式(2)可得:
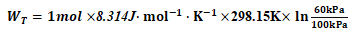
=-1266.2443J
另恒温过程,理想气体的ΔU=Q+WT=0
所以该热力学过程,Q=-WT=1266.2443J
由上式可得上述过程:ΔS=Q/T=1266.2443J/[(273.15+25)K]=4.247J/K
2.理想气体绝热可逆膨胀
理想气体绝热可逆膨胀(或压缩)也是一类常见的可逆过程.
[例2]. 25℃、100kPa下1摩尔氮气, 绝热可逆膨胀至氮气压强为60kPa,试解析该热力学过程.
析:绝热可逆膨胀,要求热力学过程的任意瞬间,系统压强与环境压强恒相等;即:p≡pe.
此时体积功δWT=-pe·dV=-p·dV (3)
由上可知,理想气体绝热可逆膨胀过程,要求环境压强pe随系统压强变化而变化;表明这类可逆过程同样是理想化热力学过程.
解:由式(3)可知,绝热条件下,
 (4)
(4)
由于存在V、T两个变量, 不易通过式(4)积分求算体积功.
对于理想气体的绝热可逆膨胀过程:
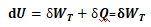 (5)
(5)
 (6)
(6)
另: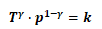 (7)
(7)
由于氮气为双原子理想气体,氮气的CV,m=5/2R,Cp,m=7/2R
式(7)中![]()
将已知数据代入式(7)可得:
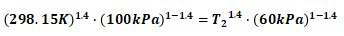 (8)
(8)
解式(8)可得:T2=257.66K
由式(6)可得:ΔU=n·CV,m·ΔT=1mol×5/2×8.314J·mol-1·K-1×(257.66K-298.15K)=-841.58J
即:ΔU=WT=-841.58J
另该过程,Q=0
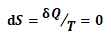 (9)
(9)
由上式可得该过程:ΔS=0
3. 建立平衡的化学反应(或相变)
建立平衡的化学反应(或相变)也是一类典型的可逆过程.
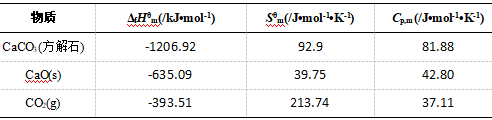
[例3]. 煅烧CaCO3(方解石)的反应为:CaCO3(方解石)=CaO(s)+CO2(g),试计算CaCO3(方解石)
的热分解温度;25℃、100kPa下相关物质的热力学性质参见如下表1[1].
表1. 25℃、100kPa下相关物质的热力学性质
解:依热力学基本原理可得298.15K时,
ΔrHθm(298.15K)=ΔfHθm(CaO,s,298.15K)+ΔfHθm(CO2,g,298.15K)-ΔfHθm(CaCO3,方解石,298.15K) (10)
ΔrSθm(298.15K)=Sθm(CaO,s,298.15K)+Sθm(CO2,g,298.15K)-Sθm(CaCO3,方解石,298.15K) (11)
将表1数据分别代入式(10)、(11)可得:
ΔrHθm(298.15K)=-635.09kJ·mol-1-393.51kJ·mol-1-(-1206.92kJ·mol-1)=178.32kJ·mol-1
ΔrSθm(298.15K)=39.75J·mol-1·K-1+213.74J·mol-1·K-1-92.9J·mol-1·K-1=160.59J·mol-1·K-1
另该反应的ΔrCp,m=Cp,m(CaO,s)+Cp,m(CO2,g)-Cp,m(CaCO3,方解石) (12)
将表1数据分别代入式(12)可得:
ΔrCp,m=42.80J·mol-1·K-1+37.11J·mol-1·K-1-81.88J·mol-1·K-1=-1.97J·mol-1·K-1
由基希霍夫公式可得:
 (13)
(13)
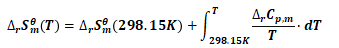 (14)
(14)
将相关数据分别代入式(13)、(14)可得:
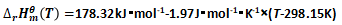 (15)
(15)
 (16)
(16)
令: (17)
(17)
将式(15)、(16)依次代入式(17),并整理可得:
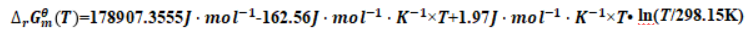
用试商法可由上式解得平衡温度: TC=1118.5K
 ;
; .
.
平衡时, (18)
(18)
4.结论
⑴建立平衡的化学反应(或相变)是真实存在的可逆过程;
⑵理想气体的恒温(或绝热)可逆过程,要求热力学过程任意瞬间系统压强与环境压强恒相等; 客观并不存
在.
参考文献
[1]Lide D R. CRC Handbook of Chemistry and Physics. 89th ed, Chemical Co, 2008,17:2688
https://blog.sciencenet.cn/blog-3474471-1402638.html
上一篇:理想气体摩尔定压热容与摩尔定容热容
下一篇:化学平衡的热力学解读