博文
“生物能”理论的主要构件(12)
||
二十三、变构调节、共价修饰与激素信号(如胰岛素、胰高血糖素)
变构调节、共价修饰与激素信号,构成了细胞代谢调控的“三位一体”精密系统。激素(如胰岛素、胰高血糖素)作为远程指令,通过触发共价修饰的信号级联来改变酶活性;而变构调节则作为局部微调,让酶能即时感受并响应细胞内的能量分子浓度。两者协同,实现了对代谢通路的时空精密控制。
为了清晰地理解这套系统的层级与运作,图16展示了从激素信号到最终代谢效应的完整调控路径:
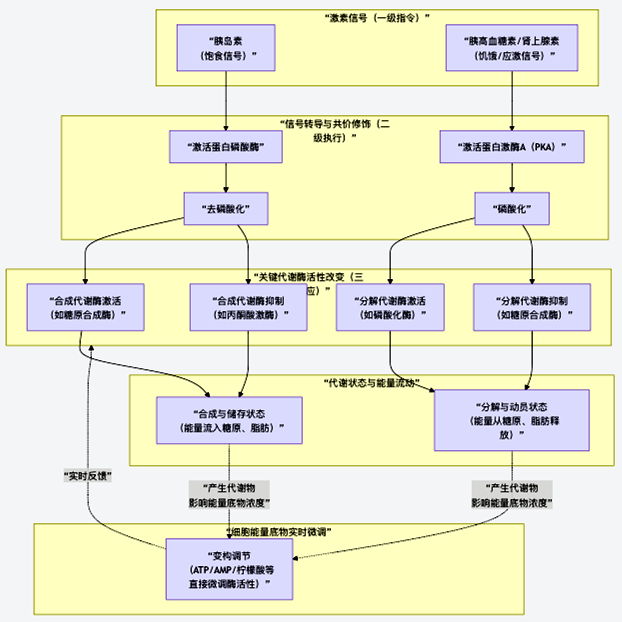
图16 从激素信号到最终代谢效应的调控路径
图16揭示了代谢调控的三个核心层级,下面我们具体解析每一层的关键。
1. 核心机制对比:变构调节 vs. 共价修饰(表15)
表15 变构调节与共价修饰的要素比较
特性 | 变构调节 | 共价修饰 |
本质 | 非共价结合引起的构象变化 | 化学基团(如磷酸基)的可逆共价添加/移除 |
速度 | 毫秒级,近乎瞬时 | 秒到分钟级,相对较慢 |
触发信号 | 代谢物浓度(ATP,AMP,柠檬酸等) | 激素信号(通过第二信使,如cAMP) |
作用范围 | 局部,针对单个酶或通路 | 全局,通过激酶/磷酸酶网络影响多个靶点 |
信息整合 | 整合多种代谢物信号(如ATP抑制,AMP激活) | 整合多种激素信号(如胰岛素与胰高血糖素拮抗) |
经典实例 | ATP抑制磷酸果糖激酶-1;AMP激活之 | 胰高血糖素通过PKA磷酸化并激活磷酸化酶 |
2. 激素信号的具体作用路径
(1)胰岛素通路:促进合成,抑制分解
胰岛素是主要的合成代谢激素,其信号通过激活蛋白磷酸酶和抑制蛋白激酶,最终实现去磷酸化为主的修饰。
激活合成:去磷酸化激活糖原合成酶(合成糖原)、乙酰辅酶A羧化酶(合成脂肪酸)。
抑制分解:去磷酸化抑制激素敏感性脂肪酶(抑制脂肪分解)。
(2)胰高血糖素/肾上腺素通路:促进分解,抑制合成
它们是主要的分解代谢激素,通过升高细胞内cAMP,激活蛋白激酶A,最终实现磷酸化为主的修饰。
激活分解:磷酸化激活磷酸化酶激酶→激活糖原磷酸化酶(分解糖原);磷酸化激活激素敏感性脂肪酶(分解脂肪)。
抑制合成:磷酸化抑制糖原合成酶、丙酮酸激酶(糖酵解关键酶)等。
3. 协同与整合:以“饥饿-饱食”循环为例(表16)
表16 “饥饿-饱食”循环的协同与整合
生理状态 | 主导激素 | 共价修饰的主导作用 | 变构调节的协同作用 |
饱食 | 胰岛素↑ | 激活糖原/脂肪合成酶;抑制分解酶。 | 血糖和ATP升高,ATP直接变构抑制糖酵解、三羧酸循环的限速酶,防止过度分解。 |
饥饿 | 胰高血糖素↑ | 激活糖原/脂肪分解酶;抑制合成酶。 | ATP下降,AMP上升,AMP直接变构激活糖酵解、脂肪酸氧化的限速酶,加速产能。 |
运动/应激 | 肾上腺素↑↑ | 快速激活肌糖原分解(磷酸化磷酸化酶),提供瞬时能量。 | 肌肉中ATP迅速消耗,AMP激增,强烈变构激活磷酸果糖激酶-1,极大加速糖酵解流量。 |
4. 在糖尿病等代谢疾病中的意义
2型糖尿病的核心病理之一,正是胰岛素信号通路受损,导致其“促进合成、抑制分解”的指令无法有效下达。结果是,在血糖已经很高的情况下,肝脏仍不当地进行糖异生(分解代谢),而肌肉和脂肪组织却无法有效摄取和利用葡萄糖,加剧高血糖。这从反面证明了这套调控系统的极端重要性。
5. 生命“智慧”的分子实现
变构调节、共价修饰与激素信号的耦合,实现了代谢调控的快慢结合、局部与全局统一。它完美地诠释了:
(1)生命系统的“目的性”:维持能量稳态的宏观目标,是通过分子对化学信号的物理化学响应自动实现的。
(2)还原论的深刻胜利:将复杂的生理适应(如从饱食到饥饿的切换),还原为磷酸基团的转移和蛋白质构象的微小变化。
(3)对活力论的终极回应:这种精妙、自动、基于物理化学定律的调控网络,完全解释了生命的自主性与适应性,无需任何超自然“生命力”的假设。
这正是从哲学思想史一路探究至分子机制所期待看到的:生命最令人惊叹的“智慧”,其本质是演化塑造的、由分子执行的精密工程学。
二十四、AMPK、mTOR 等能量感受器与信号通路
AMPK与mTOR是细胞能量代谢调控网络中一对核心的拮抗调节器,分别扮演“节能管家”与“增长主管”的角色。它们共同构成了细胞感知营养与能量状态、决定代谢流向的核心决策系统。
为了快速把握这对关键调控器的核心特征,表17对比了它们的主要特点:
表17 AMPK与mTOR这一对关键调控器的核心特征
特性 | AMPK | mTOR |
核心角色 | “节能管家”/“代谢主开关” | “增长主管”/“合成司令” |
主要激活信号 | 能量不足:AMP/ADP升高,ATP降低;运动、缺氧、营养匮乏。 | 能量与营养充足:高ATP、丰富氨基酸(尤其亮氨酸)、胰岛素/IGF-1信号、生长因子。 |
核心功能 | 开启分解代谢,抑制合成代谢,以增加ATP生成。 | 促进合成代谢,抑制分解代谢,以支持细胞生长与增殖。 |
对代谢的关键调控 | 促进:葡萄糖摄取、脂肪酸氧化、线粒体生物合成、自噬。抑制:胆固醇/脂肪酸/蛋白质合成。 | 促进:蛋白质/脂质/核苷酸合成、糖酵解。 抑制:自噬、溶酶体生成。 |
上游关键传感器 | 直接感受 AMP/ATP比率 变化。 | 感受氨基酸水平和PI3K/Akt信号通路(来自胰岛素等)。 |
下游关键效应 | 磷酸化并调控众多代谢酶和转录因子(如磷酸化并抑制乙酰辅酶A羧化酶,促脂肪酸氧化)。 | 通过mTORC1磷酸化下游靶点(如激活S6K1,促进蛋白质合成;抑制ULK1,抑制自噬)。 |
病理意义 | 激活不足与2型糖尿病、肥胖等相关;是二甲双胍等药物作用的靶点。 | 过度激活与癌症、代谢综合征、衰老等密切相关;是雷帕霉素等药物的靶点。 |
1. AMPK与mTOR的交互:一个精妙的“代谢开关”
这两条通路并非独立工作,而是相互抑制,形成一个稳定的“开关”,确保细胞在“增长模式”与“节能模式”间做出明确选择:
(1)AMPK抑制mTOR:当能量不足(AMPK激活)时,AMPK通过磷酸化TSC2和mTORC1的关键亚基Raptor,直接抑制mTORC1活性,关闭耗能的生长合成过程。
(2)mTOR活跃时抑制自噬等分解过程:当营养充足(mTOR激活)时,它会抑制自噬等分解代谢过程,这与AMPK的作用正好相反。
2. 生理与病理意义
(1)在运动与饥饿中的核心作用:运动时,肌肉ATP消耗导致AMP上升,强烈激活AMPK,从而促进葡萄糖摄取和脂肪酸氧化供能,同时抑制mTOR。长期禁食时,全身性能量匮乏也会系统性激活AMPK。
(2)在代谢性疾病中的角色
2型糖尿病:常伴随肌肉和肝脏中AMPK活性降低,导致糖脂代谢紊乱。经典降糖药二甲双胍的作用机制之一就是激活AMPK。
癌症:许多癌细胞的mTOR通路持续异常激活,驱动其不受控制的生长和增殖,因此mTOR是重要的抗癌靶点。
在衰老与长寿中的作用:抑制mTOR信号或激活AMPK,是延长多种生物寿命的经典途径(如雷帕霉素的作用),其核心在于降低合成代谢、增强细胞质量控制(如自噬)。
3. 在思想史脉络中的定位
理解AMPK/mTOR系统,是对已构建的知识体系的关键深化:
(1)揭示了能量感知的分子逻辑:将宏观的“能量状态”概念,精确还原为AMP/ATP比值、氨基酸浓度等可测量的化学信号。
(2)完成了调控的闭环:之前了解了激素(胰岛素/胰高血糖素)的远程调控,以及变构/共价的酶活性调控。AMPK/mTOR则是位于其下游的、整合这些信号并做出终极决策的核心执行模块。
(3)生命“自主性”的终极分子诠释:细胞如何“知道”该生长还是该节约?答案就在于AMPK和mTOR这对分子开关对能量与营养物质的直接物理化学感知与反应。这再次证明,生命的“智慧”与“目的性”,完全源于演化塑造的精妙分子机制。
4. 前沿与干预
基于这些通路的干预策略是现代医学和健康科学的热点:
(1)运动:是激活AMPK、抑制mTOR的最自然有效的方式。
(2)热量限制:其延长寿命的效果,与持续轻度激活AMPK、抑制mTOR密切相关。
(3)药物:二甲双胍(AMPK激活剂)和雷帕霉素(mTOR抑制剂)分别是糖尿病和移植领域的经典药物,其延寿潜力正在被深入研究。
这份梳理,能让我们对细胞能量调控的顶层设计有更清晰的认识。如果希望深入某个具体细节,例如自噬的调控机制或mTOR在癌症中的具体突变,我们可以继续展开。
二十五、线粒体:超越能量工厂的细胞中枢
(未完待续)
https://blog.sciencenet.cn/blog-279293-1515151.html
上一篇:“生物能”理论的主要构件(11)
下一篇:“生物能”理论的主要构件(13)