博文
第7章:氢氧气治疗肿瘤的潜力 英国博士论文
||
第7章:氢氧气体在肿瘤学治疗中的潜力:对EB病毒永生化B淋巴细胞(TK6)细胞的研究
本文摘自文献《氢氧气体在肿瘤学中的治疗潜力:对Epstein–Barr病毒永生化B淋巴细胞(TK6)细胞的研究》(Russell, Grace, et al. Hydrogen 4.4 (2023): 746-759.)
7.1 引言
越来越多的证据表明,氢气和氢氧疗法正作为有效的抗炎和抗氧化气体而兴起(Ohta, 2015; Kura等人,2019; Nogueira和Branco, 2021; Deryugina等人,2023a),这些气体在生理上被广泛耐受,这一点在一系列全面的临床研究中得到证实(Kajiyama等人,2008; Nishimaki等人,2018; Akagi和Baba, 2019; Chen等人,2019a; Chen等人,2020a)。作为一种潜在的革命性抗炎、抗氧化和抗肿瘤物质,氢疗法的兴趣正在学术界和商业界迅速增长,特别是作为传统癌症治疗的辅助手段(Yang, Zhu和Xi, 2018; Chen等人,2019b; Yang等人,2020b)。
关于氢氧的生物学效应的研究很少,而且很少有比较研究阐明相应的氧气增加如何影响细胞活动。然而,有广泛的临床和实证研究证明氢气具有抗炎(Itoh等人,2009; Niu等人,2020; Rochette等人,2021; Yang等人,2023)和抗氧化(Slezak等人,2021; You等人,2021)特性,这可能有益于肿瘤疾病。
对氢气对恶性细胞系的影响研究表明,氢气可能在氧化还原信号传导中扮演双重角色:(i)通过抑制氧化活动和支持代谢稳态(Delos Reyes等人,2021; Asgharzadeh等人,2022),以及(ii)通过上调氧化还原诱导的信号传导级联反应来促进凋亡(Tsai等人,2009; Al Zahrani等人,2019; Russell等人,2023)。最近对氢气和氢氧疗法效果的研究显示,它们显著减少了由氧化应激和炎症引起的生理损伤(Kura等人,2019; LeBaron等人,2019a; Fang等人,2020)。例如,在体外乳腺肿瘤模型中,HRW被显示通过缓解氧化压力和血管内皮生长因子(VEGF)诱导的血管生成,通过抑制炎症反应来抑制乳腺癌细胞的活性(Frajese等人,2018)。同一项研究还指出,HRW的消费延迟了BALB-neuT小鼠中人类表皮生长因子受体-2 (HER2)乳腺肿瘤的发展,得出结论HRW可以抑制人类细胞和哺乳动物宿主中的乳腺癌细胞生存。氢氧气吸入的效果进一步在一项针对82名III期和IV期癌症患者的“真实世界”调查中得到研究,其中患者每天至少吸入氢氧3小时,持续3个月或更长时间(Chen等人,2019b)。收集的证据表明,经过四周每天吸入后,食欲、认知、疲劳、疼痛和失眠有了实质性的改善,尽管这些研究的结果是否由于恶性细胞的凋亡增加尚未完全阐明。
7.2 理论基础
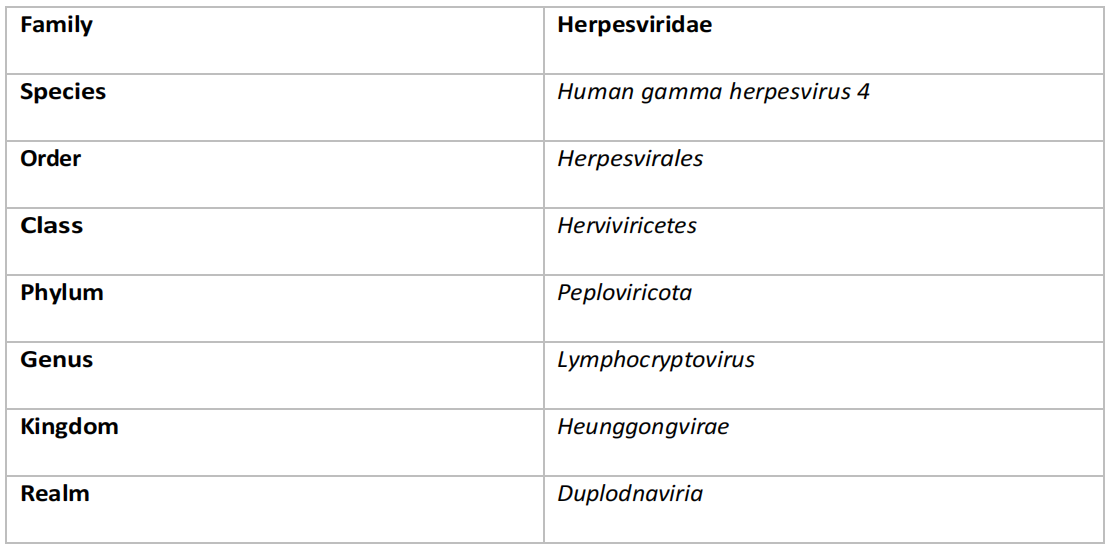
EB病毒属于疱疹病毒科(表7.1),已知会引起单核细胞增多症,俗称腺热或接吻病。EB病毒通过血液、唾液和精液等体液传播(Zhao等人,2019),原发性病毒感染的症状包括呼吸困难、疲劳、发烧和光敏感,持续时间约为2-3周。此外,原发性疾病的严重程度与病毒载量相关(Kimura等人,2008)。类似于COVID-19等病毒感染,EBV可以进展为病毒后综合征(肌痛性脑脊髓炎/慢性疲劳综合征(ME/CFS)),其中原发性感染的严重程度再次是发展ME/CFS的指标。此外,ME/CFS被报告为癌变的风险因素(de Oliveira, Müller-Coan和Pagano, 2016),以前的EBV感染与伯基特淋巴瘤、霍奇金淋巴瘤和非霍奇金淋巴瘤以及乳腺癌、胃癌和鼻咽癌的发生有关(Gequelin等人,2011)。
表7.1 表示Epstein-Barr病毒分类的表格。数据检索自https://ictv.global/taxonomy [访问日期 09/08/2022]。
7.3 目标
治疗长期疾病如恶性肿瘤(例如乳腺癌、霍奇金和非霍奇金淋巴瘤)可能既具挑战性又昂贵(Hsu, Chang和Chen, 2022; McCloskey等人,2023)。为了更好地理解氢气和/或氢氧是否能为肿瘤疾病提供一种替代性和可持续的疗法,实施了一系列测试。首先,进行细胞计数,以观察单次治疗或多次使用氢气和氢氧是否对细胞行为有明显影响。其次,为了评估初始观察是否在加入生长刺激物(ConA)后重复出现,记录了进一步的复制能力观察(仅氢氧)。最后,应用流式细胞术分析来阐明细胞周期如何受到氢气和/或氢氧管理的影响。
7.4 结果
7.4.1 a pH:氢氧
为了评估氢氧注入对RPMI培养基pH的影响,测量了注入后5分钟的pH(19°C ± 2°C)。结果显示,在用氢氧发生器注入30分钟后,pH从7.25(制造商标准)增加到8.3。
7.4.1 b pH:氢气
在19°C(±2°C)下评估仅注入氢气的培养基的pH也显示,在注入30分钟后,pH直接从7.25上升到8.3。
7.4.2 细胞培养基中注入的氢气保留
为了确认氢气已溶解到培养基中,图7.1说明了氢气的水平及保留情况。注入前,培养基中未检测到溶解的氢气。注入使RPMI培养基中的氢气含量增加到0.69 mg/L/H2,并在30分钟内逐渐减少,表明RPMI培养基中氢气浓度下降50%的时间约为36分钟(外推数据)。值得注意的是,与12分钟的保留时间(H2O)(第5章,第5.4.3节)相比,氢气在RPMI培养基中的消耗速度较慢,在30分钟后达到可忽略水平。出于实验目的,这段时间的暴露被认为是足够的。
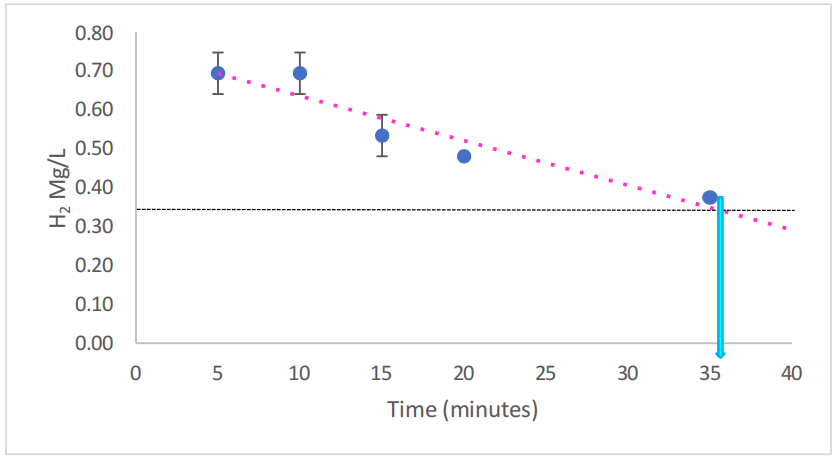
图7.1. 使用H2Blue测量的RPMI培养基中氢气的浓度和保留情况。
虚线粉红色线表示在使用HydroVitality氢氧发生器(每分钟300 mL H2 + 150 mL O2)注入30分钟后,RPMI培养基中溶解的氢气水平的趋势线。n = 3适用于所有样本。水平黑色虚线表示氢气减少50%。两者之间的交点,用浅蓝色箭头显示,突出了在RPMI中50%的氢气消散所需的时间。误差条表示±SEM。
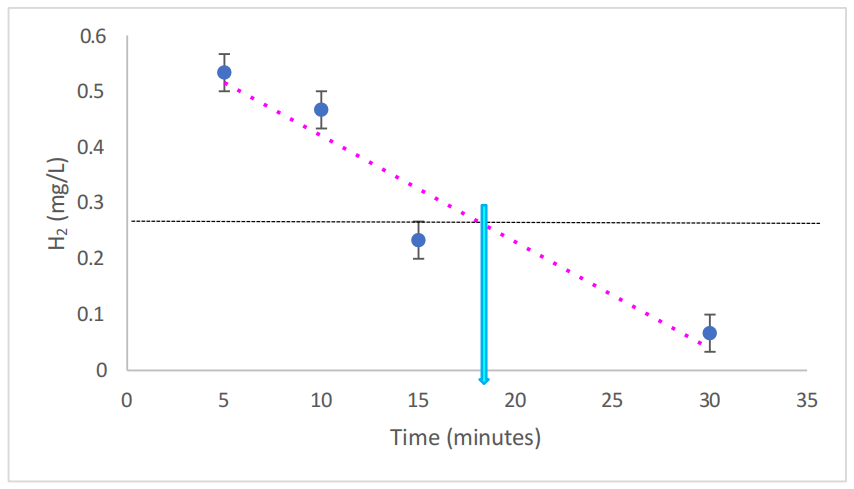
图7.2. 使用H2Blue测量的RPMI培养基中氢气的浓度和保留情况。
数据由在我的监督下(Grace Russell)进行研究的MSc学生G. Mannings(2023)生成。虚线粉红色线表示在使用ABS-XQ-O2纯氢气发生器(每分钟300 mL H2)注入30分钟后,RPMI培养基中溶解的氢气水平的趋势线。n = 3适用于所有样本。水平黑色虚线表示氢气减少50%。两者之间的交点,用浅蓝色箭头显示,突出了在RPMI中50%的氢气消散所需的时间。误差条表示±SEM。
7.4.3 细胞培养基中注入的O2保留
为了评估RPMI培养基中的溶解氧含量,图7.3说明了O2在RPMI培养基中的水平和保留情况。注入前,记录到的溶解氧含量为6.99 mg/L/O2。注入将O2含量增加到9.79 mg/L。这逐渐消耗,表明O2的50%消耗率约为45分钟。
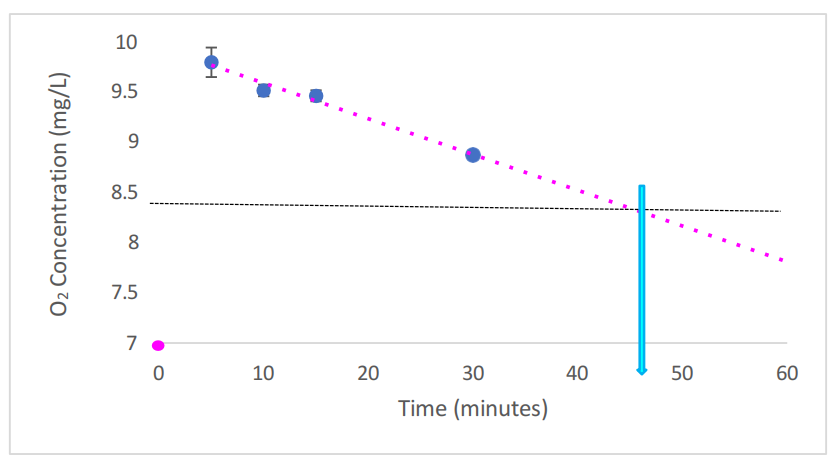
图7.3. RPMI培养基中O2的浓度和保留。
虚线粉红色线表示在使用HydroVitality™氢氧发生器(每分钟300 mL H2 + 150 mL O2)注入30分钟后,RPMI培养基中溶解的O2水平的趋势线。n = 3适用于所有样本。误差条表示±SEM。水平黑色虚线表示O2减少50%。两者之间的交点,用浅蓝色箭头显示,突出了在RPMI中50%的O2消散所需的时间。粉红色圆点代表注入前的O2水平。
7.4.4 细胞增殖实验
7.4.4.1 氢氧
为了分析氢氧气是否会对TK6细胞的复制能力产生影响,首先评估了细胞计数。值得注意的是,对照组中的细胞平均浓度在24小时时大约是接种量的两倍,这与Zhan等人(2004年)的预期一致,在48小时和72小时的时间点也观察到相同的事件模式。然而,在单次氢氧处理组中没有看到这种初始的生长和复制期(图7.4 A)。T检验统计分析表明,在24小时(p = 0.061, 95% CI [5.06, 15.44])、48小时(p = 0.135, 95% CI [-0.22, 22.56])和72小时(p = 0.268, 95% CI [37.12, 72.74])时,急性氢氧组与对照组之间的细胞密度没有明显差异(图7.4 A)。相反,在所有时间点(24、48和72小时)都有一种非统计性的生长抑制趋势。通常在急性氢氧暴露后72小时恢复细胞生长率。
在对照组中也注意到了相同的复制模式,每天添加氢氧(慢性方案)确实在24小时和48小时产生了显著数据,但在72小时没有。对每日用氢氧注入的培养基进行治疗的统计分析(图9.4 B)显示,细胞数量在24小时(p = 0.029, 95% CI [1.66, 2.32])和48小时(p = 0.005, 95% CI [3.95, 4.57])之间存在显著差异,但在72小时(p = 0.257, 95% CI [4.15, 12.92])没有显著差异。
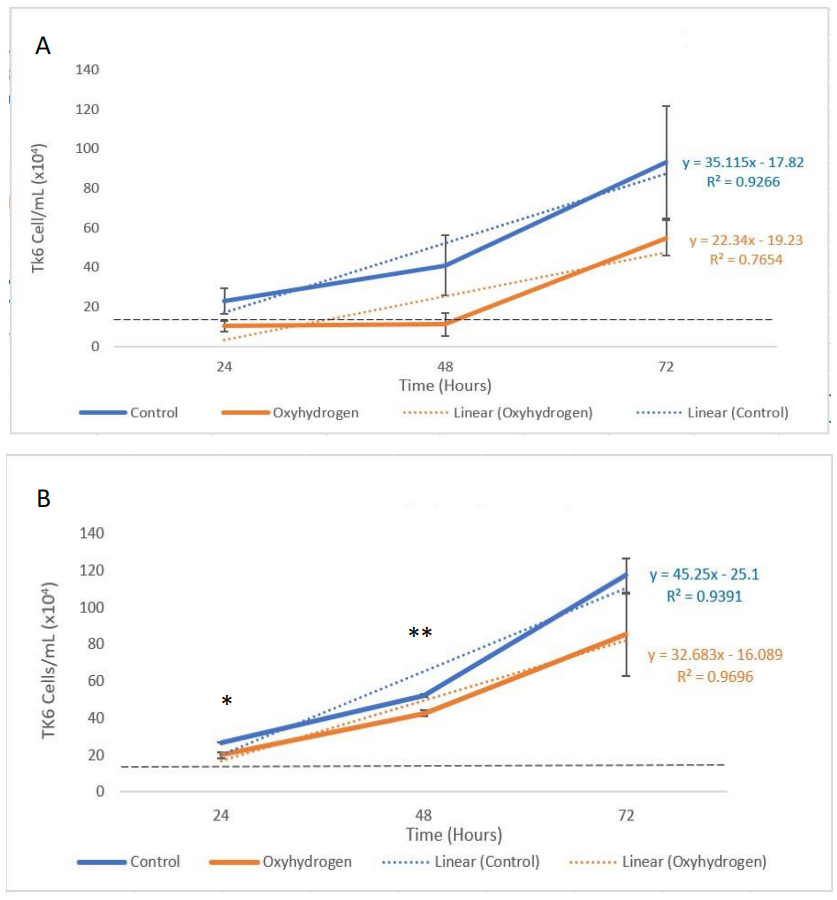
图7.4 (A/B) 显示了单次氢氧处理组(A)的细胞群体测量。图7.4 (B) 识别了每日氢氧处理组的细胞群体。n = 3适用于所有样本。误差条表示±SEM。蓝线指示对照组(A/B)。橙线描绘氢氧注入(A/B)* (p ≤ 0.05), ** (p ≤ 0.01)。虚线黑线代表初始细胞接种计数。蓝色和橙色文本(y=)表示变化率。决定系数(R²)解释了实验结果中包含的方差比例,是趋势线近似数据的统计度量(注意:R²为1表示数据完全适合线性模型)。
为了评估图7.4 (A/B)中看到的对细胞复制的抑制效果是否在有丝分裂原刺激的细胞中重复出现,从而表明氢氧处理是否可以抑制恶性细胞的过度增殖,向细胞培养基中添加了16 µg/mL的ConA。然而,由于时间限制,这个方案没有为仅氢气实验组重复进行。
图7.5 显示了氢氧组与对照组和有丝分裂原刺激组之间细胞群体的统计意义减少;氢氧 vs. 对照 (p = 0.017, 95% CI [17.42, 19.51]) 和氢氧 vs. ConA (p = 0.029, 95% CI [28.24, 56.23]) 在24小时显示氢氧单独最有效地减少细胞增殖,但在其他任何时间点没有确定任何组之间的统计差异(p ≥ 0.05)。然而,在所有时间点观察到有丝分裂原和氢氧/有丝分裂原组之间的非显著复制抑制趋势:24小时 (p = 0.06, 95% CI [22.11, 26.08]), 48小时 (p = 0.12, 95% CI [35.17, 76.97]) 和72小时 (p = 0.15, 95% CI [58.19, 131.48])。
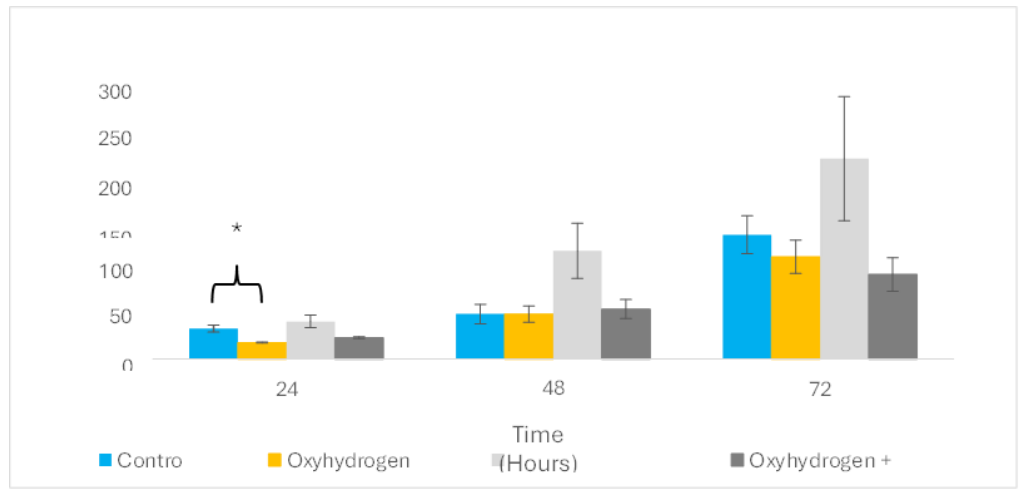
图7.5 氢氧气对有丝分裂原刺激的TK6细胞的影响。在有丝分裂原刺激(16 µg/ConA)后细胞群体的生长。蓝色:对照组(-ve控制)。橙色:氢氧处理组(+ve控制)。浅灰色:刀豆球蛋白A组。深灰色:氢氧和刀豆球蛋白A。n = 3适用于所有样本。误差条表示±SEM。* p ≤ 0.05。
尽管在分析ConA处理组与氢氧/ConA处理组之间的差异时没有产生统计意义数据,但再次观察到在每个时间点氢氧/ConA处理组中存在明显的生长抑制趋势,这使得这些组值得进一步研究。
7.4.4.2 氢气
仅氢气注入在24小时(p = 0.02, 95% CI [-0.15, 1.77])和48小时(p = 0.04, 95% CI [3.02, 6.54])表现出对TK6细胞增殖的统计显著减少(图7.5)。然而,这一效应在72小时(p = 0.76, 95% CI [-1.82, 9.13])并不具有统计显著性。对照组中的细胞平均浓度在24小时大约是接种量的两倍,并在48小时和72小时时间点观察到类似的复制模式。然而,相同的模式并未在单次氢气处理组中观察到,在这些组中,复制能力在24小时(p = 0.02)和48小时(p = 0.04)显著降低(图7.6)。
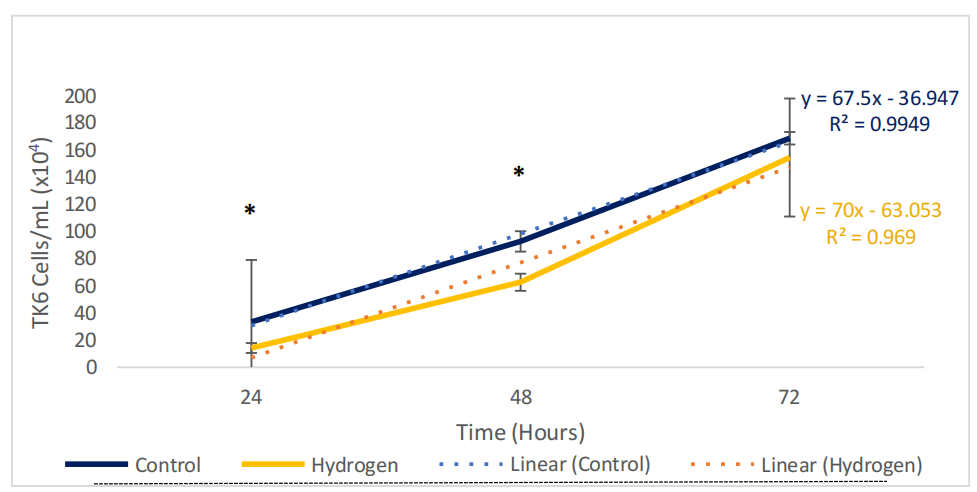
图7.6 显示了单次(急性)氢气处理组的细胞群体测量。数据由G. Mannings(2023年)在我的监督下(Grace Russell)产生。n = 3适用于所有样本。误差条表示±SEM。深蓝线表示对照组。橙色线描绘了氢气注入* (p ≤ 0.05)。虚线黑线代表初始细胞接种数。蓝色和橙色文本(y=)表示变化率。决定系数(R²)解释了实验结果中包含的方差比例,是衡量趋势线对数据拟合程度的统计指标(注意:R²为1表示数据完全符合线性模型)。
7.4.5 流式细胞术
7.4.5.1 氢氧混合气
为了识别氢氧混合气体对细胞周期的影响,并更好地理解图7.4(A/B)、7.5和7.6中观察到的细胞数量减少背后的机制,进行了流式细胞术分析。图7.7描述了在单次氢氧混合气体注入后24小时和48小时每个细胞周期阶段(生长阶段1和2(分别为G1和G2)以及静止期(S/P))的平均细胞百分比。亚生长期(Sub G1)不属于细胞周期的一部分,因为用碘化丙啶(PI)染色显示DNA降解或破碎(Darzynkiewicz, Huang and Zhao, 2017)。处于Sub G1期的细胞比公认的细胞周期阶段(G1、G2和S/P)中的DNA含量低,这是与细胞凋亡相关的一个因素(Darzynkiewicz, Huang and Zhao, 2017; Manohar, Shah and Nair, 2021)。图7.7显示了氢氧混合气体处理后24小时(对照组:9%对比46%)和48小时(对照组:18%对比40%)Sub G1期细胞显著增加,同时伴随G1期(24小时:对照组:39%对比25%;48小时:对照组:37%对比31%)和G2期(24小时:对照组:28%对比10%;48小时:对照组:19%对比10%)的显著减少。氢氧混合气体处理组在24小时的Sub G1期(p = < 0.001, 95% CI [37.68, 52.65])、G1期(p = 0.001, 95% CI [23.80, 24.66])和G2期(p = 0.002, 95% CI [5.42, 11.58])显示出与对照组的统计学显著差异。对S/P期细胞的分析没有发现显著差异(p = 0.108, 95% CI [16.57, 20.76])。在48小时,氢氧混合气体处理组在所有阶段均表现出显著差异,Sub G1期(p = 0.004, 95% CI [35.03, 47.51])、G1期(p = 0.002, 95% CI [32.18, 33.89])、S期(p = 0.004, 95% CI [20.13, 23.41])和G2期(p = 0.012, 95% CI [6.85, 14.21])。氢氧混合气体的给药显然减少了细胞群体中的细胞数量,显著降低了两个生长阶段(G1和G2)的细胞数量,并明显增加了Sub G1期的DNA量,可以合理假设氢氧混合气体有效地促进了恶性B细胞的凋亡。
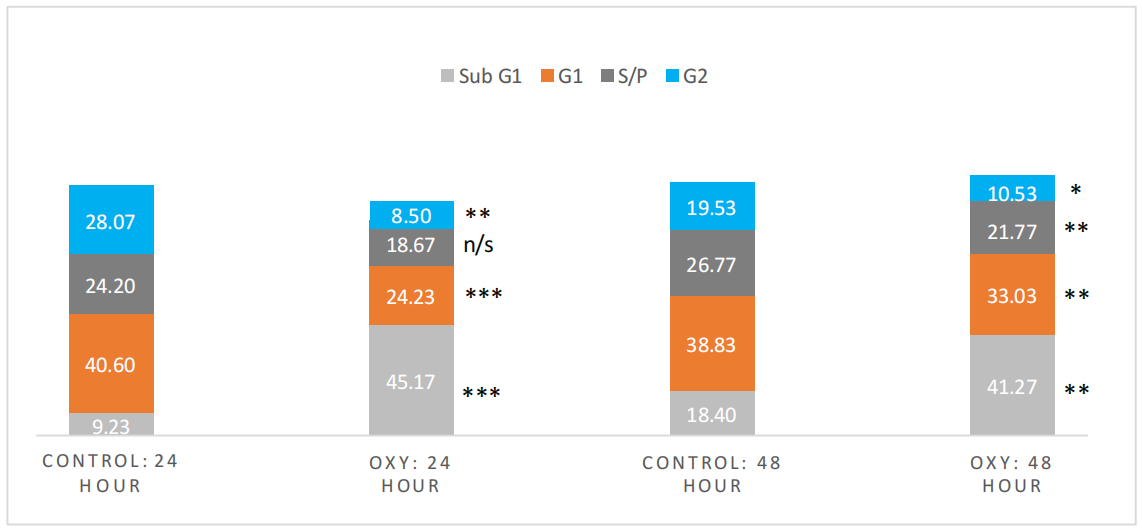
图7.7 显示了3000(±500个细胞)TK6细胞在细胞周期的每个阶段的百分比。从左到右:对照组24小时的结果。氢氧混合气体组24小时的结果。对照组48小时的结果。氢氧混合气体组48小时的结果。从上到下:淡蓝色,生长阶段2。深灰色,合成阶段。橙色,生长阶段1。浅灰色,Sub G1。* (p ≤ 0.05) ** (p ≤ 0.01) *** (p ≤ 0.001) n/s = 无显著性。
7.4.5.2 氢气
值得注意的是,由于在准备阶段中出现实验错误,细胞受到4000 xg而不是400 xg的离心力,导致初始细胞群体在Sub G1阶段的比例比预期高得多(图7.8中的50.4%对比图7.7中的9.23%)。然而,根据氢氧混合气体的数据进行的纯氢气注入的流式细胞术分析显示,氢气在24小时(89.2%)和48小时(66.4%)时将大多数细胞停滞在Sub G1阶段(分别为p = 0.02, 95% CI [85.1, 93.3];p = 0.39, 95% CI [44.1, 88.7])(图7.8),表明氢气在这些细胞中有效促进凋亡。在细胞周期的所有其他分析阶段,对照组与氢气注入组之间观察到统计学显著差异:G1期(p = 0.02, 95% CI [4.91, 5.74])、合成阶段(p = 0.04, 95% CI [-4.15, -1.17])和(p = 0.03, 95% CI [-1.25, 1.14])在24小时但非48小时,G1期(p = 0.16, 95% CI [5.0, 23.9])、合成阶段(p = 0.30, 95% CI [5.1, 23.2])和G2期(p = 0.9, 95% CI [2.0, 11.4])。
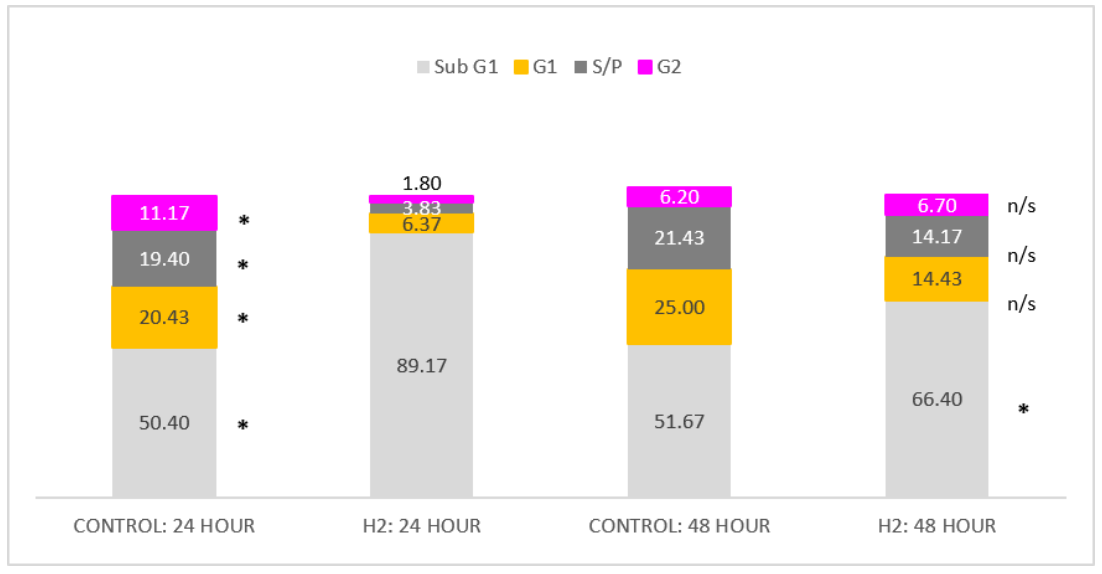
图7.8 显示了3000(±500个细胞)TK6细胞在细胞周期的每个阶段的百分比。数据由MSc学生G. Mannings(2023)生成。从左到右:对照组24小时的结果。氢气注入组24小时的结果。对照组48小时的结果。氢气注入组48小时的结果。从上到下:粉色,生长阶段2。深灰色,合成阶段。橙色,生长阶段1。浅灰色,Sub G1。* (p ≤ 0.05) n/s = 无显著性。
7.5 研究结果总结
为了评估氢氧混合气体和/或纯氢气气体是否会对TK6细胞的增殖能力产生影响,这项研究专注于将每种气体注入细胞培养基中的效果,试图模拟上述气体在血液或浆液中最可能的扩散和保留模式。本报告的主要发现表明,将氢气或氢氧混合气体溶解到细胞培养基中对TK6细胞的增殖具有抑制作用(图7.3 A/B和7.4),通过上调凋亡(图7.7和7.8)。这些因素可能在许多恶性条件的临床治疗中很重要,尤其是那些与先前EBV感染相关的疾病(例如乳腺癌、霍奇金和非霍奇金淋巴瘤)(Wong et al., 2022)。然而,如果要解决哪种气体对肿瘤疾病的治疗更有效的问题,还需要进行更多的比较研究。
https://blog.sciencenet.cn/blog-41174-1451123.html
上一篇:葛根素通过脑肠轴减少脂肪吸收
下一篇:氢气与生物进化和医学应用前景分析(英论文8)