博文
科学家发现新酶,为绿色癌症治疗铺平道路  精选
精选
||
科学家发现新酶,为绿色癌症治疗铺平道路
诸平
MIB-0920
据英国曼彻斯特大学(University of Manchester, Manchester, UK)2024年7月8日提供的消息,科学家发现新酶,为绿色癌症治疗铺平道路(Scientists pave way for greener cancer treatments with new enzyme discovery)。
曼彻斯特大学的科学家们发现了一种更有效、更可持续的方法来制造基于肽的药物,在对抗癌症方面显示出有希望的效果。
肽类(Peptides)是由氨基酸的小链组成的,而氨基酸又是蛋白质的组成部分。肽类在我们的身体中起着至关重要的作用,被用于许多药物中,以对抗癌症、糖尿病和感染等疾病。它们还被用作疫苗、纳米材料和许多其他应用。然而,目前在实验室中制造肽类物质是一个涉及化学合成的复杂过程,会产生大量有害废物,对环境造成破坏。
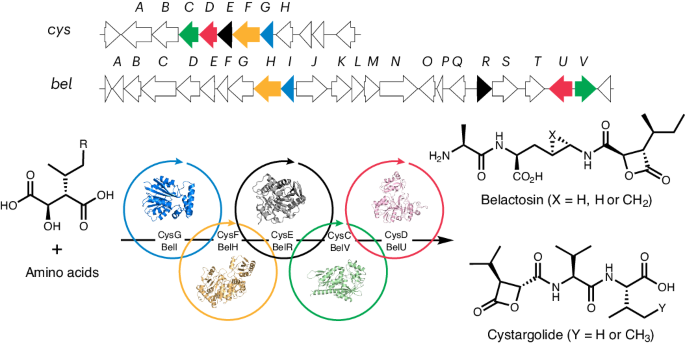
2024年7月1日发表在《自然化学生物学》(Nature Chemical Biology)杂志网站上的一项新突破中,曼彻斯特大学的科学家们发现了一种新的连接酶(ligase enzymes)家族——一种分子胶(molecular glue),可以帮助更简单、更牢固地组装短肽序列,与传统方法相比,产生的肽类量明显更高。原文详见:Guangcai Xu, Daniele Torri, Sebastian Cuesta-Hoyos, Deepanjan Panda, Luke R. L. Yates, Rémi Zallot, Kehan Bian, Dongxu Jia, Andreea I. Iorgu, Colin Levy, Sarah A. Shepherd, Jason Micklefield. Cryptic enzymatic assembly of peptides armed with β-lactone warheads. Nature Chemical Biology (2024). DOI: 10.1038/s41589-024-01657-7. Published: 01 July 2024. https://doi.org/10.1038/s41589-024-01657-7
这一突破可能会彻底改变癌症和其他严重疾病的治疗方法,提供一种更有效、更环保的生产方法。
“使用我们的新型连接酶,我们可以在一个单一的过程中生产出具有良好抗癌活性的肽类物质,而且产量很高。以前,这些类型的肽是通过非常费力的10~12步化学合成过程,而且以低得多的产量来进行生产。通过在单一级联反应中将不同的连接酶结合在一起,我们可以制造出许多不同的肽类物质。”
多年来,科学家们一直在研究生产肽类物质的新方法。大多数现有技术依赖于复杂且受到严格保护的氨基酸前体、有毒化学试剂和有害的挥发性有机溶剂,产生大量危险废物。目前的方法成本也很高,而且难以扩大规模,导致重要肽药物的供应有限且昂贵。
曼彻斯特的研究小组寻找新的连接酶,这些连接酶参与了在简单细菌中组装天然肽的生物过程。他们成功地分离和表征了这些连接酶,并在与多种氨基酸前体的反应中对它们进行了测试。通过分析细菌连接酶的序列,研究小组确定了许多可能参与其他肽途径的连接酶簇。
这项研究为未来如何制造包括重要药物在内的肽类物质提供了蓝图。
参与该项目的徐广才博士(Dr Guangcai Xu音译)说:“我们发现的连接酶提供了一种非常清洁和有效的生产肽类物质的方法。通过搜索现有的基因组序列数据,我们发现了许多类型的相关连接酶(related ligase enzymes)。我们相信,使用这些连接酶,我们将能够组装用于一系列其他治疗应用的更长的肽类物质。”
根据这一发现,研究小组现在将优化新的连接酶,以提高它们的产量,用于更大规模的肽类物质的合成。他们还与一些顶级制药公司建立了合作关系,以帮助推出新的连接酶技术,用于制造未来的肽疗法(peptide therapeutics)。
这项工作由英国工程和物理科学研究委员会{Engineering and Physical Sciences Research Council (EPSRC) grant code EP/V048929/1) }、英国生物技术和生物科学研究委员会{Biotechnology and Biological Sciences Research Council (BBSRC) grant codes BB/V016083/1 and BB/V008552/1}、欧洲委员会玛丽-居里学者奖学金 (European Commission Marie Skłodowska-Curie Actions fellowship code EP/Y023714/1) 以及中国留学基金委(Chinese Scholarship Council for supporting the secondment of Dongxu Jia to Manchester from Zhejiang University of Technology and CoEBio3 for a PhD studentship)的资助或者支持。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
Nature has evolved biosynthetic pathways to molecules possessing reactive warheads that inspired the development of many therapeutic agents, including penicillin antibiotics. Peptides armed with electrophilic warheads have proven to be particularly effective covalent inhibitors, providing essential antimicrobial, antiviral and anticancer agents. Here we provide a full characterization of the pathways that nature deploys to assemble peptides with β-lactone warheads, which are potent proteasome inhibitors with promising anticancer activity. Warhead assembly involves a three-step cryptic methylation sequence, which is likely required to reduce unfavorable electrostatic interactions during the sterically demanding β-lactonization. Amide-bond synthetase and adenosine triphosphate (ATP)-grasp enzymes couple amino acids to the β-lactone warhead, generating the bioactive peptide products. After reconstituting the entire pathway to β-lactone peptides in vitro, we go on to deliver a diverse range of analogs through enzymatic cascade reactions. Our approach is more efficient and cleaner than the synthetic methods currently used to produce clinically important warhead-containing peptides.
https://blog.sciencenet.cn/blog-212210-1441761.html
上一篇:革命性的磁性:偏振光解锁超快数据存储和自旋电子学
下一篇:科学家揭穿了关于间歇性禁食安全的4个流行神话
