博文
注射释氢镁基水凝胶抗骨质疏松效应研究  精选
精选
||
背景:骨质疏松性骨缺损的修复仍然充满挑战,原因是过量的反应性氧物种(ROS)、持续的炎症以及成骨与破骨之间的不平衡。
方法:在这里,我们开发了一种可注射的释氢水凝胶(镁@聚乙二醇-聚(乳酸-共-乙醇酸),Mg@PEG-PLGA),以重塑具有挑战性的骨环境并加速骨质疏松性骨缺损的修复。
结果:这种Mg@PEG-PLGA凝胶展现出卓越的可注射性、形状适应性和相变能力,可以通过微创注射填充不规则的骨缺损区域,并可以原位转化为多孔支架以提供机械支撑。通过适当释放H2和镁离子,载有2毫克镁的2Mg@PEG-PLGA凝胶显示出显著的免疫调节效果,通过减少细胞内ROS,引导巨噬细胞向M2表型极化,以及抑制IκB/NF-κB信号通路。此外,体外实验表明,2Mg@PEG-PLGA凝胶在抑制破骨细胞形成的同时促进了成骨。最值得注意的是,在动物实验中,2Mg@PEG-PLGA凝胶通过清除ROS、抑制炎症和破骨细胞形成,显著促进了骨质疏松性骨缺损的体内修复。
结论:总的来说,我们的研究为设计和发展释氢镁基水凝胶作为修复骨质疏松性骨缺损的潜在植入物提供了关键见解。
本研究作者来自重庆医科大学。
Zhou, H., He, Z., Cao, Y., Chu, L., Liang, B., Yu, K., Deng, Z. (2024). An injectable magnesium-loaded hydrogel releases hydrogen to promote osteoporotic bone repair via ROS scavenging and immunomodulation. Theranostics, 14(9), 3739-3759.
骨质疏松症是一种影响骨代谢的系统性疾病,其特征是骨量减少和骨结构恶化,导致易发生脆性骨折和骨缺损的风险增加。在治疗骨质疏松性骨缺损时,常用抗骨质疏松药物如双膦酸盐、降钙素和特立帕肽等作为手术的辅助治疗手段,以促进新骨形成和降低再骨折风险。然而,这些药物在到达缺损区域和直接促进局部骨再生方面面临挑战。骨移植,包括自体骨、异体骨和人工骨移植,是治疗骨质疏松性骨缺损的有效方法,但常常受到供应限制、供体部位发病率、免疫原性和疾病传播风险的限制。传统上,生物惰性材料如金属和聚甲基丙烯酸甲酯(PMMA)常用于临床实践中的内固定和骨质疏松性椎体压缩性骨折。然而,这些没有生物活性的材料骨整合效果差,可能导致应力遮挡效应,进而引起植入物松动甚至失败。此外,传统的骨修复生物材料往往因不规则的缺损形状、受损的成骨细胞活性和骨再生能力而在骨质疏松患者中未能达到预期的临床效果。因此,迫切需要新的方法来避免这些不良问题并治疗骨质疏松性骨缺损。
最近的研究表明,骨质疏松骨微环境中过量的反应性氧物种(ROS)显著阻碍了骨再生。特别是,具有最强细胞毒性的羟基自由基•OH可以无差别地与核酸、脂质和蛋白质反应,导致异常的炎症风暴并抑制骨髓间充质干细胞的成骨作用。迄今为止,许多抗氧化剂已被用于生物材料的开发中,通过清除ROS来减轻炎症并促进骨质疏松性骨的修复。例子包括合成纳米酶和金属氧化物如MnO2和CeO2。然而,这些抗氧化剂的治疗有效性因其在组织内的扩散受限而受到影响。此外,当前的ROS清除策略无意中消除了生理上有益的ROS,这些ROS在信号调节中起着至关重要的作用。另一个问题是含有微量元素的生物材料的生物安全性和生物相容性。这些持续存在的问题凸显了需要创新的方法,不仅要有效地针对骨质疏松性骨缺损中的ROS,还要保持有益ROS的微妙平衡以维持生理功能。
氢气(H2)作为一种新兴的治疗剂,展现出了卓越的抗氧化和抗炎特性,对治疗与反应性氧物种(ROS)相关的疾病具有巨大潜力。其优异的组织和细胞膜渗透性能使其有效扩散至组织内部并靶向线粒体和细胞核——ROS的主要来源。H2能立即被输送以缓解氧化应激,通过与高度细胞毒性的•OH发生反应并解毒,而不会干扰正常的代谢氧化或细胞信号系统。这一能力有效抑制了炎症并促进了组织修复。除了其治疗潜力外,作为内源性惰性气体的氢已被证明在通过各种途径给药时高度安全且生物相容,如吸入、饮用、静脉或腹腔内注射以及原位注射。例如,Chen等人报告说,饮用氢化水显著预防了卵巢切除大鼠的骨质减少,增加了骨矿物质含量和骨矿物质密度。然而,由于H2的保留时间短及其在体液中的溶解度极低,实现满意的效果一直是个挑战。最近生物材料的发展旨在通过促进原位H2输送来解决这一挑战,用于治疗炎症性疾病(如类风湿性关节炎和动脉粥样硬化)和组织修复(如骨缺损和糖尿病伤口)。例如,He等人设计了一种使用电喷雾聚羟基脂肪酸封装的CaSi2纳米粒子的释氢生物玻璃支架。他们的发现表明,该支架实现了局部H2供应,有效地重塑了衰老的微环境,并促进了老年小鼠模型中关键大小骨缺损的愈合。总之,分子氢通过改善恶劣的微环境,对于促进骨缺损修复具有重大潜力。但据我们所知,尚未有研究报道专门针对骨质疏松性骨缺损的释氢生物材料。
镁(Mg)基植入物因其出色的生物相容性、诱导成骨性和可生物降解性而在骨组织修复方面受到广泛关注。以前的研究表明,特定浓度范围内的Mg2+离子可在骨质疏松症中创造一个促成骨和抗破骨细胞的免疫微环境,突显了Mg基植入物治疗骨质疏松性骨缺损的巨大潜力。最近,研究人员探索了镁颗粒与H2O反应产生的氢用于ROS清除和抗炎效应。例如,涂有透明质酸的镁微粒(Mg-HA)被制造出来,并用于关节内注射治疗类风湿性关节炎。由于HA涂层的小孔,Mg-HA微粒实现了持久且持续的H2气泡生成,并在缓解关节损伤和抑制关节炎整体严重程度方面表现出显著效果。然而,这些载镁微粒由于是粉末形式,无法为骨缺损部位提供必要的结构支持。为应对这一挑战,被称为“原位形成植入物”(ISFIs)的可生物降解聚合物基可注射溶液因其优越的可注射性、形状适应性和生物降解性而受到重视。在目标部位注射后,ISFIs固化并原位转化为支架,促进药物输送和组织再生。这种方法为重建骨质疏松性骨缺损提供了一种高效且微创的策略。在我们之前的工作中,开发了一种可注射的相变聚(乳酸-共-乙醇酸)(PLGA)/1-甲基-2-吡咯烷酮(NMP)溶液(PLGA水凝胶),一种FDA批准的ISFI,用作多孔仿生支架进行药物输送和组织生长。这种PLGA水凝胶在重建颅骨缺损和不规则肿瘤性骨缺损方面显示出令人满意的效果。重要的是,通过仔细调节装载内容,实现了药物和镁离子的预期释放行为。
在本研究中,我们设计了一种含镁的PLGA水凝胶(Mg@聚乙二醇(PEG)-PLGA),用于局部输送H2和Mg2+离子,这对于有效重塑具有挑战性的骨骼环境和促进骨质疏松性骨缺损的修复提供了几个优势(方案1)。首先,Mg@PEG-PLGA凝胶的卓越可注射性和顺应性便于以微创方式填充骨缺损,无需额外的开放手术。这一优势特别有利于具有不规则、深层或封闭缺损的患者。其次,具有不对称涂层的Mg@PEG微球与H2O反应,在Mg@PEG-PLGA凝胶的互联孔隙内释放H2。这种原位反应增加了支架的孔隙率,促进了营养/氧气扩散和组织生长。第三,经确认具有所需弹性模量、孔隙率和细胞相容性的2Mg@PEG-PLGA凝胶(装载2 mg Mg),通过适当的H2和Mg2+离子释放,在体外显示出有效的ROS清除和抗炎作用。这一能力有望改善骨质疏松症患者的恶劣骨骼环境。此外,体外实验证明,2Mg@PEG-PLGA凝胶不仅抑制了破骨细胞生成,还促进了成骨。值得注意的是,在骨质疏松性骨缺损的大鼠模型中证实了2Mg@PEG-PLGA凝胶的治疗效果,其中骨体积分数比对照组高出两倍多。此外,RNA测序分析证实了2Mg@PEG-PLGA凝胶体内具有抗炎和抗破骨细胞生成效果,表明其治疗效果可能与抑制TNF-α信号通路有关。总之,释放H2的Mg@PEG-PLGA凝胶为促进骨质疏松性骨缺损再生提供了一种通过ROS清除和免疫调节的新策略。
合成与表征Mg@PEG-PLGA水凝胶
与预制形状的植入物相比,可注射的形状形成植入物(ISFIs)在治疗骨缺损方面具有优势。它们可以通过微创注射输送,并在经历相变后提供机械支撑。在本研究中,我们通过将聚乙二醇(PEG)包覆的镁微粒装载到PLGA水凝胶(PLGA/NMP)中,开发了一种可注射的镁基水凝胶,用于修复骨质疏松性骨缺损。如图1A所示,通过嵌入法用生物可降解的PEG包覆镁颗粒,制备了具有非对称结构的Mg@PEG微球。根据SEM(图1B)和EDS(图1C及图S1)结果,所制备的Mg@PEG微球直径(55.78 ± 4.65 μm)(图1D)大于镁微粒(49.49 ± 5.14 μm)(图S2)。值得注意的是,Mg@PEG微球的非对称涂层,在结构一侧有一个小开口(约15 μm),作为镁-水反应界面,以延长和控制H2的释放。热重分析也被用来测定实际掺入Mg@PEG微球中的镁含量,结果显示镁含量约为94.6 wt %(图S3)。随后,将制备的Mg@PEG微粒加入到PLGA/NMP溶液中,形成不同镁微粒浓度(0.25、0.5、1、2和4 mg/mL)的Mg@PEG-PLGA水凝胶(图1E),展示了令人满意的可注射性(图1F)、相变能力(图1G)和形状适应性(图1H)。生物材料与骨缺损部位的良好粘附对于安全有效的骨再生至关重要。在股骨髁部缺损处的固化Mg@PEG-PLGA水凝胶被显示为牢固地粘合在缺损部位,旋转测试期间没有位移或变形(图S4)。这些发现表明,可注射的Mg@PEG-PLGA水凝胶在体内应用时,可以以微创方式填充不规则骨缺损,尽可能保留周围骨组织——这对于患有骨质疏松症的老年患者尤为重要。XRD分析结果(图1I)表明,在合成Mg@PEG-PLGA过程中,镁微粒的晶体结构保持不变,保留了产生H2的能力。以前的研究表明,PLGA水凝胶系统可以通过液-固相变原位转变成多孔支架,形成有利于营养/氧气扩散和细胞生长的互联孔结构 [35](图S5A)。固化的Mg@PEG-PLGA横截面揭示了水凝胶内的多孔支架状结构,这有利于植入体内时的营养/氧气扩散和细胞生长。XPS(图S6及图1J)和FTIR(图1K)光谱表明,固化的Mg@PEG-PLGA内形成了Mg2+离子和Mg(OH)2,表明一些掺入的镁微粒在相变过程中与H2O发生了反应。此外,元素映射(图S5B)证明了这些含镁微粒在整个固化的Mg@PEG-PLGA凝胶中均匀分布,使得在降解过程中能够稳定释放镁离子。
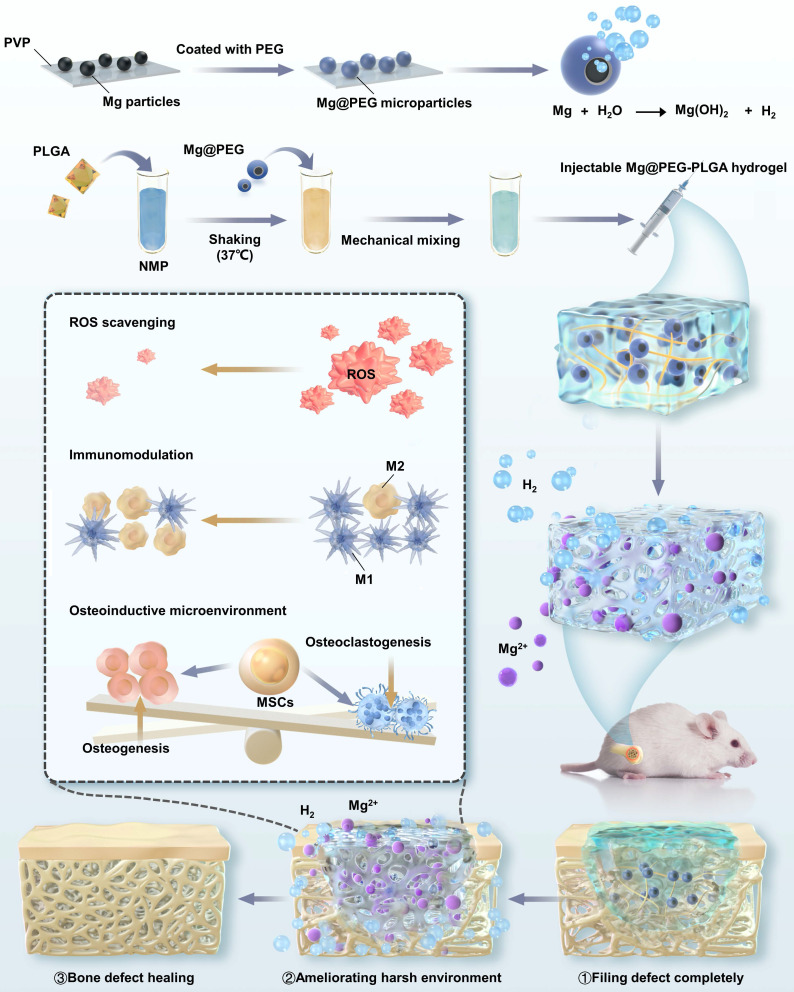
研究方案
可注射的Mg@PEG-PLGA水凝胶有效促进骨质疏松性骨再生的机制示意图。
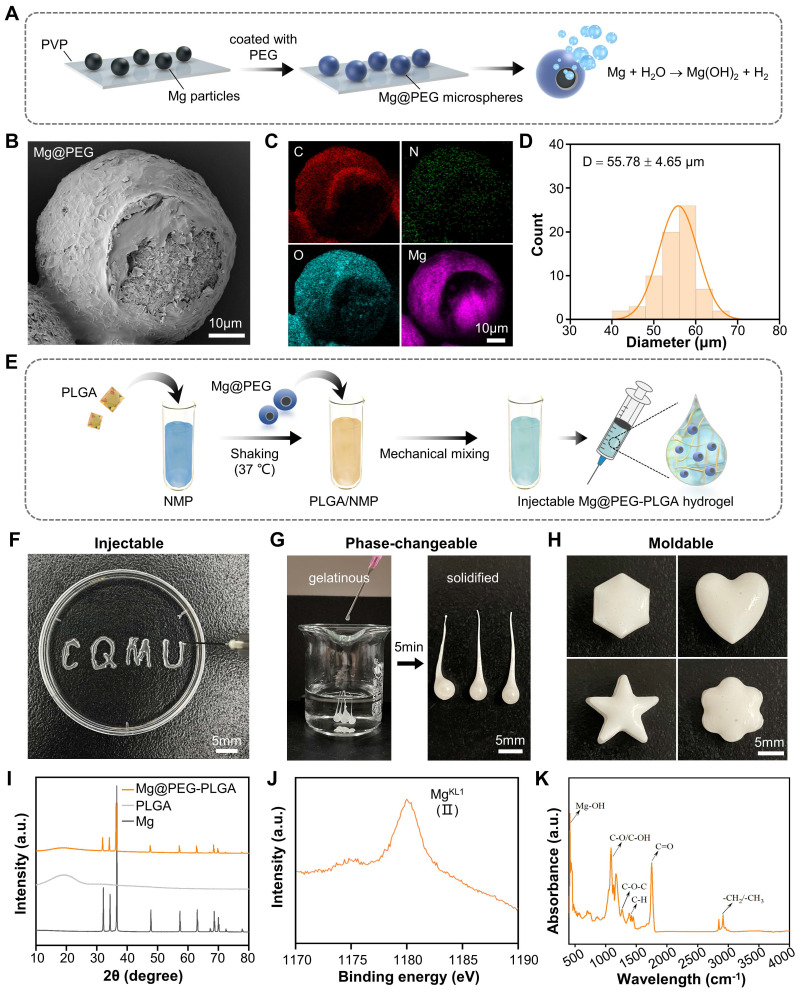
图1.Mg@PEG-PLGA水凝胶的合成与特性。(A)Mg@PEG微球的制备示意图。(B)Mg@PEG微球的SEM图像以及(C)对应的C、O、N和Mg的元素映射。(D)Mg@PEG微球的尺寸分布。(E)Mg@PEG-PLGA水凝胶的制备示意图。Mg@PEG-PLGA水凝胶的(F)可注射性、(G)相变能力和(H)成型性的数码图像。(I)镁微粒、PLGA和Mg@PEG-PLGA凝胶的XRD图谱。(J)固化的Mg@PEG-PLGA凝胶的MgKL1 XPS光谱。(K)固化的Mg@PEG-PLGA凝胶的FTIR光谱。
在固化后,研究了不同镁微粒浓度的Mg@PEG-PLGA水凝胶的机械性能(图S7)。结果表明,与大多数现有的原位水凝胶相比,PLGA和Mg@PEG-PLGA水凝胶显示出更高的弹性模量(范围从20.1 ± 3.3到38.9 ± 0.7 MPa),提供了植入后所需的机械支撑。
总之,这些发现表明,具有高度优势特性的Mg@PEG-PLGA水凝胶,可以作为多孔支架通过原位微创注射用于骨质疏松性骨再生。
镁微粒包覆聚乙二醇-聚乳酸/乙醇酸水凝胶的氢生成和孔隙分析
分子氢因其高生物安全性和优异的抗氧化能力而被广泛研究,并已针对各种疾病的临床应用进行了调查。然而,由于H2在体液中的保留时间短和溶解度有限,实现可持续和稳定的氢气(H2)输送是具有挑战性的,这大大限制了其治疗效果。在此,Mg@PEG-PLGA水凝胶提供了一种局部H2生成策略,通过以下反应清除活性氧:Mg + H2O → H2 + Mg(OH)2。如图2A所示,将PLGA凝胶浸泡在PBS溶液中6小时后,未观察到显著的气泡。然而,在镁含量较高的Mg@PEG-PLGA组中观察到更多的气泡。为了评估从Mg@PEG-PLGA释放的H2,使用了补充有Pt纳米颗粒的MB溶液,并通过在664 nm处的MB吸收的标准曲线来确定氢气含量(图S8)。反应如图2B所示。如图2C-D所示,所有Mg@PEG-PLGA组(0-12小时)都检测到显著的初始爆发式H2释放,这可能是由于相变过程中H2O与镁微粒之间的反应。这种初始爆发式释放对于缓解组织损伤早期阶段活性氧介导的急性炎症至关重要。随后,Mg@PEG-PLGA组中的H2释放速率降低,且随着镁含量的增加,H2释放量增加:0.25Mg@PEG-PLGA(8.24 ± 1.10 μmol)< 0.5Mg@PEG-PLGA(17.12 ± 2.16 μmol)< 1Mg@PEG-PLGA(32.54 ± 3.83 μmol)< 2Mg@PEG-PLGA(57.53 ± 5.40 μmol)< 4Mg@PEG-PLGA(71.32 ± 8.15 μmol)。这一结果暗示了通过调节掺入的镁微球含量来调整H2释放的可行性。值得注意的是,2Mg@PEG-PLGA和4Mg@PEG-PLGA显示出持续的H2释放曲线(长达7天),覆盖了骨再生的炎症和血管生成期。孔隙率是骨替代材料的一个重要特性,会影响物质运输、细胞粘附、血管化和骨生长。通常认为,修复松质骨需要大于70%的孔隙率。SEM和自动孔隙分析结果(图2E和图S9)显示,随着镁含量的增加,Mg@PEG-PLGA组的孔径和孔隙率增加,表明镁微粒可以作为成孔剂改善PLGA凝胶的孔结构(图2F)。关键的是,2Mg@PEG-PLGA和4Mg@PEG-PLGA水凝胶具有理想最大孔径(> 20 μm)和孔隙率(> 80%),与其他凝胶相比,更适合营养/氧气扩散、细胞内生长和组织再生。
总之,我们已经证明,特别是2Mg@PEG-PLGA和4Mg@PEG-PLGA,在PBS中表现出适宜且可持续的H2释放,这对于骨质疏松性骨缺损早期骨环境的重塑有益。此外,由于相变过程中产生的H2,形成了具有增大孔径和孔隙率的多孔2Mg@PEG-PLGA和4Mg@PEG-PLGA支架,为植入后细胞和组织的生长提供了一个有利的平台。
镁微粒包覆聚乙二醇-聚乳酸/乙醇酸水凝胶的降解性和细胞相容性
大量研究表明,Mg2+可以刺激骨髓基质细胞(BMSCs)的增殖和成骨分化,对体内骨再生产生积极影响。因此,从含镁骨科植入物中实现适宜且可持续的Mg2+离子释放至关重要。如图S10A所示,7天时,4Mg@PEG-PLGA凝胶显示出明显的初始爆发式释放(超过250 μg/mL),这可能会损害成骨作用。相比之下,0.5Mg@PEG-PLGA、1Mg@PEG-PLGA和2Mg@PEG-PLGA凝胶表现出稳定且可持续的Mg2+释放。重要的是,在1Mg@PEG-PLGA和2Mg@PEG-PLGA组中,在7天和14天后分别观察到诱导成骨的镁浓度(约50-200 μg/mL)。此外,据报道,由于其酸性降解副产品,PLGA可能导致酸积累和局部炎症。如图S10B所示,在PLGA和0.25Mg@PEG-PLGA组中观察到pH值显著下降。然而,0.5Mg@PEG-PLGA、1Mg@PEG-PLGA和2Mg@PEG-PLGA组在整个28天浸泡期间表现出相对稳定的pH值(pH值分别为:6.90-7.48、6.95-7.56和7.02-7.85)。这一结果表明,适当掺入碱性镁基材料可以中和PLGA的酸性降解产物,可能提高其生物相容性,并使其能够更广泛应用。
除了所需的物理性能外,高生物相容性对于将可生物降解水凝胶用作骨修复材料至关重要。为了评估PLGA和Mg@PEG-PLGA凝胶的细胞相容性,将小鼠胚胎成纤维细胞(MEFs)和RAW264.7细胞与不同凝胶一起培养,并通过CCK-8测定法定量确定细胞活力。如图S11所示,PLGA、0.25Mg@PEG-PLGA、0.5Mg@PEG-PLGA、1Mg@PEG-PLGA和2Mg@PEG-PLGA凝胶显示出良好的细胞相容性,而4Mg@PEG-PLGA组在24和48小时时的细胞活力明显低于对照组。这一观察结果,结合降解测试的结果,表明这种效应可能是由于4Mg@PEG-PLGA凝胶产生的苛刻碱性条件和镁离子过量释放所致。
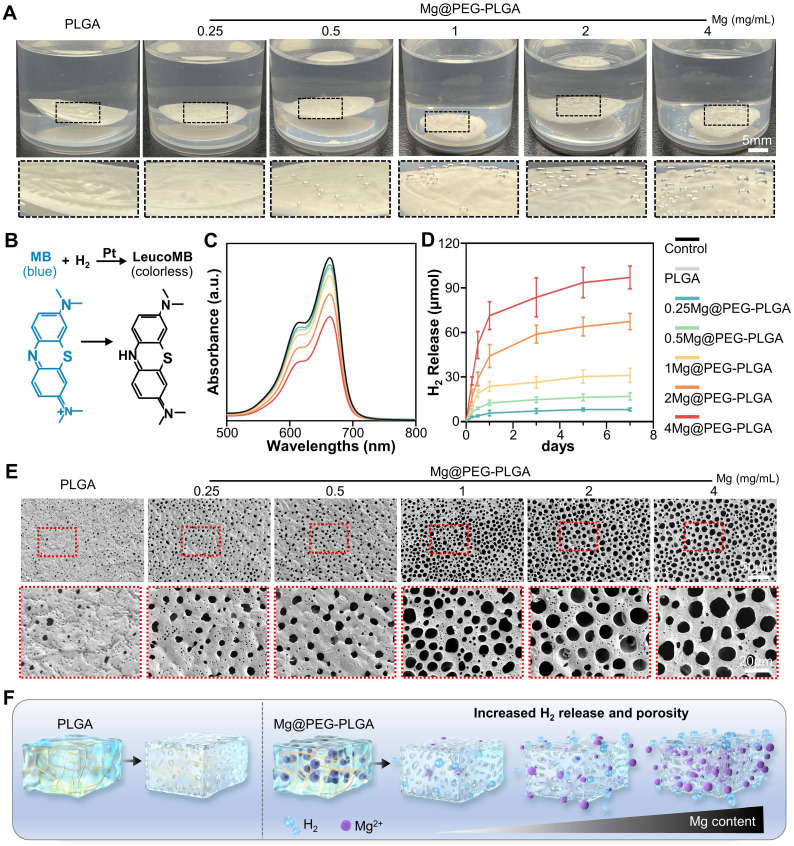
图2.Mg@PEG-PLGA水凝胶的H2释放和孔隙分析。(A) 显示PBS中Mg@PEG-PLGA凝胶产生H2的照片。(B) MB-Pt探针溶液测定H2生成的原理示意图。(C) 加入或未加入水凝胶(6小时)的MB探针溶液的吸收光谱。(D) 通过MB探针从Mg@PEG-PLGA水凝胶中随时间测量的H2生成量。(E) 固化的PLGA和Mg@PEG-PLGA凝胶的SEM图像。(F) 提高Mg含量的Mg@PEG-PLGA凝胶改善H2生成能力的原理示意图。
如前所述,2Mg@PEG-PLGA凝胶因其合适的H2释放、孔结构及细胞相容性而成为后续生物活性测试的首选。
2Mg@PEG-PLGA水凝胶的抗氧化性能
各种抗氧化剂的生物材料,如多巴胺修饰的寡核苷酸和含锰生物陶瓷,已被广泛探索用于促进骨质疏松症骨再生的能力,通过清除ROS来实现。然而,由于生物活性不稳定、潜在的细胞毒性和组织渗透性差,当前材料在临床应用中面临挑战。最近,氢介导的气体疗法因分子氢能专门淬灭有害的活性氧化物而不干扰其他ROS的物理功能,而在与ROS相关的疾病中受到越来越多的关注。此外,与传统药物和材料相比,氢具有相对较小的分子质量,可以迅速扩散并穿透细胞膜,在各种急性和慢性炎症性疾病中显示出理想的生物学效应。
如图3A-B所示,与其他凝胶相比,2Mg@PEG-PLGA的氢生成能力显著降低了BMPO/•OH的特征峰强度,表明该材料具有出色的羟基自由基(•OH)清除能力。使用MEFs和RAW264.7细胞评估了2Mg@PEG-PLGA清除细胞内过量ROS的能力。为了控制Mg2+离子的影响,后续实验中使用了与2Mg@PEG-PLGA加载相同Mg含量的Mg(OH)2@PEG-PLGA组。根据CCK-8结果(图3C),2Mg@PEG-PLGA水凝胶的抗氧化保护效果明显大于其他组。此外,为了确定细胞内ROS清除的程度,使用了2',7'-二氯荧光素二乙酸酯(DCFH-DA),它在被细胞酯酶氧化时强烈发出绿色荧光(DCF),作为ROS指示剂。如图3D-G所示,在H2O2刺激的MEFs和RAW264.7细胞中观察到强烈的绿色DCF荧光信号,表明产生了丰富的ROS。与H2O2组相比,PLGA或Mg(OH)2@PEG-PLGA凝胶组的ROS水平未见显著变化。相比之下,2Mg@PEG-PLGA凝胶显著降低了H2O2处理的MEFs和RAW264.7细胞中的细胞内ROS水平(图3G)。总的来说,这些结果表明2Mg@PEG-PLGA凝胶能够通过消除有害的羟基自由基有效地保护不同细胞免受ROS介导的损伤,在骨质疏松症中清除ROS显示出巨大潜力。
体外2Mg@PEG-PLGA水凝胶的免疫调节作用
巨噬细胞在组织修复的启动和维持阶段起着至关重要的作用,特别是在表型极化的调节中[46]。M1巨噬细胞是促炎性的,而M2巨噬细胞减轻炎症并促进骨缺损再生。如图4A和图S12所示,与对照组相比,H2O2组的iNOS(M1巨噬细胞的标志物)数量显著增加,而Arg-1(M2巨噬细胞的标志物)的数量减少,表明H2O2响应下M1巨噬细胞极化增强,M2极化被抑制。相反,与H2O2组相比,2Mg@PEG-PLGA组的iNOS水平显著降低,Arg-1水平增加。这些结果表明,与仅用H2O2相比,2Mg@PEG-PLGA显著减少了M1巨噬细胞极化并诱导了M2巨噬细胞极化。通过流式细胞术(FCM)分析获得了类似的结果,其中M1巨噬细胞用CD86标记,M2巨噬细胞用CD206标记(图4B-C和图S13)。此外,检查了典型生物标志物的促炎细胞因子(TNF-α和IL-1β)和抗炎细胞因子(TGF-β和IL-10)的水平,以评估2Mg@PEG-PLGA的免疫调节效果(图4D-G)。结果显示,与H2O2组相比,2Mg@PEG-PLGA组的TNF-α和IL-1β的分泌显著降低,而TGF-β和IL-10的分泌显著增加,表明2Mg@PEG-PLGA凝胶具有优越的抗炎活性。
涉及氧化还原敏感转录因子的NF-κB信号通路调控炎症、成骨分化和细胞凋亡。许多研究表明,过量的ROS导致NF-κB信号通路异常激活,在H2O2组中也观察到类似结果,其中IκBα和NF-κB蛋白的磷酸化比率显著增加(图4H-J)。然而,与H2O2组相比,2Mg@PEG-PLGA组中IκBα对NF-κB的磷酸化比率显著降低,表明抑制了IκBα/NF-κB信号通路。值得注意的是,NF-κB通路在Mg(OH)2@PEG-PLGA组中也被下调。这些结果表明,除了通过H2缓解氧化应激外,下调NF-κB信号通路的潜在机制可能与2Mg@PEG-PLGA组中的Mg2+离子有关,它们可以抑制IκB的降解和游离NF-κB的产生。
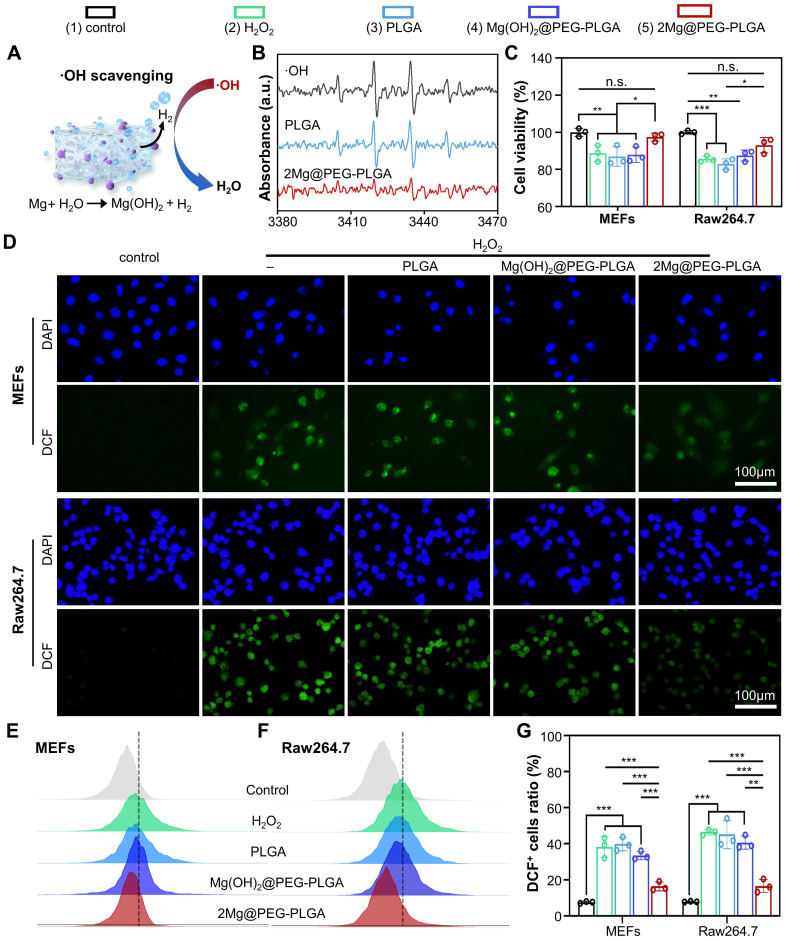
图3. 2Mg@PEG-PLGA水凝胶的ROS清除分析。(A) 示意图显示·OH与来自2Mg@PEG-PLGA水凝胶产生的H2的反应。(B) 通过ESR检测到的2Mg@PEG-PLGA对·OH的清除效果。(C) H2O2刺激的MEFs和RAW264.7细胞在有无水凝胶处理下的存活率。(D) 不同处理后MEFs和RAW264.7细胞中的ROS清除情况。(E-F) FCM结果显示不同处理后MEFs和RAW264.7细胞内的ROS水平,以及(G)相应的定量分析。
如上所述,2Mg@PEG-PLGA水凝胶通过调节巨噬细胞极化和抑制IκBα/NF-κB通路发挥显著的抗炎作用(图4K),这可能为体内成骨提供有益的免疫微环境。
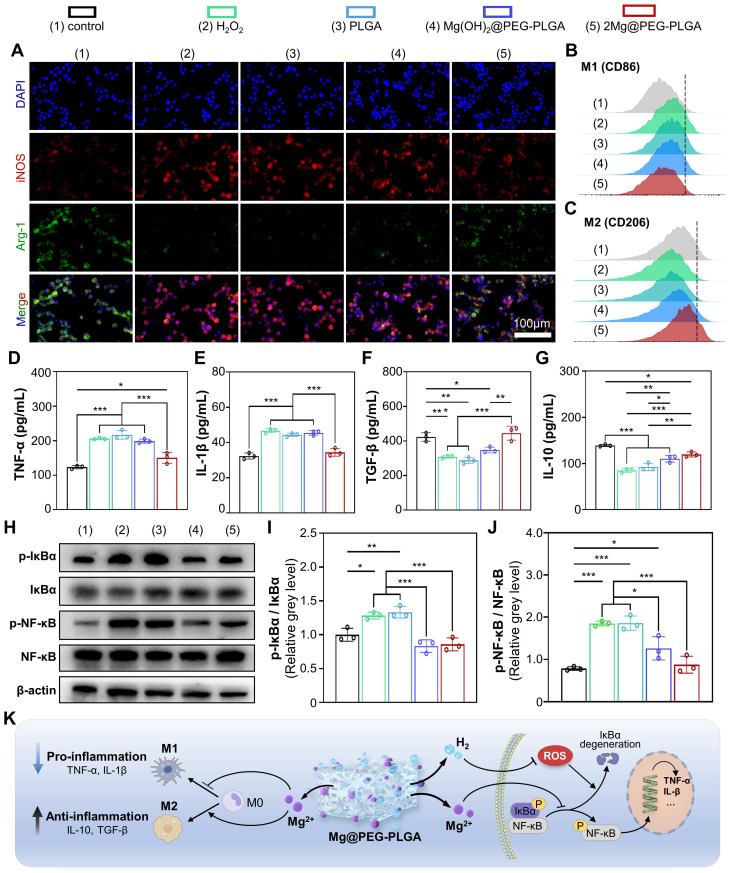
图4. 2Mg@PEG-PLGA水凝胶的免疫调节特性。(A)不同组别巨噬细胞中iNOS、Arg-1和DAPI染色的免疫荧光图像。FCM结果展示(B)M1(CD86+)和(C)M2(CD206+)巨噬细胞。(D-G)巨噬细胞悬液中TNF-α、IL-1β、TGF-β和IL-10的分泌水平。(H)指示组别中p-IκBα、IκBα、p-NF-κB、NF-κB和β-actin的代表性Western blot图像。定量分析(I)p-IκBα/IκBα和(J)p-NF-κB/NF-κB比率。(K)2Mg@PEG-PLGA凝胶的免疫调节机制示意图。
体外抗破骨和促成骨特性的2Mg@PEG-PLGA水凝胶
在骨质疏松症患者中,由于过度的破骨细胞生成和BMSCs成骨分化减弱,骨形成与吸收之间的平衡被打破,这对治疗骨质疏松性骨缺损提出了挑战。在此背景下,使用RAW264.7细胞研究了2Mg@PEG-PLGA凝胶对破骨细胞生成的影响。经过破骨细胞诱导后,OCM组和PLGA组之间破骨酶活性(通过TRAP染色分析)没有显著差异(图5A-B)。然而,在Mg(OH)2@PEG-PLGA和2Mg@PEG-PLGA组中观察到TRAP+多核破骨细胞的数量减少。破骨细胞分化的抑制可能归因于Mg2+离子的释放,已知这些离子在体外和体内都能抑制破骨细胞生成。此外,使用具有多能分化潜能的MEFs评估了2Mg@PEG-PLGA凝胶的成骨诱导能力。如图5C-D所示,与OBM组相比,2Mg@PEG-PLGA组的ALP蛋白水平和活性显著增加。此外,根据ARS染色分析(图5E-F),用2Mg@PEG-PLGA凝胶处理后,MEFs的生物矿化显著增加。
总之,2Mg@PEG-PLGA凝胶在体外展现出优异的抗破骨和促成骨特性,预计通过解决成骨细胞骨形成与破骨细胞骨吸收之间的不平衡,加速体内相关骨质疏松性骨再生。
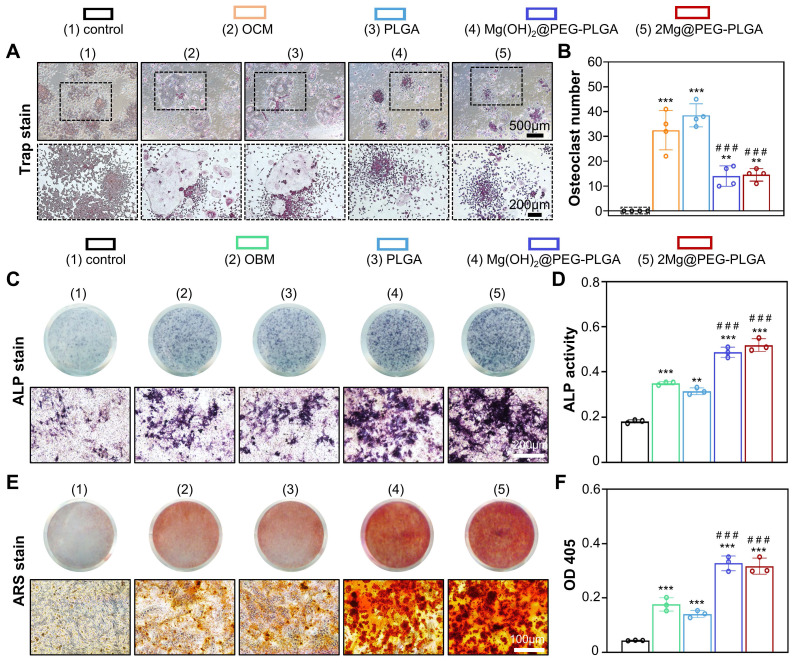
图5.体外抗破骨和促成骨特性的2Mg@PEG-PLGA水凝胶。(A)在补充有或无不同水凝胶的OCM中培养7天的RAW264.7细胞的TRAP染色,以及(B)每个孔中TRAP+细胞的相应定量分析。(C)在补充有或无不同水凝胶的OBM中培养7天的MEFs的ALP染色和(D)ALP活性定量分析。(E-F)在补充有或无不同水凝胶的OBM中培养14天的MEFs的ARS染色和相应定量分析。数据表示为平均值±标准差。**p < 0.01, ***p < 0.001,与对照组相比;###p<0.001,与OCM(图5B)或OBM(图5D和图5F)组相比。
超声引导下微创植入Mg@PEG-PLGA水凝胶
骨植入物将从微创属性中受益,以减少手术创伤,从而缩短愈合时间。如图S14所示,建立了一个兔子股骨髁缺陷模型(直径5毫米,深度3毫米),以评估超声引导下微创植入Mg@PEG-PLGA水凝胶的潜力。定位股骨髁缺陷后,在连续超声引导下缓慢插入一根针(16 G)(图S14C)。成功注射约25μL的水凝胶填充骨缺损。局部输注0.9%生理盐水5分钟后,观察到固化的Mg@PEG-PLGA水凝胶回声强度增加。这些结果表明,结合超声引导使用Mg@PEG-PLGA水凝胶进行骨缺损的微创治疗是可行的。
2Mg@PEG-PLGA水凝胶在体内骨质疏松骨缺损修复效果
使用已建立的骨质疏松股骨缺损模型在OVX大鼠中评估了2Mg@PEG-PLGA的骨质疏松骨缺损修复能力(图6A)。大鼠接受卵巢切除(OVX)或假手术。双侧OVX后三个月,微CT图像显示OVX大鼠的椎体比假手术大鼠的椎体具有更无序的小梁微观结构和扩大的空腔(图S15)。骨参数的定量分析显示OVX大鼠的BV/TV、BMD和Tb.Sp降低。H&E和Masson染色进一步揭示了由OVX程序在大鼠股骨和椎体中诱导的广泛骨质流失(图S16),确认了雌性OVX大鼠中骨质疏松的建立。随后,在大鼠股骨中创建了一个钻孔缺损,并用原位形成的复合凝胶进行治疗,如图6B所示。在Mg@PEG-PLGA水凝胶植入3天后,大鼠股骨的植入部位被暴露(图S17)。没有观察到水凝胶泄漏到周围组织中,固化的水凝胶与周围骨组织紧密粘附,表明Mg@PEG-PLGA水凝胶在体内植入后对骨缺损部位具有良好的粘附性。
在第4周和第8周,通过微CT和组织学分析评估了骨质疏松骨缺损的再生情况。新骨形成在股骨缺损中的代表性3D图像清楚地描绘了四组之间的差异(图6C)。与控制组、PLGA组和Mg(OH)2@PEG-PLGA组在缺损边缘形成的少量新骨组织不同,2Mg@PEG-PLGA组在术后8周时缺损几乎被新骨填满。根据定量微CT分析的结果,与控制组相比,2Mg@PEG-PLGA组在术后4周和8周时显示出明显更多的新骨量(图6D)。HE染色显示,在术后8周时,控制组的缺损区域充满了纤维组织,表明这样的骨缺损在骨质疏松条件下无法自我修复(图6E)。在PLGA组和Mg(OH)2@PEG-PLGA组中,术后4周和8周时仅在缺损边缘形成了少量的骨。值得注意的是,在术后4周时,2Mg@PEG-PLGA组观察到显著增加的骨再生,其中几乎一半的每个缺损被新形成的骨组织填满。伴随着2Mg@PEG-PLGA凝胶在8周时的完全降解,缺损区域被填充了重塑的骨组织和许多骨髓空间,证明了2Mg@PEG-PLGA水凝胶在体内修复骨质疏松骨缺损的优越效果。
此外,通过DHE、TRAP和IHC染色分析了缺损区域,以在细胞和分子水平上研究骨再生过程。为了评估2Mg@PEG-PLGA的体内ROS清除能力,如先前报道的那样应用了DHE探针。与之前发表的研究结果一致,OVX程序后ROS水平高度升高,表明恶劣的环境不利于骨质疏松骨的再生。如图7A-B所示,2Mg@PEG-PLGA凝胶显著逆转了植入区域内的局部ROS产生。此外,TRAP染色证实了2Mg@PEG-PLGA凝胶在体内的抗破骨细胞特性(图7C-D)。另外,通过IHC评估了缺损区域中成骨标志物(OPN和OCN)的表达。如图7E所示,2Mg@PEG-PLGA组观察到最高的OPN和OCN表达水平,表明增加了成骨和新骨再生。有趣的是,在Mg(OH)2@PEG-PLGA组也观察到ROS水平和破骨细胞数量减少。据报道,在骨质疏松条件下,过度激活的破骨细胞是过量ROS的主要来源之一。综上所述,这些发现表明,从镁基植入物释放的Mg2+离子可能通过抑制破骨细胞生成来清除骨质疏松症中的ROS。
为进一步研究2Mg@PEG-PLGA介导骨质疏松骨再生的内在机制,我们对对照组和2Mg@PEG-PLGA组4周的骨组织进行了高通量RNA测序(图8A)。热图(图S18)清楚地显示了下调基因(蓝色)的数量大于上调基因(橙色)的数量。火山图显示,与对照组相比,2Mg@PEG-PLGA组中62个基因的表达显著上调,413个基因的表达显著下调(图8B)。GO富集分析表明,这些基因显著参与了多个生物学过程,包括细胞粘附、单核细胞趋化性的负调节和细胞迁移过程的正调节(图S19)。为了更好地理解2Mg@PEG-PLGA凝胶中差异表达基因(DEGs)的生物学功能,我们进行了KEGG通路富集分析,结果显示MAPK信号通路、钙信号通路、GnRH信号通路和TNF-α信号通路高度参与了2Mg@PEG-PLGA的治疗过程(图8C)。值得注意的是,在炎症和破骨细胞分化中起关键作用的TNF-α信号通路在2Mg@PEG-PLGA组中受到显著抑制(图8D)。为了验证这一结果,我们评估了骨缺损区的TNF-α水平。正如预期的那样,2Mg@PEG-PLGA组的TNF-α水平明显低于对照组(图8E),这与上述体外实验结果一致。因此,我们得出结论,2Mg@PEG-PLGA凝胶可以通过抑制TNF-α信号通路减少体内炎症和破骨细胞生成,改善骨质疏松骨再生微环境(图8F)。
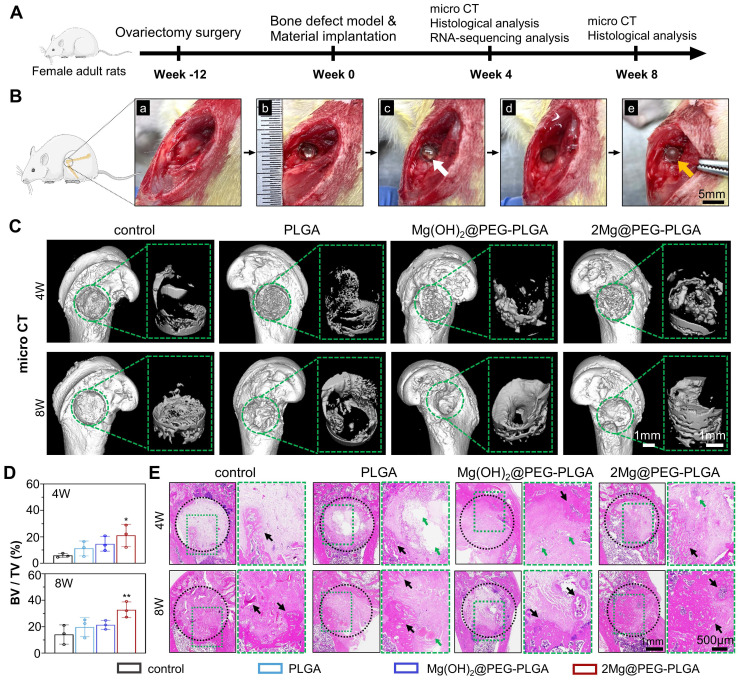
图6. 2Mg@PEG-PLGA水凝胶对骨质疏松性骨缺损的修复效果。(A)体内研究的时间表示意图。(B)2Mg@PEG-PLGA水凝胶在骨质疏松性骨缺损中原位植入的手术过程。(a-b)股骨外侧髁上构建骨缺损(直径3 mm ×深度3 mm)。(c-e)植入的2Mg@PEG-PLGA水凝胶在生理盐水中浸泡5分钟后凝固。白色和红色箭头分别表示凝胶状和固化的2Mg@PEG-PLGA凝胶。(C)大鼠远端股骨和新形成的骨缺损内骨的微CT三维重建图像,时间为4周和8周。绿色圆圈标记骨缺损。(D)通过微CT分析新形成骨缺损内的骨体积分数(BV/TV)。(E)不同组大鼠股骨在4周和8周时的HE染色。黑色圆圈标记骨缺损。绿色箭头表示残留材料。黑色箭头表示新形成的骨头。
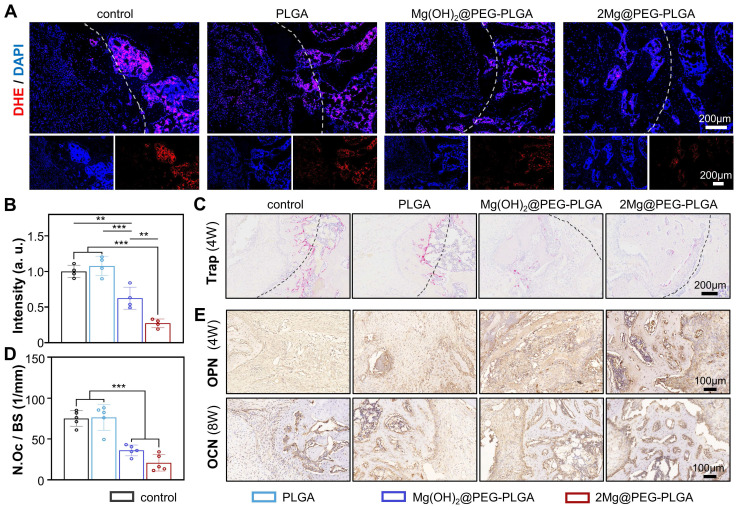
图7. 2Mg@PEG-PLGA水凝胶在体内清除活性氧(ROS)、抑制破骨细胞生成和促进成骨的能力。(A) 第4周骨缺损部位DHE染色的代表性图像和(B)相应的定量分析。白色虚线标记了骨缺损区域。(C) TRAP染色和(D)第4周骨缺损部位TRAP+破骨细胞数量的相应定量分析。黑色虚线标记了骨缺损区域。(E) 骨缺损中OPN和OCN的免疫组织化学染色图像。
2Mg@PEG-PLGA水凝胶的体内生物相容性分析
正如其他研究者及我们组所报告的,PLGA/NMP水凝胶是可生物降解且生物相容的,并被广泛用作纳米/微米材料和药物载体。此外,临床产品Eligard已被商业化并用于治疗晚期前列腺癌。在此,通过组织学和血清学分析处理过的大鼠来调查2Mg@PEG-PLGA的体内生物相容性。首先,收集实验大鼠的主要器官,包括心脏、肝脏、脾脏、肺、肾脏和大脑,进行H&E染色的病理分析(图S20),在2Mg@PEG-PLGA组中未观察到明显的组织学变化。其次,血清ALT、AST、BUN和CREA水平在正常参考范围内,表明2Mg@PEG-PLGA组在植入后前8周内肝脏和肾脏功能正常(表S1)。此外,2Mg@PEG-PLGA组在观察期间血清中的Mg2+浓度处于正常范围内(表S1)。这些初步结果显示,2Mg@PEG-PLGA凝胶可被视为一种潜在的无毒且具有生物相容性的植入物,能有效加速骨质疏松骨的再生。
结论
本研究包括了体外和体内评估的全面评价,为观察到的治疗效果提供了潜在的机制洞见。开发的2Mg@PEG-PLGA凝胶不仅解决了与骨质疏松性骨缺损相关的挑战,还提供了可注射性、控制氢气释放以及调节骨微环境的优势。这项研究通过引入一种结合氢气疗法和镁离子治疗骨质疏松性骨缺损的新方法,为骨再生领域做出了贡献。这些体外和体内的结果支持了这样一个观点:2Mg@PEG-PLGA凝胶通过调节炎症、破骨细胞生成和TNF-α信号通路有效地促进了骨再生。
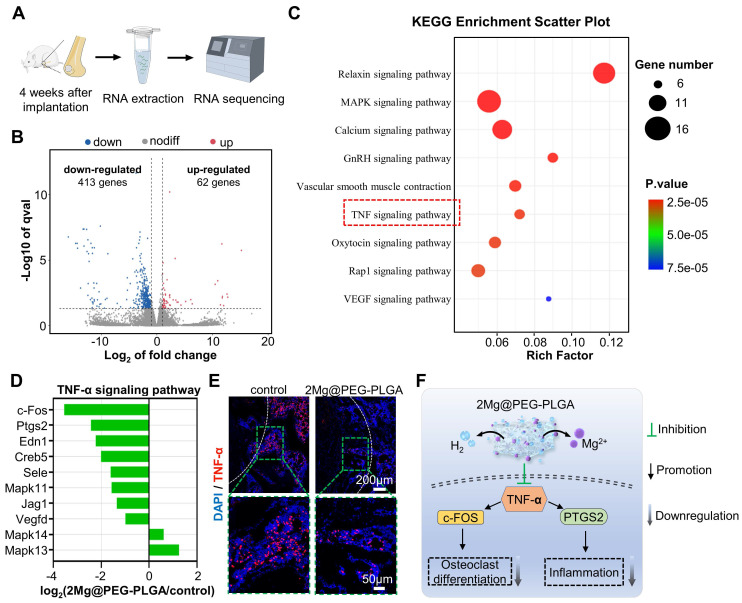
图8.使用转录组高通量测序研究了2Mg@PEG-PLGA凝胶对骨质疏松性骨缺损修复的影响。(A)在4周时从对照和2Mg@PEG-PLGA组提取的股骨缺损内组织的RNA序列分析示意图。(B)对照组和2Mg@PEG-PLGA组之间差异表达基因的火山图。(C)与对照组和2Mg@PEG-PLGA组之间显著差异表达的基因相关的代表性KEGG通路。(D)涉及TNF-α信号通路的差异表达基因。(E)4周时股骨缺损中TNF-α蛋白表达的免疫荧光图像。白色虚线标记了骨缺损区域。红色荧光:TNF-α;蓝色荧光:DAPI。(F)2Mg@PEG-PLGA通过抑制TNF-α信号通路下调破骨细胞生成和炎症的机制示意图。
重要的是,这项研究的成功为进一步研究和潜在的临床应用带来了机会。这些有希望的结果鼓励在其他模型中探索类似策略或优化凝胶配方以获得更广泛的应用。此外,长期研究评估2Mg@PEG-PLGA凝胶的持续效果和安全性档案对未来的临床转化将是宝贵的。
总的来说,这项研究展示了开发的2Mg@PEG-PLGA凝胶作为一种创新且有效的工具治疗骨质疏松性骨缺损的潜力,它具有独特的可注射性、控制气体释放和免疫调节特性。
实验部分
材料
镁微粒(约50 μm)购自上海乃欧纳米科技有限公司,中国。聚乙烯吡咯烷酮(PVP,MW = 40000)购自西格玛-奥德里奇(美国),而聚乙二醇(PEG,MW = 2000)、乙酸乙酯和1-甲基-2-吡咯烷酮(NMP)购自阿拉丁(上海,中国)。聚(乳酸-共-乙醇酸)(PLGA,MW = 40000, 50:50)购自济南大港生物材料有限公司,中国。本研究中使用的所有其他化学试剂均为分析纯,无需进一步纯化。
制备Mg@PEG微粒
为了制造具有不对称PEG涂层的Mg@PEG微球,采用了包埋法。简而言之,用丙酮彻底清洗镁微粒以去除任何多余的MgO层。随后,在玻璃板上轻轻喷涂一层精细的聚乙烯吡咯烷酮(PVP)作为镁微粒的基础。下一步是将镁微粒均匀分布在涂有PVP的表面上。接下来,小心地将溶解在乙酸乙酯中的2 wt% PEG溶液逐滴添加到镁微粒上。沉积完成后,通过从玻璃板上刮下仔细收集Mg@PEG微球。
制备PLGA和Mg@PEG-PLGA水凝胶
按照之前报道的方法准备PLGA水凝胶。简而言之,将PLGA颗粒引入到固定质量体积比的NMP溶液中,并在37°C下搅拌直至PLGA完全溶解。随后,通过机械搅拌将Mg@PEG微粒按不同质量比例加入到PLGA水凝胶中,形成Mg@PEG-PLGA水凝胶(表1)。为了确定Mg2+离子的潜在影响,按照上述相同程序准备了负载有与Mg@PEG-PLGA相当的镁含量的对照水凝胶Mg(OH)2@PEG-PLGA。
对于生物学分析,所有材料均通过紫外线(UV)照射或过滤灭菌进行消毒。简而言之,PLGA和合成的Mg@PEG微粒暴露于紫外线(UV)照射30分钟进行灭菌。NMP溶液通过0.22 μm针头过滤器(Millex)进行过滤灭菌。然后,在无菌条件下准备Mg@PEG-PLGA水凝胶。
材料表征
通过使用德国Zeiss Merlin Compact仪器的扫描电子显微镜(SEM)在金涂层后评估Mg和Mg@PEG颗粒的形态。使用与SEM相同的参数,通过能量色散光谱(EDS)进行元素映射。为了确定Mg@PEG微球中Mg的含量,进行了热重分析(TGA;TGA5500)。通过数字成像记录了Mg@PEG-PLGA凝胶的可注射性、液-固相变和形状适应性。为了评估Mg@PEG-PLGA水凝胶对骨缺损部位的粘附性,将约20 μL的水凝胶注入每只大鼠的股骨髁缺损(直径和深度均为3 mm)中。用0.9%生理盐水冲洗5分钟后,在旋转测试中记录了Mg@PEG-PLGA水凝胶的变化。使用日本Rigaku Ultima IV仪器进行了X射线衍射(XRD)实验。使用美国Thermo Scientific K-Alpha设备进行了X射线光电子能谱(XPS)分析。使用美国INSTRON万能材料测试机评估了固化的PLGA和Mg@PEG-PLGA凝胶的机械性能,测试速度为1 mm/min,直到样品变形60%。制备形状均匀(直径5 mm,高6 mm)的水凝胶样品,并进行压缩测试,弹性模量计算为应力-应变曲线中对应于0-5%应变的线性区域的斜率。使用傅里叶变换红外(FTIR)光谱仪(Nicolet 6700)获取红外光谱。
Mg@PEG-PLGA水凝胶的H2释放和孔隙分析
使用亚甲基蓝(MB)探针基于先前报道的方法评估了H2释放。MB(特征吸收峰在664 nm处)可以在Pt纳米颗粒存在下与H2反应生成无色亚甲蓝(leucoMB),按照以下方程式:
MB(蓝色)+ 2H+ + 2e- → leucoMB(无色)
简而言之,将1 mL的每个Mg@PEG-PLGA凝胶引入到MB-Pt探针溶液中(MB:30 μM,Pt:2 w/w%,10 mL)。在指定的时间间隔,替换MB-Pt探针溶液,并使用UV‒Vis分光光度计(UV-3101PC Shimadzu光谱仪)监测MB-Pt探针溶液在664 nm处的吸光度变化。随后,基于MB标准曲线量化了H2释放。
在金涂层后,通过SEM检查了固化的PLGA和Mg@PEG-PLGA凝胶的形态特征和元素映射。使用自动孔隙分析仪(AutoPore 9500,美国)确定了固化凝胶的孔结构。所有分析均进行了三次重复,以获得可靠和可靠的结果。
Mg@PEG-PLGA水凝胶的降解
将1 mL的PLGA和Mg@PEG-PLGA(负载不同Mg浓度)样品加入到10 mL的PBS中,在37°C下持续4周,期间每周更换一次溶液。在每个指定的时间点,使用美国PerkinElmer Optima 8000仪器的感应耦合等离子体-光学发射光谱法(ICP-OES)定量了PBS中的Mg2+浓度。使用pH计(Smart Sensor,中国)监测了PBS的pH变化。
体外成骨分化
将MEFs(每孔5×10^3)接种到24孔板中,培养过夜。然后,将培养基更换为不同处理组的成骨诱导培养基,即PBS(OBM组)、PLGA、Mg(OH)2@PEG-PLGA和2Mg@PEG-PLGA,分别培养7天和14天。对于碱性磷酸酶(ALP)染色,用PBS洗涤细胞并用4%多聚甲醛固定15分钟。然后,用PBS洗涤细胞三次,并用BCIP/NBT ALP显色试剂盒(Beyotime,中国)进行染色。通过ALP检测试剂盒(Beyotime,中国)按照制造商的说明书评估ALP活性。对于茜素红S(ARS)染色,如上所述固定细胞,并使用茜素红工作液(Beyotime,中国)染色30分钟。为了定量分析ARS染色结果,向每个孔中加入500 μL的10%乙酸,并在405 nm处用平板阅读器读取吸光度。仅用培养基处理的细胞作为对照组。
超声引导下的微创植入Mg@PEG-PLGA水凝胶
为了评估结合超声引导使用Mg@PEG-PLGA水凝胶进行骨缺损微创治疗的可行性,使用低速球形磨钻建立了兔股骨髁缺损模型(直径5 mm,深度3 mm)。然后,使用超声机器(VisualSonics, Inc., 加拿大)进行了超声引导的Mg@PEG-PLGA水凝胶(约25 μL)注射。局部输注0.9%生理盐水5分钟后,获取了植入部位的超声图像。
骨质疏松大鼠骨缺损模型
所有动物程序均遵循中国科技部卫生指南关于实验室动物护理和使用指南,并获得重庆医科大学机构伦理委员会(IEC)的批准。对10周龄(250-300 g)的雌性Sprague-Dawley大鼠进行卵巢切除术(OVX),然后维持12周以建立卵巢切除骨质疏松模型。随后,收获一些OVX大鼠的股骨和椎体,用4%多聚甲醛固定48小时,并进行微CT(µCT100,Scanco Medical,瑞士)和组织学分析。进行微CT数据分析和远端股骨干骺端的组织学染色,以评估OVX大鼠的骨丢失程度。
其他OVX大鼠通过腹腔注射戊巴比妥(40 mg/kg)进行麻醉。在连续生理盐水冲洗下,使用低速球形磨钻在股骨外侧髁突上创建一个圆柱形缺损(直径和深度均为3 mm)。大鼠随机分为四组:(1)缺损不填充(对照组);(2)缺损填充PLGA水凝胶(PLGA组);(3)缺损填充Mg(OH)2@PEG-PLGA水凝胶(Mg(OH)2@PEG-PLGA组);(4)缺损填充2Mg@PEG-PLGA水凝胶(2Mg@PEG-PLGA组)。大约注入20 μL的水凝胶以完全填充骨缺损。将水凝胶在0.9%生理盐水中浸泡5分钟后,手术部位逐层缝合。所有操作均在无菌条件下进行。
骨质疏松骨缺损修复的体内表征
手术后四周和八周时,每组三只大鼠以评估水凝胶的骨修复效果。收获的股骨用4%多聚甲醛固定48小时以备后续分析。样本通过微CT系统(µCT100, Scanco Medical, 瑞士)扫描,并使用微CT系统软件进行再生骨的3D重建。定量分析骨组织体积/总组织体积(BV/TV),并与对照组比较以评估骨再生的程度。为了评估水凝胶的体内抗氧化效果,如之前报道,第四周时使用二氢乙啶(DHE)染色测量骨缺损处的活性氧物种(ROS)差异。脱钙后,样本准备用于后续的组织学检查。按照制造商的说明进行了苏木精和伊红(HE)、TRAP以及骨桥蛋白(OPN)和骨钙素(OCN)的免疫组织化学染色。
为了进一步研究2Mg@PEG-PLGA水凝胶促进骨质疏松骨缺损修复的机制,我们从对照组和2Mg@PEG-PLGA组各选取了三只大鼠股骨缺损样本进行转录组测序和后续生物信息学分析。简而言之,样本在植入4周后收集,立即浸入液氮中,并储存于-80°C。通过单向方差分析(ANOVA),定义差异表达基因(DEGs)的标准为变化倍数>2且P值<0.05。使用Gene Ontology(GO)平台对DEGs进行功能富集分析。此外,使用京都基因与基因组百科全书(KEGG;)来识别与DEGs显著相关的通路。将P值阈值<0.05的通路视为进一步探索的潜在目标通路。
https://blog.sciencenet.cn/blog-41174-1440684.html
上一篇:GLP-1受体激动剂平息大脑食物噪音的机制
下一篇:神经科学家不该害怕研究宗教