博文
氢气用于药物性间质性肺病案例【马】
||
氢气用于药物性间质性肺病案例
药物性间质性肺病(DIILD)是癌症治疗中可能出现的严重并发症。常规治疗方法包括大剂量糖皮质激素和支持性护理。本病例报告旨在探讨氢疗在DIILD管理中的潜在作用。一名64岁女性被诊断为早期HER2阳性乳腺癌,并接受了辅助化疗。在第4周期随访期间,她出现呼吸困难,最初被认为是肺炎所致。然而,她的病情迅速恶化,因呼吸衰竭需要住院并在重症监护室(ICU)接受呼吸支持。CT显示提示间质性肺病的改变,因此开始使用大剂量糖皮质激素。尽管如此,她的临床状况仍未改善,由于持续的氧饱和度下降和体力耐受降低,出院时配备了氢/氧吸入机。出院两周后,她在随访中显示出显著恢复,能够在不吸氧的情况下行走。已有多项研究报道氢疗具有抗炎和抗氧化特性。虽然部分文章报告了氢疗在这些疾病中的疗效,但它仍处于研究阶段,缺乏强有力的科学证据。基于本病例,我们认为氢吸入疗法可能是DIILD的一种有前景的治疗选择。

Lin, Ooi Po, Ho Gwo Fuang, and Chiew Wern Way. "Inhalation Hydrogen Therapy in Drug-Induced Interstitial Lung Disease: A Case Report."
一、引言
抗肿瘤药物是药物性间质性肺病(DIILD)的主要原因,占病例的23%–51%,其中博来霉素、依维莫司、厄洛替尼、曲妥珠单抗德鲁替康以及免疫检查点抑制剂是最常见的致病药物[1]。本病例展示了一名接受含表柔比星和环磷酰胺化疗并合并肺栓塞的患者所面临的诊断困境。她出现了4级DIILD[2],随后在糖皮质激素和氢/氧治疗后好转。
二、病例介绍
A. 患者信息
我们报告一名64岁华人女性,既往有控制良好的2型糖尿病和高血压。她的体能状态(PS)为0。她最初于2023年4月因左乳1cm肿块就诊,检查显示左乳浸润性导管癌(IDC),cT1N0M0,雌激素受体(ER)阴性,孕激素受体(PR)阴性,人表皮生长因子受体(HER2)扩增。诊断时的胸腹部盆腔计算机断层扫描(TAP CT)未发现远处转移,肺野正常。她随后于2023年6月15日接受了保乳手术和前哨淋巴结活检(SLNB),病理显示1cm IDC伴导管原位癌(DCIS)成分,前哨淋巴结4/4阴性,切缘干净。术后出现伤口裂开并感染粘质沙雷菌,经环丙沙星充分治疗后好转,因此辅助治疗启动时间延迟。
她于2023年8月开始接受表柔比星/环磷酰胺(EC)辅助化疗,前3周期耐受良好,仅出现1级乏力。她原计划进行第4周期化疗,并到门诊复查。她主诉咳嗽伴黄痰3周,活动耐量下降,并出现胸膜炎性胸痛,但无其他提示脓毒症的症状和体征。临床检查未发现明显异常,尤其是肺部。胸片未见明显异常。化疗被推迟,但未立即住院。她于同一天因呼吸衰竭就诊于急诊科。
B. 临床发现
在急诊科,她被发现呼吸急促,呼吸频率为25次/分钟。她出现呼吸窘迫,使用辅助呼吸肌。肺部检查显示双侧广泛湿啰音。她的血氧饱和度较低,SPO2为90%。
C. 诊断评估
急诊科动脉血气分析显示1型呼吸衰竭。血液检查显示白细胞(WBC)计数正常,为6.3×10⁹/L,C反应蛋白(CRP)升高至99.8mg/dL。门诊就诊时的胸片未见明显异常。急诊科复查胸片显示双侧弥漫性网状阴影。呼吸道病原体检测(病毒PCR)显示人鼻病毒/肠道病毒和流感嗜血杆菌感染。痰培养及药敏(2023年10月16日)显示鲍曼不动杆菌生长,对氨苄西林-舒巴坦、头孢他啶和头孢吡肟敏感。其他检查包括结核(TB)相关检查、TB GeneXpert、血培养均无阳性结果。由于抗生素治疗1周后仍无改善,最终进行了CT肺动脉造影(CTPA),显示右上叶前段和后段以及左下叶后段的亚段肺栓塞,并伴有双侧感染性肺部改变,包括磨玻璃影和实变影(图1)。
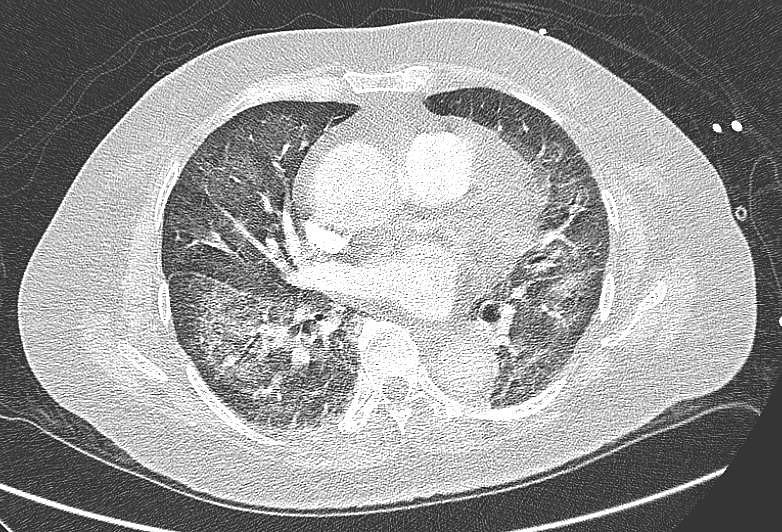
图1. 胸部CT显示双肺中央支气管血管周围分布的磨玻璃影及网状肺改变
D. 诊断挑战
她最初接受静脉哌拉西林-他唑巴坦治疗,并加用阿奇霉素覆盖非典型病原体。尽管如此,她的临床状况仍未改善,即使升级为美罗培南,她仍然呼吸急促。她的病情恶化,因持续1型呼吸衰竭而接受无创呼吸支持。随后根据培养和药敏结果调整抗生素为静脉氨苄西林-舒巴坦。她还接受依诺肝素治疗肺栓塞。她的炎症指标包括白细胞计数和CRP均已恢复正常。尽管感染和肺栓塞得到充分治疗,她仍无法脱离持续气道正压通气(CPAP),并且在不吸氧的情况下无法维持血氧饱和度,也无法用力走到卫生间。因此,做出了DIILD的诊断。
E. 诊断
本病例在治疗过程中的诊断难点在于多种疾病可能导致呼吸困难症状。尽管努力治疗感染和肺栓塞,她的主要临床症状(呼吸困难)仍然没有改善。在开始口服泼尼松龙3天后,她的临床状况迅速改善,这支持了DIILD的诊断。最终诊断为化疗(表柔比星/环磷酰胺)相关的DIILD,合并人鼻病毒/肠道病毒和流感嗜血杆菌感染,以及并发肺栓塞。
F. 治疗干预
她开始接受大剂量口服泼尼松龙60mg,每日两次。开始使用类固醇3天后,她的临床状况迅速改善。最终在3天后成功脱离CPAP,改为文丘里面罩,随后改为鼻导管3L/min。类固醇在4周内逐渐减量。出院时,她开始使用由上海潓美医疗科技有限公司生产的AMS-H-01型氢(H₂)/氧(O₂)机进行治疗,其中氢浓度为66.66%,氧浓度为33.33%,流量为3L/min,雾化速率为30ml/h。患者最初每天24小时持续使用,并在2周内逐渐减量。随后她能够进一步减量,仅在夜间睡觉时使用。在2周复查时,她仅在活动后感到呼吸困难时间歇性使用。氢/氧给药的调整是根据患者的临床症状进行的。
G. 随访和结果
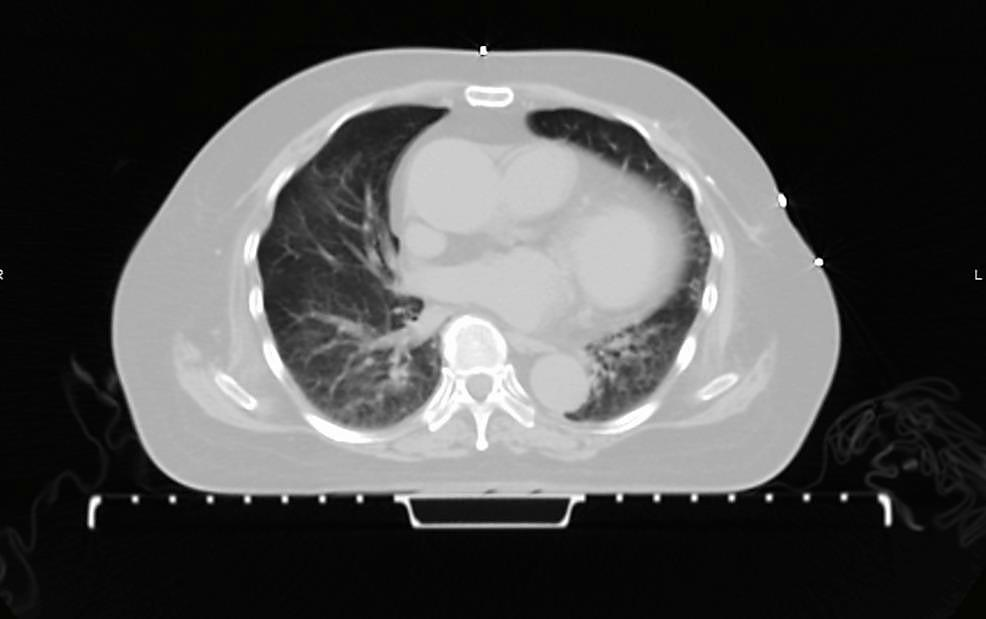
图2. 胸部CT显示双肺网状改变明显改善
出院时,患者每天24小时使用3升氢/氧治疗。她的日常生活活动依赖他人,行走需要辅助。两周后在门诊复查时,她未携带氧气,能够独立行走,无任何困难。此时,她的临床症状已完全缓解。肺部检查也显示双侧无湿啰音。胸片显示肺野网状阴影已消失。1个月后进行的胸部CT显示双肺网状改变显著改善(图2)。她对氢/氧治疗耐受良好,无不良事件。她最终也在4周内逐渐停用泼尼松龙。随后决定不再继续化疗,并开始对右侧乳腺进行放疗。自化疗停止以来,她的疾病仍处于缓解期,并且在2年的随访中临床状况良好。
三、讨论
本病例的一个显著局限性是同时使用了糖皮质激素,这可能对患者的临床改善起到了一定作用。由于类固醇治疗和氢疗均在治疗过程中启动,因此难以确定每种干预对肺炎的缓解和症状改善的具体贡献程度。观察到的恢复可能代表两种治疗的综合效果,而非单纯对氢疗的反应。迄今为止,尚无已发表的研究专门评估糖皮质激素与氢疗的联合使用,因此潜在的协同或累加效应仍不确定。
间质性肺病(ILD)的发病率在马来西亚或全球范围内尚未得到全面记录,这可能是由于该疾病的诊断较为复杂。在诊断特发性间质性肺炎之前,应谨慎排除继发性因素。美国胸科学会/欧洲呼吸学会(ATS/ERS)分类是间质性肺病(ILD)的关键分类系统,主要根据组织病理学和影像学模式进行划分。该框架将ILD大致分为特发性间质性肺炎(IIP)、未分类IIP以及继发性ILD。IIP包括多个亚组,例如慢性纤维化类型(如特发性肺纤维化IPF和特发性非特异性间质性肺炎NSIP);吸烟相关类型(如呼吸性细支气管炎相关ILD RB-ILD和脱屑性间质性肺炎DIP);急性和亚急性形式(如隐源性机化性肺炎COP和急性间质性肺炎AIP);以及罕见类型(如淋巴细胞性间质性肺炎LIP和特发性胸膜肺实质纤维弹性增生症PPFE)。由于特征重叠或组织样本有限而无法明确归入单一诊断类别的病例被分类为未分类IIP。相比之下,继发性ILD包括与已知原因或系统性疾病相关的类型,例如结缔组织病相关ILD(CTD-ILD)、药物性ILD、过敏性肺炎(HP)、结节病以及尘肺病(如石棉肺或矽肺)。该分类提供了一种结构化方法,整合临床、放射学和病理学数据,以指导诊断和管理[3]。当无法确定具体原因时,该疾病被归类为特发性或原发性,诊断依赖组织学和影像学技术。
多种已确定的药物与药物性间质性肺病(DIILD)相关。例如,博来霉素、胺碘酮、甲氨蝶呤、来氟米特以及多种靶向抗癌药物(如EGFR抑制剂、mTOR抑制剂、免疫检查点抑制剂)在多项综述和药物警戒研究中均被报道可导致ILD[4-5]。然而,DIILD的临床、病理和影像学特征通常较为模糊,难以与其他形式的间质性肺炎区分。DIILD的诊断主要是排除性诊断,需要仔细排除可能表现为类似临床或影像学特征的其他病因,例如肺部感染、心源性肺水肿、液体超负荷、肺栓塞或疾病进展。
确诊需要将药物暴露与症状发作之间的时间关系、典型影像学表现以及停药后的改善情况进行综合分析。整合临床、放射学以及(在可用时)病理学数据的多学科评估对于提高诊断可信度并将DIILD与其他弥漫性肺损伤原因区分开来至关重要。尽管许多ILD病例表现出重叠的临床和影像学特征,但仍有相当一部分病例最终被归类为特发性。ILD的发病机制通常涉及肺实质内的慢性炎症和损伤,而肺实质是负责气体交换的功能组织。由肺泡、肺泡管和细支气管组成的肺实质含有多种细胞因子、生长因子和结构蛋白,这些物质在持续激活时会促进成纤维细胞增殖和细胞外基质沉积。反复的上皮损伤和修复失调最终导致结缔组织过度积聚,从而引起进行性肺纤维化和呼吸功能受损[6]。
DIILD的管理核心是及时识别并停用致病药物,随后给予支持性护理,并在特定情况下使用糖皮质激素治疗。尽早停用致病药物是最关键的干预措施,因为持续暴露会显著恶化预后[7]。全身性糖皮质激素常用于中重度病例,已被证明有助于加速影像学和症状改善,尽管证据主要来自病例系列而非随机试验[4]。对于类固醇难治性或复发性病例,可根据具体情况考虑使用硫唑嘌呤或环磷酰胺等其他免疫抑制剂,但相关数据仍然有限[8]。支持性治疗(包括氧疗、肺康复和感染预防)对于优化恢复和预防并发症至关重要。对于对药物治疗无反应的严重或进展性疾病,可能需要考虑转诊进行肺移植。
由肿瘤学家、呼吸科医生和放射科医生组成的多学科团队对于确保准确诊断、监测疾病进展以及指导必要药物的安全重新使用或替代至关重要[5]。
尽管Dole等人的早期研究提出了氢气(H₂)作为治疗性气体的概念,但随后的几十年中,人们对其生物学效应和临床意义有了更详细的理解[9]。现代研究表明,H₂作为一种选择性抗氧化剂和抗炎分子,可靶向细胞毒性活性氧并调节Nrf2和NF-κB等信号通路[10]。
临床前研究表明,在包括辐射和博来霉素诱导的肺损伤在内的动物模型中,H₂可以减轻氧化应激并减少纤维化[11]。最近的人体研究——尤其是在病毒性肺炎和早期间质性肺病患者中——表明H₂可能有助于改善氧合、呼吸困难和炎症生物标志物,同时具有良好的安全性[12]。然而,支持H₂在药物性间质性肺病(DIILD)中应用的证据仍然有限。目前尚无随机对照试验专门评估H₂作为DIILD的辅助治疗。因此,本病例中观察到的改善可能反映了类固醇反应、自发恢复或H₂治疗的潜在协同效应。未来需要进一步研究以确定DIILD中H₂的最佳给药方式、剂量和时机。
中国最近使用由潓美医疗科技有限公司开发的医用级氢/氧发生器(MS-H-01/AMS-H-03)进行的临床试验显示,其在治疗哮喘和慢性阻塞性肺疾病(COPD)等呼吸系统疾病方面取得了良好效果。在COVID-19大流行期间,中国国家卫生健康委员会推荐使用66.6%氢/33.3%氧混合气体治疗COVID-19,该建议得到了世界卫生组织中国办公室的支持[13]。本报告中的患者有机会使用与这些临床试验相同的AMS-H-01设备。尽管ILD中的确凿数据仍然有限,但ILD中氧化应激、炎症损伤和纤维化之间的机制重叠为辅助氢疗提供了合理的治疗依据。在这名表现为药物性ILD特征的患者中,氢疗作为糖皮质激素治疗的辅助手段被引入,旨在减轻氧化和炎症性肺损伤并促进恢复。
由于DIILD的一个潜在机制是炎症驱动的纤维化,因此氢疗被认为通过中和自由基发挥作用,如图3所示。研究表明,氢可以抑制羟自由基(•OH)和其他活性氧(ROS)的产生[14-15]。包括平野真一(Shin-ichi Hirano)及其同事在内的研究人员提出,氢还可能通过调节基因表达发挥间接作用,例如减轻炎症、促进抗氧化、调节凋亡或焦亡[16]。虽然ILD中的临床数据有限,但早期ILD试验提供了初步的直接信号。COPD急性加重研究中的可靠结果证明了在病变肺中的可行性和耐受性,为ILD环境中的氢疗提供了支持性背景。动物模型,特别是吉非替尼诱导的肺损伤研究,为药物性DIILD提供了理论桥梁。然而,迄今为止,没有任何人体试验专门针对DIILD或将氢作为主要治疗手段。因此,氢疗可被视为一种实验性辅助治疗,其合理性来自机制上的可行性和一些早期人体信号,但需要谨慎解读。类固醇的联合使用和自发恢复仍然是潜在的混杂因素。应当承认,目前缺乏针对DIILD的精心设计的临床试验,本病例可能有助于为未来研究提出假设。
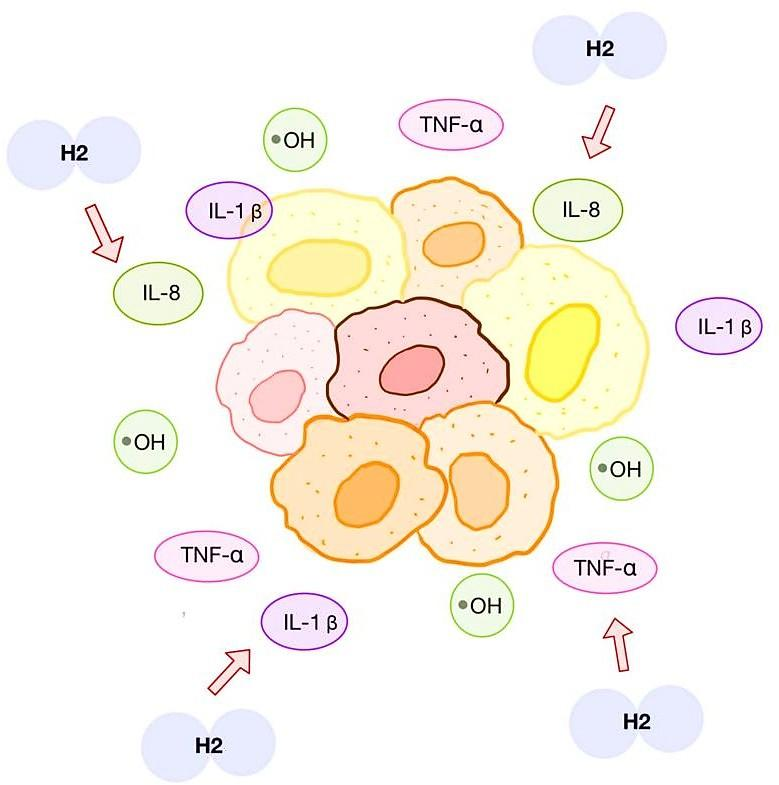
图3. 氢分子在DIILD中作为自由基清除剂的 Proposed Mechanism(示意图)
作者原创绘制。H2:氢分子,IL-8:白细胞介素-8,IL-1β:白细胞介素-1β,•OH:自由基,TNF-α:肿瘤坏死因子
四、结论
氢疗代表了一种新颖且具有生物学合理性的辅助治疗方法,可用于药物性间质性肺病(DIILD)的管理。在临床前研究和其他呼吸系统疾病的有限临床研究中,氢已被证明具有抗氧化和抗炎特性,这表明它可能有助于减轻DIILD中导致纤维化进展的氧化和炎症性肺损伤。在本病例中,糖皮质激素和氢疗的联合使用与症状和影像学改善相关;然而,由于治疗效果重叠且缺乏对照数据,无法确定因果关系。目前,氢疗在DIILD中的作用仍处于实验阶段,主要得到来自哮喘、COPD和病毒性肺炎研究的机制合理性和早期可行性证据的支持。未来需要进一步的前瞻性随机试验来阐明其疗效、最佳剂量、安全性以及与糖皮质激素等既定治疗的相互作用。在获得此类数据之前,氢疗应仅被视为多学科临床决策框架内的一种支持性或研究性选择。
https://blog.sciencenet.cn/blog-41174-1519155.html
上一篇:开放科学运动真的如支持者所言那般有益吗?
下一篇:牙齿感染可导致糖尿病