博文
衰老损害身体对严重感染的反应  精选
精选
|
衰老损害身体对严重感染的反应
一项在小鼠中的研究表明,一个在年轻小鼠中能保护其免受败血症侵害的基因,在老年小鼠中却会增加死亡风险。
扫描电子显微镜图像显示大量金黄色葡萄球菌。
金黄色葡萄球菌(经人工染色)被注射到小鼠体内,引发名为败血症的严重疾病。
根据一项发表在《自然》杂志上的小鼠研究,年轻时保护身体免受感染的基因在老年时可能会造成伤害。研究结果表明,衰老会以意想不到的方式降低免疫力,而不仅仅是削弱免疫反应。
研究作者报告称,心脏中一个特定基因的存在有助于小鼠在强毒性感染中存活——但前提是小鼠是年轻的。对于老年小鼠来说,该基因反而增加了死亡风险。
“在一种情况下它是保护性的,在另一种情况下它实际上会导致死亡。”康涅狄格州纽黑文耶鲁大学的免疫学家安德鲁·王(Andrew Wang)说,他并未参与这项研究。该研究表明,“保护器官的机制确实可能存在巨大差异”。
这些关于年龄如何影响身体承受病原体入侵能力的发现,于1月14日发表在《自然》杂志上,研究人员表示,这可能是朝着开发治疗某些疾病的疗法迈出的一步,这些疾病的特征是广泛的免疫功能障碍损害身体。
承受攻击——以及防御
在感染中存活下来,既需要免疫系统击退有害入侵者,也需要身体避免病原体和过度活跃的免疫细胞造成的损伤。
年轻人通常既能承受感染,也能承受身体为杀死感染性生物而释放的免疫防御。“但随着年龄增长,你做到这一点的能力会下降。”英国爱丁堡大学的免疫学家马努·尚卡尔-哈里(Manu Shankar-Hari)说。
衰老与炎症相关——但仅在工业化国家
为了理解这种承受能力为何会随着动物寿命的增加而下降,该小鼠研究的合著者、加州圣地亚哥索尔克生物研究所的免疫学家珍妮尔·艾尔斯(Janelle Ayres)及其同事研究了一种名为败血症的危及生命的疾病。当免疫系统对感染产生过度反应时,就会发生败血症。由此产生的免疫风暴会导致器官损伤,有时甚至死亡。除了常规抗生素外,目前没有针对性的治疗方法。
作者给小鼠注射了大剂量细菌,导致许多动物患上败血症。一组包括年轻小鼠(相当于人类20–30岁);另一组是老年小鼠(相当于人类56–69岁)。
令人惊讶的是,死亡的年轻小鼠与死亡的老年小鼠相比,表现出不同的器官损伤模式。作者将这种差异与一个名为 Foxo1 的基因联系起来。在年轻小鼠中,该基因可以防止败血症引起的心脏损伤和死亡。但在老年小鼠中,它会导致严重的心脏萎缩和死亡。
越“老”越“完美”?
科学家删除了老年小鼠的 Foxo1 基因,发现这些啮齿动物更能在败血症中存活——这证实了该基因对于承受感染和伴随的免疫反应的能力至关重要。相比之下,在年轻小鼠中删除 Foxo1 会使它们更容易受到严重感染和死亡的影响。
那么,老年人在面对严重感染时是否“注定会有生物学上的厄运”?“简短的答案是‘不’。”艾尔斯在一份声明中说。“衰老改变了生存规则,但并没有消除保护的可能性。”
这些发现表明,“治疗年轻人的方法必须与治疗老年人的方法非常不同。”葡萄牙奥埃拉什古尔班基安分子医学研究所的免疫学家米格尔·苏亚雷斯(Miguel Soares)说。
新闻二:
衰老重塑身体对感染的耐受性
在危及生命的败血症中,保护年轻小鼠免于器官功能障碍的同一信号通路,会加剧老年动物的损伤和致死率。
米格尔·P·苏亚雷斯(Miguel P. Soares)和埃莉萨·詹托(Elisa Jentho)
衰老如何影响我们的身体处理感染的方式?桑切斯等人在《自然》杂志上发表的研究通过研究不同年龄的小鼠对致命细菌感染的反应来寻找答案。研究结果表明,使年轻小鼠能够存活的相同遗传程序,在生命后期会增加死亡风险,这为20世纪50年代首次提出的一种进化理论提供了进一步的分子证据。该研究还表明,有必要扩大治疗策略,以考虑感染后器官功能障碍的年龄依赖性影响。
桑切斯及其同事研究了衰老如何改变身体保护自己免受败血症侵害的方式。败血症是一种危及生命的器官功能障碍,估计每年导致1100万人死亡。败血症是由宿主对不同类别病原体的感染产生失调反应引起的——最常见的是细菌,但也包括病毒、真菌和原生动物寄生虫。研究人员用细菌接种物感染年轻和老年小鼠(分别代表人类20–30岁和56–69岁),剂量经过调整,使每个群体中有50%会死于败血症。然后,作者着手识别和表征决定生存的应激反应遗传程序中存在的年龄依赖性差异。他们的发现挑战了一个被广泛接受的观点,即随着年龄增长而增加的感染易感性主要归因于免疫系统的逐渐衰退。
尽管年轻小鼠和老年小鼠的细菌负荷相似,但两组在疾病的严重程度和结果上表现出显著差异。未存活的年轻动物出现心肌增大(心脏肥大),并伴有严重充血(这会降低心脏有效泵血的能力)和心脏损伤。相比之下,未存活的老年小鼠表现出心脏萎缩(肌肉萎缩)和肾功能衰竭,且比年轻小鼠更为明显。这些相反的模式表明,控制组织损伤的机制存在根本不同的年龄依赖性。这些模式反映了疾病耐受性,这是一种进化上保守的防御策略,通过限制组织损伤而不是直接针对病原体来支持宿主在感染中的存活。
作者通过一种名为“拮抗多效性”的进化概念来解释他们的发现。该理论认为,在生命早期给生物体带来适应优势的基因,可能会在生命后期、繁殖年龄结束后、自然选择压力减弱后带来健康成本。
桑切斯及其同事证明,转录因子 Foxo1 及其靶基因 Trim63(编码 MuRF1 蛋白)在心脏中的表达,可以保护年轻小鼠免受感染诱导的心脏重塑和损伤。然而,在老年宿主中,同一通路会导致更严重的心脏病理和更高的死亡风险(图1)。
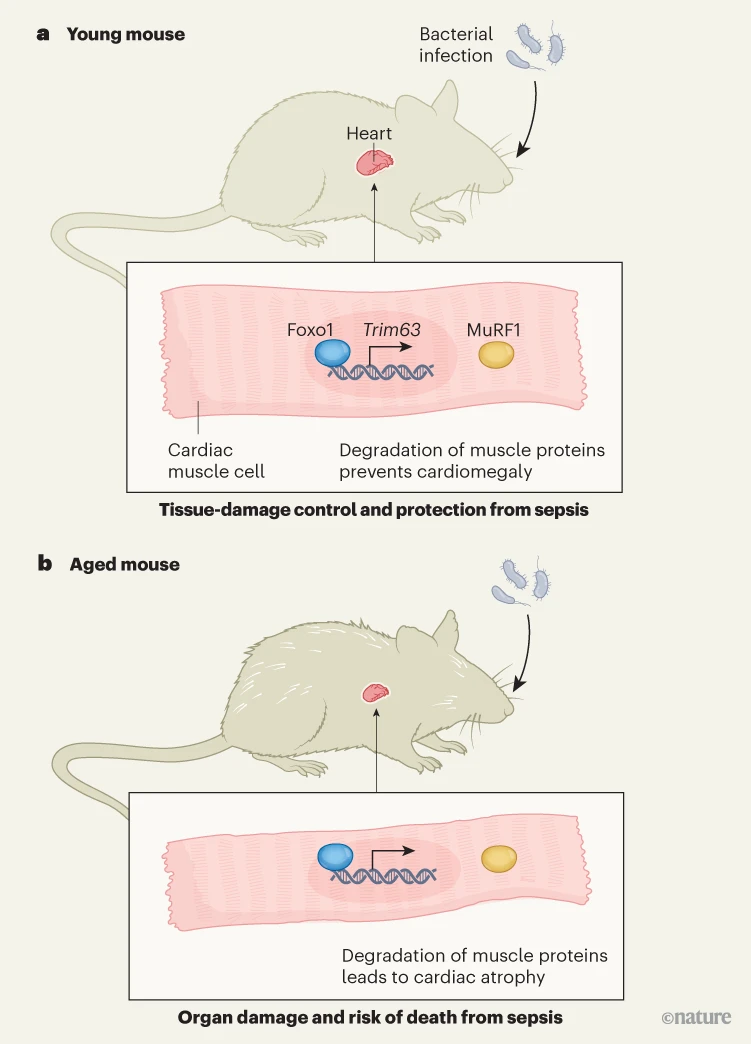
图1 | 疾病耐受性随年龄变化。桑切斯等人让年轻和老年小鼠暴露于细菌感染,使每个群体中有一半死于败血症——这是一种以器官功能障碍为特征的感染失调反应。他们报告了疾病耐受性的年龄相关差异:身体保护自己免受器官功能障碍的方式(组织损伤控制),与对抗病原体的机制是分开的。在心肌细胞中,转录因子 Foxo1 的表达会驱动 Trim63 基因的表达,该基因编码一种参与降解肌肉蛋白的酶(MuRF1)。a,在年轻小鼠中,该信号通路保护心脏免受病理性增大(心脏肥大),防止进一步的器官损伤。b,在老年小鼠中,同一通路在感染反应中驱动肌肉萎缩、器官损伤和死亡风险。这些发现反映了一种名为拮抗多效性的进化概念:在繁殖年龄通过组织损伤控制增强疾病耐受性的应激反应,可能会在繁殖后生命中带来致命成本。
Foxo 转录因子在物种间进化保守,长期以来被认为在代谢、寿命和细胞应激抗性中发挥核心作用。桑切斯及其同事的发现特别有趣的一点是,Foxo1 在感染背景下的功能会随着年龄而发生逆转。在年轻小鼠中,心脏 Foxo1 基因的表达防止了心脏肥大并提高了存活率。用药物抑制 Foxo1 或删除 Foxo1 基因会使年轻动物更容易受到感染。该通路似乎通过 MuRF1 发挥作用,MuRF1 参与蛋白质降解并调节心肌重塑。年轻小鼠中 Trim63 表达的缺失产生了与 Foxo1 基因缺失相似的效果,导致心脏肥大、多器官损伤,并增加感染后败血症死亡的风险。
在老年小鼠中则发现了相反的情况。Foxo1 的基因缺失或 Foxo1 蛋白的药物抑制提高了存活率,而 Trim63 缺陷保护老年小鼠免受败血症侵害。值得注意的是,心脏重塑的模式发生了逆转:年轻的败血症幸存者出现轻度心脏萎缩,而老年幸存者则出现心脏肥大。尽管细菌负荷相似,但致命心脏改变仍出现了这种年龄特异性逆转,这表明这些变化反映了驱动感染疾病耐受性的组织损伤控制机制的差异。
免疫细胞关闭的逆转保护衰老大脑
这些发现与进化医学领域中新兴的观点一致,即宿主生物的免疫防御可能为了早期生命的适应度而优化,却以后期功能障碍为代价。例如,参与调节炎症反应的基因在面对生物或环境挑战时进化以维持稳态,但在整个生命周期中可能表现出拮抗多效性。心肌细胞中的 Foxo1–Trim63 轴表明,拮抗多效性在免疫系统介导的炎症防御中发挥作用,并且发生在参与调节感染期间维持组织功能和完整性的应激反应的基因中。
这些发现对败血症治疗的发展具有意义:目前的治疗方法不足,且主要集中在控制感染源以及使用抗生素和器官支持。桑切斯及其同事的研究表明,针对组织损伤控制机制的干预可能具有年龄依赖性益处。例如,激活 Foxo1 或其下游效应器 MuRF1 可能对年轻人有益,但对老年人可能有害,这凸显了此类治疗方法中年龄分层的必要性。
与任何突破性发现一样,也出现了几个关键问题。心肌细胞中的 Foxo1–Trim63 信号传导如何随着年龄从保护性转变为破坏性?心脏的基线结构、代谢和应激反应也会随着年龄变化——这些是否会影响感染后的存活?在其他器官系统或对不同病原体的反应中是否存在类似的年龄依赖性逆转?
随着人口老龄化以及败血症成为全球主要死亡原因之一,了解感染防御策略如何随着年龄受到调节变得越来越重要。这项小鼠研究将在多大程度上带来治疗败血症的新方法仍有待确定。然而,它确实强调了需要将宿主免疫反应的研究扩展到传统的针对病原体的细胞和分子成分之外。
人类败血症的临床表现具有变异性。结果受病原体类别、感染部位、共存的医疗条件和遗传因素影响。FOXO1–TRIM63 信号传导在人类败血症中是否表现出年龄依赖性多效性,需要进一步研究。如果是这样,确定哪些人群可能从靶向这些通路中受益将是关键。尽管如此,这项研究为理解进化如何在整个生命周期中塑造对感染的反应做出了重大贡献,并强调了基础研究对于指导败血症治疗发展的价值。
https://blog.sciencenet.cn/blog-41174-1518549.html
上一篇:开放科学运动真的如支持者所言那般有益吗?
下一篇:《自然-健康》启航