博文
氢气降低肺动脉高压大鼠肺部炎症和血压【俄罗斯】
||
氢气降低肺动脉高压大鼠肺部炎症和血压【俄罗斯】
摘要
研究表明,氢气对羟自由基具有选择性抗氧化作用,并能发挥抗氧化和抗炎效应。野百合碱(monocrotaline, MCT)诱导的肺动脉高压模型适合用于研究具有抗氧化活性的物质,因为野百合碱可诱导氧化应激。
在第 1 天,雄性 Wistar 大鼠皮下注射野百合碱的水‑酒精溶液,或仅注射水‑酒精溶液作为对照。其中一组接受野百合碱注射的大鼠被置于持续通入含 4% 分子氢空气的塑料箱中;另外两组(野百合碱组和对照组)则置于通入普通空气的箱中。
21 天后,在乌拉坦麻醉下测量血流动力学参数。结果显示,尽管氢气吸入对野百合碱诱导的肺动脉高压主要指标无明显影响,但可降低系统性血压(主要归因于收缩压成分),并降低 TGF‑β 的表达,同时减少含类胰蛋白酶(tryptase)的肥大细胞数量。
Kuropatkina, Tatyana, et al. "Hydrogen inhalation reduces lung inflammation and blood pressure in the experimental model of pulmonary hypertension in rats." Biomedicines 11.12 (2023): 3141.
1 引言
氢气(H₂)是一种无色、无毒、无味、无臭的气体。研究表明,吸入分子氢可减少脑缺血中的灌注不足,这与其能够中和高反应性羟自由基(•OH)以及一氧化氮的活性形式——具有显著细胞毒性的过氧亚硝酸盐(ONOO⁻)有关[1,2,3]。
正如 Ohta 等人所证实的,分子氢被认为是最具选择性的抗氧化剂之一[3,4]。他们发现,氢气在显著降低细胞内 •OH 水平的同时,并不会淬灭细胞中重要的信号氧化物质(如 O₂⁻、H₂O₂ 和 NO•)。这是因为 •OH 的高氧化活性使其能够与氢分子发生反应,而 O₂⁻、H₂O₂ 和 NO• 的氧化活性较低,不足以与 H₂ 反应[2,3,4]。因此,氢气可以在不改变细胞正常生理过程的前提下减轻氧化应激并纠正细胞的氧化还原状态[5]。这种医用气体没有剂量限制,也未发现已知毒性[4,6,7]。
一些研究报道,氢气的作用不仅限于清除羟自由基,还能抑制促炎和炎症细胞因子,如白介素 1、白介素 6、肿瘤坏死因子(TNF‑α)等。此外,H₂ 还能降低促凋亡因子(如 BAX、caspase‑3、8、12)的表达,并激活抗凋亡因子(如 Bcl‑2 和 Bcl‑XL)[1,8,9]。因此,H₂ 可被视为一种调节细胞内信号通路的分子,能够协调体内细胞的生化过程[10]。
多项研究证实,氧化应激在心血管疾病(包括肺动脉高压,PH)的发病机制中起关键作用[11]。肺动脉高压的特征包括内皮功能障碍、右心室压力升高和右心室肥厚[12]。在多种 PH 模型(包括野百合碱诱导的 PH)中,均已观察到 ROS 增加、肺氧化还原状态改变以及右心室压力升高[13]。在这些模型中,ROS 的产生主要源于 NADPH 氧化酶、黄嘌呤氧化酶和内皮型一氧化氮合酶的活性。随着疾病进展,循环单核细胞和骨髓来源的单核前体细胞迁移并聚集在肺血管中。这些炎症细胞一旦定居,会产生 ROS 并分泌促有丝分裂和促纤维化细胞因子,从而诱导血管壁细胞增殖和纤维化,导致进行性血管重构[13]。
野百合碱诱导的肺动脉高压(MCT‑PH)是最常用的实验模型。MCT 处理的内皮细胞在细胞膜过程中出现明显紊乱,影响多种膜蛋白[14]。MCT 吡咯导致的细胞损伤会促进 IL‑1、IL‑6、TNF‑α 等促炎细胞因子的合成[15,16,17],并增加主要纤维化因子——结缔组织生长因子(CTGF)的分泌[18],从而促进肺组织瘢痕形成以及肺动脉和右心室组织的肥厚。
在 MCT‑PH 中,肺弹性动脉和肌性动脉的中膜肥厚并不伴随肺间质小动脉的增殖和肌化[13]。该模型具有可重复性强、结果稳定等特点,且其病理改变理论上可被分子氢影响。本研究旨在探讨吸入含 4% 氢气的空气对雄性 Wistar 大鼠野百合碱诱导肺动脉高压模型症状的影响,并评估其对血压、肺组织学改变及炎症程度的作用。
2 材料与方法
实验使用 2 月龄雄性 Wistar 大鼠(体重 180–220 g)。动物操作遵循欧盟理事会指令 86/609/EEC 的原则。实验方案经莫斯科大学生物学院伦理委员会批准(批准号 113‑G,日期 2020 年 6 月 19 日)。动物来自俄罗斯莫斯科普通病理学与病理生理学研究所实验动物中心。大鼠在 12 小时光照周期下饲养,自由饮水和进食,湿度和温度均受控。运输后的适应期至少为 7 天。随后对大鼠称重,并使用尾套体积描记法测量两次收缩压。
在第 1 天,两组动物皮下注射野百合碱(MCT)(60 mg/kg,溶于 60% 乙醇)(Sigma Aldrich,德国达姆施塔特)。对照组仅皮下注射 MCT 的溶剂(60% 乙醇),作为 MCT 效应的对照。
接受 MCT 注射的动物被分为两组:吸入普通空气组(MCT 对照组)和吸入含 4% 氢气空气组(MCT‑H₂)。除换笼清洁期间(每 3 天 1 小时)外,吸入持续进行。大鼠持续吸入空气或含 4% H₂ 的空气 21 天。每个笼内 4 只大鼠,每组 2 个笼(对照组、MCT 组和 MCT + H₂ 组)。
2.1 实验装置
大鼠被置于 130 升塑料箱中(SAMLA 203.764.41,宜家)。共使用 3 个塑料箱,每个箱内放置 2 个 T2 动物笼。每组包含 2 个笼(共 8 只大鼠):对照组、MCT 组和 MCT + H₂ 组。使用线性气泵(SPP‑15GAS,Hiblow XP 40,日本 Techno Takatsuki)为箱体通气。分子氢由氢气发生器产生(Pioneer,OOO,Vodorodpomogaet,俄罗斯)。图 1 为实验装置示意图。
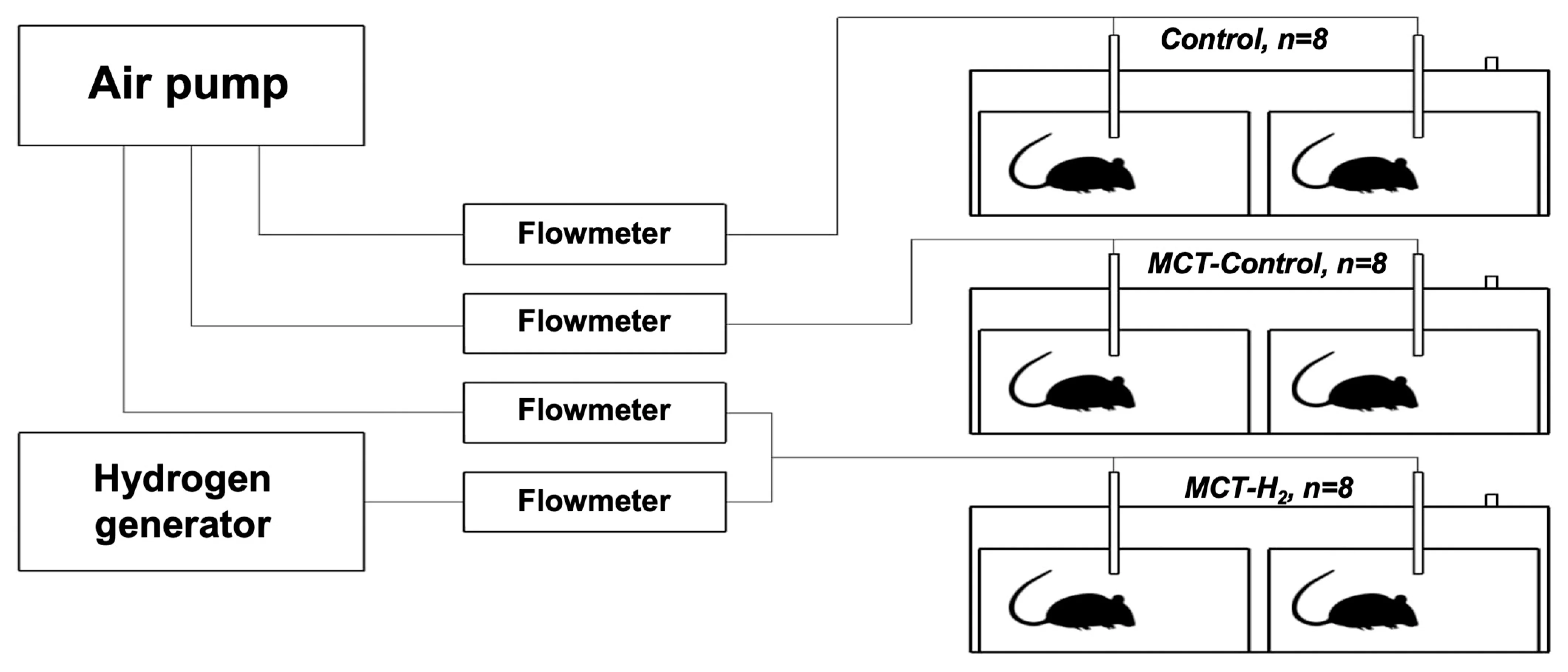
图 1. 实验装置示意图。
氢气流速和空气流速由转子流量计(LZB‑3,LZM‑4T,中国)控制,分别保持在 0.15 L/min 和 4 L/min,使箱内空气中氢气体积分数达到 3.5–4.0%。
2.2 体内血流动力学参数测量
大鼠经腹腔注射乌拉坦麻醉(水溶液,1.2 g/kg,0.6 g/mL)。使用 Statham 血压换能器(Statham Instrument Inc.,美国洛杉矶)、运算放大器和 L‑Card E14–140 多通道模数转换器(L‑Card,俄罗斯莫斯科)直接测量平均动脉压(MBP)和右心室收缩压(RVSP)。将 PE10 导管置入股动脉,将 PE50 导管(Medsil,俄罗斯莫斯科)经右颈静脉插入右心室。RVSP 用于评估肺动脉高压的严重程度。
2.3 形态计量学测量
在乌拉坦麻醉下通过断头法对大鼠实施安乐死。安乐死后取出心脏并在生理盐水中冲洗,切除心房,将左心室与右心室及室间隔分离。右心室肥厚程度以右心室重量与左心室加室间隔重量之比评估(RV/(LV + S)),以常规单位表示。同时测量肺重量。
2.4 肺组织形态学检查
肺组织样本固定于 10% 中性福尔马林,按标准流程处理。制备 5 µm 厚切片,进行苏木精‑伊红(HE)染色,并采用 May–Grunwald 和 Giemsa 染色(Mallory 法)观察肺实质纤维化改变。采用免疫组化方法检测肥大细胞类胰蛋白酶表达(小鼠抗类胰蛋白酶单克隆抗体,ab2378,稀释度 1:2000,Abcam,英国),并使用兔抗 TGF‑β1 单克隆抗体 [EPR21143](ab215715,稀释度 1:500,Abcam,英国)评估肺纤维化程度。
所有组织切片采用盲法,在 Zeizz Imager.A2 显微镜及 Zen 3.0 光学显微镜软件包下分析。在 ×200 倍放大下观察 30 个视野。
使用数字病理图像分析开源软件 QuPath[19] 进行肺结缔组织细胞外基质面积的平面测量,并计算其相对含量。
2.5 统计分析
实验数据以平均值 ± 标准差(M ± SD)表示。使用 Statistica 12.0(Statistica Inc.,美国帕洛阿尔托)和 GraphPad Prism 8.0 软件进行统计分析。采用 Shapiro–Wilk 检验评估数据正态性。使用单因素方差分析(one‑way ANOVA)比较三个或更多独立组之间的差异。使用双因素方差分析(two‑way ANOVA)评估组别和暴露时间的共同作用及其交互效应。采用 Kruskal–Wallis 检验进行秩次比较。使用 ROUT 准则(Q ≤ 1%)排除统计异常值。定性数据以绝对频数(n)和相对频数(%)表示。p < 0.05 视为具有统计学意义。
3 结果
3.1 对血压的影响
MCT 显著升高 RVSP 和相对右心室重量,但对心率无明显影响。吸入含 4% H₂ 的空气对 MCT‑PH 的主要症状无显著改变。具体而言,如图 2A 所示,各组之间无统计学差异(p > 0.05)。MCT 对照组的 RVSP 为 57 ± 9 mm Hg,MCT‑H₂ 组为 58 ± 9 mm Hg,均显著高于对照组(平均 37 ± 5 mm Hg,p < 0.05)(图 2A)。各组之间的心率也无显著差异(图 2B)。
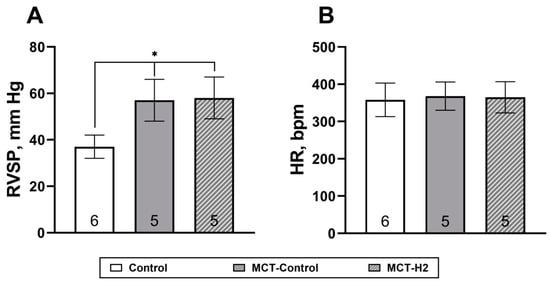
图 2.(A)右心室收缩压(RVSP)。(B)实验第 21 天的心率(HR)。
* 与 MCT-对照组、MCT-H₂ 组相比,对照组 *p < 0.05,单因素方差分析(one-way ANOVA)。
与对照组相比,MCT 注射显著增加了右心室相对质量(*p < 0.05),这证实所有 MCT 处理组均发生了肺动脉高压(表 1)。然而,与仅注射 MCT 的组相比,吸入 4% H₂ 对右心室相对质量无显著影响(*p > 0.05)(表 1)。
表 1. 实验第 21 天大鼠右心室质量及右心室肥厚指标。
吸入含 4% H₂ 空气的组,其平均动脉压显著低于 MCT-对照组和对照组(分别为 82 ± 7 mmHg 对比 95 ± 7 mmHg 和 93 ± 9 mmHg,*p* < 0.05)(图 3A)。进一步分析表明,这一差异主要由收缩压下降引起:对照组、MCT-对照组和 MCT-H₂ 组的收缩压分别为 120 ± 15、121 ± 9 和 107 ± 8 mmHg(图 3B)。此外,三组之间的舒张压无显著差异(*p* > 0.05)(图 3B)。
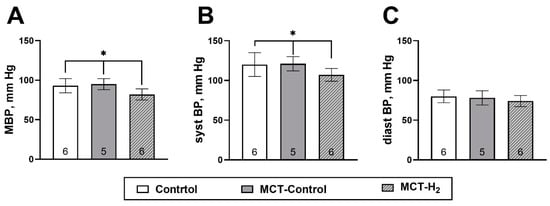
图 3. 实验第 21 天的平均动脉压(A)、收缩压(B)和舒张压(C)。
* MCT‑H₂ 组与对照组、MCT‑对照组相比,p < 0.05,单因素方差分析(one‑way ANOVA)。
3.2 肺组织形态学分析
对 MCT‑对照组大鼠左肺组织苏木精‑伊红(HE)染色切片的形态学分析显示,存在肺动脉高压特有的病理改变(图 4)。在 MCT‑对照组的所有动物中均观察到动脉中膜肥厚。同时可见与肺纤维化发展相关的血栓形成,以及小动脉管腔狭窄。此外,慢性炎症迹象明显,肺组织的血管周围和支气管周围区域弥漫性浸润免疫活性细胞。
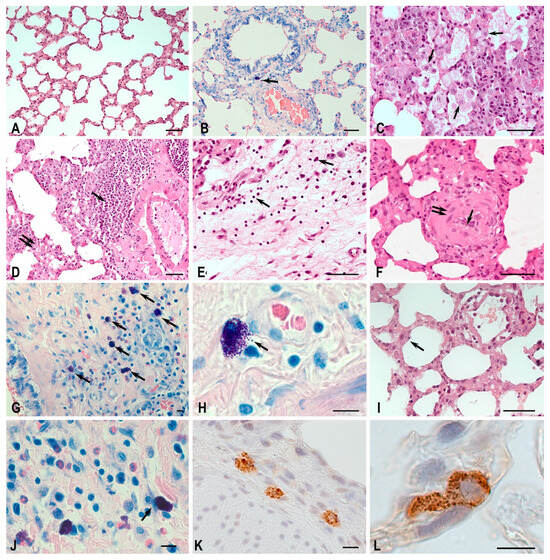
图 4. Wistar 大鼠肺组织结构和肥大细胞的组织学特征。
方法:苏木精‑伊红染色(A、C–F、I),May–Grunwald 和 Giemsa 染色(B、G、H、J),肥大细胞类胰蛋白酶(MC tryptase)免疫组化检测(K、L)。
(A、B)对照组。
(A)肺呼吸部可见细长的肺泡管与薄壁肺泡相连;肺泡隔内可见少量巨噬细胞。
(B)肺肥大细胞数量稀少,主要分布于血管周围和支气管壁,大多无脱颗粒或仅有轻度脱颗粒(箭头)。
(C–H)MCT‑对照组。
(C)肺泡腔中可见肺泡巨噬细胞聚集(箭头)。
(D)血管周围淋巴细胞浸润并形成淋巴小结(箭头),背景为明显的间质水肿(双箭头)。
(E)结缔组织基质重构,可见成纤维细胞增殖灶(梭形细胞),并伴有淋巴细胞‑浆细胞浸润(箭头)。
(F)小动脉壁结构和功能改变,内膜闭塞(箭头),中膜肥厚(双箭头)。
(G)支气管壁中肥大细胞聚集(箭头),并与中性粒细胞‑嗜酸性粒细胞相关。
(H)肥大细胞活跃脱颗粒(箭头)。
(I–L)MCT‑H₂ 组。
(I)间质隔水肿较轻,肺泡上皮细胞可见肥大迹象(箭头)。
(J)肥大细胞轻度脱颗粒,并与成纤维细胞共定位(箭头)。
(K、L)肺组织中类胰蛋白酶阳性肥大细胞。
比例尺:(A–F、I)50 μm,其余为 10 μm。
许多肺泡腔中积聚了肺泡巨噬细胞(图 4C)。可见血管周围淋巴细胞浸润并形成淋巴小结(图 4D)。呼吸腺泡壁和部分气道出现水肿(图 4D)。肺基质的许多局部区域出现成纤维细胞增殖和浆细胞迁移(图 4E)。许多小动脉的管壁结构改变,伴有明显管腔狭窄和肌鞘肥厚(图 4F)。
Giemsa 染色可对肥大细胞(MC)的异染性群体进行定量分析。在纤维化发展区域和狭窄血管周围观察到最高的肥大细胞活性,并伴有脱颗粒迹象(图 5)。肥大细胞不仅聚集在大血管和气道的外膜,也聚集在气道壁中(图 4G、H),这在对照组动物中很少观察到。同时,肥大细胞常与其他免疫活性细胞密切相关,特别是中性粒细胞和嗜酸性粒细胞(图 4G)。
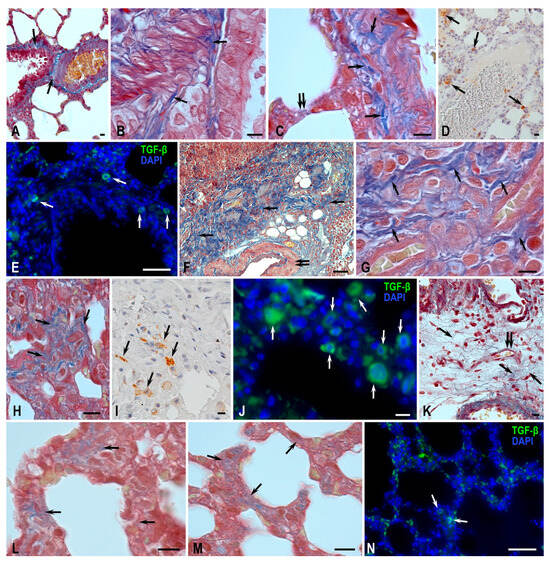
图 5. Wistar 大鼠肺组织细胞外基质重构过程的形态学分析。
方法:Picro Mallory 染色(A–C、F–H、K–M)和 TGF‑β 免疫组化检测(D、E、I、J、N)。
(A–E)对照组。
(A–C)支气管和肺血管基质中的粗大胶原纤维束(箭头);呼吸部仅见细纤维(双箭头)。
(D、E)血管周围 TGF‑β 阳性细胞(箭头)。TGF‑β 阳性细胞含量低,主要位于大支气管基质中(箭头)。
(F–J)MCT‑对照组。
(F)肺实质中致密结缔组织纤维过度生长,表现为明显纤维化改变(箭头),肺组织含气性降低,血管壁增厚(双箭头)。
(G、H)呼吸部某些区域结缔组织和胶原纤维束显著增加(箭头)。
(I)分散的 TGF‑β 分泌细胞群(箭头),周围环绕结缔组织纤维和薄壁血管。
(J)呼吸腺泡某些区域大量 TGF‑β 阳性细胞聚集(箭头)。
(K–N)MCT‑H₂ 组。
(K)肉芽组织样改变,为血管间基质硬化过程的一种消退形式,可见纤细疏松的结缔组织纤维(箭头)及新生血管形成(双箭头)。
(L、M)呼吸腺泡结构中细胞外基质纤维成分含量低(箭头)。
(N)呼吸腺泡中 TGF‑β 阳性细胞含量低(箭头)。
比例尺:(E、F、N)50 μm,其余为 10 μm。
Picro Mallory 染色显示,在 MCT 作用下出现血管改变:肺动脉大分支外膜鞘中的纤维结缔组织成分发生重构,并形成纤维化迹象(图 5)。肺实质中可见密度不均的纤维化改变,表现为胶原纤维束增多、呼吸结构管腔减小和血管壁增厚(图 5F)。在某些气道区域,结缔组织和胶原纤维束显著增加(图 5G、H)。
对扫描显微图像的肺结缔组织含量综合评估显示,该指标的绝对值和相对值均增加(表 2)。与对照组相比,肥大细胞类胰蛋白酶表达显著升高,并伴有不同程度脱颗粒迹象(表 3)。
表 2. 大鼠肺基质中细胞外结缔组织基质含量。
表 3. ×20 倍放大下每 30 个视野中肺肥大细胞的平均数量。
与对照组和 MCT‑H₂ 组相比,MCT‑对照组肺泡巨噬细胞和 II 型肺泡细胞的 TGF‑β 分泌显著升高(图 6)。随着 TGF‑β+ 细胞总数增加,它们在肺呼吸部的分布不均,并在腺泡某些区域形成优先聚集(图 5J)。
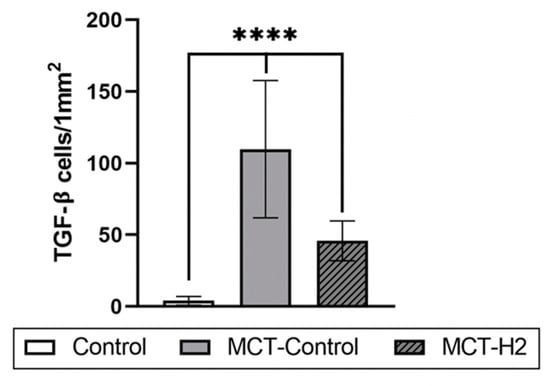
图 6. 实验第 21 天肺组织中 TGF‑β 阳性细胞的平均数量。
对照组 vs. MCT‑对照组、MCT‑H₂;MCT‑H₂ vs. MCT‑对照组,p < 0.00001,单因素方差分析(one‑way ANOVA)。
MCT‑H₂ 组样本的形态学分析显示,腺泡结构恢复经典形态;肺泡呈蜂窝状,肺泡壁轻度增厚,间质中毛细血管充盈(图 4I)。间质水肿减轻,但仍可见具有肥大迹象的肺泡上皮细胞(图 4I)。与 MCT‑对照组相比,肥大细胞反应在数量和功能上均降低。肥大细胞类胰蛋白酶表达分析显示其呈下降趋势,且以无脱颗粒迹象的功能形式为主(与 MCT‑对照组相比)(表 2、图 4G–L)。Picro Mallory 染色显微切片分析未发现明显纤维化程度(图 5K–M、表 3)。然而,部分肺泡中仍存在结缔组织含量增加(图 5L、M)。肺动脉大分支外膜壁重构并形成纤维结节的现象仍可见。与 MCT‑对照组相比,MCT‑H₂ 组 TGF‑β 分泌显著减少,仅在肺泡结构中可见散在单个阳性细胞(图 5N 和图 6)。
组织化学分析显示,MCT‑H₂ 组肥大细胞数量(包括含类胰蛋白酶的肥大细胞)平均比 MCT‑对照组低 30%(表 2),p < 0.05。
4 讨论
鉴于分子氢具有抗氧化和抗炎特性,并可能对多种疾病的发病机制具有治疗作用[1,2,3,4,5,6],本研究探讨了吸入含 4% H₂ 的空气对 MCT‑PH 发展症状、实验大鼠肺组织形态学及炎症标志物的影响。尽管已有研究表明氢气可成功应用于 PH 治疗[20,21,22],但本研究未观察到吸入 4% H₂ 对 PH 主要症状(RVSP 和右心室肥厚)的类似改善作用。这可能是由于以往研究使用富氢水或腹腔注射富氢盐水,而本研究采用持续吸入 4% H₂。已知不同给药途径的氢气动力学存在差异[23,24]。此外,有报道称饮用富氢水或间歇性吸入 2% H₂ 气体对帕金森病大鼠模型具有有益作用,而持续暴露于 2% H₂ 气体则无显著效果[25]。此外,更高浓度的氢气可能会产生更明显的效果。事实上,一些研究对 COVID‑19 患者使用高达 66.67% 的氢气吸入[26]。然而,我们选择 4% H₂,因为临床研究已显示 2–4% H₂ 具有治疗效果[27],且氢气在浓度低于 4.6% 时不具可燃性。
尽管如此,尽管对 PH 主要参数无影响,我们仍发现氢气对 MCT‑PH 引起的肺组织形态学改变和炎症水平具有保护作用。病理形态学改变的减轻与 RVSP 无变化之间的不一致,可能与样本量小、研究持续时间相对较短以及其他影响 RVSP 的未知机制有关。然而,我们的数据清楚地表明 H₂ 对肺组织具有保护作用。确实,组织学结果显示持续吸入 4% 分子氢可降低肺组织纤维化的程度和频率。
这种效应可能部分归因于转化生长因子‑β(TGF‑β)产生的显著减少,这与其他作者的研究一致。TGF‑β 是一种多功能介质,可调节多种细胞的增殖、分化、凋亡、黏附和迁移,如巨噬细胞、活化 T 和 B 细胞、未成熟造血细胞、中性粒细胞和树突状细胞。TGF‑β1 在内皮细胞、造血细胞和结缔组织细胞中表达。目前普遍认为 TGF‑β/Smad 信号通路是纤维化(如肾纤维化、肝纤维化和肺纤维化)的重要途径。在多种肺部疾病中,巨噬细胞、气道上皮、平滑肌细胞和成纤维细胞中的 TGF‑β 信号均增强。TGF‑β 刺激肌成纤维细胞分化,作为对损伤的异常反应,从而加剧进行性肺纤维化[28]。
Tao 等人表明,氢气可抑制肺 TGF‑β 的产生,而 TGF‑β 参与上皮‑间质转化(EMT)过程中的基因表达重编程,并引发慢性炎症、细胞外基质(ECM)过度沉积和肺组织瘢痕形成[29]。此外,在野百合碱作用下,观察到炎症激活和肺组织肥大细胞数量增加,这也促进肺组织重构。肥大细胞脱颗粒时释放多种介质,可分为三类:预先形成的介质(如组胺、类胰蛋白酶和糜蛋白酶)、新合成介质(如前列腺素 D2、白三烯 B4 和 LTD4),以及多种细胞因子和生长因子(如 TNF‑α、TGF‑β、VEGF、GM‑CSF、IL‑10、IL‑8、IL‑5、IL‑3 和 IL‑1)[5,6]。未来研究应测量这些介质,以阐明分子氢的分子机制。在纤维化肺病中,肥大细胞与成纤维细胞的相互作用形成促纤维化环境:成纤维细胞通过产生干细胞因子(SCF)支持肥大细胞存活和增殖;反过来,肥大细胞来源的糜蛋白酶激活潜在 TGF‑β1,介导成纤维细胞向肌成纤维细胞分化[30]。
通过分泌组成分,肥大细胞密切参与适应性和病理性状态的发生,不仅是疾病进展的重要标志物,也是有前景的治疗靶点。肥大细胞特异性蛋白酶(如类胰蛋白酶)尤为重要[31]。
已知类胰蛋白酶分泌肥大细胞数量增加,并与肺动脉高压严重程度和肺血管重构相关[32]。吸入 4% 氢气可减少肥大细胞数量(包括含类胰蛋白酶的肥大细胞),证实其抗炎特性。此外,野百合碱可激活炎症并增加肺组织肥大细胞数量,这也促进肺组织重构。显然,分子氢的抗纤维化作用很大程度上基于肥大细胞数量和分泌活性的降低,因为它们在胶原纤维形成中起积极作用[33]。
尽管我们未观察到 H₂ 对 MCT‑PH 症状(如 RVSP 升高和右心室肥厚)的影响,但证实了 H₂ 暴露对全身血压的调节作用。本研究报道 MCT‑H₂ 组的平均动脉压和收缩压显著低于高血压对照组和正常血压对照组。Liu 等人的随机安慰剂对照研究也显示类似结果。该研究纳入 60 名 50–70 岁高血压患者,每天吸入空气或含 0.2–0.4% 氢气的空气 4 小时,持续 2 周[34]。结果发现,氢气吸入后收缩压较基线显著下降,而安慰剂组无此变化。作者认为,这一效应可能与氢气显著降低血管紧张素 II、皮质醇、醛固酮及其血浆肾素比值有关[34]。
Nakayama 等人的研究也显示类似结果:使用溶解 H₂ 的透析液可通过降低收缩压成分改善透析后平均动脉压,但作者未阐明其机制[35]。
我们的结果表明,呼吸空气中 4% H₂ 可通过降低收缩压成分而降低平均血压。这可能与氢气对自主神经系统调节的影响(降低交感神经激活)[36]、通过促进一氧化氮生成改善大动脉弹性[37],以及其抗氧化、抗炎和抗纤维化作用有关[28,34]。
尽管本研究观察到的有益效果具有启发性,但在得出更强结论之前仍需进一步研究。本研究的局限性包括样本量小(每组 n = 5)且均为雄性大鼠。其他关于 H₂ 的研究提示可能存在性别差异[38],应进一步探讨。此外,如前所述,不同给药途径、浓度、频率和持续时间均需进一步研究以确定最佳给药方式。未来还需更多机制研究以明确分子氢在该疾病中的作用方式和主要靶点。监测其他组织中 TGF‑β1 阳性细胞水平也有助于阐明其多效性作用。
尽管如此,本研究结果与以往发表的研究相结合表明,分子氢可能是治疗肺动脉高压的有用药物。因此,有必要进行更多机制和临床研究。
https://blog.sciencenet.cn/blog-41174-1518279.html
上一篇:开放科学运动真的如支持者所言那般有益吗?
下一篇:癌细胞“窃取”线粒体来逃避免疫防御