博文
治疗骨质疏松的“模拟运动药丸”  精选
精选
|
治疗骨质疏松的“模拟运动药丸”
骨质疏松是一种慢性骨骼疾病,其特征是骨量减少和骨微结构退化,导致骨脆性增加和骨折风险上升。当骨吸收速度超过骨形成速度时,骨质疏松就会发生,而这一过程通常会随着年龄增长、激素变化和机械负荷减少而加速。

科学家揭示了 Piezo1 蛋白如何将身体活动转化为更强壮的骨骼,为开发模拟运动效果的疗法提供了新途径。
香港大学李嘉诚医学院(HKUMed)临床医学学院医学系的科学家发现了一个生物过程,可以解释运动如何帮助维持骨骼强度。这一发现可能为骨质疏松和无法进行身体活动的人群带来新的治疗方法。
研究人员发现了一种充当身体“运动传感器”的蛋白质,它能将身体运动转化为保护骨骼健康的信号。这一发现为开发能够复制运动效果的药物提供了可能,从而造福老年人、卧床患者以及骨折风险较高的慢性病患者。该研究结果发表在《Signal Transduction and Targeted Therapy》期刊上。
“骨质疏松和年龄相关的骨流失影响着全球数百万人,常常使老年人和卧床患者容易发生骨折并失去自理能力,”该研究的领导者、香港大学医学院医学系讲座教授、药学生物技术国家重点实验室主任徐爱民教授说。
“目前的治疗方法严重依赖身体活动,但许多患者根本无法做到。我们需要先了解运动时骨骼是如何变强的,才能找到在分子层面复制运动益处的方法。这项研究是朝着这一目标迈出的关键一步。”
激活骨骼的“运动传感器”,减少脂肪并促进新骨形成
世界卫生组织估计,50 岁以上人群中约有三分之一的女性和五分之一的男性会因骨量下降而发生骨折。随着香港人口老龄化,这一问题尤为严重:65 岁以上女性中有 45%、男性中有 13% 患有骨质疏松。与骨质疏松相关的骨折往往会导致长期疼痛和残疾,降低独立性和生活质量,同时也给医疗系统和整体经济带来巨大压力。
随着年龄增长,骨骼自然会失去强度,变得更薄、更多孔。在骨髓中,间充质干细胞可以分化为成骨细胞或脂肪细胞。这些干细胞对身体活动和机械压力等外部影响非常敏感。然而,随着年龄增长,它们更容易分化为脂肪细胞。当脂肪在骨髓中堆积时,会挤占健康的骨组织,进一步削弱骨骼,并形成一个难以逆转的骨流失恶性循环。
当受到身体活动激活时,Piezo1 蛋白可以减少骨髓中的脂肪堆积并促进新骨形成。
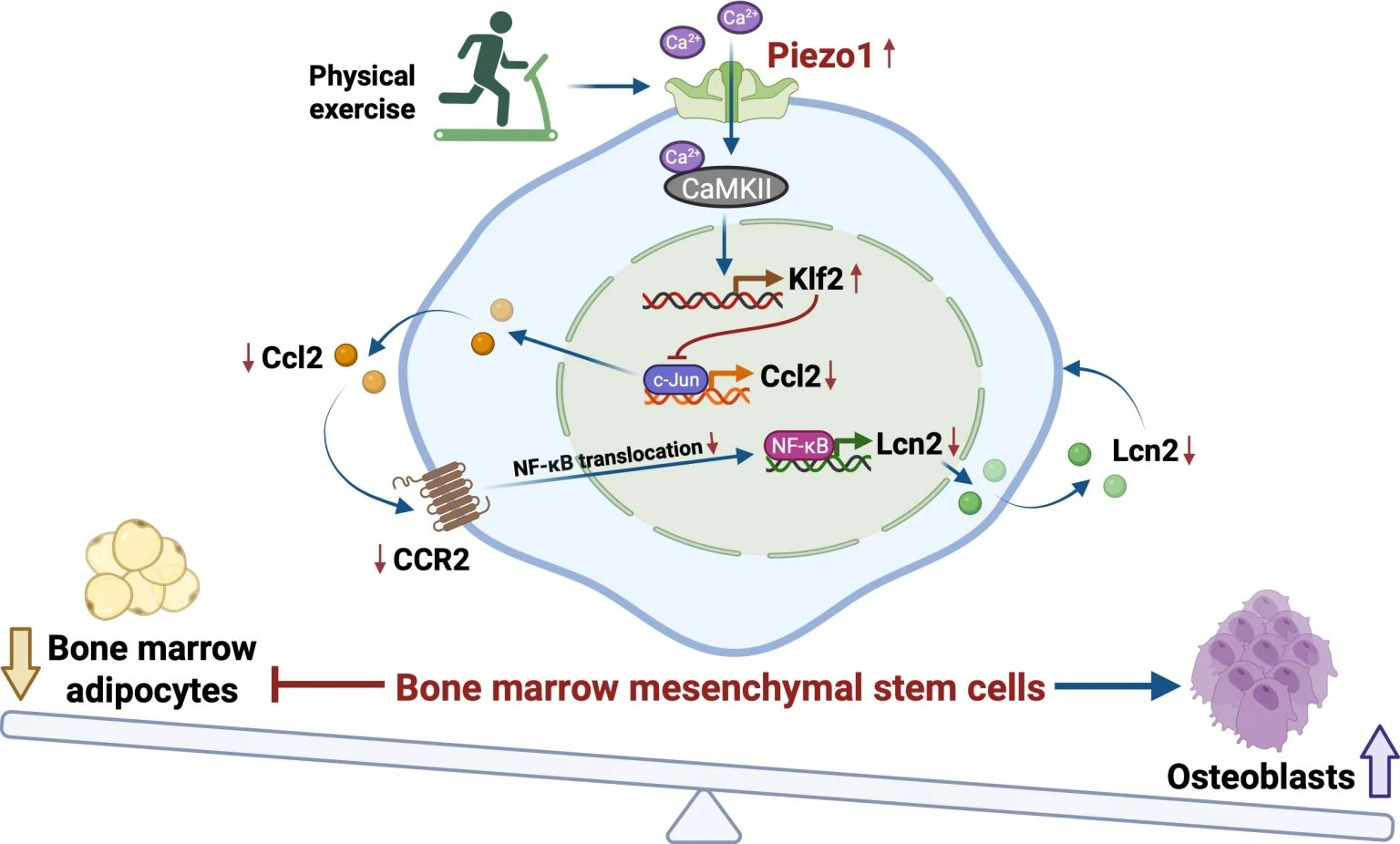
通过研究小鼠模型和人类干细胞,研究人员发现了一个关键的“开关”——Piezo1。这是一种位于骨髓间充质干细胞表面的蛋白质,充当“运动传感器”,能够检测运动产生的机械信号,从而帮助维持骨骼强度并减少与年龄相关的虚弱。在小鼠中,通过运动激活 Piezo1 可以限制骨髓脂肪堆积并促进新骨形成。
当 Piezo1 缺失时,情况则相反:干细胞更倾向于积累脂肪,加速骨流失。Piezo1 的缺失还会增加特定促炎信号(Ccl2 和 lipocalin‑2)的释放,这些信号会进一步推动干细胞向脂肪细胞分化,并干扰骨形成。研究人员发现,阻断这些信号有助于恢复更健康的骨发育。
为行动受限者模拟运动效果
“我们实际上已经解码了身体如何将运动转化为更强壮的骨骼,”徐爱民教授说。“我们找到了分子层面的运动传感器 Piezo1 及其控制的信号通路。这为我们提供了明确的干预靶点。通过激活 Piezo1 通路,我们可以模拟运动的益处,即使在没有运动的情况下,也能让身体‘以为’自己在运动。”
研究团队确定了治疗骨质疏松的明确干预靶点,有助于开发模拟运动效果的药物。这为卧床或行动受限等弱势群体提供了潜在的靶向治疗,其效果可与身体活动相媲美。
共同领导该研究的同系研究助理教授王百乐博士补充道:“这一发现对因虚弱、受伤或慢性疾病而无法运动的老年人和患者尤其有意义。我们的研究结果为开发‘运动模拟药物’打开了大门——这类药物通过化学方式激活 Piezo1 通路,帮助维持骨量并支持独立性。”
“这提供了一种超越传统物理治疗的有前景策略,”法国国家科学研究中心分子与细胞药理学研究所团队负责人 Eric Honoré 教授说,他也是该研究的共同领导者。“未来,我们有可能通过靶向治疗提供运动带来的生物学益处,从而减缓卧床患者或行动受限者等弱势群体的骨流失,并显著降低他们的骨折风险。”
研究团队目前正致力于将这些发现转化为临床应用,目标是开发新的治疗方法,以保护骨骼健康,并改善老龄化人口和卧床患者的生活质量。
https://blog.sciencenet.cn/blog-41174-1517932.html
上一篇:开放科学运动真的如支持者所言那般有益吗?
下一篇:天作之合:氢气与体外气体交换,一项体外初步研究