博文
氢气对呼吸暂停综合征治疗eNOS机制研究
||
背景
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome, OSAHS)是一种高发疾病,其特征为慢性间歇性缺氧(chronic intermittent hypoxia, IH)。慢性间歇性缺氧可通过氧化应激和破坏一氧化氮(nitric oxide, NO)稳态,引发严重的血管内皮功能障碍,进而增加心血管疾病风险。氢气(molecular hydrogen, H₂)已被证实是一种具有治疗潜力的选择性抗氧化剂,但其针对OSAHS诱导的内皮损伤的保护机制尚未得到充分研究。本研究旨在探讨H₂是否能通过恢复NO生物利用度,在OSAHS背景下维持内皮功能,并阐明其潜在的分子通路。
方法
本研究采用转化医学研究方法,同时构建了IH的体外和体内模型。将人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)置于IH循环(1%氧气环境5分钟/21%氧气环境10分钟)中处理24小时,实验分为两组:一组使用富氢培养基(0.6 mmol/L),另一组不使用。同时,通过将大鼠暴露于IH环境(8%氧气环境5分钟/21%氧气环境5分钟,每天8小时)中4周,建立OSAHS大鼠模型;其中治疗组大鼠每日吸入2%的H₂,持续1小时。本研究对以下指标进行了全面评估:血管病理学特征、氧化应激标志物[活性氧(reactive oxygen species, ROS)/丙二醛(malondialdehyde, MDA)]、NO通路关键成分[内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)磷酸化水平、四氢生物蝶呤(tetrahydrobiopterin, BH4)及其氧化形式BH2]、炎症指标[肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、细胞间黏附分子-1(intercellular cell adhesion molecule-1, ICAM-1)]以及细胞凋亡情况。
结果
研究结果表明,H₂处理可显著减轻IH诱导的氧化应激,降低细胞和主动脉组织中ROS与MDA的水平。关键在于,H₂通过增强eNOS在Ser1177位点的磷酸化水平,并维持关键的BH4/BH2比值,恢复了NO的生物利用度,从而防止eNOS解偶联和超氧化物过量生成。这一作用在功能上得到了验证:经H₂处理的OSAHS大鼠,其内皮依赖性血管舒张功能显著改善。此外,H₂干预还可减轻血管重构(减少中膜增厚和胶原沉积),并通过下调TNF-α和ICAM-1的表达抑制炎症反应。最后,H₂能显著降低主动脉组织中的内皮细胞凋亡率。
结论
H₂可通过调节氧化还原稳态、使eNOS重新偶联以促进NO生成,同时抑制炎症激活和细胞凋亡,有效缓解OSAHS相关的内皮功能障碍。这些多方面的保护作用表明,H₂作为一种新型辅助治疗手段,在降低OSAHS患者心血管并发症风险方面具有重要治疗潜力。
Chen, Qi, et al. "Hydrogen rescues vascular endothelial cells in obstructive sleep apnea-hypopnea syndrome by modulating nitric oxide." Journal of Thoracic Disease 17.11 (2025).
作者地址Mili Sun, BA. School of Clinical Medicine, Chengdu Medical College, Baoguang Street 278, Xindu District, Chengdu 610500, China; Department of Neurology, The First Affiliated Hospital of Chengdu Medical College, Chengdu 610500, China. Email: m18782967657@163.com.
作者来自成都医学院第一附属医院
核心发现
• 在实验性OSAHS模型中,氢气(H₂)处理可减轻氧化应激和血管重构。
• H₂通过保护eNOS的关键辅因子BH4,使eNOS重新偶联,从而恢复NO的生物利用度。
• H₂可同时抑制炎症反应和内皮细胞凋亡,对IH诱导的内皮功能障碍发挥多方面保护作用。
已知信息与创新点
• 已知:OSAHS主要通过IH诱导的氧化应激导致血管内皮功能障碍,进而引发eNOS解偶联、NO缺乏和慢性炎症。
• 创新点:本研究首次证实H₂可特异性靶向OSAHS相关的IH病理过程,并提供了机制性证据——H₂通过恢复BH4/BH2比值以防止eNOS解偶联,同时发挥抗炎和抗凋亡作用,从而实现保护效果。
意义与未来展望
• 意义:H₂是一种具有明确机制的潜在辅助治疗手段,可与标准治疗(如持续气道正压通气)联合使用,以降低OSAHS患者的心血管风险。
• 未来方向:本研究结果为后续临床试验提供了依据,未来需通过临床试验验证H₂干预在改善OSAHS患者内皮功能和心血管结局方面的疗效,尤其针对接受常规治疗后仍存在残余风险的患者。
引言
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是一种高发睡眠障碍,全球约有10亿成年人受其影响;其中重症患者的心血管病发病率和死亡率较普通人群高2-3倍(1)。OSAHS的特征是睡眠期间上气道反复部分或完全塌陷,导致慢性间歇性缺氧(IH)、高碳酸血症和睡眠片段化(2)。在这些病理生理特征中,IH被认为是全身性血管功能障碍的主要驱动因素,可诱发高血压、动脉粥样硬化和内皮损伤(3,4)。血管内皮细胞衬于血管内壁,通过调节血管舒张、抗炎反应和血栓平衡,在维持血管稳态中发挥关键作用(5)。一氧化氮(NO)是这些功能的核心介导因子,它是一种气体信号分子,由内皮型一氧化氮合酶(eNOS)合成(6)。然而,在OSAHS中,IH诱导的氧化应激会破坏NO的生物利用度,导致内皮功能障碍——这是心血管疾病的重要前期病变(7,8)。
OSAHS中IH的周期性(缺氧与复氧交替)类似于缺血再灌注损伤,可通过线粒体功能障碍和烟酰胺腺嘌呤二核苷酸磷酸氧化酶激活,产生过量活性氧(ROS)(9)。ROS包括超氧化物(O₂·⁻)和过氧化氢(H₂O₂),它们会超过内源性抗氧化防御系统(如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶)的清除能力,导致脂质、蛋白质和DNA发生氧化损伤(10)。在 endothelial cells中,ROS会直接氧化四氢生物蝶呤(BH4)——eNOS酶活性的关键辅因子(11)。BH4耗竭会导致eNOS“解偶联”,使其功能从合成NO转向生成O₂·⁻,进一步加剧氧化应激并形成过氧亚硝酸盐(ONOO⁻)——一种强效氧化剂,可使蛋白质亚硝基化并灭活NO(11)。这种“ROS生成→eNOS解偶联→NO缺乏”的恶性循环,是OSAHS患者内皮功能障碍的核心机制(12)。
OSAHS相关的内皮功能障碍主要表现为:内皮依赖性血管舒张受损、血管通透性增加以及促炎细胞因子释放。研究表明,与健康对照者相比,OSAHS患者的血管舒张能力显著降低,且这一变化与夜间缺氧严重程度相关(13,14)。此外,循环中黏附分子(如细胞间黏附分子-1(ICAM-1)、血管细胞黏附分子-1)和炎症介质(如肿瘤坏死因子-α(TNF-α)、白细胞介素-6)水平升高,提示患者存在慢性炎症状态,而这种炎症会进一步加重血管损伤(15-17)。这些病理变化不仅会加速动脉粥样硬化进程,还可能导致难治性高血压和心力衰竭,因此,研发针对OSAHS患者内皮保护的治疗方法具有迫切需求。
OSAHS的一线标准治疗方法是持续气道正压通气(CPAP),该疗法可有效缓解IH并改善心血管结局(18)。然而,患者依从性差(30%-60%),且长期使用者的内皮损伤无法完全逆转,这些因素限制了其临床应用(19,20)。他汀类药物、血管紧张素转换酶抑制剂等药物干预虽有一定获益,但对OSAHS相关的氧化通路缺乏特异性(21)。维生素C、N-乙酰半胱氨酸等抗氧化剂已被用于研究,但它们的非选择性ROS清除作用常破坏细胞功能必需的氧化还原信号(22,23)。因此,目前迫切需要一种能选择性中和细胞毒性ROS、同时维持生理性氧化还原稳态的新型治疗手段。
氢气(H₂)作为一种独特的氧化还原稳态调节剂,具有潜在的 hormesis效应(即低剂量刺激有益反应);它并非通过直接清除ROS发挥作用,而是通过影响有益信号分子(如NO(H₂O₂和·NO)和H₂O₂(·OH和ONOO⁻))实现调节功能(24)。H₂分子体积小且呈非极性,可快速穿过细胞膜和血脑屏障,高效靶向线粒体和细胞核(25)。临床前研究表明,H₂在多种氧化应激相关疾病中均具有疗效,包括缺血再灌注损伤、神经退行性疾病和代谢综合征(26-28)。在心血管领域,吸入H₂可减轻高血糖状态下的内皮细胞凋亡,并通过提高NO生物利用度改善吸烟者的内皮功能(29)。然而,H₂在OSAHS诱导的内皮损伤中的作用尚未被研究,这一空白使得其对OSAHS这一高危人群的治疗潜力无法得到充分认识。
鉴于ROS介导的eNOS解偶联是OSAHS相关内皮功能障碍的核心机制,本研究提出假设:H₂可通过双重机制恢复NO稳态,从而保护内皮细胞:(I)减轻氧化应激以保护BH4,防止eNOS解偶联;(II)激活eNOS磷酸化以促进NO合成。为验证这一假设,本研究采用转化医学方法,同时构建了IH的体外和体内模型:对暴露于IH循环的人脐静脉内皮细胞(HUVECs)和OSAHS模型大鼠,分别采用富氢培养基和吸入H₂进行处理。通过评估氧化应激标志物、eNOS活性、NO生物利用度和血管功能,阐明H₂发挥保护作用的分子通路。
本研究首次探讨了H₂在OSAHS相关内皮损伤中的疗效,为其抗氧化和NO调节特性提供了机制性见解。研究结果或可为研发基于H₂的辅助疗法奠定基础,以补充CPAP治疗,尤其适用于存在残余心血管风险的患者。本文的撰写符合ARRIVE(动物研究报告规范)和MDAR(分子与细胞生物学研究报告规范)清单要求。
方法
实验设计
本研究通过体外和体内模型,探讨H₂治疗对IH诱导的内皮功能障碍(模拟OSAHS病理过程)的作用。体外实验中,将HUVECs置于IH循环(1%氧气环境5分钟,21%氧气环境10分钟)中处理24小时,分为三组:对照组(Control)、IH组(仅IH处理)、IH+H₂组(IH处理+富氢培养基(0.6 mmol/L))。体内实验中,将Sprague-Dawley大鼠暴露于IH环境(8%氧气环境5分钟,21%氧气环境5分钟;每小时12个循环,每天8小时)中4周,同时对治疗组大鼠进行H₂吸入处理(2%浓度,每天1小时);动物分为三组:假手术组(Sham)、OSAHS组(仅IH处理)、OSAHS+H₂组(IH处理+H₂吸入),每组6-8只大鼠。研究结局指标包括:氧化应激标志物、NO代谢指标、炎症指标、凋亡指标及血管重构情况。所有实验流程均经成都医学院动物伦理委员会批准(批准号:CMC2024MS522),且符合美国国立卫生研究院(NIH)的实验动物饲养和使用指南(30)。
细胞培养、IH模型构建与H₂处理
细胞培养
人脐静脉内皮细胞(HUVECs,购自美国加利福尼亚州卡尔斯巴德市ScienCell研究实验室,货号8000)采用内皮细胞培养基(ECM,ScienCell,货号1001)培养,培养基中添加5%胎牛血清(ScienCell,货号0025)、1%内皮细胞生长补充剂(ScienCell,货号1052)和1%青霉素/链霉素(ScienCell,货号0503)。细胞置于37℃、含5%CO₂的恒温培养箱(美国马萨诸塞州沃尔瑟姆市赛默飞世尔科技公司,型号3111)中培养,当细胞融合度达到80%-90%时,使用0.25%胰蛋白酶-乙二胺四乙酸(EDTA)(美国纽约州格兰德岛市Gibco公司,货号25200072)消化传代。实验使用第3-6代细胞。
间歇性缺氧(IH)诱导
将细胞置于模块化低氧培养箱(美国加利福尼亚州德尔马市Billups-Rothenberg公司,型号MIC-101)中,该培养箱已预设周期性低氧程序。每个IH循环包括:先在1%氧气环境下维持5分钟(低氧阶段,通过通入94%氮气、5%二氧化碳与1%氧气的混合气体实现),随后在21%氧气环境下维持10分钟(复氧阶段,即环境空气)。上述循环持续重复24小时。常氧对照组细胞始终维持在21%氧气环境中。
氢气(H₂)处理与分组
富氢培养基(0.6 mmol/L)的制备方法:将99.99%纯氢气(中国成都市宏锦化工有限公司)在0.4 MPa压力下通入内皮细胞培养基(ECM)中30分钟。采用氢气敏感电极(丹麦奥胡斯市Unisense公司,型号H₂-100)验证培养基中氢气浓度。在细胞暴露于IH环境期间,用富氢培养基处理细胞,每6小时更换一次培养基以维持有效氢气浓度——这是补偿氢气从水溶液中快速逸散的标准实验方案(24)。细胞分为三组:对照组(Control)、IH组(仅IH处理)、IH+H₂组(IH处理+富氢培养基)。
动物、OSAHS模型构建与氢气吸入处理
动物饲养
雄性Sprague-Dawley大鼠(8周龄,体重200-220 g)饲养于可控环境中(温度22±1℃,12小时光照/12小时黑暗循环),可自由摄取标准饲料(中国北京市科澳协力饲料有限公司)和饮水。所有动物根据Excel(美国华盛顿州雷德蒙德市微软公司)生成的随机数字表进行随机编号,按随机数递增顺序排序并分配至不同组别。实验操作和数据分析过程中使用数字样本标识,研究人员对处理分组实施盲法。
OSAHS模型构建
OSAHS组大鼠构建模型的方法:将大鼠置于低氧培养箱(美国纽约州雷德菲尔德市BioSpherix公司,型号A84XOV)中,该培养箱预设IH循环程序:先在8%氧气环境下维持5分钟(通过混合氮气与压缩空气实现),随后在21%氧气环境下维持5分钟,每小时重复12次,每天持续8小时(上午9:00-下午5:00),共持续4周。假手术对照组(Sham)大鼠始终维持在21%氧气环境中。
氢气吸入与分组
OSAHS组大鼠在每次IH暴露结束后,立即通过鼻吸式吸入系统(加拿大魁北克省蒙特利尔市Scireq公司,型号PLY3213)吸入2%氢气(以压缩空气为平衡气体),每天1小时。采用质量流量控制器(美国亚利桑那州图森市Alicat Scientific公司,型号MC-5SLPM)将气体流速校准为1 L/分钟。选择该流速(高于大鼠典型分钟通气量)是为确保培养箱内气体持续流通,防止二氧化碳蓄积,并维持鼻吸式培养箱内大气环境稳定。通过动物附近出口处的氢气传感器(Unisense公司,型号H₂-100)实时验证输送系统内氢气浓度,在此条件下,该系统可稳定实现时间加权平均2%的氢气暴露量。OSAHS对照组大鼠在相同条件下吸入压缩空气。动物分为三组:假手术组(Sham)、OSAHS组(仅IH处理)、OSAHS+H₂组(IH处理+氢气吸入),每组6-8只大鼠。
组织采集
4周后,采用戊巴比妥钠(50 mg/kg,腹腔注射)麻醉大鼠,解剖分离胸主动脉。主动脉组织一部分用4%多聚甲醛固定(固定24小时,用于组织学检测),另一部分用液氮快速冷冻(-80℃保存,用于分子生物学检测)。
组织学染色
苏木精-伊红(H&E)染色
将石蜡包埋的主动脉切片(厚度5 μm)脱蜡后,用H&E染色液(中国北京市索莱宝科技有限公司,货号G1120)染色,在光学显微镜(日本东京市尼康公司,型号Eclipse E100)下观察成像。采用ImageJ软件(美国国立卫生研究院,NIH)测量每张切片上10个随机位点的主动脉中膜厚度。
Masson三色染色
采用Masson染色试剂盒(索莱宝公司,货号G1340)对切片进行染色,以评估胶原沉积情况。通过ImageJ软件量化纤维化区域(蓝色染色部分)占主动脉总面积的百分比。
活性氧(ROS)检测
体外检测(细胞层面)
将人脐静脉内皮细胞(HUVECs)与10 μmol/L 2',7'-二氯二氢荧光素二乙酸酯(DCFH-DA;美国伯灵顿市Sigma-Aldrich公司,货号D6883)在37℃下孵育30分钟。使用酶标仪(美国佛蒙特州威努斯基市BioTek公司,型号Synergy H1)检测荧光强度(激发波长/发射波长:488 nm/525 nm)。
体内检测(动物层面)
将主动脉匀浆与10 μmol/L二氢乙锭(DHE;Sigma-Aldrich公司,货号D7008)孵育30分钟。通过荧光显微镜(日本东京市奥林巴斯公司,型号BX53)量化超氧化物水平。
逆转录聚合酶链反应(RT-PCR)
采用TRIzol试剂(美国加利福尼亚州卡尔斯巴德市Invitrogen公司,货号15596026)从HUVECs中提取总RNA。使用逆转录试剂盒(中国大连市宝生物公司,货号RR037A)合成互补DNA(cDNA)。采用SYBR Green Master Mix(德国曼海姆市罗氏公司,货号04887352001)在QuantStudio 5实时PCR系统(赛默飞世尔科技公司)上进行逆转录定量聚合酶链反应(RT-qPCR)。PCR反应体系总体积为25 μL,包含SYBR Green Master Mix(罗氏公司)和0.5 μmol/L引物。PCR反应条件:95℃预变性5分钟;随后进行40个循环,每个循环包括95℃变性30秒、60℃退火30秒、72℃延伸30秒。引物序列通过美国国家生物技术信息中心(NCBI)Primer-BLAST设计,由中国上海市生工生物工程股份有限公司合成,具体序列如下:
- 肿瘤坏死因子-α(TNF-α):
- 上游引物:5'-CAGGCGGTGCCTATGTCTC-3'
- 下游引物:5'-CGATCACCCCGAAGTTCAGT-3'
- 细胞间黏附分子-1(ICAM-1):
- 上游引物:5'-CTGTGGCCTGGAGCTGTTTA-3'
- 下游引物:5'-CAGGGGCCGTACAGTTGATA-3'
- 甘油醛-3-磷酸脱氢酶(GAPDH,内参基因):
- 上游引物:5'-GGAGCGAGATCCCTCCAAAAT-3'
- 下游引物:5'-GGCTGTTGTCATACTTCTCATGG-3'
蛋白质印迹法(Western blot)
采用RIPA裂解液(中国上海市碧云天生物技术有限公司,货号P0013B)从HUVECs或主动脉组织中提取蛋白质。将蛋白质裂解液(每泳道30 μg)在10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)上进行电泳分离,随后转移至聚偏二氟乙烯(PVDF)膜(美国马萨诸塞州伯灵顿市Millipore公司,货号IPFL00010)上。用5%脱脂牛奶封闭膜后,在4℃下与一抗孵育过夜,所用一抗包括:磷酸化内皮型一氧化氮合酶(Phospho-eNOS,Ser1177位点;美国马萨诸塞州丹弗斯市Cell Signaling Technology公司,货号9571,稀释比例1:1000)、总内皮型一氧化氮合酶(Total eNOS;英国剑桥市Abcam公司,货号ab76198,稀释比例1:1000)、细胞间黏附分子-1(ICAM-1;中国武汉市Proteintech公司,货号60299-1-I,稀释比例1:1000)、β-肌动蛋白(β-actin;Proteintech公司,货号66009-1-Ig,稀释比例1:5000)。加入辣根过氧化物酶(HRP)标记的二抗(稀释比例1:5000,Proteintech公司)孵育后,采用电化学发光(ECL)试剂(Millipore公司,货号WBKLS0500)显影蛋白条带,并通过ImageJ软件量化条带灰度值。
酶联免疫吸附试验(ELISA)
采用商品化ELISA试剂盒检测血浆中四氢生物蝶呤(BH4)和二氢生物蝶呤(BH2)水平(美国明尼苏达州明尼阿波利斯市R&D Systems公司,货号分别为K9965-100和K9966-100)。采用MDA ELISA试剂盒(中国武汉市Bioswamp公司,货号RA20003)量化主动脉组织中丙二醛(MDA)含量。
末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)染色
采用TUNEL检测试剂盒(如罗氏公司,货号11684795910或同类产品)检测凋亡细胞。将切片脱蜡、复水后,用蛋白酶K(20 μg/mL)在37℃下处理15分钟。透化处理后,将切片与TUNEL反应混合液(末端脱氧核苷酸转移酶+荧光素标记的dUTP)在湿盒中37℃孵育60分钟。用4',6-二脒基-2-苯基吲哚(DAPI,1 μg/mL)染色10分钟以标记细胞核。在主动脉内皮中评估内皮细胞凋亡情况:通过荧光显微镜(德国哥廷根市蔡司公司,型号Axio Imager)观察每张切片的6个随机视野(20倍物镜,比例尺:20 μm),采用ImageJ/Fiji软件计数TUNEL阳性内皮细胞(绿色荧光)和DAPI染色的总细胞核(蓝色荧光)数量。凋亡指数计算公式为:(TUNEL阳性内皮细胞数/总内皮细胞数)×100%。
统计学分析
数据以“均值±标准误(mean ± SEM)”表示,n=3次独立实验。采用GraphPad Prism 9.0软件进行统计学分析:两组间比较采用Student t检验;多组间比较采用单因素方差分析(ANOVA),随后进行Tukey事后检验。显著性水平设定为:与对照组(Control)或假手术组(Sham)比较,*P<0.05、**P<0.01、***P<0.001;与IH组或OSAHS组比较,P<0.05、P<0.01、P<0.001。
结果部分
氢气(H₂)减轻内皮细胞和OSAHS大鼠中IH诱导的氧化应激
体外实验中,HUVECs暴露于IH循环(1%氧气5分钟后转入21%氧气10分钟,持续24小时)后,通过DCFH-DA荧光量化显示,其细胞内ROS水平较常氧对照组升高3.2倍(与Control组比较,P<0.001,图1A)。在IH暴露期间用富氢培养基(0.6 mmol/L)处理细胞,可使ROS生成量显著降低60%(与IH组比较,P<0.001,图1A)。
体内实验中,OSAHS大鼠经4周IH处理(8%氧气5分钟与21%氧气5分钟交替,每小时12个循环,每天8小时)后,脂质过氧化标志物——主动脉MDA含量较假手术组升高2.3倍(与Sham组比较,P<0.01,图1B)。每天吸入2%氢气1小时可使MDA水平降低45%(与OSAHS组比较,P<0.05,图1B),证实H₂在血管组织中具有抗氧化功效。

图1 氢气减轻内皮细胞和OSAHS大鼠中IH诱导的氧化应激
(A)采用DCFH-DA荧光法量化常氧组(Control)、间歇性缺氧组(IH)、间歇性缺氧+富氢培养基组(IH+H₂)HUVECs的细胞内ROS水平。数据以均值±SEM表示(n=3)。与Control组比较,***P<0.001;与IH组比较,P<0.001。
(B)采用ELISA法检测对照组(Control)、OSAHS组、OSAHS+H₂组大鼠的主动脉MDA含量。数据以均值±SEM表示(n=3)。与Sham组比较,**P<0.01;与OSAHS组比较,P<0.05。
缩略词:DCFH-DA,2',7'-二氯二氢荧光素二乙酸酯;ELISA,酶联免疫吸附试验;H₂,氢气;HUVECs,人脐静脉内皮细胞;IH,间歇性缺氧;MDA,丙二醛;OSAHS,阻塞性睡眠呼吸暂停低通气综合征;ROS,活性氧;SEM,标准误。
氢气(H₂)通过内皮型一氧化氮合酶(eNOS)重偶联与四氢生物蝶呤(BH4)保护恢复一氧化氮(NO)生物利用度
间歇性缺氧(IH)会损害人脐静脉内皮细胞(HUVECs)的eNOS活性,具体表现为:磷酸化eNOS(Ser1177位点)水平降低65%(与对照组比较,P<0.001,图2A、2B),NO代谢产物(亚硝酸盐/硝酸盐)减少55%(与对照组比较,P<0.01,图2C)。H₂处理可逆转上述效应:使eNOS磷酸化水平升高1.8倍(与IH组比较,P<0.01,图2A、2B),NO代谢产物恢复至IH组水平的85%(P<0.05,图2C)。机制层面,IH使eNOS偶联的关键决定因素——BH4/BH2比值降低70%(与对照组比较,P<0.001,图2D);而补充H₂可使BH4/BH2比值升高2.2倍(与IH组比较,P<0.05,图2D),有效阻止eNOS解偶联及超氧化物过量生成(与IH组比较,P<0.001,图2E)。在OSAHS大鼠中,乙酰胆碱诱导的内皮依赖性血管舒张功能降低50%(与假手术组比较,P<0.01,图2F);而吸入H₂可使血管舒张功能改善40%(与OSAHS组比较,P<0.01,图2F),证实NO介导的血管舒张功能得到恢复。
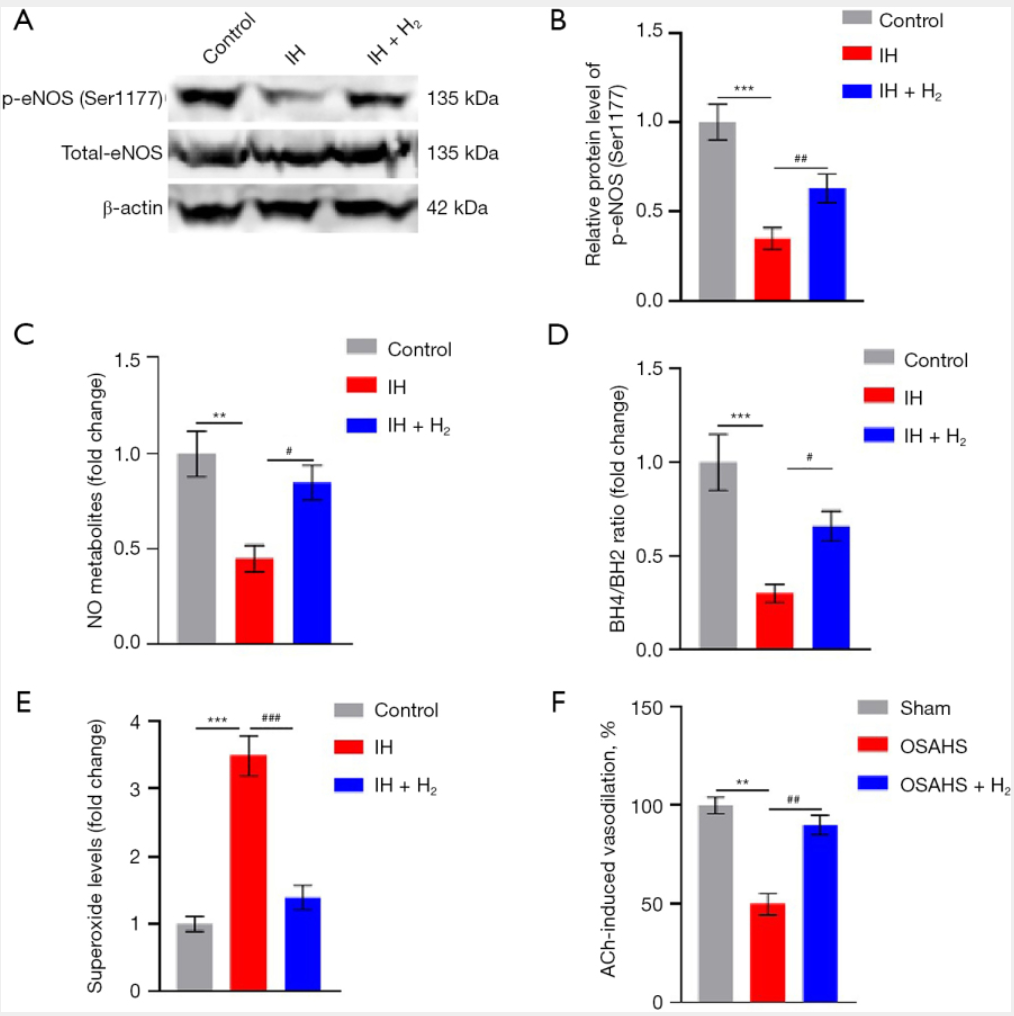
图2 氢气通过eNOS重偶联与BH4保护恢复NO生物利用度
(A)采用蛋白质印迹法(Western blot),用磷酸化eNOS抗体和总eNOS抗体检测HUVECs中磷酸化eNOS(Ser1177位点)水平,以β-肌动蛋白(β-actin)作为内参蛋白。
(B)磷酸化eNOS(Ser1177位点)水平的量化结果(以β-肌动蛋白为参照进行标准化)。与对照组比较,***P<0.001;与IH组比较,P<0.01。
(C)采用格里斯试剂法(Griess assay)量化HUVECs中亚硝酸盐/硝酸盐(NO代谢产物)水平。与对照组比较,**P<0.01;与IH组比较,P<0.05。
(D)采用酶联免疫吸附试验(ELISA)检测HUVECs中BH4/BH2比值。与对照组比较,***P<0.001;与IH组比较,P<0.05。
(E)采用二氢乙锭荧光法检测HUVECs中超氧化物水平。与对照组比较,***P<0.001;与IH组比较,P<0.001。
(F)通过血管反应性实验评估大鼠主动脉中乙酰胆碱诱导的内皮依赖性血管舒张功能。数据以舒张百分比表示(均值±标准误,n=3)。与假手术组比较,**P<0.01;与OSAHS组比较,P<0.01。
缩略词:ACh,乙酰胆碱;BH4,四氢生物蝶呤;ELISA,酶联免疫吸附试验;eNOS,内皮型一氧化氮合酶;H₂,氢气;HUVECs,人脐静脉内皮细胞;IH,间歇性缺氧;NO,一氧化氮;OSAHS,阻塞性睡眠呼吸暂停低通气综合征;SEM,标准误。
氢气(H₂)改善间歇性缺氧(IH)诱导的血管重构与炎症反应
组织病理学分析显示,OSAHS大鼠存在明显的主动脉重构:苏木精-伊红(H&E)染色显示主动脉中膜厚度增加2.1倍(与假手术组比较,P<0.01,图3A、3B);Masson三色染色显示胶原沉积增加3.4倍(与假手术组比较,P<0.001,图3C、3D)。H₂处理可改善这些结构异常:使中膜增生减少35%(与OSAHS组比较,P<0.05,图3A、3B),纤维化区域减少48%(与OSAHS组比较,P<0.01,图3C、3D)。同时,IH可上调促炎标志物:HUVECs中肿瘤坏死因子-α(TNF-α)信使核糖核酸(mRNA)水平升高4.1倍(与对照组比较,P<0.001,图3E);OSAHS大鼠主动脉中细胞间黏附分子-1(ICAM-1)蛋白水平升高3.8倍(与假手术组比较,P<0.001,图3F、3G)。H₂干预可抑制上述反应:使TNF-α表达降低50%(与IH组比较,P<0.05,图3E),ICAM-1水平降低40%(与OSAHS组比较,P<0.05,图3F、3G)。
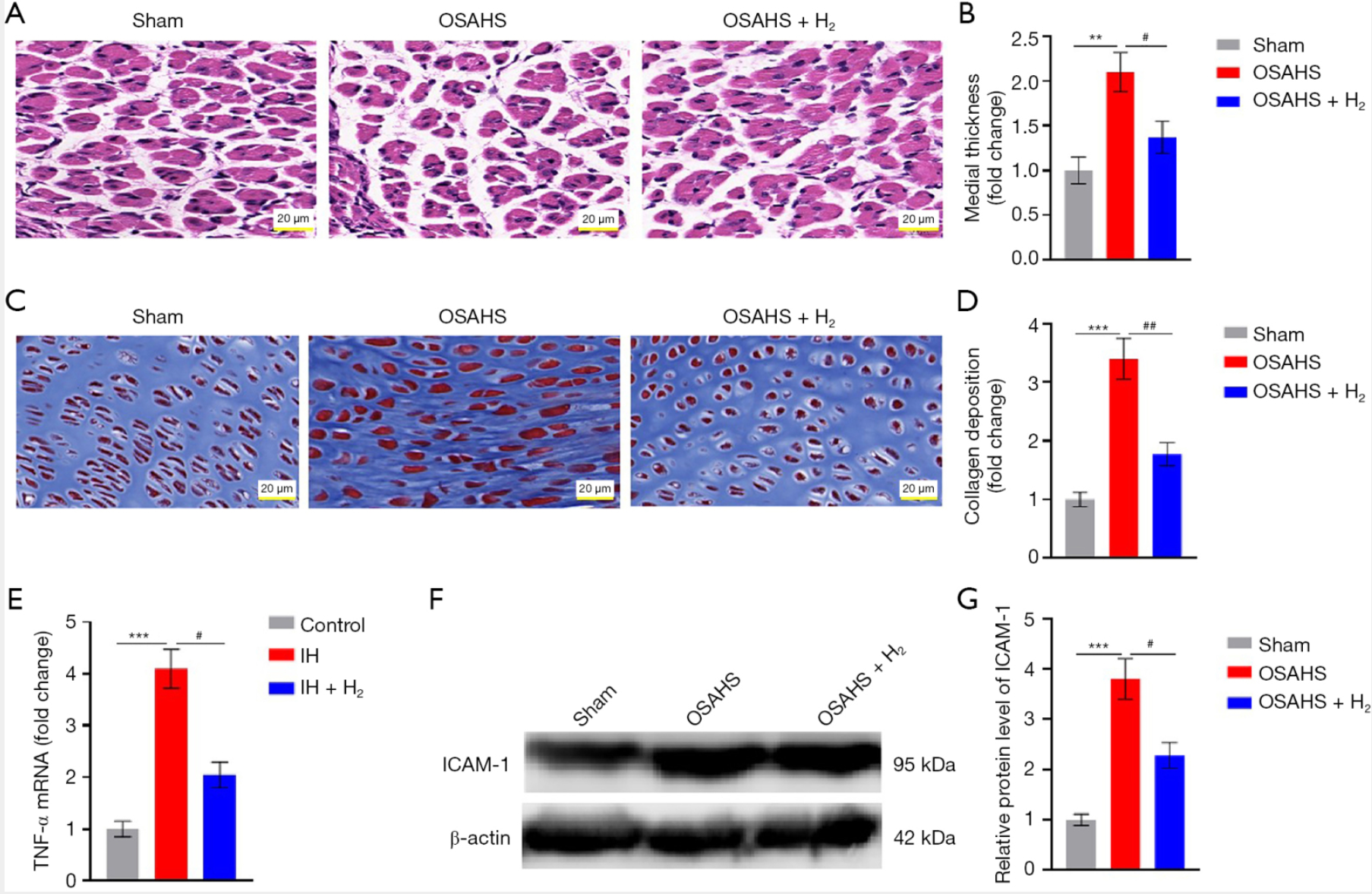
图3 氢气减轻OSAHS中的血管重构与炎症反应
(A)主动脉切片的代表性H&E染色结果(比例尺:20 μm)。
(B)主动脉中膜厚度的量化结果。与假手术组比较,**P<0.01;与OSAHS组比较,P<0.05。
(C)主动脉切片的代表性Masson染色结果(比例尺:20 μm)。
(D)纤维化区域的量化结果。与假手术组比较,***P<0.001;与OSAHS组比较,P<0.01。
(E)采用逆转录聚合酶链反应(RT-PCR)分析HUVECs中TNF-α mRNA水平。与对照组比较,***P<0.001;与IH组比较,P<0.05。
(F)采用Western blot检测大鼠主动脉中ICAM-1蛋白水平,以β-肌动蛋白作为内参蛋白。
(G)ICAM-1蛋白水平的量化结果(以β-肌动蛋白为参照进行标准化)。与假手术组比较,***P<0.001;与OSAHS组比较,P<0.05。
缩略词:H&E,苏木精-伊红;HUVECs,人脐静脉内皮细胞;ICAM-1,细胞间黏附分子-1;IH,间歇性缺氧;mRNA,信使核糖核酸;OSAHS,阻塞性睡眠呼吸暂停低通气综合征;RT-PCR,逆转录聚合酶链反应;TNF-α,肿瘤坏死因子-α。
氢气(H₂)治疗效应的全身与细胞水平验证
对OSAHS大鼠的血浆分析显示,全身性氧化应激标志物——8-异前列腺素水平升高2.6倍(与假手术组比较,P<0.001,图4A);而吸入H₂可使该指标降低62%(与OSAHS组比较,P<0.01,图4A)。在HUVECs中,IH使超氧化物歧化酶(SOD)活性降低75%(与对照组比较,P<0.01,图4B);H₂处理可使SOD活性恢复至接近对照组水平(与IH组比较,P<0.01,图4B)。末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)染色进一步显示,H₂可使IH诱导的主动脉组织内皮细胞凋亡减少55%(与OSAHS组比较,P<0.01,图4C、4D),这与血管完整性的维持一致。

图4 氢气治疗效应的全身与细胞水平验证
(A)采用ELISA检测大鼠血浆中全身性氧化应激标志物8-异前列腺素水平。与假手术组比较,***P<0.001;与OSAHS组比较,P<0.01。
(B)HUVECs中超氧化物歧化酶(SOD)活性检测结果。与对照组比较,**P<0.01;与IH组比较,P<0.01。
(C)采用TUNEL染色检测主动脉组织中内皮细胞凋亡情况(比例尺:20 μm),黄色箭头指示TUNEL阳性凋亡内皮细胞。
(D)凋亡指数计算公式为:TUNEL阳性内皮细胞数/总内皮细胞数×100%。数据以均值±标准误表示(n=3)。与假手术组比较,***P<0.001;与OSAHS组比较,P<0.01。
缩略词:DAPI,4',6-二脒基-2-苯基吲哚;ELISA,酶联免疫吸附试验;HUVECs,人脐静脉内皮细胞;IH,间歇性缺氧;OSAHS,阻塞性睡眠呼吸暂停低通气综合征;SEM,标准误;SOD,超氧化物歧化酶;TUNEL,末端脱氧核苷酸转移酶介导的dUTP缺口末端标记。
讨论部分
本研究结果表明,补充H₂可减轻IH诱导的氧化应激、使eNOS重偶联并维持血管结构完整性,从而填补了OSAHS治疗领域的关键空白。因此,本研究提供了有力证据:氢气可通过抗氧化与抗炎双重机制恢复NO稳态,有效减轻OSAHS中的血管内皮功能障碍。尽管Li等人(2025年)近期的一项临床研究已证实富氢水可改善OSAHS患者的代谢指标(31),但H₂保护血管内皮免受损伤的具体机制仍不明确。本研究结果不仅拓展了已知的H₂心脏保护作用,还通过证实H₂可减轻氧化应激、使eNOS重偶联并恢复NO生物利用度,为其对抗OSAHS特异性内皮损伤的作用提供了机制层面的见解。
本研究的核心创新点在于采用转化医学研究方法,通过体外与体内模型的结合,阐明H₂的多方面作用机制。与以往聚焦H₂在慢性缺氧或缺血再灌注模型中抗氧化作用的研究不同(32),本研究专门针对OSAHS的周期性IH模式——该模式会独特地引发ROS振荡性爆发与eNOS解偶联。通过证实H₂可维持BH4/BH2比值(eNOS偶联的决定因素),我们为早期在高血糖与吸烟模型中观察到的“H₂提高NO生物利用度”现象提供了明确的机制解释。我们的数据与“BH4耗竭是心血管疾病中内皮功能障碍的基础”这一报道一致(33),同时将该机制拓展至OSAHS领域——在OSAHS中,IH诱导的氧化应激既是eNOS调节异常的原因,也是其结果。H₂可使BH4/BH2比值恢复2.2倍,这一结果凸显了其在靶向氧化还原敏感性辅因子方面的特异性;相比之下,维生素C等非选择性抗氧化剂可能会破坏生理性ROS信号通路。这种特异性提示,H₂并非直接的化学计量型清除剂,而是通过间接调节氧化还原平衡发挥作用,其潜在机制可能包括轻度线粒体应激、激活核因子红细胞2相关因子2等通路,从而维持有益的氧化还原信号。
H₂作用的功能意义可通过OSAHS大鼠内皮依赖性血管舒张功能改善40%得到证实——该指标与临床结局直接相关。这与人类研究中“OSAHS患者血流介导的舒张功能受损”的结果一致,但此前尚无任何疗法能同时解决氧化应激、NO缺乏与血管重构问题(34)。值得注意的是,H₂的抗炎作用(可抑制50%的TNF-α并减少40%的ICAM-1)与其抗氧化作用相辅相成,这与它在类风湿关节炎等炎症性疾病中的疗效相似。然而,本研究首次将这些作用与OSAHS相关的内皮病理过程关联,提示H₂的多效性作用可能与持续气道正压通气(CPAP)协同,为依从性差的患者解决残余心血管风险问题。尽管取得了这些进展,本研究仍存在一些局限性:首先,尽管我们的大鼠模型复制了IH模式,但未能完全模拟人类OSAHS的复杂性——人类OSAHS常伴随肥胖、代谢紊乱与神经反射异常。值得注意的是,H₂在OSAHS中的潜在益处可能超出改善内皮功能的范畴。鉴于OSAHS患者常合并代谢紊乱(如胰岛素抵抗、血脂异常),已有研究证实H₂具有代谢调节作用(在动物模型与新兴临床研究中均观察到其可改善糖代谢与血脂水平)(35,36),这为H₂的治疗应用提供了额外依据。这提示H₂可能同时靶向OSAHS的心血管与代谢并发症,成为一种综合性治疗策略。其次,本研究聚焦H₂的急性与亚慢性给药,尚未探索其对血管重构的长期效应及潜在耐受性。第三,本研究未探究H₂调节BH4合成的精确分子通路(如鸟苷三磷酸环化水解酶I的调控机制),仍需进一步完善机制研究。未来研究应在更大规模的动物模型与OSAHS患者中验证这些结果,评估H₂与CPAP的相互作用,并探索针对eNOS解偶联下游效应因子(如精氨酸酶、不对称二甲基精氨酸)的联合治疗策略。
结论部分
综上所述,本研究证实H₂是治疗OSAHS相关内皮功能障碍的潜在辅助疗法,为打破“慢性氧化应激升高→NO缺乏→炎症失调”的恶性循环提供了具有明确机制的策略。通过同时针对分子层面与功能层面的指标,本研究推进了H₂的转化应用潜力,同时也强调了开展临床试验的必要性——以评估其在改善这一高危人群心血管结局方面的疗效。
https://blog.sciencenet.cn/blog-41174-1513966.html
上一篇:首个慢性疲劳综合征血液检测方法问世
下一篇:从基础到临床,从临床到基础(上海临床研究中心)