博文
Rieske铁硫蛋白是氢气的主要作用靶点【亮点】
||
Rieske铁硫蛋白是氢气的主要作用靶点
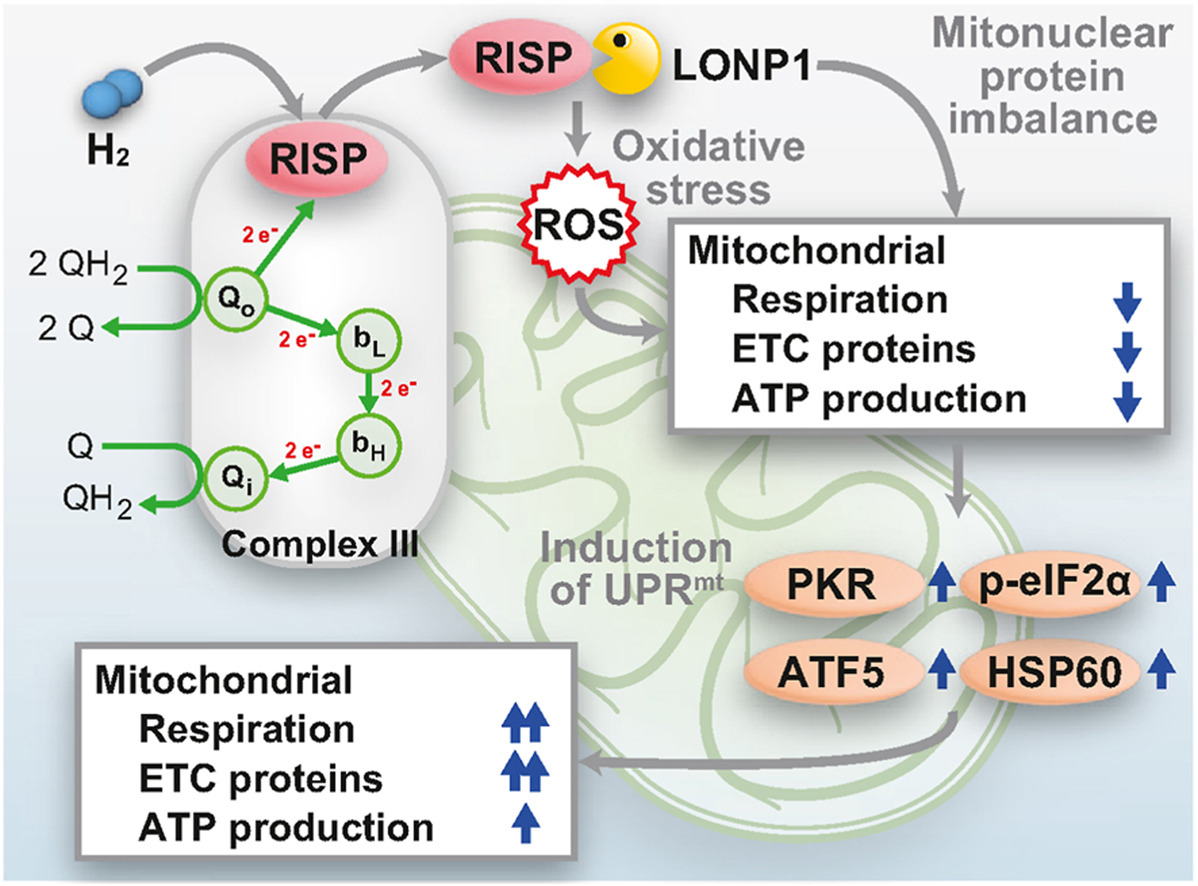
长期以来,人们认为氢气(H₂)具有生物惰性,因此其生物医学效应的潜在机制尚不明确,且常被归因于它对羟基自由基的选择性清除作用。本研究证实,氢气具有生物活性,可特异性靶向Rieske铁硫蛋白(RISP)。
研究首先发现,在培养细胞中以及小鼠饮用富氢水后的肝脏组织中,氢气均可诱导线粒体未折叠蛋白反应(UPRmt)。在小鼠肝匀浆中,氢气可在2分钟内将电子传递链复合体Ⅲ的活性抑制至对照组的78.5%。鉴于氢化酶与铁硫蛋白在进化上的关联,我们将RISP作为氢气的潜在作用靶点进行了研究。结果发现,在培养细胞中,氢气可通过激活线粒体Lon蛋白酶1(LONP1),在1小时内促进RISP降解。
RISP的减少以及后续UPRmt的激活,或可解释氢气所具有的多效性及看似矛盾的效应。这些研究结果证实RISP是氢气的主要作用靶点,同时表明氢气作为一种信号分子具有生物活性。
AI点评:
这篇发表于《Redox Biology》期刊的论文《The Rieske iron-sulfur protein is a primary target of molecular hydrogen》揭示了分子氢(H₂)在生物体内的新作用机制,挑战了长期以来认为H₂是生物惰性分子的观点。以下是论文主要内容的详细总结:
一、研究背景与问题· 传统观点:H₂因其小分子、中性、非极性的特性,被认为在哺乳动物中无生物活性,其作用被归因于选择性清除羟基自由基(·OH)。
· 矛盾与挑战:H₂与·OH的反应速率较慢,且体内H₂浓度低、停留时间短,难以解释其长效(数小时至数天)的保护效应(如抗炎、抗氧化、改善代谢等)。
· 新假设:H₂可能通过靶向线粒体中与氢酶进化相关的铁硫蛋白(如Rieske铁硫蛋白,RISP)发挥生物学作用。
二、核心发现1. H₂特异性靶向RISP并诱导其降解· 靶点识别:RISP是线粒体电子传递链复合体III(Complex III)中唯一含有[2fe-2S]铁硫簇的蛋白,其结构与氢酶的活性中心相似。
· 实验证据:
o H₂处理1小时内,AML12细胞(小鼠肝细胞系)中RISP蛋白水平下降至73.3%(图4)。
o RISP降解由线粒体Lon peptidase 1(LONP1)介导(图5):敲低LONP1或使用抑制剂CDDO-Me均能阻断H₂对RISP的降解作用。
· 特异性:H₂不影响其他氧化磷酸化复合体蛋白(如复合体I、II、IV),表明靶向作用具有高度选择性(图S2)。
2. H₂抑制复合体III活性并触发线粒体未折叠蛋白反应(UPRmt)· 快速抑制复合体III:在分离的小鼠肝脏线粒体中,H₂在2分钟内将复合体III活性抑制至78.5%(图3A),但不影响复合体I或IV。
· 诱导UPRmt:
o 在AML12细胞和小鼠肝脏中,H₂处理上调UPRmt关键蛋白(PKR、p-eIF2α、ATF5、HSP60)的表达(图2)。
o UPRmt的诱导依赖于RISP降解导致的线粒体核蛋白失衡(mitonuclear protein imbalance)。
3. H₂引发双相性线粒体应激反应(线粒体激素效应)· 早期抑制(1小时内):
o 线粒体超氧化物水平和膜电位短暂下降(图1)。
o ATP产量降至85.1%(图4C),反映电子传递链暂时受阻。
· 后期增强(6-24小时):
o 超氧化物和膜电位显著升高,ATP水平恢复(图1, 4C)。
o RISP和MT-CO1(复合体IV亚基)蛋白水平补偿性上升(图4B),表明UPRmt激活了适应性修复机制。
4. 机制验证:H₂通过FeS-c₁通路调控电子传递· 使用复合体III抑制剂(antimycin A、myxothiazol)验证:
o H₂与antimycin A(阻断Qi位点)联用可阻断UPRmt,而与myxothiazol(完全阻断Qo位点和FeS-c₁通路)联用无叠加效应(图3C-E)。
o 表明H₂特异性作用于FeS-c₁通路(RISP所在路径),部分抑制电子传递而非完全阻断。
三、机制模型1. H₂与RISP结合:可能通过其独特的组氨酸配位[2fe-2S]簇改变RISP构象,使其被LONP1识别为“错误折叠”蛋白而降解。
2. 触发UPRmt:RISP降解导致复合体III功能暂时抑制,引发线粒体应激和UPRmt。
3. 适应性修复:UPRmt上调线粒体蛋白合成,恢复电子传递功能并增强抗氧化能力,实现线粒体激素效应(低剂量应激诱导保护)。
四、理论与临床意义· 重新定义H₂的角色:从“惰性抗氧化剂”转变为“生物活性信号分子”,通过靶向RISP调控线粒体信号通路。
· 解释矛盾现象:双相反应机制(先抑制后增强)合理解释了既往研究中H₂对氧化应激、炎症标记物的双向调节作用。
· 临床启示:间歇性H₂暴露(如饮用富氢水)可能通过诱导适度应激优化线粒体功能,为神经退行性疾病、代谢性疾病治疗提供新思路。
五、研究局限· 未直接解析H₂与RISP结合的分子结构变化。
· LONP1识别H₂修饰后RISP的具体机制尚待阐明。
总结该研究首次明确RISP是H₂的直接作用靶点,揭示了H₂通过LONP1介导的RISP降解-UPRmt激活通路调控线粒体功能的分子机制,为H₂的临床应用提供了坚实的理论基础。
1. 引言
氢气(H₂)的治疗潜力可追溯至1793年,其与羟基自由基(•OH)的反应动力学特征在20世纪60年代得到阐明[1]。然而,由于H₂分子体积小、呈电中性且无极性,加之人类体内不存在氢化酶,长期以来H₂被认为是生物惰性气体。与一氧化碳(CO)、硫化氢(H₂S)、一氧化氮(NO•)等气体信号分子不同,H₂曾被认为缺乏与生物大分子相互作用所需的物理化学特性。正是基于“生物惰性气体”这一认知,自20世纪40年代起,H₂被用作深海潜水的安全惰性呼吸气体[2],而其在生理学中的作用也仅被视为微生物的代谢副产物[3]。
然而,越来越多的证据表明,肠道菌群产生的内源性H₂增加与代谢健康和认知健康改善、心血管疾病风险降低以及百岁老人寿命延长相关[4]。但目前尚未有合理机制能解释这些重要发现。
1975年,人们对H₂的认知发生了关键转变——《科学》(Science)杂志发表的一篇研究指出,高压氢气(而非氦气)能显著抑制小鼠肿瘤进展,研究认为其机制可能是H₂具有清除细胞毒性•OH自由基的能力[5]。2007年,《自然·医学》(Nature Medicine)的一项研究进一步凸显了这一机制假说:该研究发现H₂可减轻大鼠脑卒中模型的脑损伤[6]。上述两项研究均以“自由基清除”作为核心机制。但这一观点受到了质疑——相较于其他更丰富的亲核生物分子,H₂的二级反应速率较慢[7]。尽管如此,关于H₂的研究仍迅速增多,目前已发表超过3000篇相关文献,其中包括200项人体研究,均强调了其潜在治疗作用[8]。然而,H₂作用的主要分子靶点和机制仍不明确,多数文献仍将H₂仅定义为一种抗氧化剂。最新研究显示,H₂可与铁卟啉(Fe-porphyrin)结合,形成的氢化铁卟啉(hydrided Fe-porphyrin)能还原羟基自由基[9];此外,H₂可将结合于铁卟啉的二氧化碳(CO₂)转化为一氧化碳(CO)。但通过该途径还原的羟基自由基数量及生成的CO量可能过低,不足以产生有效的生物学效应。同样,在细胞内(in cellulo)和体内(in vivo)环境中,H₂的浓度过低且停留时间过短[8,10],无法解释其为何能产生持续数小时至数天的残余保护作用。
鉴于现有假说机制存在局限性,我们提出以下假设:H₂可能与一种进化上保守、含铁硫([Fe–S])簇的类氢化酶蛋白相互作用。线粒体电子传递链(ETC)复合体Ⅲ中的 Rieske 铁硫蛋白(RISP,由UQCRFS1基因编码)含有[2Fe–2S]簇,是与H₂相互作用的潜在候选蛋白。在Q循环中,RISP负责将电子从泛醇传递至细胞色素c1。尽管RISP缺乏典型的H₂激活或结合位点,但其保守的[2Fe–2S]簇在结构和进化上与氢化酶催化中心具有相似性。
线粒体功能障碍会激活线粒体未折叠蛋白反应(UPRmt)——这是一种通过线粒体 hormesis(线粒体应激适应)机制维持线粒体稳态的适应性通路[11]。祖父江(Sobue)等人报道,H₂可在小鼠肝脏中诱导UPRmt[12];我们此前的研究也发现,在H₂诱导UPRmt的细胞中,H₂可改善线粒体功能[13]。
本研究揭示,H₂可直接靶向RISP,诱导其通过LONP1介导的途径降解,从而抑制复合体Ⅲ活性,并随后激活UPRmt。这一靶向作用阐明了一种此前未被发现的机制,将H₂的定位从“生物惰性分子”重新定义为“可调控线粒体信号通路的生物活性信号分子”。
2. 材料与方法
2.1 动物实验与氢气水自由饮用
所有动物实验均经名古屋大学动物护理与使用委员会批准,并严格遵循相关实验指南。7周龄C57BL/6N小鼠购自日本SLC公司。氢气水(H₂水)每晚使用“Hydrogen Water 7.0”(Ecomo International公司产品,由MiZ株式会社友好提供)新鲜制备,新鲜制备的氢气水中H₂浓度为2.5~3.5 mM。置于小鼠笼中的玻璃容器内,H₂浓度呈指数级下降,半衰期为1.09小时[35]。由于小鼠夜间约每小时饮水一次,据此推算小鼠饮用的氢气水平均浓度为1.7 mg/L[35]。小鼠自7周龄起开始饮用氢气水,4周后禁食17小时,随后在异氟烷深度麻醉下处死。收集小鼠全肝组织,迅速置于液氮中冷冻保存。
2.2 细胞培养与氢气暴露处理
我们此前已分析过H₂对AML12、A549、HCT116、HeLa、HepG2、HT1080、PC3和SH-SY5Y细胞的作用,发现前五种细胞(AML12、A549、HCT116、HeLa、PC3)对H₂的反应性高于其他细胞[13]。由于除AML12细胞外,其余四种均为癌细胞,因此本研究选用源自正常小鼠肝细胞的AML12细胞。AML12细胞购自美国典型培养物保藏中心(ATCC),培养于含10%胎牛血清(FBS,赛默飞世尔科技公司)、地塞米松(Sigma公司)和胰岛素-转铁蛋白-亚硒酸钠(Sigma公司)的DMEM/F-12培养基(Gibco公司)中。
将6孔或96孔培养板置于560 mL密闭塑料盒内,塑料盒底部加水保湿;随后将塑料盒放入培养箱(SLI-221,EYELA公司),维持盒内温度37℃。将H₂或氮气(N₂)气体(流速6 mL/min)与含二氧化碳的空气(5% CO₂、95%空气,流速54 mL/min)混合,制备10% H₂或10% N₂混合气体。由于空气本身含78.1% N₂,因此标注为“10% N₂”的混合气体中,实际N₂浓度为76.8%,但为简化表述,本研究中仍称之为“10% N₂气体”。混合气体通过进气管通入塑料盒,塑料盒同时配备出气管,将盒内气体排至室外。
培养基中H₂浓度的测定方法如下:取1 mL培养基与100 mL 100% N₂气体在铝袋中平衡,随后取1 mL平衡后的气体,通过气相色谱仪(EAGanalyzer GS-23)进行分析。所有细胞实验均在同一天进行3次或4次重复,培养皿数量详见各图图例。为验证H₂是否通过减少活性氧(ROS)来降低RISP水平,在AML12细胞暴露于10% H₂气体1小时前,先用2 mM N-乙酰半胱氨酸(NAC)处理18小时。
2.3 小鼠肝匀浆中线粒体电子传递链(ETC)活性测定
ETC活性测定参照此前报道的方法[36]。简要步骤如下:取5 μL小鼠肝匀浆或细胞裂解液用于反应;采用Pierce 660 nm蛋白测定试剂(赛默飞世尔科技公司)检测各样本的蛋白浓度。使用NanoDrop 2000C(赛默飞世尔科技公司)分别测定ETC复合体Ⅰ、Ⅲ、Ⅳ的活性:复合体Ⅰ活性通过180秒内NADH在340 nm处的吸光度下降值衡量;复合体Ⅲ活性通过120秒内还原型细胞色素c在550 nm处的吸光度上升值衡量;复合体Ⅳ活性通过180秒内还原型细胞色素c在550 nm处的吸光度下降值衡量。本研究严格遵循此前报道的孵育时间[36],未对实验条件进行调整。在加入匀浆前,立即使用“Hydrogen Water 7.0”(浓度2.5~3.5 mM)将H₂溶解于反应缓冲液中。
2.4 电子传递链复合体Ⅲ抑制剂
抗霉素A(Antimycin A)和粘噻唑(Myxothiazol)购自Sigma Aldrich公司。在收集细胞前12小时,将不同浓度的上述抑制剂加入培养基中。
2.5 线粒体超氧化物水平与线粒体膜电位测定
为评估H₂在10分钟和30分钟内对线粒体超氧化物水平及线粒体膜电位的急性影响,使用“Hydrogen Water 7.0”(浓度2.5~3.5 mM)将H₂溶解于培养基中,随后加入AML12细胞。为评估H₂在1~24小时内的延迟效应,将AML12细胞置于上述10% H₂或10% N₂气体环境中培养。
细胞用PBS清洗后,分别加入含5 μL MitoSOX(货号M36008,赛默飞世尔科技公司)的汉克平衡盐溶液(HBSS,Gibco公司)或含100 nM四甲基罗丹明(TMRM,货号T668,赛默飞世尔科技公司)的PBS,在培养箱中37℃孵育30分钟。随后用含0.25%胰蛋白酶/0.1% EDTA的PBS消化收集细胞,在4℃下以3000×g离心2分钟;用PBS清洗后,使用BD FACS Calibur流式细胞仪(BD科学公司)定量检测MitoSOX和TMRM的信号强度。
2.6 荧光素酶报告基因实验检测HSPD1(HSP60)启动子活性
通过PCR扩增人HSPD1基因启动子的1333 bp片段(根据GRCh38基因组版本,对应位置为197499187~197500519),并将其克隆至pGL4.10荧光素酶报告质粒(Promega公司)中。按照试剂盒说明书,使用Lipofectamine 2000转染试剂(Invitrogen公司)将pGL4.10-HSPD1质粒与phRL-TK质粒(海肾荧光素酶质粒,Promega公司)共转染至AML12细胞。转染6小时后,将细胞暴露于10% H₂或10% N₂气体中18小时。使用双荧光素酶报告基因检测系统(Promega公司)结合PowerScan4检测仪(DS Pharma Biomedical公司)测定荧光素酶活性。
2.7 Lonp1基因敲低与CDDO-Me抑制LONP1活性
参照i-Score Designer设计小鼠Lonp1基因的小干扰RNA(siRNA)[37],siRNA序列如下:si783(5’-GGUGGAGGUUGAGAAUGUA-3’)和si1194(5’-GGAGAAAGAUGAUAAAGAU-3’)。为实现Lonp1基因敲低,按照试剂盒说明书,使用Lipofectamine RNAiMax转染试剂(Invitrogen公司)将150 pmol Lonp1靶向siRNA(si783或si1194)或对照siRNA(AllStars阴性对照siRNA,Qiagen公司)转染至AML12细胞。转染48小时后,将细胞暴露于10% H₂或10% N₂气体中1小时或12小时。
为通过化学手段抑制LONP1活性,用0.1 μM或1 μM CDDO-Me(Sigma公司)处理AML12细胞,随后在10% H₂或10% N₂气体环境中培养1小时。
2.8 细胞裂解液制备与蛋白质印迹实验(Western blotting)
使用PLC裂解缓冲液收集细胞,该缓冲液成分如下:50 mM HEPES(pH 7.0)、150 mM NaCl、10%甘油、1% Triton X-100、1.5 mM MgCl₂、1 mM EGTA、100 mM NaF、10 mM焦磷酸钠、1 μg/μL抑肽酶、1 μg/μL亮抑酶肽、1 μg/μL胃蛋白酶抑制剂A、1 mM苯甲基磺酰氟(PMSF)、1 mM原钒酸钠,以及磷酸酶抑制剂混合物(PhosSTOP,Roche公司)。
将裂解液在4℃下于旋转摇床上振荡15分钟,随后在4℃下以17900×g离心15分钟;取上清液与2×Laemmli缓冲液混合,在95℃下煮沸5分钟。将样本上样至10%或14% SDS-聚丙烯酰胺凝胶进行电泳,随后转移至Immobilon-P膜(Millipore公司)上。用含0.05% Tween 20的Tris缓冲盐水(TBS-T)清洗膜,室温下用含5%脱脂牛奶的TBS-T封闭1小时。将膜与一抗(详见补充表S1)在4℃下孵育过夜;用TBS-T清洗后,加入辣根过氧化物酶(HRP)偶联的山羊抗小鼠IgG二抗(1:5000,货号LNA931V/AG,GE Healthcare公司)或山羊抗兔IgG二抗(1:5000,货号LNA934V/AE,GE Healthcare公司),室温孵育1小时。
使用Amersham ECL蛋白质印迹检测试剂(GE Healthcare公司)显影抗体结合的蛋白质,并用ImageQuant软件(GE Healthcare公司)定量检测信号强度。
2.9 ATP定量检测实验
将AML12细胞置于10%氮气(N₂)环境中孵育24小时后,再分别置于10%氢气(H₂)或10%氮气环境中培养1~24小时。使用荧光素酶ATP检测试剂盒(货号ab113849,abcam公司)对ATP含量进行定量分析。
2.10 统计学分析
所有数据均以“平均值±标准误(mean ± SEM)”表示。除非另有说明,细胞实验(in cellulo)数据均以10%氮气处理组细胞的数据为基准进行标准化。采用GraphPad Prism 10.6.1版和IBM SPSS 29.0.2.0版软件,通过Student's t检验、单因素方差分析(one-way ANOVA)结合Tukey事后检验、双因素方差分析(two-way ANOVA)结合Sidak事后检验、双因素方差分析结合Tukey事后检验或Jonckheere-Terpstra趋势检验评估数据的统计学显著性。P值小于0.05被认为具有统计学意义。
3 结果
3.1 氢气调控线粒体超氧化物水平与线粒体膜电位
我们检测了氢气对AML12细胞线粒体超氧化物生成量及线粒体膜电位的影响,结果显示:与对照气体(10%氮气/4.5%二氧化碳/85.5%空气)相比,暴露于10%氢气气体(10%氢气/4.5%二氧化碳/85.5%空气)10分钟后,细胞线粒体超氧化物水平和膜电位分别降至对照组的80.0%和78.1%(图1A、B)。然而,培养1小时后,超氧化物水平和膜电位分别升高至对照组的116.6%和130.1%;培养24小时后,进一步升高至对照组的137.2%和203.6%。超氧化物生成量和膜电位先降低后升高的变化趋势,提示氢气可能抑制线粒体电子传递链(ETC)活性并诱导线粒体应激适应(mitohormesis)。
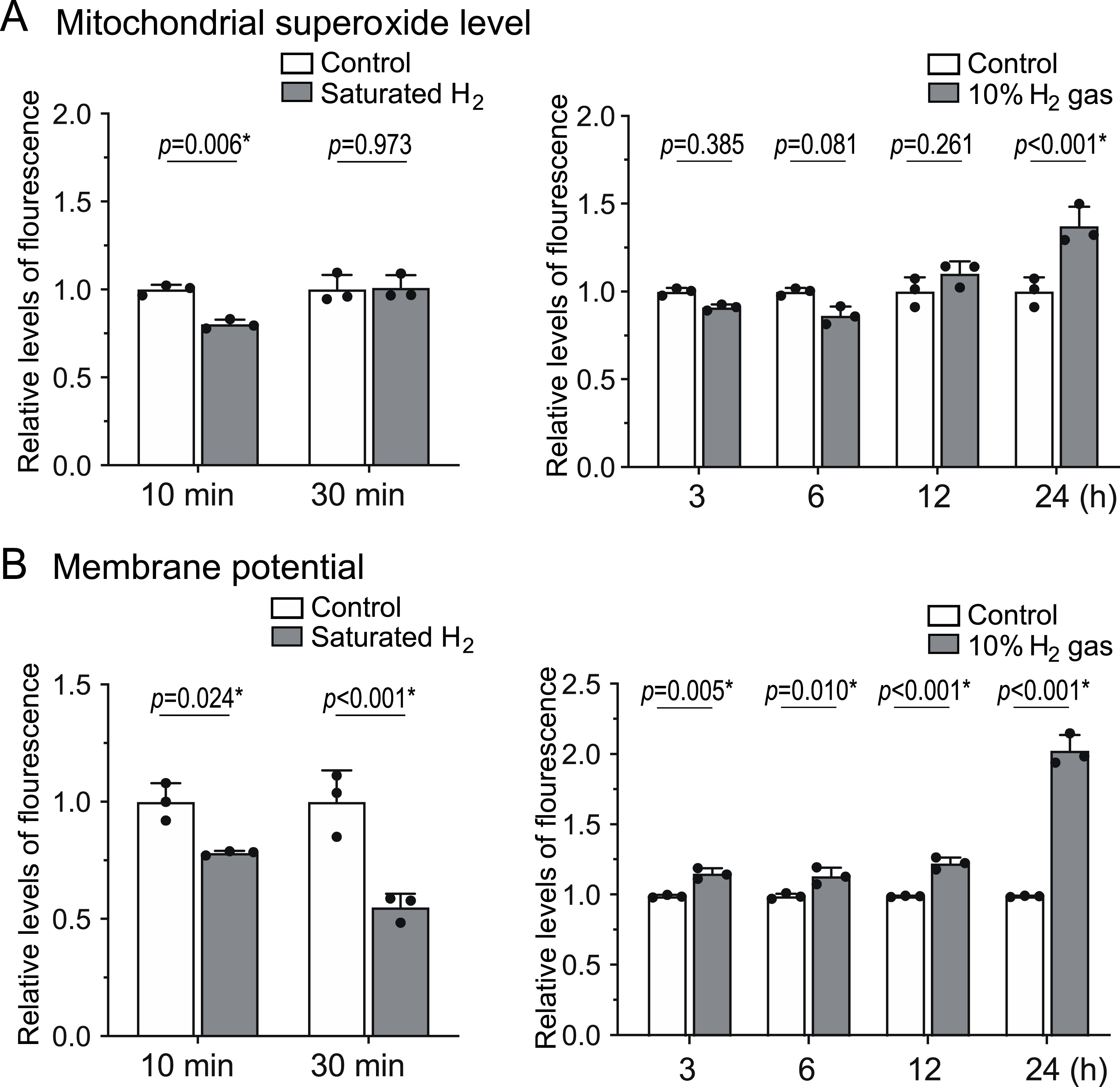
图1 氢气先抑制线粒体电子传递链活性,随后通过诱导线粒体未折叠蛋白反应(UPRmt)上调其活性**
将AML12细胞置于10%氢气或对照气体环境中培养10分钟至24小时,分别用MitoSOX(检测线粒体超氧化物,图A)和TMRM(检测线粒体膜电位,图B)染色。短期暴露(左图)实验中,培养基预先饱和氢气后再加入细胞;长期暴露(右图)实验中,培养板直接置于10%氢气或对照气体环境中。采用双因素方差分析结合Sidak事后检验分析P值(n=3个培养皿),星号表示具有统计学显著性。
3.2 氢气在培养细胞及野生型小鼠肝脏中诱导线粒体未折叠蛋白反应(UPRmt)
为明确线粒体应激适应的参与情况,我们检测了氢气是否能在小鼠肝脏来源的AML12细胞及野生型小鼠肝脏中诱导UPRmt。结果显示:与对照气体相比,AML12细胞暴露于10%氢气环境6小时及以上,UPRmt相关蛋白(PKR、磷酸化eIF2α(p-eIF2α)、ATF5、HSP60)的表达水平显著升高(图2A、B),且编码HSP60的Hspd1基因启动子活性也显著增强(图2C)。类似地,野生型C57BL/6N小鼠自由饮用富氢水4周后,肝脏中UPRmt相关蛋白(PKR、p-eIF2α、ATF5、HSP60)的表达水平同样升高,尽管ATF5和HSP60的升高未达到统计学显著性(图2D、E)。我们还检测了线粒体分裂与融合相关蛋白的表达水平,以评估氢气对线粒体动力学的影响,结果显示:氢气处理AML12细胞6小时后,这些蛋白的表达水平未发生显著变化(补充图S1)。
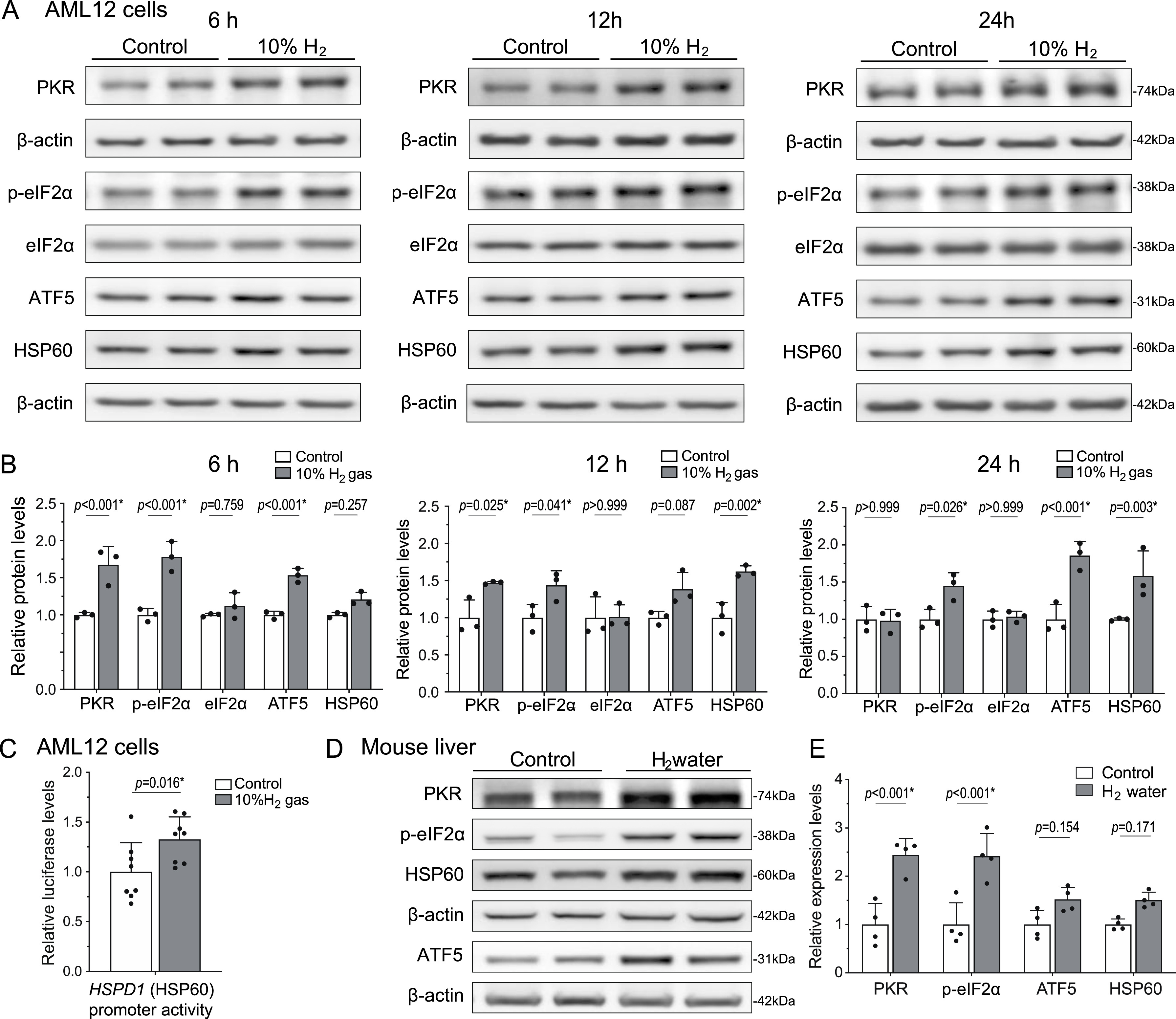
图2 氢气在AML12细胞和小鼠肝脏中诱导UPRmt**
(A、B)将AML12细胞暴露于10%氢气或对照气体环境中6、12、24小时,UPRmt相关蛋白(PKR、p-eIF2α、eIF2α、ATF5、HSP60)的蛋白质印迹代表性结果(A)及定量分析(B)。采用双因素方差分析结合Sidak事后检验分析P值(每组n=3个培养皿),*P<0.05。
(C)将AML12细胞暴露于10%氢气或对照气体环境中18小时,人HSPD1(HSP60)基因启动子的pGL4荧光素酶活性经海肾荧光素酶(phRL-TK)活性标准化,并以对照组的比值为基准进行校正。采用Student's t检验分析P值(每组n=8个培养皿),*P<0.05。
(D、E)C57BL/6N小鼠自由饮用富氢水4周,小鼠肝脏中UPRmt相关蛋白(PKR、p-eIF2α、ATF5、HSP60)的蛋白质印迹代表性结果(D)及定量分析(E)。采用双因素方差分析结合Sidak事后检验分析P值(每组n=4只小鼠),星号表示具有统计学显著性。
3.3 氢气减少ATP生成并抑制线粒体电子传递链(ETC)复合体Ⅲ的酶活性
接下来,我们检测了氢气对线粒体ETC复合体Ⅰ、Ⅲ、Ⅳ活性的影响(这三种复合体共同构成NADH生成ATP的主要通路)。结果显示:将野生型C57BL/6N小鼠肝脏分离的线粒体置于富氢缓冲液中,仅2~3分钟即可使ETC复合体Ⅲ的酶活性降至对照组的78.5%,但对复合体Ⅰ和Ⅳ的活性无显著抑制作用(图3A)。这表明氢气可能选择性抑制ETC复合体Ⅲ的某个关键亚基。
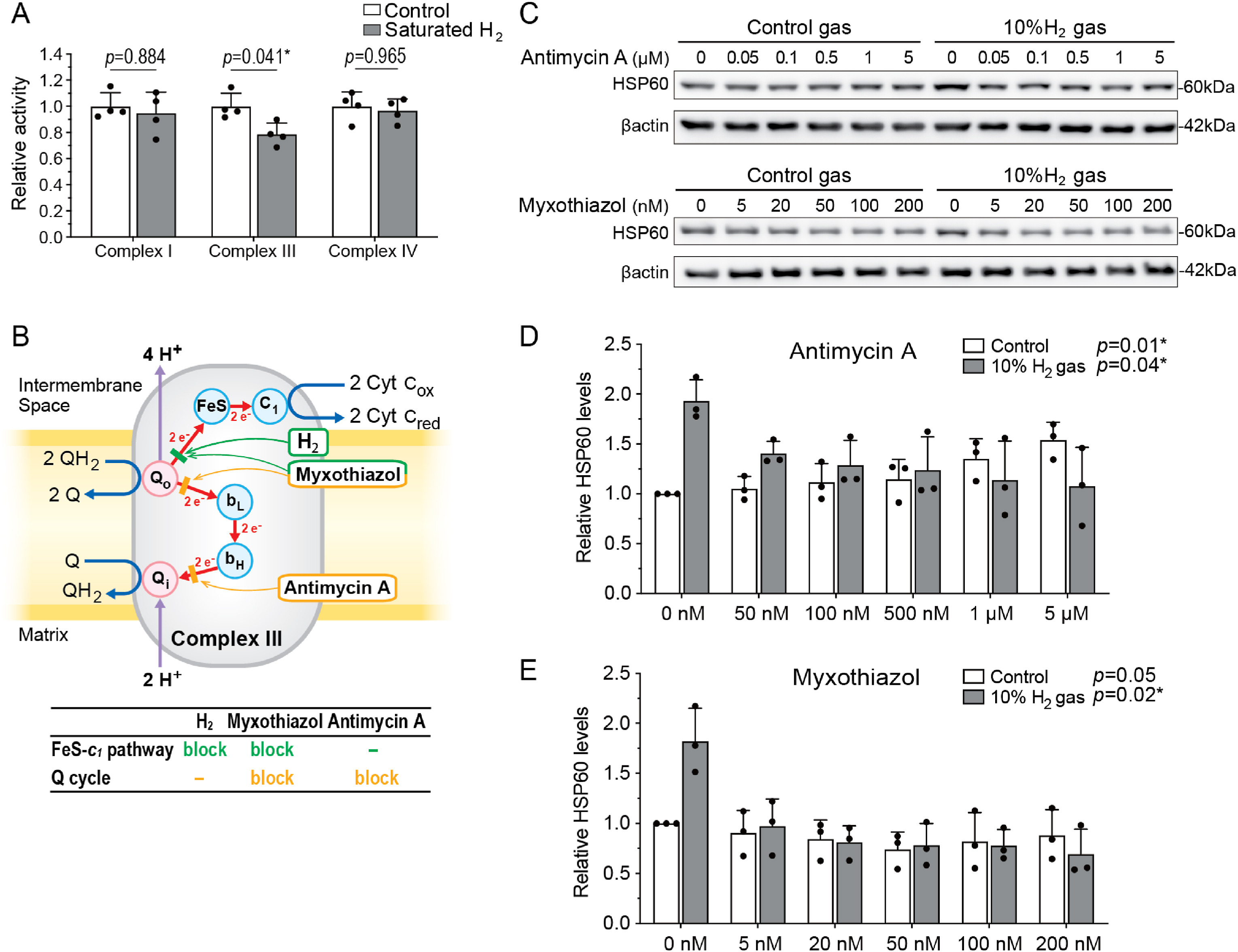
图3 氢气通过阻断FeS-c1通路降低ETC复合体Ⅲ活性**
(A)将分离的小鼠肝脏线粒体置于饱和氢气的反应缓冲液中2~3分钟,检测线粒体ETC各复合体活性。采用双因素方差分析结合Sidak事后检验分析P值(每组n=4只小鼠),*P<0.05。
(B)抗霉素A和粘噻唑(myxothiazol)在不同位点阻断Q循环(黄色条),而粘噻唑与氢气则阻断FeS-c1通路(绿色条)。单一阻断(抗霉素A或氢气)可保留对UPRmt的应答能力,双重阻断(粘噻唑)则会消除该应答能力。Q:泛醌;FeS:Rieske铁硫蛋白(RISP)。
(C、D、E)在存在复合体Ⅲ抑制剂(抗霉素A(图C、D)或粘噻唑(图C、E))的情况下,将AML12细胞暴露于10%氢气或对照气体环境中12小时,UPRmt相关蛋白HSP60的蛋白质印迹代表性结果(C)及定量分析(D、E)。采用Jonckheere-Terpstra趋势检验分析P值(每组n=3个培养皿),该检验用于判断数值变化是否呈单相趋势,每个条件对应一个P值,星号表示具有统计学显著性。
3.4 氢气调控复合体Ⅲ中FeS-c1通路的电子传递
为深入分析氢气对ETC复合体Ⅲ的作用,我们向AML12细胞中加入不同浓度的复合体Ⅲ抑制剂(抗霉素A和粘噻唑),孵育12小时后检测氢气对UPRmt的诱导效应。如图3B所示:抗霉素A在Qi位点(细胞色素bH→泛醌Q)阻断电子传递[14];而粘噻唑在Qo位点(泛醇QH₂→细胞色素bL)阻断电子传递,进而也阻断FeS-c1通路的电子传递[15],因此抑制作用更彻底。
在对照气体处理的AML12细胞中,抗霉素A在12小时内以剂量依赖性方式诱导UPRmt(图3C、D),而粘噻唑在相同时间内未诱导UPRmt(图3C、E)。单独暴露于氢气环境可显著诱导UPRmt(图3C~E);但氢气与抗霉素A联合处理时,UPRmt的诱导效应被抑制(图3C、D)。这一结果与粘噻唑的作用相似,提示氢气可能调控FeS-c1通路的电子传递。氢气对电子传递的部分抑制可能破坏电子流并减少半醌自由基的形成,而氢气与抗霉素A联合处理则完全阻断电子传递,从而抑制半醌自由基形成及UPRmt诱导。因此,氢气的作用靶点可能位于FeS-c1通路中。
3.5 氢气靶向并降低Rieske铁硫蛋白(RISP)的水平
以氢气为直接底物反应的氢化酶均含有铁硫簇(Fe-S簇)[16]。由UQCRFS1基因编码的RISP是复合体Ⅲ中唯一含铁硫簇的组分,且在FeS-c1通路的Q0位点直接接受电子(图3B)。基于此,我们检测了氢气对RISP的影响,结果显示:AML12细胞暴露于氢气环境1小时后,RISP水平降至对照组的73.3%(图4A、B)。为寻找其他潜在的氢气作用靶点,我们检测了氢气处理1小时后线粒体氧化磷酸化系统各复合体代表性蛋白的水平,未发现显著差异(补充图S2)。
我们还探究了RISP的降解是否由羟基自由基等活性氧(ROS)减少介导:将AML12细胞用2 mM N-乙酰半胱氨酸(NAC,ROS清除剂)处理18小时以降低ROS水平,再置于10%氢气环境中培养1小时。结果显示:NAC仅轻微降低RISP水平(无统计学显著性),而即使在NAC存在的情况下,氢气仍能降低RISP水平,这表明ROS减少并非氢气诱导RISP降低的介导因素(补充图S3)。由于NAC无法抵消氢气的作用,因此RISP的降低不太可能由氢气介导的自由基清除作用(若存在)引起。
进一步检测发现:RISP水平在3小时时恢复至基线,6小时时升高至对照组的147.4%,24小时时仍维持在对照组的131.2%。与RISP的变化趋势一致,氢气处理1小时后细胞ATP水平降至对照组的85.1%,但在12小时和24小时时恢复至基线水平(图4C)。相反,由线粒体DNA上MT-CO1基因编码的复合体Ⅳ组分——细胞色素c氧化酶亚基Ⅰ(cytochrome c oxidase subunit I),在6小时内水平无显著变化,24小时时则升高至对照组的155.4%(图4A、B)。
由于核线粒体蛋白失衡是诱导UPRmt的主要原因之一[17],因此1小时时RISP的短暂降低可能启动了UPRmt,进而在24小时时诱导RISP和MT-CO1的代偿性升高。我们还在其他细胞系中检测了氢气的作用,结果显示:氢气处理1小时后,HT1080细胞和HeLa细胞中的RISP水平同样降低(补充图S4)。
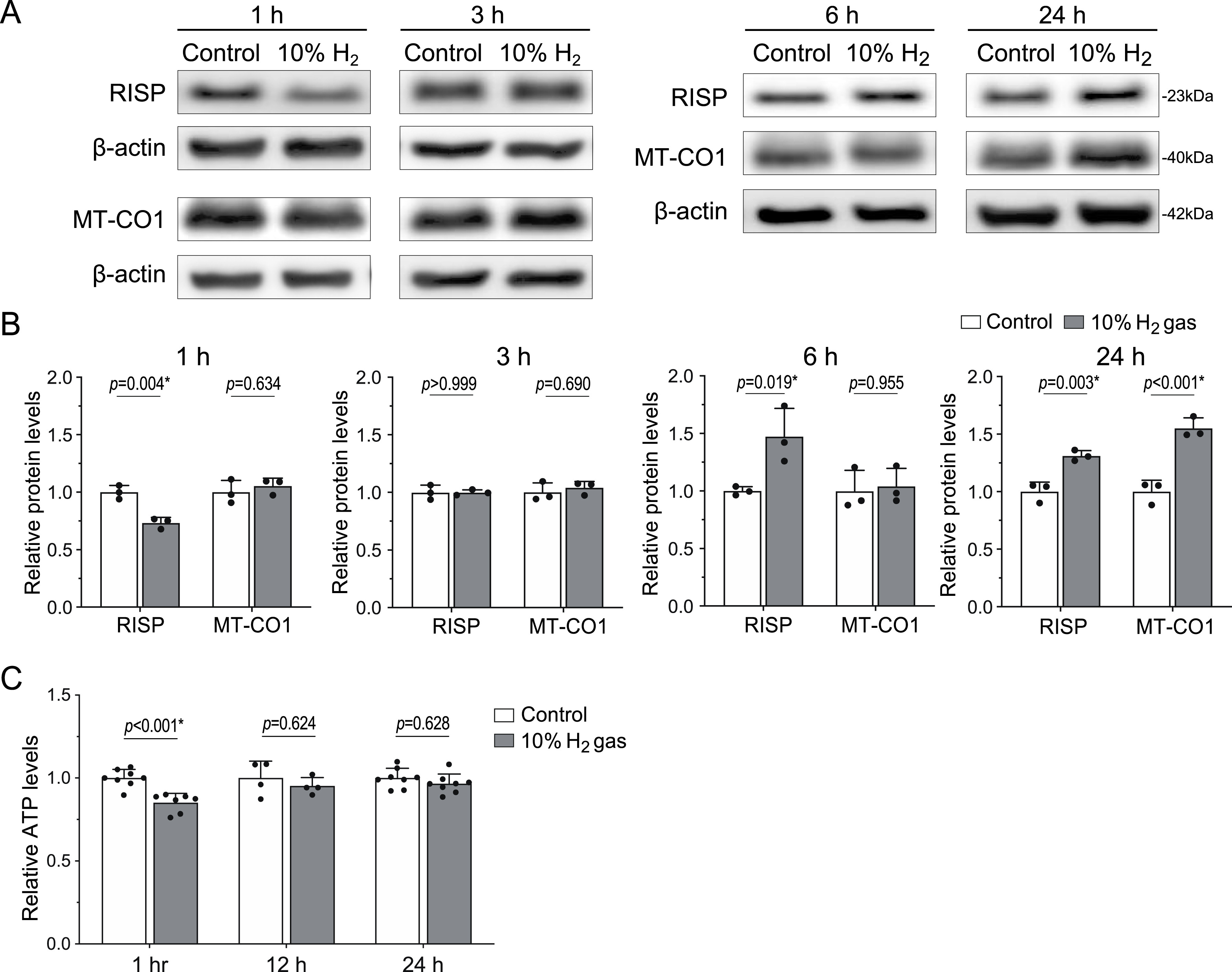
图4 氢气处理AML12细胞1小时后降低RISP水平,处理6小时和24小时后升高RISP水平
(A、B)AML12细胞在10%氢气或对照气体环境中培养1、3、6、24小时后,核DNA编码的RISP与线粒体DNA编码的MT-CO1的蛋白质印迹代表性结果(A)及定量分析(B)。采用双因素方差分析结合Sidak事后检验分析P值(n=3个培养皿),*P<0.05。
(C)AML12细胞在10%氢气或对照气体环境中培养1、12、24小时后的ATP水平。采用双因素重复测量方差分析结合Sidak事后检验分析P值(培养1、12、24小时组分别对应n=7、4、8个培养皿),星号表示具有统计学显著性。
3.6 线粒体Lon蛋白酶1(LONP1)介导氢气诱导的RISP降解
由LONP1基因编码的线粒体Lon蛋白酶1(LONP1)是线粒体中的主要蛋白酶,可选择性降解线粒体中错误折叠、未组装或受损的多肽,且在UPRmt诱导过程中发挥重要作用[18]。我们探究了LONP1是否参与氢气介导的RISP降解,结果显示:敲低LONP1可完全消除氢气在1小时内降低RISP水平的效应(图5A、B)。类似地,使用LONP1抑制剂CDDO-Me处理后,氢气在1小时内降低RISP水平的效应也被抵消(图5C、D)。由此可见,氢气可触发LONP1介导的RISP降解。此外,敲低LONP1还能阻断氢气在12小时内诱导HSP60表达升高的效应(图5E、F),这表明氢气诱导的RISP构象变化是激活LONP1及UPRmt的关键。LONP1激活后会选择性降解错误折叠/未折叠/受损的线粒体蛋白,而RISP被其降解,提示RISP是氢气的主要作用靶点。
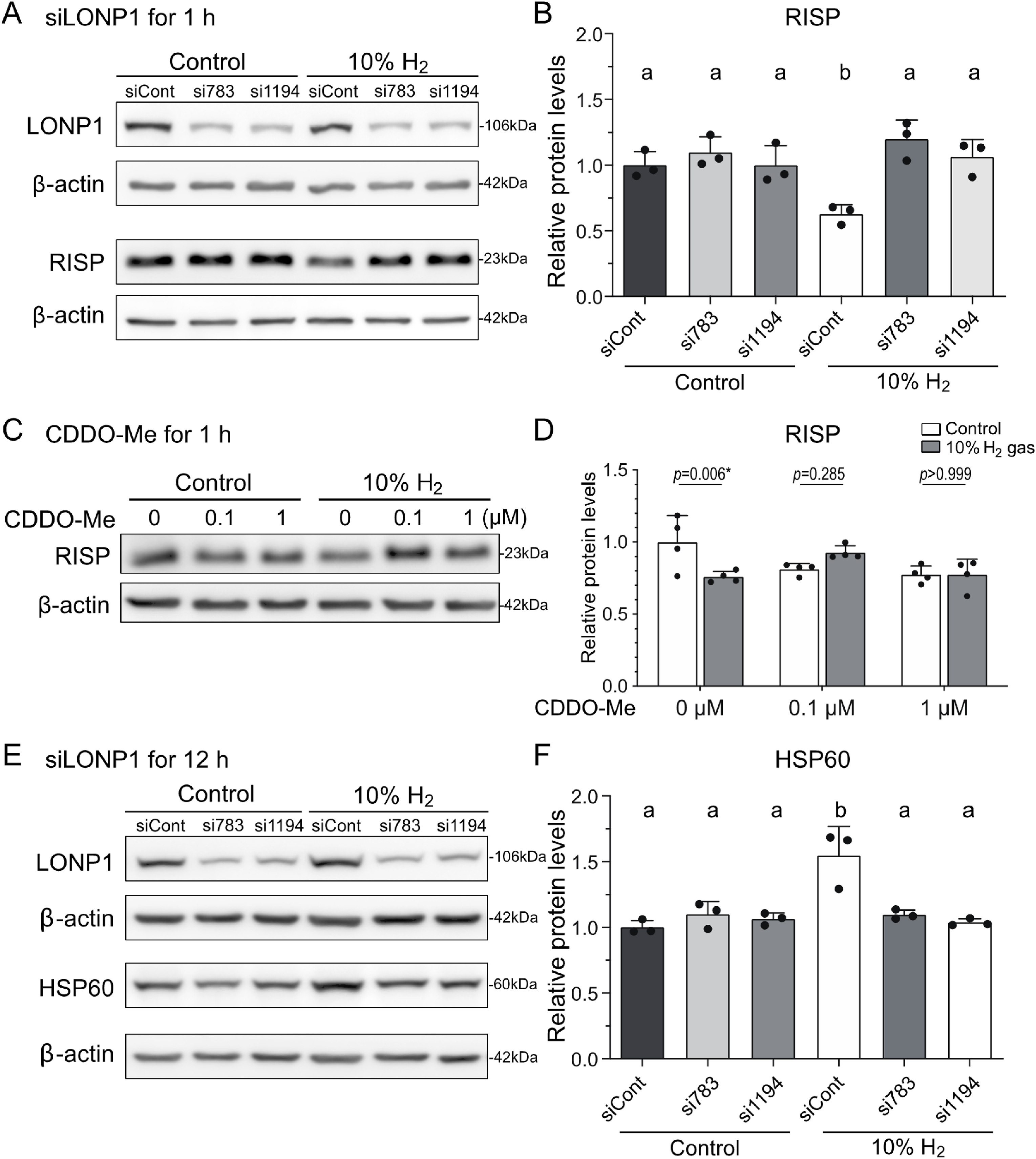
图5 通过基因敲低或特异性抑制剂抑制LONP1,可消除氢气对AML12细胞中RISP的降低效应
(A、C、E)分别采用si783或si1194敲低LONP1(A、B、E、F),或使用CDDO-Me抑制LONP1(C、D),在10%氢气或对照气体环境中培养AML12细胞后,RISP(A、B、C、D)与HSP60(E、F)的蛋白质印迹代表性结果(A、C、E)及定量分析(B、D、F)(B、D、F组分别对应n=3、4、3个培养皿)。
(B、F)采用单因素方差分析结合Tukey事后检验分析,“a”和“b”表示P<0.05。
(D)采用双因素方差分析结合Sidak事后检验分析P值(星号表示具有统计学显著性)。
4 讨论
氢气对ETC复合体Ⅲ的特异性抑制作用,以及进化过程中氢化酶普遍含铁硫簇的特性,促使我们探究氢气对复合体Ⅲ中唯一含铁硫簇的分子——RISP的影响。研究证实,氢气主要靶向RISP,并启动其通过LONP1介导的降解过程。氢气可能会使RISP的构象发生改变,导致LONP1将其识别为错误折叠或变形的蛋白。然而,氢气诱导RISP发生此类构象变化的具体机制仍不明确。值得注意的是,在哺乳动物铁硫蛋白中,RISP的独特之处在于其通过两个组氨酸配位[2Fe-2S]簇,相较于其他铁硫蛋白中仅通过半胱氨酸配位的方式,这种配位方式会提高铁硫簇的氧化还原电位[19]。这种独特结构可能是RISP与氢气发生特异性相互作用的基础,而其他通过半胱氨酸配位的铁硫蛋白则未显示出对氢气的应答[20]。
RISP的水平由两方面共同决定:一是LONP1介导的降解作用,二是后续由UPRmt介导的代偿性诱导合成作用。在氢气存在的情况下,LONP1持续降解RISP,引发短暂的核线粒体蛋白失衡,进而激活UPRmt。这种代偿性反应会上调RISP的合成,使得RISP水平在后续时间点(如处理6小时和24小时后,见图4B)逐渐恢复并最终超过基线水平。我们此前的研究发现,饮用富氢水或间歇性吸入氢气(而非持续性吸入氢气)可改善大鼠帕金森病模型的症状[21]。这一结果可能与间歇性氢气暴露(饮用富氢水或间歇性吸入)可终止RISP的降解过程有关。这提示,间歇性氢气暴露足以优化“应激诱导”与“适应性恢复”之间的平衡,而这种平衡正是应激适应(hormesis)的典型特征。
本研究发现,UPRmt的诱导与线粒体超氧化物生成、膜电位、ATP水平及ETC复合体Ⅲ酶活性的“双相调控”相关,这表明存在一个受到严格调控的应激适应反应。氢气暴露10分钟内,超氧化物水平和膜电位初步降低(图1A、B),这可能反映了复合体Ⅲ电子传递的短暂抑制——分离线粒体实验显示,氢气可使复合体Ⅲ酶活性降至对照组的78.5%(图3A),也印证了这一推断。这种电子传递的阻断与处理1小时后ATP水平降至对照组的85.1%(图4C)相关,提示线粒体活性降低。然而,在随后的数小时内,超氧化物生成量和膜电位显著升高(图1A、B),与此同时,ATP水平在12小时和24小时时恢复至基线(图4C)。这种代偿性反应可能反映了由线粒体应激适应驱动的线粒体功能适应性增强。尽管氢气在AML12细胞中诱导UPRmt的幅度,低于使用化学应激诱导剂或基因工程手段引发核线粒体失衡的研究[11],但需注意的是,后者的实验条件超出了生理可行性和相关性。相比之下,即使是高剂量/高浓度的氢气,也可安全应用于人体且无不良反应[22]。
本研究观察到的线粒体动力学双相变化,解释了以往研究中关于活性氧(ROS)和炎症标志物的看似矛盾的结果。与其他小分子气体信号分子(NO•、CO、H₂S)[23]类似,已有研究显示氢气可双向调控多种分子、通路及指标,包括丙二醛[24]、活性氧衍生物[25]、超氧化物水平[26]、8-羟基脱氧鸟苷[27]、Nrf2[28]、NF-κB[28,29]、热休克蛋白[30]、ATP水平[6,26]、线粒体膜电位[31]、ETC复合体活性[32]及线粒体自噬[33],同时在应激条件下发挥促进细胞存活的治疗效应。早期机制研究认为,氢气并非作为生物活性分子发挥作用,而仅通过其与羟基自由基反应的化学特性起效[6,9]。因此,这些研究无法解释氢气在氧化还原及炎症通路中表现出的时间动态性和看似矛盾的效应。与之相反,本研究结果表明,氢气是一种生物活性物质,可通过选择性调控复合体Ⅲ、改变电子传递过程,触发线粒体信号通路及适应性应激通路(如UPRmt),从而介导双相反应。
线粒体起源于古老的氢化酶类微生物——在氧气成为地球大气主要成分之前,这类微生物依赖氢气维持能量系统和氧化还原调控[34]。本研究证实,氢气(一种对早期生命形式至关重要的气体)可特异性靶向线粒体ETC复合体Ⅲ中的RISP。这种应激适应性相互作用将线粒体与氢气这两种原始元素联系起来,并将氢气的定位从“生物惰性分子”重新定义为“生物活性信号分子”。随着关于氢气的临床研究日益增多,阐明其确切作用机制可为临床试验方案的设计与解读提供关键依据,从而充分发挥其治疗潜力。
本研究存在以下局限性:尽管我们证实氢气可诱导LONP1介导的RISP降解,但尚未探究氢气诱导RISP发生的具体构象变化,也未明确LONP1如何将经氢气处理的RISP识别为降解靶点。
5 结论
本研究证实,氢气主要靶向线粒体ETC复合体Ⅲ中的RISP。这种靶向作用会引发一系列效应:(1)LONP1介导的RISP降解;(2)线粒体ETC活性初步受抑;(3)随后通过核线粒体蛋白失衡及活性氧增加诱导UPRmt,进而激活线粒体ETC活性。这一已阐明的机制可合理解释氢气在氧化还原及炎症标志物调控中表现出的时间差异性和看似矛盾的效应。随着关于氢气的临床研究不断积累,明确其确切作用机制可为未来临床研究的设计与解读提供关键指导,助力评估氢气的治疗效果并优化其治疗潜力。
https://blog.sciencenet.cn/blog-41174-1512383.html
上一篇:首个慢性疲劳综合征血液检测方法问世
下一篇:英国驻华外交官提醒世界正确面对中国的科学领导《自然》