博文
氢气和硫化氢等还原性气体增强癌症光热治疗的最新进展【综述】
||
还原性气体增强癌症光热治疗的最新进展
研究亮点
- 系统综述纳米医学中还原性气体的释放机制。
- 用于还原性气体增强高温光热治疗(PTT)的创新纳米平台。
- 用于还原性气体增敏低温光热治疗的前沿策略。
- 深入剖析光热治疗/气体治疗(PTT/GT)当前面临的挑战与未来展望。
Zhang, Li, Jun Liu, and Yonggang Lv. "Recent advances in reductive gas-augmented cancer photothermal therapy." Chemical Engineering Journal (2025): 170871.
摘要
温度依赖性光热治疗(photothermal therapy, PTT)是一种极具潜力的非侵入性癌症治疗策略。然而,其疗效受限于一个关键矛盾:高温光热治疗虽作用强效,但常引发有害炎症反应,可能导致组织损伤并促进肿瘤复发;相反,低温光热治疗虽能最大程度减少附带损伤,却常因热休克蛋白(heat shock proteins, HSPs)诱导的耐热性而效果受损。还原性气体治疗(gas therapy, GT)以一氧化碳(CO)、硫化氢(H₂S)、氢气(H₂)等分子为作用介质,为克服上述局限提供了新方向。本综述提出,还原性气体与光热治疗的协同作用本质上源于线粒体调控的双重机制:
主要机制为气体诱导的线粒体功能障碍——该过程会破坏氧化磷酸化,耗竭细胞内三磷酸腺苷(adenosine triphosphate, ATP)。由于热休克蛋白的分子伴侣功能高度依赖ATP,这种能量危机将直接破坏细胞的耐热机制,从而使癌细胞对低温光热治疗敏感。
次要协同机制则利用这类气体强大的抗炎与抗氧化特性:通过清除活性氧(reactive oxygen species, ROS)和活性氮(reactive nitrogen species, RNS),并调控核因子κB(nuclear factor kappa B, NF-κB)等促炎通路,有效减轻高温光热治疗相关的有害炎症与氧化应激,降低副作用并提升治疗安全性。
此外,将光热治疗/气体治疗与其他治疗方式整合为多模态策略,可进一步提升治疗效果。本综述全面总结了还原性气体增强癌症光热治疗的最新进展:首先概述刺激响应性气体发生系统,随后分别探讨其在“抗炎增强型高温光热治疗”与“热休克蛋白下调促进型低温光热治疗”中的应用,最后分析潜在挑战与未来方向,为光热/气体协同纳米药物的持续研发提供有价值的参考。
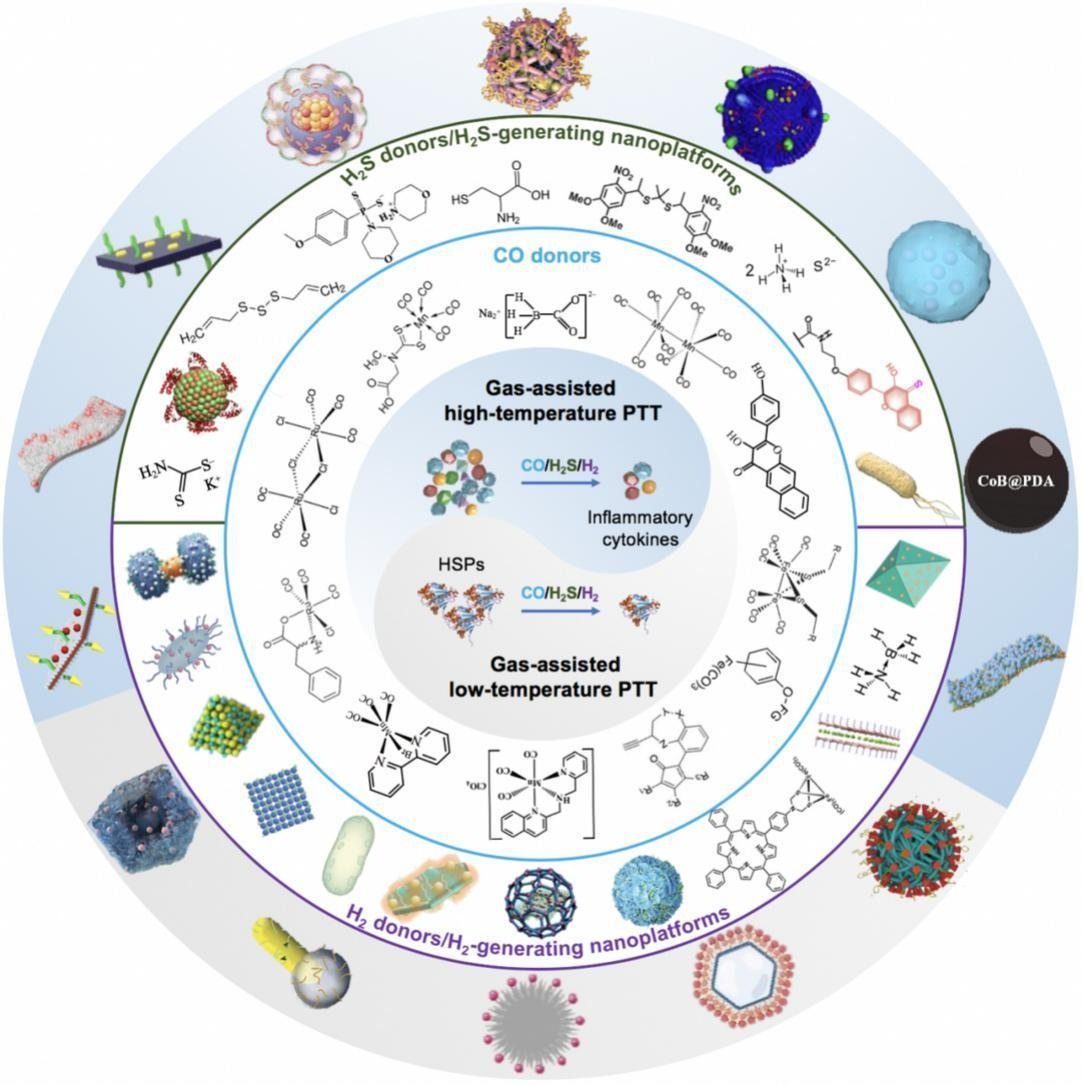
图文摘要
本综述全面探讨还原性气体辅助癌症光热治疗的最新进展:首先介绍具有代表性的CO、H₂S、H₂气体供体及气体发生纳米平台,随后深入分析针对高温与低温光热治疗设计的“光热/还原性气体”纳米药物。
引言
癌症因进展迅速、致死率与发病率高,已成为重大健康威胁[1,2]。手术、化疗、放疗等传统临床治疗手段虽长期用于各类癌症治疗,但受限于侵入性强、副作用严重、易产生耐药性等问题[3,4],这些缺陷常导致治疗效果不佳,甚至可能引发致命后果。
过去十年,光热治疗因具有微创、精准、疗效可观、副作用低等优势,在临床前研究中备受关注[5,6]。光热治疗由700-1350 nm的近红外(near-infrared, NIR)光触发,通过多种光热剂(photothermal agents, PTAs)发挥作用,包括无机纳米材料(如贵金属、金属硫化物、碳材料)与有机纳米材料(如有机小分子、聚合物)[7-13]。这些光热剂在特定部位产生局部热量,从而有效破坏肿瘤。
通常,肿瘤完全消融需温度超过50℃,这往往需要高浓度光热剂或强激光照射,而此类条件可能超出美国国家标准协会(American National Standards Institute)规定的人体皮肤安全暴露限值(1064 nm、980 nm、808 nm激光的安全限值分别为1、0.72、0.33 W·cm⁻²)[14]。此外,过量热量会诱导细胞严重坏死并触发炎症反应,对周围健康细胞与组织构成威胁[15]。尽管木犀草素、麦角异胺等抗炎药物可显著降低光热治疗过程中的炎症因子水平,但光热治疗与抗炎药物联用常需多次给药,导致治疗周期延长,且可能增加治疗方案的复杂性[16,17]。
为减少对正常细胞的损伤,一种潜在策略是在较温和温度下消融肿瘤,即“低温光热治疗”或“温和温度光热治疗”[18]。然而,低温条件下肿瘤的有效破坏受限于热休克蛋白的高表达——激光照射后,热休克蛋白可快速修复蛋白质损伤,帮助肿瘤细胞产生耐热性[19,20]。因此,抑制HSP90、HSP70、HSP60等热休克蛋白的表达,是降低癌细胞耐热性、提升低温光热治疗效果的直接有效手段[21-23]。目前,研究人员通过共价键、静电力、π-π相互作用、氢键、疏水作用等机制,将热休克蛋白小分子抑制剂或小干扰RNA(small-interfering RNA, siRNA)与多种光热剂结合[24,25]。但多数小分子抑制剂存在水溶性低、细胞毒性高的问题,且siRNA的递送效率低、稳定性差,这些均限制了其在光热治疗中的应用[26,27]。因此,开发安全有效的新型热休克蛋白抑制剂以提升光热治疗效果,成为当前研究的迫切需求。
气体治疗因具有“环境友好”特性,可利用内源性气体生物信使在高浓度下靶向杀伤肿瘤细胞,已成为肿瘤学领域的研究热点[28,29]。当CO、H₂S等气体分子在局部达到高浓度(通常>1 μM)时,会与细胞色素c氧化酶竞争性结合,阻碍氧气结合[30-32]。这种干扰会破坏线粒体电子传递,导致持续性线粒体功能障碍;而线粒体功能障碍会进一步破坏电子传递链与氧化磷酸化(二者均为细胞主要能量来源ATP的合成关键过程)。ATP水平降低会导致细胞能量匮乏,损害细胞维持蛋白质稳态与应对应激的能力,最终抑制依赖ATP合成与活性的热休克蛋白功能[33]。研究表明,氢气(H₂)浓度升高可促进P53蛋白表达,破坏线粒体膜电位,进而减少ATP生成并下调热休克蛋白表达[34]。
值得注意的是,这类气体还可减轻传统光热治疗的不良反应:CO、H₂S、H₂均具有显著的抗氧化能力,能中和光热治疗副产物活性氧与活性氮[35,36]。具体而言:CO是强效抗氧化剂,可通过与过氧亚硝酸盐(ONOO⁻)、活性氧等活性物质相互作用,减轻氧化应激,从而防止细胞损伤与炎症[37,38];H₂S可与羟基自由基(•OH)、超氧阴离子自由基(O₂•⁻)等活性氧反应,在其造成氧化损伤前将其清除[39,40];H₂则因能选择性还原•OH与ONOO⁻,可有效预防细胞与组织的氧化损伤(氧化损伤是光热治疗中炎症反应的关键诱因)[41,42]。
更重要的是,CO、H₂S、H₂可在分子水平调控炎症通路:炎症反应的启动通常由NF-κB激活及其他多种促炎通路共同驱动[43,44],而这些气体可通过调控氧化应激与炎症反应,防止细胞过度死亡并促进可控的免疫应答[33,45,46]。此外,CO与H₂S还能促进血管舒张,增加治疗部位的血流量;改善的血液循环有助于清除炎症介质、促进组织修复,从而缩短炎症持续时间并减轻炎症程度[28,47-49]。
综上,还原性气体与光热治疗的协同作用本质上源于以“线粒体调控”为核心的双重机制,可针对性解决光热治疗的两大局限:主要机制通过靶向细胞能量稳态,使肿瘤对低温光热治疗敏感;次要机制则通过强效抗炎与抗氧化作用,在高温光热治疗中保护健康组织。
然而,将光热剂与还原性气体分子同步递送至靶部位仍面临重大挑战。纳米技术的发展为这一问题提供了新思路——通过设计整合光热剂与气体释放组件的纳米药物,为气体增强光热治疗开辟了新可能[50]。肿瘤部位的气体浓度达到最优水平是气体辅助治疗起效的关键,近年来研究人员已开发出多种可在肿瘤部位选择性释放气体的纳米药物[29,51]。其中应用最广泛的策略之一,是将刺激响应性气体供体及前体物质(即释放CO、H₂S、H₂的化合物)用于气体治疗:这些化合物被高效包载于纳米载体中,递送至肿瘤区域后,在特定刺激下激活并释放治疗性气体[31,52]。
利用多种成像技术实现精准诊断评估与有效治疗监测,对于肿瘤实时定位、追踪治疗剂分布与蓄积情况、评估治疗进展至关重要[53,54]。在这些技术中,光声成像(photoacoustic, PA)是一种前沿方法,它融合了光学成像与超声(ultrasound, US)成像的优势,实现了二者独特性能的协同[55,56]。当光热剂暴露于特定波长激光时,会发生光热效应并导致热膨胀,进而产生声波;这些声波被声换能器捕获并分析后,可重建目标组织的高分辨率光声图像[57,58]。在此背景下,光热治疗中使用的光热剂具有“双重作用”——既作为治疗剂,又作为内源性光声成像造影剂,成为高效的多功能诊疗一体化纳米平台。
除具备无创、高分辨率、组织穿透性强等优势外,纳米医学的发展还显著拓展了光热剂的诊断潜力:光热剂可与磁共振成像(MR)、计算机断层扫描(CT)、荧光成像等互补成像技术结合,进一步提升其在临床诊断中的应用价值[59-61]。
现有综述已广泛覆盖气体释放纳米平台及其在“气体介导癌症纳米诊疗”中的应用[28-30,32,33,62-81]。本研究则详细概述“还原性气体增强光热纳米药物”的最新进展(据我们所知,该领域尚未得到系统阐述,见图1):首先探讨各类CO、H₂S、H₂发生系统,重点关注内源性与外源性刺激响应性系统;尽管还原性气体的抗炎特性已得到数十年认可,但其在低温光热治疗增敏中的应用仍属新兴策略。
本综述系统分析了“多种光热剂”与“内源性/外源性刺激响应性气体供体”的整合方式,聚焦两大核心机制——“抗炎作用增强高温光热治疗”与“热休克蛋白下调促进低温光热治疗”。为进一步提升治疗效果,研究人员开发了多模态治疗策略,将化疗、光动力治疗(PDT)、化学动力学治疗(CDT)、免疫治疗等多种方法整合。最后,本综述总结了这些前沿治疗范式面临的挑战与未来展望。
https://blog.sciencenet.cn/blog-41174-1511488.html
上一篇:首个慢性疲劳综合征血液检测方法问世
下一篇:复眼的结构形成机制:果蝇发育中的钙波调控作用