博文
氢气和植物促生菌联合治理土壤盐渍化
||
土壤盐渍化严重制约农业生产与土壤可持续利用。尽管已有研究表明植物促生菌(PGPR)和富氢水(HRW)单独使用时均能提高植物的耐盐性,但二者的协同作用及其分子机制仍有待深入探索。本研究以巨菌草为对象,探究了盐胁迫条件下耐盐PGPR菌株——坚强胞杆菌L71(Cytobacillus firmus L71)与富氢水(HRW)联合施用的效果。研究采用析因盆栽试验设计,设置3个盐浓度水平(0、250和500 mmol/L NaCl),并分别设置PGPR-HRW处理组与非处理组,测定了巨菌草的生长指标、抗氧化活性、渗透调节物质含量及转录组响应。

结果显示,在重度盐胁迫下,PGPR-HRW联合处理能显著促进巨菌草生长:与未处理对照组相比,地上部鲜重增加148%,根长增加54.60%。生理指标测定表明,联合处理显著提高了超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)的活性,同时降低了丙二醛(MDA)和过氧化氢(H₂O₂)的积累量。转录组分析发现,联合处理后植物体内富集的差异基因主要集中在植物激素信号通路、丝裂原活化蛋白激酶(MAPK)信号通路及植物-病原菌互作通路中。其中,负调控因子(如诱导气孔关闭的CaM/CML、触发过敏反应的CDPK、抑制DNA防御基因的WRKY25/33、加速胁迫诱导衰老的JAZ)表达下调,而正调控因子(如促进细胞分裂和地上部生长的A-ARR)表达上调,这些变化共同维持了气孔功能稳定、延缓了植株衰老,并改善了活性氧(ROS)平衡。
综上,本研究证实PGPR与HRW可通过协同调控生理代谢与基因转录过程,增强植物耐盐性。该结果为将微生物接种剂与富氢水结合应用于盐渍土可持续修复及作物改良提供了理论依据与实践潜力。
Chu S, Xu T, Feng Y, Ma X, Shu R, Wang R, Wang Y, Jin D, Chi Y, Zhou P, Zhang D. Synergistic alleviation effects of salt-tolerant plant growth-promoting rhizobacteria and hydrogen-rich water on salt stress in Pennisetum giganteum. Front Plant Sci. 2025 Oct 29;16:1702577.
论文作者主要来自上海交通大学
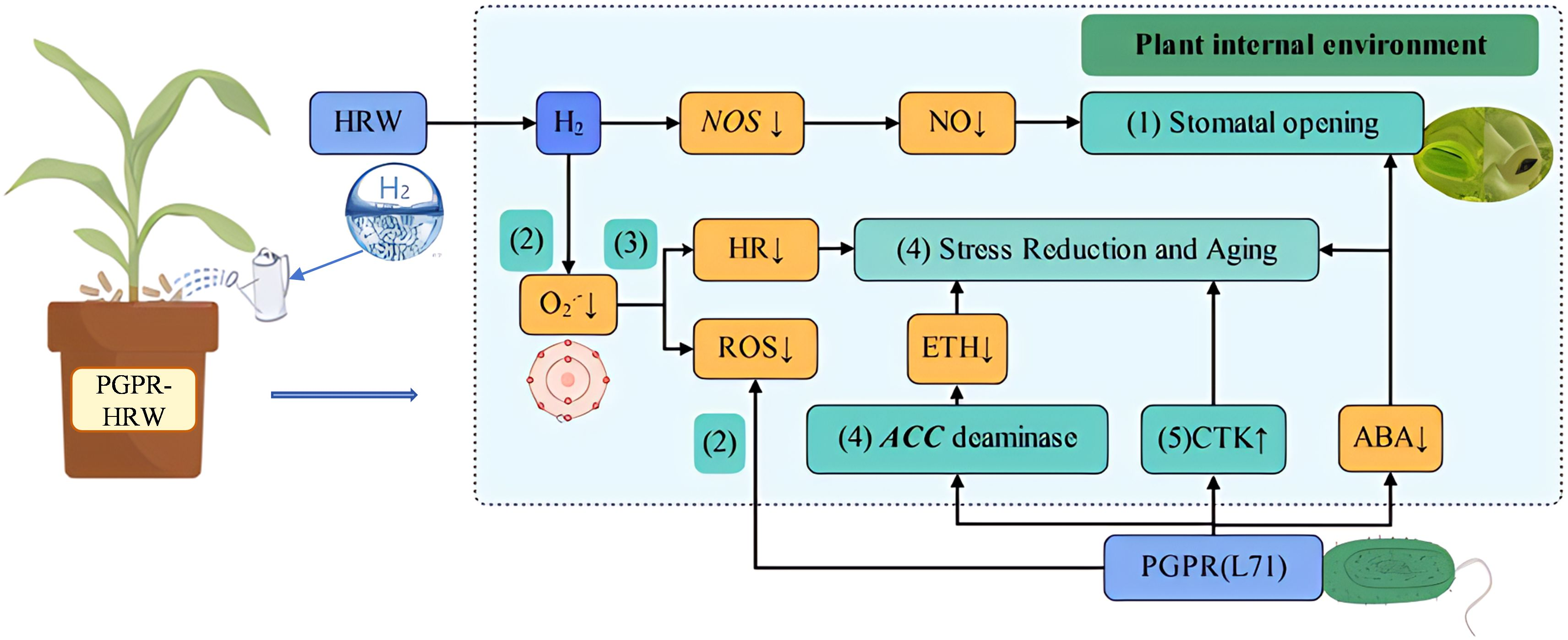
图文摘要:植物促生菌-富氢水(PGPR-HRW)联合处理诱导巨菌草耐盐性的生理与分子机制
(1)维持气孔正常开放;(2)维持活性氧(ROS)平衡;(3)延缓过敏反应(HR);(4)减少乙烯(ETH)合成并延缓衰老;(5)促进细胞分裂素(CTK)合成。
引言(Introduction)
在各类非生物胁迫中,土壤盐渍化严重制约作物产量与全球可持续发展(Mukhopadhyay等,2021;Litalien和Zeeb,2020)。根据联合国粮食及农业组织(FAO)数据,基于73%的测绘土地统计,受盐渍化影响的表层土壤(0-30 cm)面积达4.24亿公顷,亚表层土壤(30-100 cm)达8.33亿公顷(Negacz等,2022)。在中国,近9700万公顷盐渍土主要分布于华北平原、黄河河套平原及西北内陆地区(Bian等,2021),且盐渍土面积正以每年10%的速率扩张(Sharif等,2019)。土壤盐渍化通过引发渗透失衡阻碍植物对水分和养分的吸收,进而抑制植物生长(Santander等,2020);此外,盐胁迫还会诱导植物离子失衡与氧化胁迫,引发次生胁迫反应,严重时可导致植株死亡(Li等,2017;Balasubramaniam等,2023)。
利用盐生或耐盐植物进行盐渍土植物修复,具有成本低、可持续性强及生态友好等优势,是实现盐渍土高效利用的有效手段(Srivastava,2020)。巨菌草(Pennisetum giganteum Z.X. Lin)为禾本科多年生C4草本植物,具有生长速度快、根系发达及分蘖能力强等特点(Hayat等,2022),近年来已逐步应用于重金属污染土壤修复及盐渍土改良。前期研究表明,巨菌草具有较好的耐盐性,可耐受轻度至中度盐胁迫且生物量不受显著影响(Hayat等,2020)。
为提升植物修复效率,多种修复技术被应用于盐渍土改良,植物促生菌(PGPR)便是其中之一。PGPR是一类土壤细菌,可通过产生1-氨基环丙烷-1-羧酸(ACC)脱氨酶分解乙烯前体,从而减轻乙烯对植物的不利影响(Gupta等,2022);此外,PGPR还能促进磷溶解、产生胞外多糖、产铁载体及挥发性化合物(Kumawat等,2022;Ha-Tran等,2021),并合成生长素(IAA)、细胞分裂素(CTK)、赤霉素(GA)等多种植物激素(Saleem等,2021;Li等,2020)。在盐胁迫下,PGPR可通过提高钾钠离子比、减少细胞内电解质渗漏、促进养分与水分吸收等多种途径,维持植物正常生长(Bhat等,2020)。
另一方面,氢气(H₂)作为一种新型气体信号分子,在增强植物耐盐性方面展现出良好应用前景。当氢气以富氢水(HRW)形式供给植物时,可作为有益气体分子参与植物的逆境适应反应。HRW通过提高抗氧化系统活性与渗透调节能力,增强植物抗逆性(Hu等,2021)。氢气促进植物抗逆性的分子机制涉及microRNA(miRNA)调控、基因表达调控、激素水平调节及蛋白质修饰,且可能与一氧化氮(NO)、一氧化碳(CO)等多种气体信号通路相关(Wang等,2022;Chen等,2017)。现有研究表明,HRW在缓解植物干旱、盐渍、重金属及极端温度等非生物胁迫中均表现出良好效果(Wang等,2023);在盐胁迫下,HRW可通过重建活性氧稳态与离子稳态,增强植物耐盐性(Su等,2021)。然而,以往研究多聚焦于单一修复手段,PGPR与HRW联合修复的效果及分子机制仍不明确。
本研究以巨菌草为材料,采用盐胁迫与耐盐PGPR-HRW联合处理的析因试验设计,旨在:(1)量化不同NaCl浓度下PGPR-HRW处理对巨菌草幼苗生长及生物量的影响;(2)明确PGPR-HRW处理下巨菌草渗透调节、氧化状态及抗氧化酶活性的变化;(3)探究PGPR-HRW处理缓解巨菌草盐胁迫的分子机制。研究结果可为PGPR-HRW缓解植物盐胁迫提供生理与分子层面的理论依据,并为其在盐渍土修复中的应用提供指导。
材料与方法(Materials and methods)
2.1 植物材料、生长条件及胁迫处理
前期研究从滨海盐碱土中分离得到一株耐盐促生菌——坚强胞杆菌L71(Cytobacillus firmus L71),其16S rDNA基因序列在GenBank的登录号为OP935756,在中国普通微生物菌种保藏管理中心(CGMCC)的保藏号为26877。通过不同盐胁迫下巨菌草盆栽试验,设置不同浓度HRW与L71菌株处理,发现L71菌株与50% HRW联合处理对巨菌草的促生效果最佳(补充图S1-S3)。主成分分析(PCA)结果显示,50% HRW-L71联合处理可有效缓解250 mmol/L和500 mmol/L盐胁迫对巨菌草的影响,且在两种盐胁迫下均获得相同浓度处理中的最高综合得分(补充图S4)。因此,选择50% HRW-L71联合处理作为后续PGPR-HRW处理组合开展进一步试验。
采用双因素盆栽试验研究PGPR-HRW的作用效果,设置3个NaCl胁迫水平:0 mmol/L(A0)、250 mmol/L(A1)、500 mmol/L(A2);每个盐胁迫水平下设置两个处理:无PGPR-HRW处理(B0)、有PGPR-HRW处理(B1),共形成6个处理组(A0B0、A0B1、A1B0、A1B1、A2B0、A2B1),每组10次重复。试验于上海交通大学(北纬31°11′,东经121°36′)开展。巨菌草种植14天后,进行NaCl胁迫处理与PGPR-HRW处理:盐胁迫处理每20天进行一次,每盆浇灌100 mL;将L71菌株溶解于富氢水中制备成液体菌剂,同样每盆浇灌100 mL。液体菌剂的具体制备方法为:将发酵菌液在4℃、12000 rpm条件下离心10分钟,弃去上清液后,将细菌沉淀均匀溶解于富氢水中,制备成浓度为10⁸ CFU/mL的菌剂。50% HRW(氢气浓度0.8 ppm)采用CA/H-1型氢气发生器制备;对照组浇灌等量清水。处理40天后,收获巨菌草并测定相关指标。
2.2 植物形态与生理指标测定
处理40天后,测定巨菌草的株高、根长、地上部与根部鲜重及干重等表型指标(Hayat等,2020);采用南京建成生物工程研究所提供的试剂盒,测定超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性,以及过氧化氢(H₂O₂)、丙二醛(MDA)、脯氨酸(Pro)、可溶性糖(SS)含量。
2.3 转录组分析
采集不同处理40天后的巨菌草叶片,用超纯水冲洗3次后立即置于液氮中冷冻保存。采用TRIzol®试剂提取叶片总RNA,RNA提取的具体方法与质量要求详见补充文本S1。RNA纯化、反转录、文库构建及测序由上海美吉生物医药科技有限公司(中国上海)按照试剂盒说明书完成,具体方法、流程及测序平台详见补充文本S2。选取4个处理组合(A0B0、A0B1、A2B0、A2B1)进行转录组测序(RNA-seq),每个处理3次生物学重复(共12个样本)。测序共获得88.64 Gb清洁读数(每个样本≥5.98 Gb;Q30≥95.92%,补充表S1)。采用Trinity软件对所有样本的清洁读数进行从头组装,得到108308个单基因(unigene)和210290个转录本(transcript),平均长度为955.7 bp,N50为1689 bp。读数回比到组装结果的比例为85.01%-86.03%(补充表S2),质量控制与从头组装的详细流程详见补充文本S3。差异表达分析与京都基因与基因组百科全书(KEGG)功能富集分析的方法及参数设置详见补充文本S4,采用DESeq2软件通过“中位数比率法”对读数计数进行标准化,差异表达基因(DEG)的筛选标准为|log₂倍变化(FC)|≥1且错误发现率(FDR)<0.05。
2.4 实时荧光定量PCR(qRT-PCR)验证
从转录组测序获得的差异表达基因中随机选取12个候选基因,通过qRT-PCR验证其差异表达情况。候选基因的ID、NR注释信息及所用引物对详见补充表S3。简要流程如下:采用RNAprep Pure植物总RNA提取试剂盒(天根生化,DP432)提取总RNA;使用MMLV反转录酶(宝生物,RR047A)将总RNA反转录为cDNA,作为qRT-PCR模板;采用TB Green® Premix Ex Taq™ II试剂盒(宝生物,RR820A),在ABI 7500实时荧光定量PCR仪(Applied Biosystems,美国福斯特城)上进行qRT-PCR反应(Gutsch等,2019)。以甘油醛-3-磷酸脱氢酶基因(GAPDH)作为内参基因,采用2⁻ΔΔCt法计算基因相对表达量(Zhao等,2021)。每个基因与样本设置3次生物学重复和3次技术重复。
2.5 统计分析
每个处理的RNA-seq试验设置3次重复;采用Origin 2024软件绘制柱状图,使用R 4.3.2软件绘制基因表达热图;采用SPSS 27软件进行方差分析(ANOVA),并通过Duncan多重比较法(p<0.05)进行两两比较;形态与生理指标测定设置4次重复;采用SAS软件(SAS Institute,美国卡里)进行双因素方差分析,明确NaCl胁迫与PGPR-HRW处理对各测定指标的影响。
结果(Results)
3.1 PGPR-HRW联合处理促进高盐胁迫下巨菌草生长
图1显示了40天不同盐胁迫处理下巨菌草的生长状况。盐胁迫与PGPR-HRW联合处理对巨菌草地上部鲜重、根长及根部鲜重均有显著影响(p<0.05)。随着盐胁迫程度加剧,巨菌草分蘖数逐渐减少,叶片变黄;在A2(500 mmol/L NaCl)处理下,B1组(PGPR-HRW处理)的叶片黄化程度显著轻于B0组(无PGPR-HRW处理)。
不同盐胁迫下PGPR-HRW联合处理对巨菌草生长的影响对比显示:无盐胁迫(A0)时,B1组与B0组的生长差异极小;250 mmol/L NaCl(A1)胁迫下,B1组的根部鲜重显著高于B0组,增幅达92.94%(图1e);500 mmol/L NaCl(A2)胁迫下,B1组的生长优势更为明显——A2B1组的株高、根长、地上部鲜重分别较A2B0组显著增加17.13%、54.60%、148%,地上部干重增幅达81.25%(图1a、b、d)。此外,A1B0组(250 mmol/L NaCl,无PGPR-HRW处理)与A0B0组(无盐胁迫,无PGPR-HRW处理)的株高和根长无显著差异(图1a、d),表明巨菌草本身具有一定的耐盐性;而PGPR-HRW联合处理在高盐胁迫下展现出更优的促生效果。
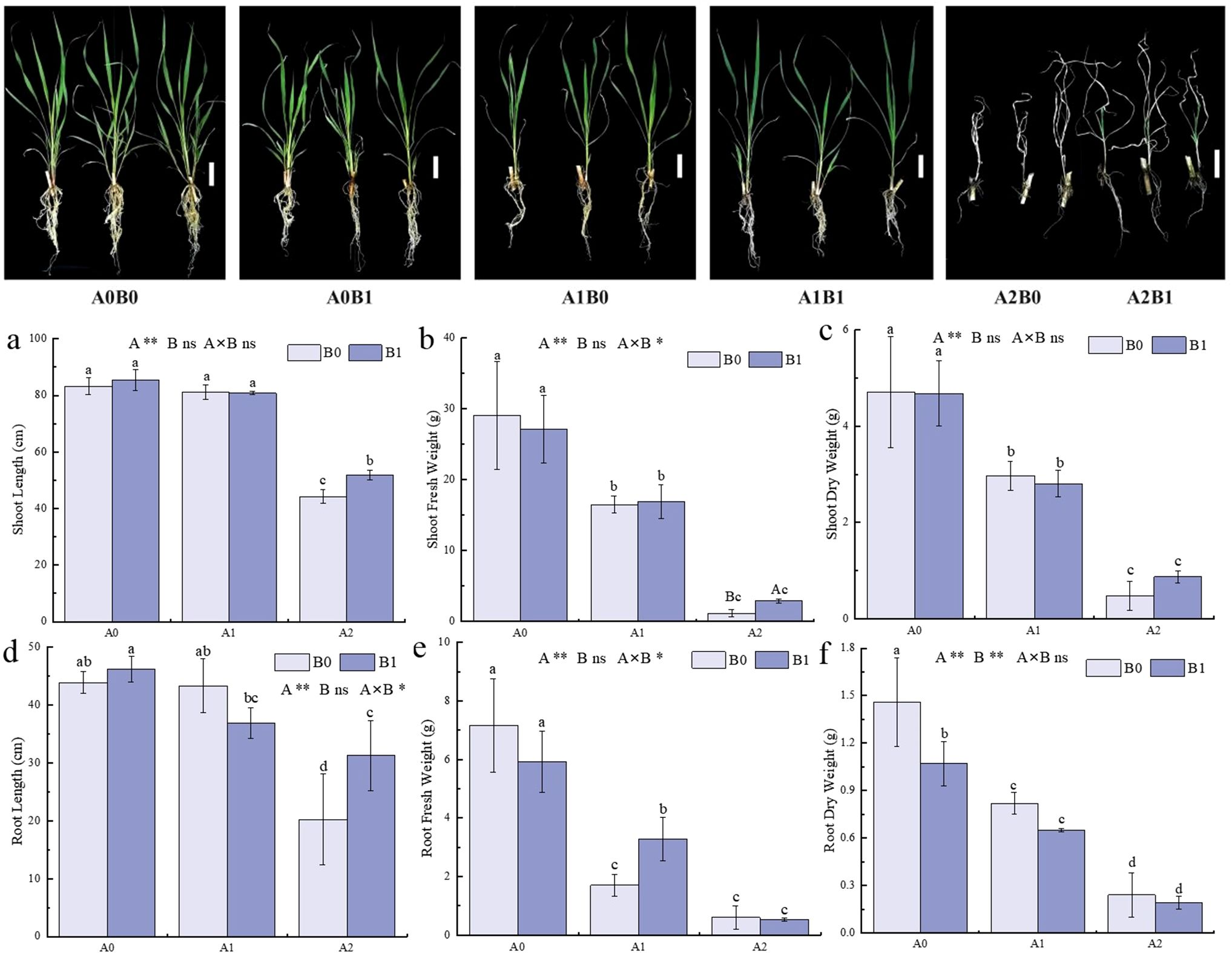
图1 各处理组间巨菌草的表型及生长特性
A0:0 mmol/L NaCl(无盐胁迫),A1:250 mmol/L NaCl(中度盐胁迫),A2:500 mmol/L NaCl(重度盐胁迫);B0:无PGPR-HRW处理,B1:PGPR-HRW处理。比例尺=10 cm。
(a-c)地上部株高(a)、鲜重(b)及干重(c);
(d-f)根长(d)、根部鲜重(e)及根部干重(f)。
不同小写字母表示各处理组间差异显著(p<0.05);不同大写字母表示相同盐浓度下两组(B0与B1)间差异显著(p<0.05)。
双因素方差分析(two-way ANOVA)结果标注如下:A为NaCl胁迫效应,B为PGPR-HRW处理效应,A×B为二者交互效应;*p<0.05(显著差异),**p<0.01(极显著差异),ns表示无显著差异。
3.2 PGPR-HRW联合处理增强盐胁迫下巨菌草的生理活性
盐胁迫会破坏植物体内活性氧(ROS)清除平衡,引发氧化胁迫(Yan等,2016)。为此,本研究测定了盐胁迫下巨菌草的生理指标,结果如下:
- 无盐胁迫(A0)条件下,B1处理(PGPR-HRW处理)显著提高了巨菌草的过氧化物酶(POD)和过氧化氢酶(CAT)活性,并降低了丙二醛(MDA)含量(图2b、c、e);
- 当盐胁迫浓度升至250 mmol/L(A1)时,B1处理的超氧化物歧化酶(SOD)活性较B0处理(无PGPR-HRW处理)显著提高26.63%,可溶性糖(SS)含量提高57.36%(图2a、f);
- 当盐胁迫浓度进一步升至500 mmol/L(A2)时,B1处理的POD和CAT活性分别较B0处理提高5.99%和13.48%(图2b、c),可溶性糖(SS)和脯氨酸(Pro)含量分别显著提高63.21%和114%(图2f、g),而MDA含量显著降低63.89%,过氧化氢(H₂O₂)含量降低48.78%(图2d、e)。
上述结果表明,随着盐胁迫程度加剧,PGPR-HRW联合处理可通过提高巨菌草的抗氧化酶活性、维持渗透调节平衡,减少MDA和H₂O₂等过氧化产物的积累。双因素方差分析显示,盐胁迫与PGPR-HRW联合处理对CAT活性和脯氨酸含量的影响均达到极显著水平(p<0.01)。
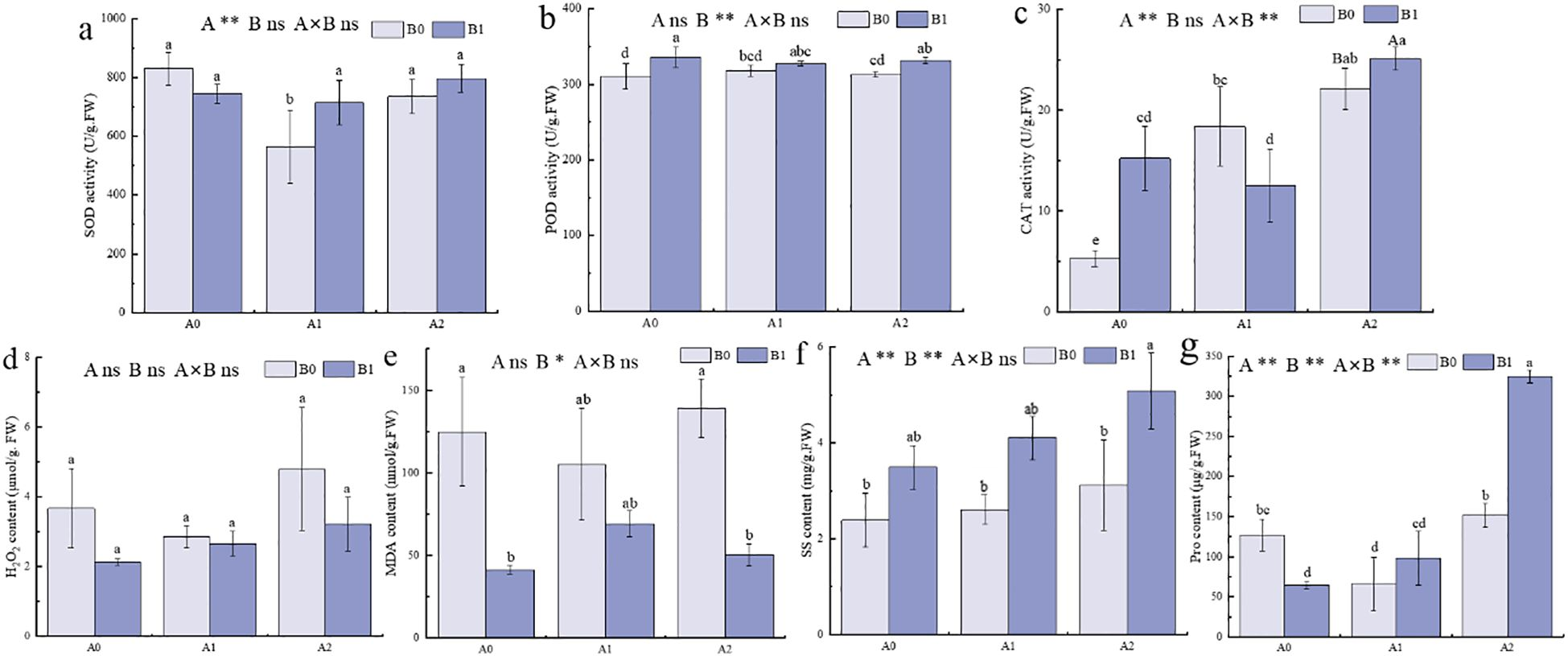
图2 各处理组间巨菌草的生理特性
A0:0 mmol/L NaCl,A1:250 mmol/L NaCl,A2:500 mmol/L NaCl;B0:无PGPR-HRW处理,B1:PGPR-HRW处理。
(a-c)超氧化物歧化酶(SOD)(a)、过氧化物酶(POD)(b)、过氧化氢酶(CAT)(c)活性;
(d-g)过氧化氢(H₂O₂)(d)、丙二醛(MDA)(e)、可溶性糖(SS)(f)、脯氨酸(Pro)(g)含量。
不同小写字母表示各处理组间差异显著(p<0.05);不同大写字母表示相同盐浓度下两组(B0与B1)间差异显著(p<0.05)。
双因素方差分析结果标注如下:A为NaCl胁迫效应,B为PGPR-HRW处理效应,A×B为二者交互效应;*p<0.05,**p<0.01,ns表示无显著差异。
3.3 差异表达基因(DEG)全局分析
生物学重复样本间的 pairwise 相关性较高(R²介于0.8-1之间),表明试验数据可靠性良好(图3a)。主成分分析(PCA)结果显示,不同处理组的基因表达聚类模式存在显著差异(图3b)。
本研究分析了三组对比(A2B1 vs A2B0、A0B1 vs A0B0、A2B0 vs A0B0)中的差异表达基因(DEG)数量及分布:
- A2B1 vs A2B0(重度盐胁迫下PGPR-HRW处理vs无处理):共鉴定出375个DEG,其中25个上调,350个下调(图3d);
- A0B1 vs A0B0(无盐胁迫下PGPR-HRW处理vs无处理):共鉴定出813个DEG,其中49个上调,764个下调(图3e);
- A2B0 vs A0B0(重度盐胁迫无处理vs无盐胁迫无处理):共鉴定出1356个DEG,其中393个上调,963个下调(图3f)。
Venn图分析显示(图3c):
- A2B1 vs A2B0、A0B1 vs A0B0、A2B0 vs A0B0三组对比中,独特DEG数量分别为153个、349个、969个;
- A2B1 vs A2B0与A0B1 vs A0B0的共有DEG为168个,A2B1 vs A2B0与A2B0 vs A0B0的共有DEG为91个,A0B1 vs A0B0与A2B0 vs A0B0的共有DEG为33个;
- 三组对比共有的DEG为37个。
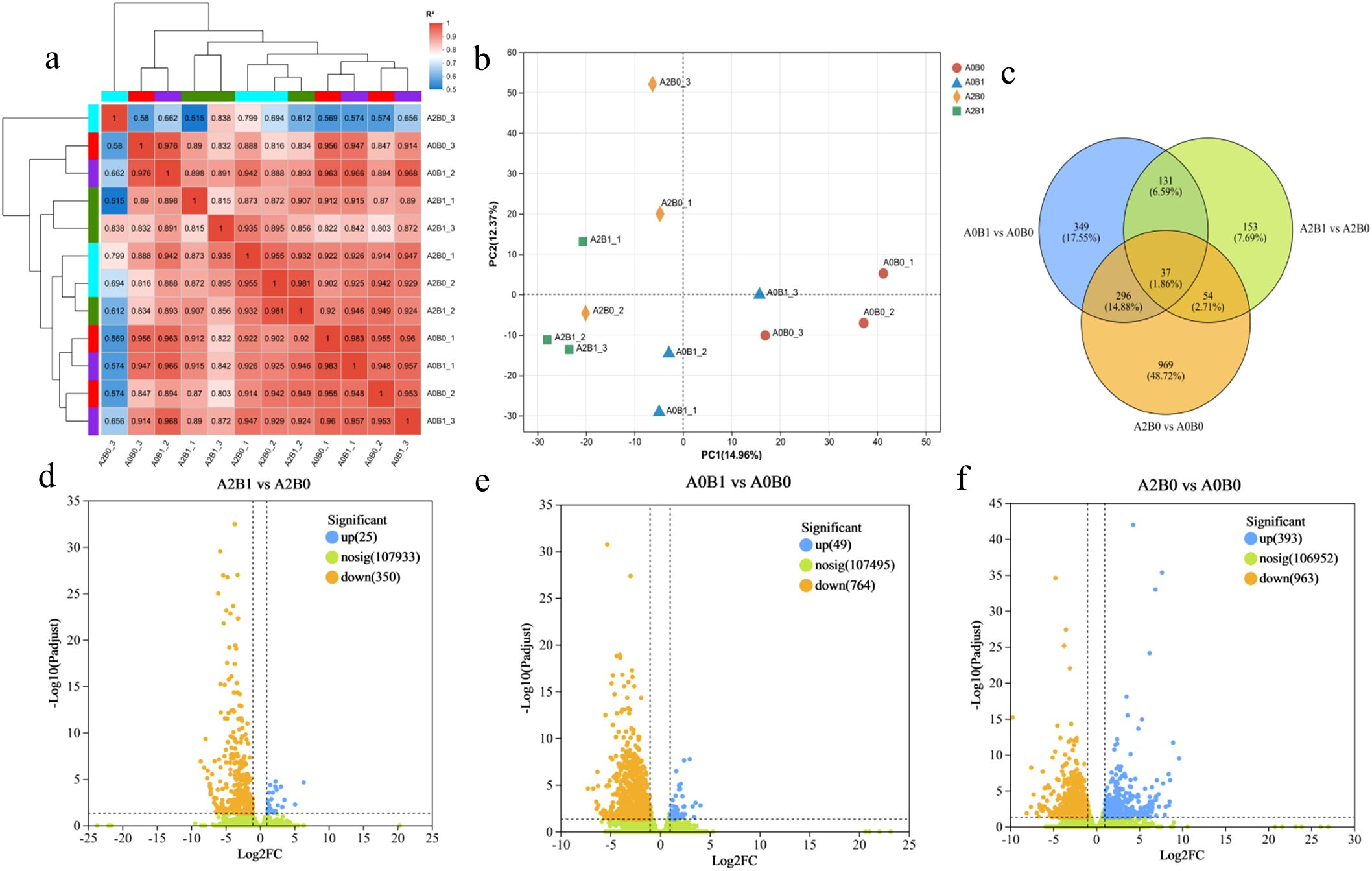
图3 不同对比组中上调与下调基因(DEG)的整体分析
(a)所有处理组(A0B0、A0B1、A2B0、A2B1)间的相关性分析;
(b)主成分分析(PCA)结果;
(c)差异表达基因(DEG)的独特与共有关系Venn图;
(d-f)各对比组中上调与下调基因数量:A2B1 vs A2B0(d)、A0B1 vs A0B0(e)、A2B0 vs A0B0(f)。
为探究三组对比中DEG涉及的生物学通路,本研究进行了京都基因与基因组百科全书(KEGG)通路富集分析。结果显示(p<0.05):
- A2B1 vs A2B0、A0B1 vs A0B0、A2B0 vs A0B0三组对比中,分别有10条、14条、20条通路显著富集;
- “植物MAPK信号通路”“植物-病原菌互作通路”“植物激素信号转导通路”在三组对比中均显著富集,且包含的DEG数量最多(图4),因此被确定为核心共有通路;
- 此外,“吲哚生物碱生物合成”“甜菜红素生物合成”“苯丙氨酸代谢”“精氨酸与脯氨酸代谢”通路在三组对比中也均有富集;
- 特有富集通路方面:“多种植物次生代谢物生物合成”“嘧啶代谢”仅在A2B1 vs A2B0中富集;“胞外多糖生物合成”“脂肪酸延长”“脂肪酸生物合成”仅在A0B1 vs A0B0中富集;“苯丙烷类生物合成”“酪氨酸代谢”“色氨酸代谢”仅在A2B0 vs A0B0中富集。
上述结果表明,B1处理(PGPR-HRW处理)与巨菌草固有的耐盐机制可能存在较大重叠,且B1处理可增强巨菌草自身的部分耐盐通路。
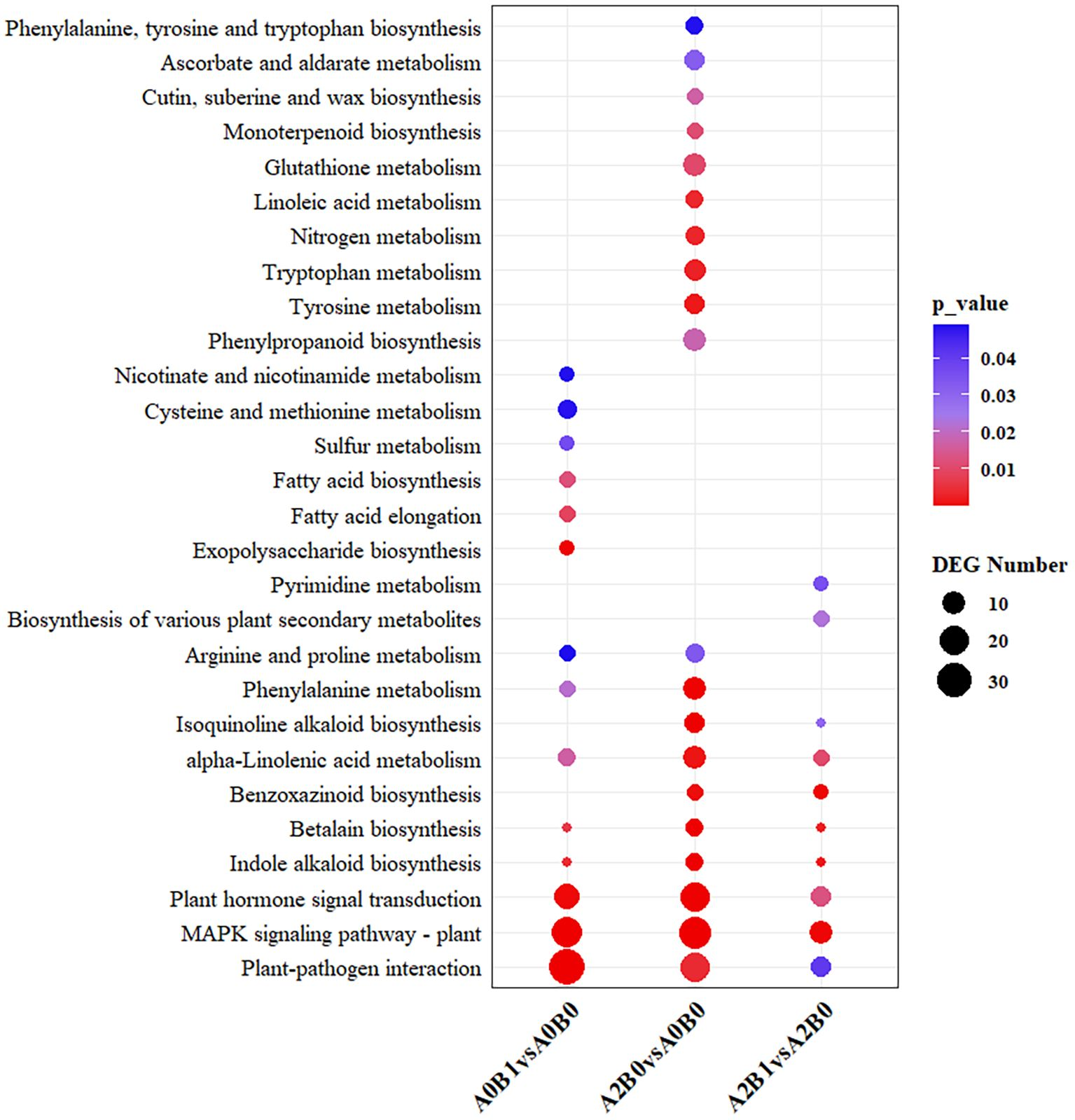
图4 A2B1 vs A2B0、A0B1 vs A0B0、A2B0 vs A0B0三组对比中差异表达基因(DEG)的显著富集KEGG通路(p<0.05)
3.4 “植物激素信号转导通路”“植物-病原菌互作通路”及“植物MAPK信号通路”分析
3.4.1 植物激素信号转导通路
KEGG分析显示,“植物激素信号转导通路”“植物-病原菌互作通路”及“植物MAPK信号通路”在三组对比中均显著富集(图4)。本研究进一步分析了这些通路中的关键调控节点及表达模式。
在植物激素信号转导通路中,差异表达基因(DEG)主要富集于细胞分裂素(CTK)、脱落酸(ABA)和茉莉酸(JA)介导的信号通路。其中,在CTK通路中,细胞分裂素(CTK)与受体CRE1结合后,会诱导AHP(组氨酸磷酸转移蛋白)磷酸化;磷酸化的AHP进入细胞核并使B-ARR(反应调节因子)磷酸化,进而通过调控A-ARR的表达来控制细胞分裂和芽萌发(图5a)。
所有对比组中均检测到3个A-ARR家族DEG的高表达,且在A0B1 vs A0B0和A2B0 vs A0B0两组对比中,这些基因的表达差异达到显著水平(图5a)。上述结果表明,B1处理(PGPR-HRW处理)可在盐胁迫下增强巨菌草的细胞分裂和芽萌发能力。
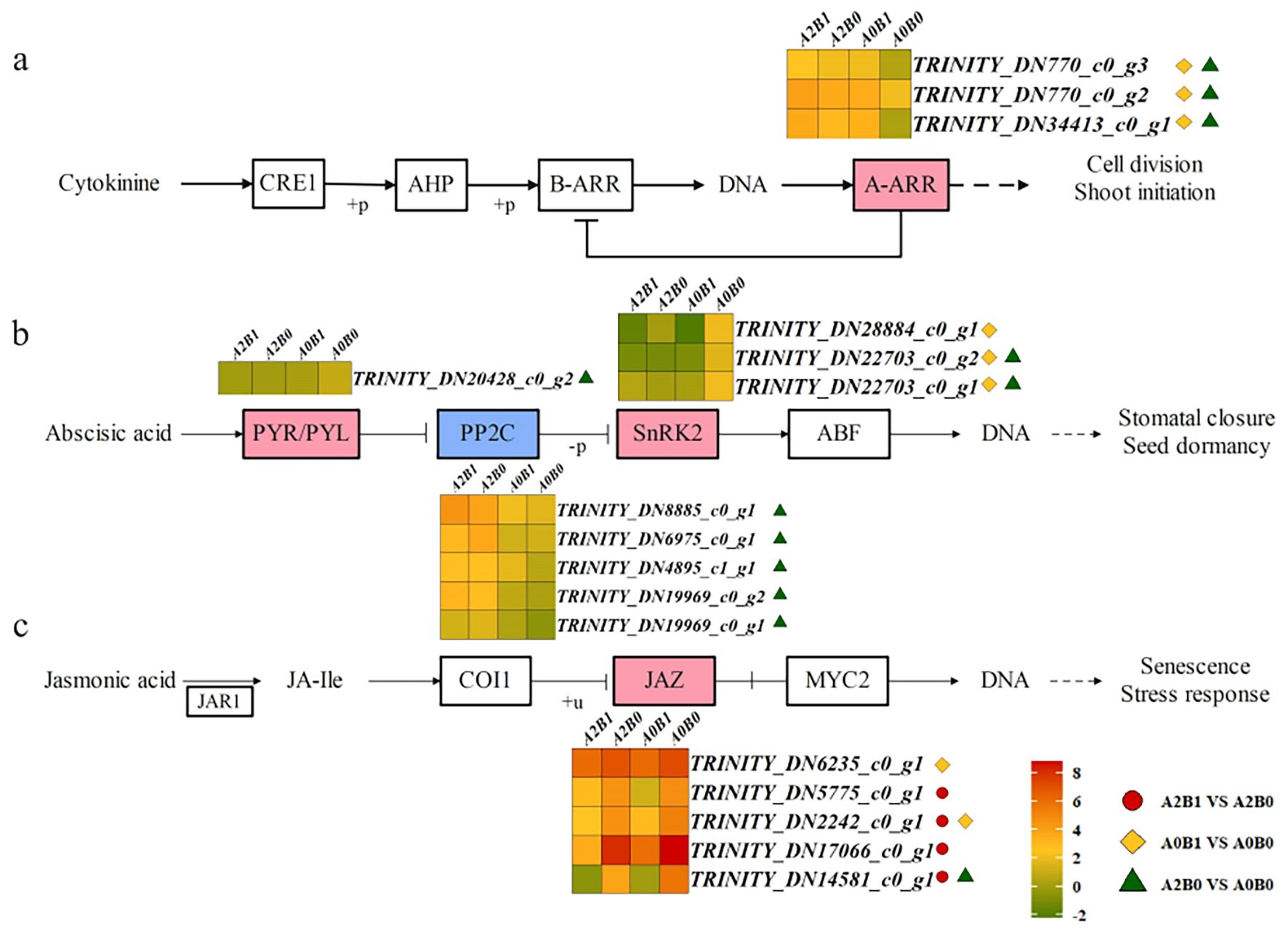
图5 不同对比组激活的“激素信号转导”通路
(a)细胞分裂素(CTK)通路;(b)脱落酸(ABA)信号通路;(c)茉莉酸(JA)信号通路。
2. 热图展示各处理组中差异表达基因(DEG)的log₂表达量;
3. 特定颜色(原文未标注具体颜色,需结合图表实际颜色)代表最终表达功能的正调控因子,另一特定颜色代表最终表达功能的负调控因子;
4. 三种不同标记表示相应对比组中DEG的表达差异达到显著水平(具体标记含义见下文注释2-4)。
在ABA信号通路中,胞内受体PYR/PYL(PYR/PYL蛋白家族)会抑制PP2C(蛋白磷酸酶2C)的活性,从而释放SnRK2(丝氨酸/苏氨酸蛋白激酶SRK2)。被激活的SnRK2会调控下游通路,进而控制气孔关闭与种子休眠(图5b)。本研究共鉴定出1个PYR/PYL家族DEG、5个PP2C家族DEG和3个SnRK2家族DEG(图5b)。在A2B0 vs A0B0(重度盐胁迫无处理vs无盐胁迫无处理)组中,5个PP2C家族DEG显著上调;而在A0B1 vs A0B0(无盐胁迫PGPR-HRW处理vs无盐胁迫无处理)组中,3个SnRK2家族DEG显著下调。PP2C表达升高与SnRK2表达降低共同抑制了气孔关闭,且与CaM/CML(钙调蛋白/钙结合蛋白)通路协同作用,维持了巨菌草气孔的正常开放。
在JA信号通路中,茉莉酸(JA)在茉莉酸氨基酸合成酶JAR1的催化下生成JA-Ile(茉莉酰异亮氨酸)。JA-Ile与COI1(CORONATINE INSENSITIVE 1)结合后进入细胞核,通过泛素化作用抑制JAZ(JASMONATE ZIM-DOMAIN)蛋白与MYC2(转录因子)的解离,从而调控植株衰老与胁迫响应(图5c)。本研究共鉴定出5个JAZ家族DEG,且这些DEG在所有对比组中均呈下调表达趋势,其中4个在A2B1 vs A2B0(重度盐胁迫PGPR-HRW处理vs重度盐胁迫无处理)组中显著下调(图5c)。这表明在A2(500 mmol/L NaCl)盐胁迫下,B1处理(PGPR-HRW处理)可抑制植株衰老与胁迫响应,为巨菌草正常生长提供保障。
3.4.2 植物-病原菌互作通路
在植物-病原菌互作通路中,胞质内的RPM1/2型抗性蛋白(包括RIN4、RPM1、RPS2)介导过敏反应(HR)。其中,RIN4蛋白与RPS2解离后结合RPM1,间接诱导RAR1(抗病蛋白辅助因子)、抑制因子SGT1(Suppressor of G2 Allele of SKP1)及热休克蛋白HSP90的表达,进而触发胞内过敏反应(图6)。在A0B1 vs A0B0和A2B0 vs A0B0两组对比中,1个RIN4家族DEG、2个RPM1家族DEG及1个RPS2家族DEG均呈下调表达;在A2B1 vs A2B0组中,除1个RPM1家族DEG(基因编号:TRINITY_DN9710_c0_g1)上调外,其余3个DEG也均呈下调趋势(图6)。这些基因的下调可间接抑制过敏反应,减少巨菌草叶片的褐变与衰老。
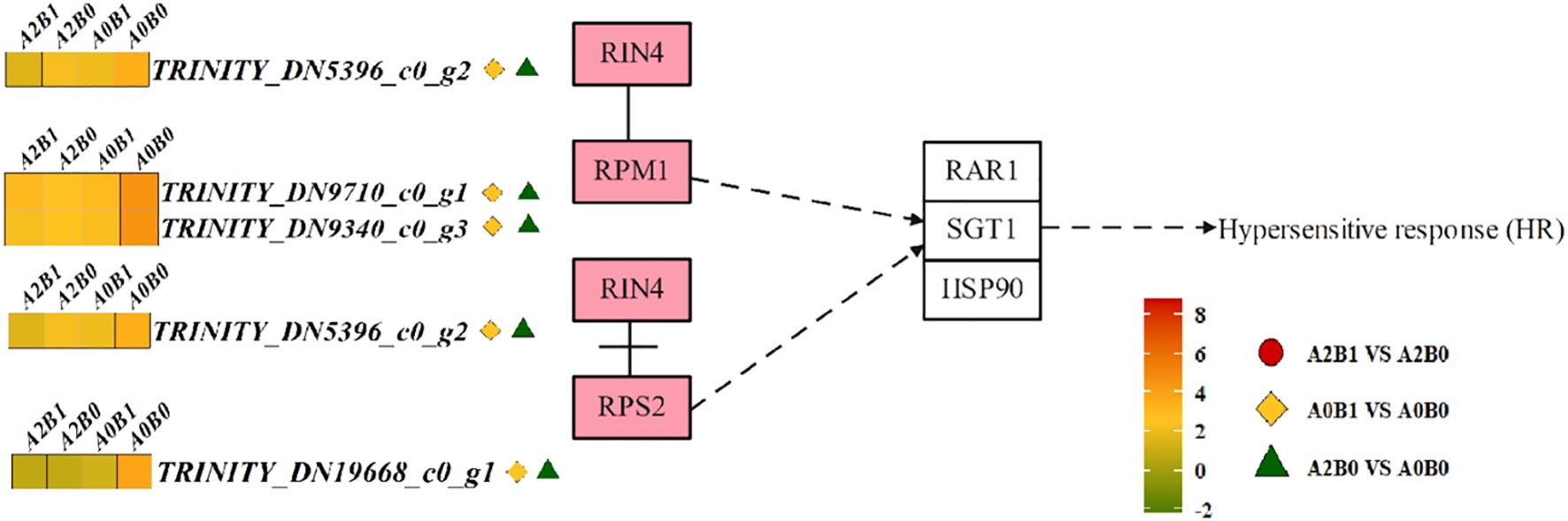
图6 不同对比组激活的“植物-病原菌互作通路”
RPM1/2型抗病蛋白启动过敏反应(HR)信号通路。
3.4.3 植物-病原菌互作通路与植物MAPK信号通路的关联
在植物MAPK信号通路的Ca²⁺-CaM4依赖型信号通路中,Ca²⁺信号通过CaM4(钙调蛋白4)传递,而CaM4会抑制OXI1(氧化应激诱导激酶1)的表达——OXI1是维持活性氧(ROS)平衡的丝氨酸/苏氨酸激酶转录因子。分组对比显示:在A2(重度盐胁迫)条件下,B0与B1处理组间有1个CaM4家族DEG显著下调;在A1(中度盐胁迫)条件下,B0与B1处理组间有3个CaM4家族DEG下调;在B0(无PGPR-HRW处理)条件下,A0与A2组间有2个CaM4家族DEG下调。其中,基因TRINITY_DN13030_c0_g1在所有上述对比组中均呈下调表达(图7a)。CaM4会激活MPK8(丝裂原活化蛋白激酶8),而MPK8通过负调控RbohD(呼吸爆发氧化酶D)维持ROS稳态。这表明盐胁迫下,巨菌草可通过下调CaM4表达平衡ROS水平,而B1处理进一步增强了该效应。
值得注意的是,3个DEG(TRINITY_DN13030_c0_g1、TRINITY_DN11419_c0_g1、TRINITY_DN11419_c0_g2)同时参与植物-病原菌互作通路的Ca²⁺依赖型信号通路,在CaM/CML(钙调蛋白/钙结合蛋白)通路中发挥作用。在此通路中,Ca²⁺信号通过CaM/CML或CDPK(钙依赖蛋白激酶)传递,激活气孔关闭与ROS依赖型过敏反应(HR)。其中,CaM/CML通过调控NOS(一氧化氮合酶)活性影响NO(一氧化氮)生成,进而诱导气孔关闭与HR。在13个CaM/CML家族DEG中,与B0处理相比,B1处理下所有DEG均显著下调,且在A2B0 vs A0B0组中也呈下调趋势(图7b)。这种抑制作用可能有助于盐胁迫下巨菌草维持气孔开放,而B1处理进一步强化了该效果。
类似地,在CDPK(钙依赖蛋白激酶)家族基因的表达中,除1个CDPK家族DEG(TRINITY_DN22981_c0_g1)在A2B0 vs A0B0组中上调外,其余8个DEG在A0B1 vs A0B0或A2B0 vs A0B0组中均显著下调(图7b)。CDPK可促进Rboh(呼吸爆发氧化酶)的磷酸化,激活植物中ROS依赖型HR。因此,CDPK相关基因的下调表达会抑制该过程。
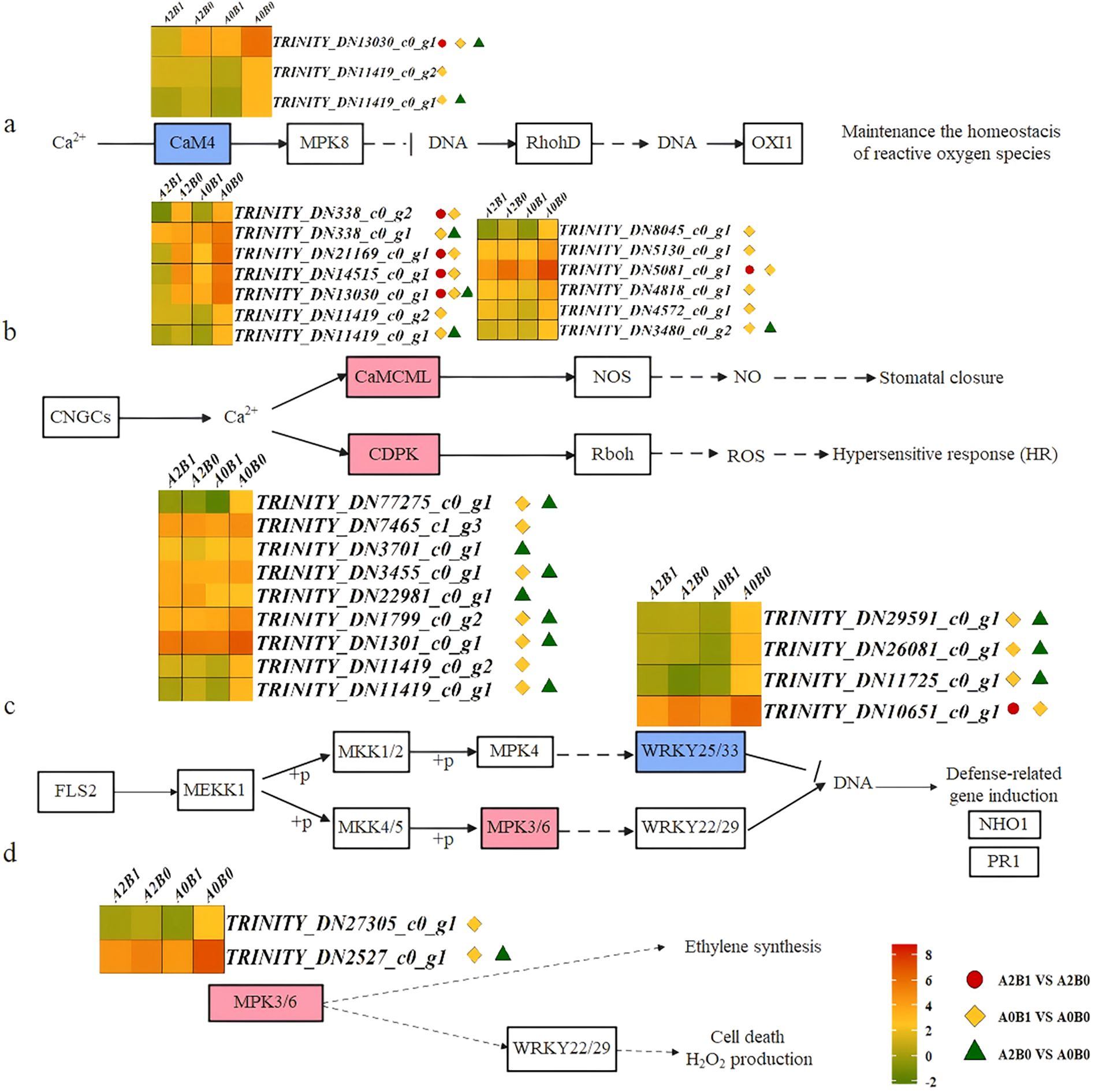
图7 不同对比组激活的“植物-病原菌互作通路”与“植物MAPK信号通路”
(a)“植物MAPK信号通路”的Ca²⁺-CaM4依赖型信号通路;(b)“植物-病原菌互作通路”的Ca²⁺依赖型信号通路;(c)“植物-病原菌互作通路”中LRR类受体丝氨酸/苏氨酸蛋白激酶(FLS2)启动的丝裂原活化蛋白激酶信号通路;(d)“植物MAPK信号通路”的MPK3/6信号通路。
植物-病原菌互作通路的另一分支由LRR(亮氨酸-rich重复)类受体丝氨酸/苏氨酸蛋白激酶FLS2启动,激活MAPK信号。该防御反应通过MEKK1-MKK1/2-MPK4-WRKY25/33或MEKK1-MKK4/5-MPK3/6-WRKY22/29级联反应介导。在这些通路中,4个WRKY25/33家族DEG在三组对比中均有特异性表达(图7c)。B1处理与A2处理均显著抑制WRKY25/33的表达。作为负转录调控因子,WRKY25/33会抑制NHO1(非宿主抗性基因1)、PR1(病程相关蛋白1)等防御相关基因的表达。因此,WRKY25/33的下调可通过“双重负调控”机制增强防御基因的表达,从而提升巨菌草的盐胁迫防御能力。
此外,同时参与上述通路的MPK3/6(丝裂原活化蛋白激酶3/6)是乙烯(ETH)合成的诱导因子,可调控H₂O₂生成与细胞死亡。在所有对比组中,MPK3/6均呈下调表达(图7d),这表明B1处理可通过抑制ETH合成延缓叶片衰老。
3.5 实时荧光定量PCR(qRT-PCR)验证DEG结果
为验证转录组测序(RNA-Seq)数据的可靠性,本研究随机选取12个与乙烯激活信号、NAC结构域蛋白及谷胱甘肽转移酶活性相关的DEG,通过qRT-PCR进行验证(补充表S3)。结果显示,所选DEG的相对表达趋势与RNA-Seq数据一致,且与Illumina测序结果相符(图8),证明RNA-Seq数据可靠。
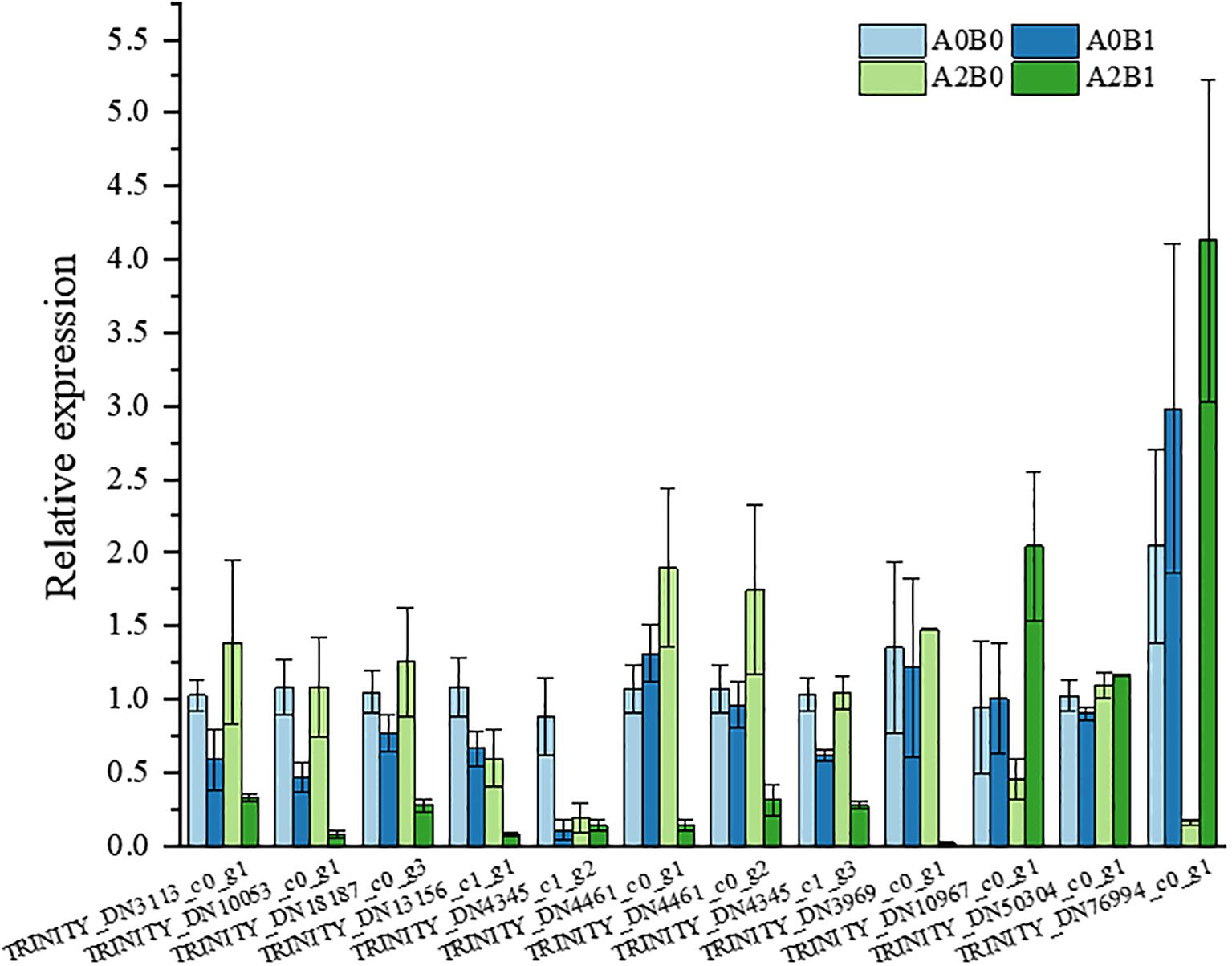
图8 随机选取差异表达基因(DEG)的qRT-PCR表达验证结果
4 讨论
4.1 PGPR-HRW联合处理对盐胁迫下巨菌草生长及生理特性的影响
PGPR与HRW联合施用显著提升了巨菌草的生长状况与耐盐性。结果显示,与对照组相比,PGPR-HRW处理组巨菌草的株高、根长及地上部鲜重均显著增加,且随着盐胁迫程度加剧,这种差异更为明显(图1)。
PGPR-HRW处理显著提高了抗氧化酶(过氧化物酶POD、过氧化氢酶CAT)活性及脯氨酸(Pro)、可溶性糖含量,同时降低了丙二醛(MDA)、过氧化氢(H₂O₂)等过氧化产物水平(图2)。这一结果与已有研究结论一致:Wu等发现,NaCl会显著抑制大麦根伸长并导致细胞活力丧失,而HRW处理可显著逆转这些不利影响(Wu等,2020);Kumar从盐渍土中分离出短小芽孢杆菌(Bacillus pumilus)菌株JPVS11,将其接种于盐胁迫水稻后,水稻的株高、根长、鲜重、干重及CAT、SOD活性均显著提升(Kumar等,2021);Patani采用5株芽孢杆菌属PGPR菌株接种盐胁迫番茄,发现番茄的表型、抗氧化酶活性及营养物质(镁、钙、钾)含量均得到显著改善(Patani等,2023)。本研究进一步拓展了这些报道的结论,证实HRW与PGPR联合处理对巨菌草生长的促进效果优于单一处理,表明二者存在协同作用而非简单的叠加效应。
4.2 PGPR-HRW处理可能通过抑制负调控因子缓解巨菌草的盐胁迫效应
转录组分析为深入揭示植物耐盐机制提供了更有效的手段。差异表达基因(DEG)分析显示,在PGPR-HRW处理与500 mmol/L盐胁迫处理下,巨菌草的下调基因数量均多于上调基因(图3d-f)。A2B0 vs A0B0组(重度盐胁迫无处理vs无盐胁迫无处理)中基因表达呈下调趋势,这与Skodra等报道的NaCl处理橄榄根时基因表达普遍受抑制的趋势一致(Skodra等,2023)。这表明巨菌草缓解盐胁迫的主要方式并非大规模激活胁迫响应基因,而是针对性抑制负调控因子的表达。
京都基因与基因组百科全书(KEGG)通路富集分析证实,这种抑制策略作用于介导胁迫响应的关键信号通路,包括“植物MAPK信号通路”“植物激素信号转导通路”及“植物-病原菌互作通路”。这些通路的富集是植物应对盐胁迫的常见特征(Ma等,2022;Kumar等,2020):Mohamed对盐胁迫下发芽油菜的转录组分析发现,“植物激素信号转导”“植物MAPK信号通路”“糖酵解/糖异生”等通路显著富集(Mohamed等,2022);盐胁迫植物接种PGPR后,PGPR会产生大量生长素(IAA)、脱落酸(ABA)等生长因子,通过调控基因表达与代谢、积累渗透调节物质(脯氨酸、甜菜碱)、提高抗氧化酶含量及活性来增强植物抗逆性(Zahra等,2023;Çam等,2023)。此外,“植物-病原菌互作通路”在PGPR与植物的互作中尤为重要,常被观察到显著富集(Zarattini等,2021;Khoso等,2024);Li通过KEGG富集分析发现,盐胁迫下西伯利亚白刺(Nitraria sibirica Pall)的DEG主要富集于“植物-病原菌互作”“植物激素信号转导”“β-丙氨酸代谢”等通路(Li等,2021)。本研究的KEGG通路富集结果与上述研究高度一致。重要的是,PGPR-HRW诱导的基因表达变化与植物固有耐盐通路存在重叠,表明联合处理是强化植物自身耐盐机制,而非激活全新的代谢过程。
该机制的核心在于对特定基因的抑制作用:关键负调控转录因子(如WRKY25/33、JAZ)与信号组件(如CaM/CML、CDPK)的下调表达,表明相关信号级联反应受到协同抑制。这些级联反应的过度激活会导致植物防御反应过强、衰老加速及生长停滞,而PGPR-HRW处理通过抑制此类反应,使巨菌草在耐受盐胁迫的同时维持生长,形成更节能的胁迫响应模式。
4.3 PGPR-HRW联合处理诱导巨菌草耐盐性的分子机制
结合转录组与生理数据,本研究提出:PGPR与HRW的协同作用通过构建以“抑制关键负调控因子”为核心的复杂调控网络,介导巨菌草的耐盐性。该网络通过以下5个相互关联的机制实现调控:
4.3.1 通过CaM/CML与ABA信号通路调控气孔开度
盐胁迫下,植物通常通过ABA信号通路诱导气孔关闭以保水,但这会牺牲光合效率(Zhao等,2022;Hedrich和Shabala,2018)。本研究发现巨菌草通过双重机制维持气孔开放:一方面,HRW提供的外源H₂显著下调巨菌草中CaM/CML(钙调蛋白/钙结合蛋白)的表达(图7b),这一变化与叶片中一氧化氮合酶(NOS)活性降低、一氧化氮(NO)生成受抑相关,从而缓解NO介导的气孔关闭——这与以往“氢气调控气体信号、减弱NO依赖型胁迫响应”的报道一致(Zhu等,2016),例如HRW可通过减少NO生成缓解铝胁迫对紫花苜蓿根伸长的抑制(Chen等,2014);另一方面,在ABA信号通路中,负调控因子PP2C(蛋白磷酸酶2C)的上调与正调控因子SnRK2(丝氨酸/苏氨酸蛋白激酶SRK2)的下调协同抑制ABA启动的气孔关闭信号(图5b)。考虑到ABA在干旱/盐胁迫诱导气孔关闭中的核心作用(Liu等,2022),这种转录模式为PGPR-HRW处理下气孔维持较高开放度提供了直接通路。值得注意的是,A2B0 vs A0B0组中5个PP2C家族负调控因子DEG显著上调(图5b),这解释了巨菌草自身的耐盐性基础,而PGPR-HRW处理进一步强化了这一效应。
4.3.2 维持活性氧(ROS)平衡并促进防御响应
盐胁迫下,植物需激活ROS系统以启动防御响应,但ROS过量积累会造成细胞损伤(Leshem等,2007)。巨菌草的生理测定显示,高盐胁迫(500 mmol/L)下,PGPR-HRW处理显著提高多种抗氧化酶活性与渗透调节物质含量,同时降低MDA、H₂O₂等过氧化产物水平(图2),这与“PGPR和HRW增强植物抗氧化能力”的报道一致(Giannelli等,2024)。KEGG富集分析发现,两个核心通路参与ROS系统活性调控:其一,在“植物MAPK信号通路”中,负调控因子CaM4(钙调蛋白4)在三组对比中均显著下调(图7a),从而维持ROS平衡;其二,在“植物-病原菌互作通路”的FLS2(LRR类受体激酶)通路中,负转录调控因子WRKY25/33的DEG下调表达(图7c),增强了巨菌草的盐胁迫防御响应。此前观察到三组对比中巨菌草的下调基因数量均多于上调基因(图3d-f),这表明盐胁迫或PGPR-HRW处理下,巨菌草主要通过抑制特定负调控因子表达来缓解盐胁迫。综上,这些变化解除了对抗氧化基因与防御基因的抑制,使植物在维持防御能力的同时,将ROS水平控制在可耐受范围。
4.3.3 减弱过敏反应(HR)以减少细胞损伤
过敏反应(HR)是植物的局部程序性细胞死亡(PCD),虽能辅助防御机制,但在非生物胁迫下过度激活会导致组织损伤(Lam等,2001;Baebler等,2020;Noman等,2020),表型上表现为叶片褐变、萎蔫等衰退症状(Liu等,2022)。转录组数据显示,PGPR-HRW处理下HR呈显著减弱趋势:首先,钙传感器与信号传递体(CaM/CML、CDPK)协同下调(图6、7b),削弱了介导HR的Ca²⁺依赖型信号;其次,RPM1/2型抗病蛋白表达下调(图6),表明NLR(核苷酸结合位点-亮氨酸-rich重复)介导的HR通路激活程度降低。这些变化共同减少了盐胁迫下HR诱导的程序性细胞死亡。巨菌草的表型变化也证实了这一机制——高盐胁迫下,PGPR-HRW处理减少叶片黄化、增加生物量,有效缓解HR响应。该结果与Akbar等的研究高度一致:他们将枯草芽孢杆菌(Bacillus subtilis)与短小芽孢杆菌(Bacillus pumilus)两种PGPR接种盐胁迫棉花,观察到类似转录组结果,即PGPR处理后与CaM/CML、CDPK、Rboh(呼吸爆发氧化酶)相关的基因均下调表达(Akbar等,2022)。
4.3.4 抑制乙烯(ETH)合成并延缓衰老
关于盐胁迫下乙烯的响应机制,学界存在两种观点:部分研究认为乙烯生成可增强植物耐盐性(Jahan等,2021;An等,2018),另一些研究则提出胁迫下乙烯生成会加速植物衰老(Paes de Melo等,2022;Gou等,2022)。本研究发现,PGPR-HRW处理通过抑制乙烯合成,延缓了盐胁迫下巨菌草的衰老:前期研究已证实,本试验所用PGPR——坚强胞杆菌L71(C. firmus L71)可产生ACC脱氨酶,通过分解乙烯前体抑制乙烯生成;转录组水平上,“植物MAPK信号通路”中作为乙烯合成、细胞死亡及H₂O₂生成诱导因子的MPK3/6(丝裂原活化蛋白激酶3/6),在三组对比中均呈下调趋势(图7d);此外,“植物激素信号转导通路”的茉莉酸(JA)信号中,JAZ(茉莉酸-ZIM结构域蛋白)家族DEG显著下调,抑制了植物衰老与胁迫响应(图5c)。这些效应共同延缓了植株衰老。实时荧光定量PCR(qRT-PCR)结果进一步验证了这一机制:在选取的12个DEG中,前8个均与乙烯激活信号通路/乙烯响应转录因子相关(补充表S3),且在A2B1处理(重度盐胁迫+PGPR-HRW)下均呈低表达(图8)。由此推断,延缓衰老是PGPR-HRW诱导巨菌草耐盐性的关键环节。
4.3.5 促进细胞分裂素(CTK)合成
盐胁迫下,细胞分裂素(CTK)作为与ABA、乙烯拮抗的激素,可促进细胞分裂并抑制ABA、乙烯诱导的衰老效应(Li等,2021)。在“植物激素信号转导通路”的CTK信号中,与细胞分裂、芽萌发相关的调控因子A-ARR(A型反应调节因子)在三组对比中均高表达(图5a),表明PGPR-HRW有效促进了巨菌草的细胞分裂与芽萌发,增强其盐胁迫响应能力。这可能与PGPR抑制乙烯生成相关——已有研究表明,乙烯与细胞分裂素存在负反馈调节关系(Yu等,2023)。该结果凸显了激素通路在协同响应中的相互关联性。
综上,PGPR-HRW联合处理诱导巨菌草耐盐性的分子机制主要包括以下5个方面:维持气孔开放、维持ROS平衡并促进防御响应、抑制HR响应、抑制乙烯合成并延缓衰老、促进CTK合成。这些机制并非独立存在,部分DEG同时在多个通路中发挥作用,共同构成PGPR-HRW盐胁迫响应网络,其具体关联仍需进一步研究。值得注意的是,在多个通路中出现的关键DEG,其过表达或敲除可能改变植物耐盐性,为耐盐植物育种提供了新方向。
本研究从分子与生理水平揭示了PGPR与HRW协同作用的全新整合视角,其核心机制在于:二者通过对多个信号通路(MAPK通路、激素通路、病原菌响应通路)中负调控因子的广泛、针对性抑制,使巨菌草能更高效地调控胁迫响应,从而节省能量与资源用于生长维持。从实际应用角度看,PGPR-HRW组合为盐渍土植物修复与农业生产提供了极具潜力的可持续策略——将固有耐盐性的巨菌草与精准配制的生物制剂结合,可显著提升盐渍土修复效率。未来研究应聚焦田间试验,验证自然条件下的协同效应,并探索其在其他重要经济耐盐作物中的应用效果。
5 结论
本研究证实,不同NaCl浓度下,PGPR与HRW联合施用均显著增强巨菌草的耐盐性:该处理不仅改善了巨菌草的株高、根长、地上部生物量等生长指标,还提高了抗氧化酶活性与渗透调节能力,减少氧化损伤,且盐浓度越高,该效应越显著,凸显PGPR-HRW在缓解重度盐胁迫中的潜力。转录组分析表明,PGPR-HRW主要通过抑制负调控因子缓解盐胁迫,关键下调基因包括CaM/CML、CaM4、CDPK、WRKY25/33、JAZ;“植物激素信号转导”“MAPK信号”“植物-病原菌互作”通路的富集进一步证实了胁迫响应的协同调控。综上,PGPR-HRW诱导耐盐性的机制涉及维持气孔开放、恢复ROS平衡、抑制HR、减少乙烯合成并延缓衰老、促进CTK信号。这些发现为微生物接种剂与HRW在植物抗逆中的互作机制提供了新见解,鉴定出的通路与候选基因值得进一步功能验证,有望为盐渍环境下作物抗逆育种与管理策略提供支撑。
https://blog.sciencenet.cn/blog-41174-1510649.html
上一篇:首个慢性疲劳综合征血液检测方法问世
下一篇:寄生蚁欺骗工蚁弑杀蚁后