博文
氢气和NAC协同抗氧化效应 缓解药物肝损伤
||
对乙酰氨基酚(APAP)过量会诱发严重肝损伤,糖尿病患者尤其易感。N-乙酰半胱氨酸(NAC)是目前临床获批的对乙酰氨基酚中毒解毒剂,但治疗窗口狭窄,临床应用受限。本研究探讨了分子氢(H₂)对糖尿病小鼠中对乙酰氨基酚诱导肝毒性的保护作用。在给予对乙酰氨基酚前,糖尿病db/db小鼠先饮用富氢水(H₂-water)两周。结果显示,饮用富氢水可显著减轻对乙酰氨基酚诱导的肝损伤,具体表现为组织学结果改善,血浆丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)水平降低。通过表达 redox 敏感型绿色荧光蛋白(roGFP)的转基因小鼠,研究证实分子氢可同时降低对乙酰氨基酚过量引起的胞质和线粒体氧化应激。此外,研究观察到分子氢可调控c-Jun氨基末端激酶(JNK)的激活,抑制Bax蛋白向线粒体的转运,并减少线粒体核酸酶的释放;同时,分子氢还能上调具有肝保护作用的成纤维细胞生长因子21(FGF21)的表达。上述结果表明,分子氢通过减轻氧化应激和上调FGF21表达,对糖尿病小鼠中对乙酰氨基酚诱导的肝损伤发挥保护作用。尽管N-乙酰半胱氨酸具有抗氧化活性,但分子氢在降低线粒体氧化应激方面效果更优。重要的是,分子氢与N-乙酰半胱氨酸联合处理对乙酰氨基酚诱导肝毒性的保护效果,显著优于单独使用N-乙酰半胱氨酸。这种协同效应可能源于两者在调控FGF21表达和线粒体氧化应激机制上的差异。因此,分子氢与N-乙酰半胱氨酸联合使用,或可为糖尿病患者对乙酰氨基酚诱导肝损伤提供更优的治疗策略。
点评:过去类似研究重点在对比,例如证明氢气抗氧化效应比某抗氧化物效果更好,本研究则独辟蹊径,证明氢气联合经典抗氧化物能产生协同效应。这说明氢气抗氧化效应存在不同于传统抗氧化物的作用方式或途径,例如本研究发现的对于FGF21作用的情况。这一研究开辟了氢气效应研究的新范式,肯定能影响将来类似研究的方法。从应用角度也有价值,例如NAC也是某些疾病的临床药物,是否联合氢气可产生更好的临床效果?
1. 引言
对乙酰氨基酚(APAP)是一种广泛使用的安全有效镇痛药和退热药。然而,对乙酰氨基酚过量会导致急性肝损伤,进而引发急性肝功能衰竭[1,2]。在治疗剂量下,大部分对乙酰氨基酚在肝脏代谢后,通过胆汁或尿液排出体外[3];而过量对乙酰氨基酚则会被细胞色素P450酶代谢为高活性中间产物——N-乙酰对苯醌亚胺(NAPQI)[4,5]。尽管NAPQI可通过与谷胱甘肽(GSH)结合而被解毒,但药物过量会耗尽体内谷胱甘肽储备,导致NAPQI与细胞蛋白发生共价结合[6,7,8]。其中,线粒体中蛋白质加合物的形成是肝细胞死亡的关键起始步骤[9,10,11],进而引发线粒体氧化应激,激活c-Jun氨基末端激酶(JNK);被激活的JNK发生磷酸化后转移至线粒体,进一步加剧氧化应激[6,12,13,14,15]。线粒体氧化应激增强会促进Bax蛋白向线粒体转运,并促使线粒体核酸酶释放,最终导致DNA断裂和细胞死亡[6,16,17,18]。基于上述机制,谷胱甘肽前体N-乙酰半胱氨酸(NAC)被开发为治疗对乙酰氨基酚中毒的临床解毒剂[19]。N-乙酰半胱氨酸可促进肝脏谷胱甘肽的补充,在对乙酰氨基酚暴露后及时给药时疗效显著[20]。然而,延迟给药会导致疗效下降[21,22],且高剂量给药可能引发不良反应[23]。这些局限性表明,亟需针对对乙酰氨基酚诱导肝毒性的不同机制,开发新的治疗策略。
近年来,机制研究推动了新型治疗方法的发展。多种具有抗氧化特性、或能抑制细胞色素P450酶活性及JNK活性的化合物,在预防对乙酰氨基酚诱导肝损伤方面展现出潜力[24]。目前,靶向线粒体氧化应激及相关信号通路,被认为是减轻对乙酰氨基酚过量所致肝毒性的极具前景的策略[25]。例如,线粒体靶向抗氧化剂Mito-Tempo已被证实可有效预防对乙酰氨基酚诱导的肝损伤[26,27];此外,肝脏激素成纤维细胞生长因子21(FGF21)可改善线粒体功能,对乙酰氨基酚诱导的肝毒性具有保护作用[28,29]。临床和临床前研究表明,肥胖、非酒精性脂肪肝(NAFLD)和2型糖尿病会增加对乙酰氨基酚诱导肝损伤的易感性[30,31,32]。
尽管N-乙酰半胱氨酸是公认的抗氧化剂[33],但其在脂肪肝背景下治疗对乙酰氨基酚诱导肝损伤的效果仍有限[32]。本团队此前研究发现,分子氢(H₂)可通过减轻氧化应激和上调FGF21表达,改善肥胖和糖尿病症状[34]。与此一致,其他研究团队也证实分子氢对脂肪肝小鼠模型的肝损伤具有保护作用[35,36]。早在1975年,就有研究报道氢气疗法可能用于癌症治疗[37];此后,在缺血再灌注损伤动物模型中证实了氢气的抗氧化特性[38],后续研究进一步发现氢气具有广泛的生物学效应,包括抗炎、抗过敏、促进能量代谢及保护线粒体功能等[39]。目前,氢气的治疗益处已在多种动物模型和临床场景中得到验证[40]。长期饮用富氢水可促进PGC-1α基因及其他线粒体相关基因的表达[41],且氢气已被证实可保护线粒体完整性,抑制自由基诱导的细胞死亡[42]。这些研究结果提示,补充氢气或可减轻糖尿病患者中对乙酰氨基酚诱导的肝损伤。
本研究在2型糖尿病小鼠模型中,探讨了氢气对乙酰氨基酚诱导肝损伤的保护作用。研究团队近期开发了一种新型转基因小鼠,可在体内检测胞质或线粒体中基于谷胱甘肽的 redox 变化;此前利用该小鼠模型的研究发现,与瘦型对照小鼠相比,糖尿病小鼠在给予对乙酰氨基酚后,线粒体氧化应激水平显著升高[31]。本研究进一步利用该模型,评估了氢气对线粒体氧化应激及其下游效应(包括对乙酰氨基酚诱导的肝脏病理改变)的影响,同时探究了氢气与N-乙酰半胱氨酸联合使用对乙酰氨基酚诱导氧化应激和肝损伤的协同作用。
结果表明,氢气与N-乙酰半胱氨酸联合治疗,可增强对糖尿病小鼠中对乙酰氨基酚诱导肝毒性的保护效果。
2. 材料与方法
2.1 实验动物
杂合子db/+小鼠(品系:BKS.Cg m+/+Leprdb/J)购自日本杰克逊实验室(Yokohama, Kanagawa, Japan)。表达redox敏感型绿色荧光蛋白(roGFP)(作为生物传感器)的转基因小鼠,参照此前文献方法构建[31]。本研究使用两种roGFP转基因小鼠品系(CRO和MRO),分别用于检测胞质和线粒体氧化应激:CRO小鼠在胞质中表达roGFP,MRO小鼠在线粒体中表达roGFP。携带redox生物传感器的糖尿病db/db小鼠,通过将杂合子db/+小鼠与roGFP转基因小鼠杂交获得。所有小鼠饲养于可控环境中,光照周期为12小时光照/12小时黑暗,自由饮水和进食标准啮齿类饲料。所有动物实验均遵循美国国家研究委员会《实验动物饲养与使用指南》(美国国家科学院出版社,华盛顿特区),并经日本日本医科大学动物伦理委员会批准(东京,日本)。
2.2 实验设计
8周龄雄性db/db小鼠禁食过夜后,腹腔注射溶于温生理盐水的对乙酰氨基酚(375 mg/kg,Sigma-Aldrich,美国密苏里州圣路易斯市),具体操作参照此前文献[31]。氢气处理组小鼠在给予对乙酰氨基酚前两周,以富氢水作为饮用水。处理开始时(小鼠6周龄),氢气处理组日均饮水量为13.3±1.3 mL,对照组为12.4±2.8 mL;随着糖尿病病情进展,小鼠饮水量增加,至8周龄时,氢气处理组和对照组日均饮水量分别为25.1±6.3 mL和25.1±5.8 mL。两组小鼠平均体重如下:6周龄时,氢气处理组29.7±1.0 g vs 对照组29.7±0.9 g;8周龄时,氢气处理组36.1±2.1 g vs 对照组37.0±1.7 g。N-乙酰半胱氨酸处理组小鼠在给予对乙酰氨基酚前30分钟,腹腔注射溶于生理盐水的N-乙酰半胱氨酸(300 mg/kg,Sigma-Aldrich,美国密苏里州圣路易斯市)。在给予对乙酰氨基酚1小时后检测肝脏氧化应激水平;分别在给药后3小时和6小时收集血液和肝脏样本。
2.3 富氢水的制备与保存
富氢水的制备和保存参照此前文献方法[43]:简而言之,通过将氢气溶解于水中至饱和状态(0.8 mM)制备富氢水,由日本Merodian公司(大阪)将其装入铝制瓶中提供。由于氢气在普通饮水瓶或阀门中储存时易泄漏,本研究采用特制饮水阀——该阀门可直接与铝制瓶出口对接,内置防逆流阀以最大限度减少氢气损失,从而防止氢气泄漏。使用针型氢气传感器(Unisense,丹麦奥胡斯N)检测溶解氢浓度:饮用前氢气浓度为饱和水平的96.84±1.03%,在上述储存条件下放置1周后,浓度仍可维持在饱和水平的70.68±0.31%。
2.4 组织病理学与生化检测
肝脏组织用10%中性缓冲福尔马林固定,石蜡包埋后切成4 μm厚切片,进行苏木精-伊红(H&E)染色以评估组织病理学变化。采用光学显微镜(Olympus BX63,日本东京)观察染色切片。血浆丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)水平,使用市售检测试剂盒(FUJIFILM Wako Pure Chemical Corporation,日本大阪)检测,具体操作参照此前文献[31]。
2.5 氧化应激检测
参照此前文献方法[31],在db/db roGFP转基因小鼠中评估肝脏氧化应激:简要来说,对麻醉小鼠进行剖腹手术,记录并分析roGFP的荧光信号。roGFP作为比率型redox传感器,具有405 nm和470 nm两个激发峰,其荧光比值可反映细胞redox状态。使用MATLAB软件(MathWorks,美国马萨诸塞州纳提克)生成荧光比值的彩色编码图像,通过ImageJ软件(美国马里兰州贝塞斯达)进行定量分析。
2.6 胞质和线粒体组分的制备
参照Liao等人的方法[44]并稍作修改,通过差速离心制备胞质和线粒体蛋白组分:将肝脏组织在含蛋白酶抑制剂(cOmplete Mini,Roche,Sigma-Aldrich,美国密苏里州圣路易斯市)和磷酸酶抑制剂(PhosSTOP,Roche,Sigma-Aldrich)的分离缓冲液(0.25 M蔗糖、20 mM Tris-HCl,pH 7.6)中匀浆;匀浆物首先在4°C下以1000×g离心10分钟,去除细胞核和碎片;上清液随后在4°C下以10,000×g离心10分钟,收集线粒体沉淀,将沉淀重悬于含蛋白酶抑制剂和磷酸酶抑制剂的分离缓冲液中;第二次离心后的上清液即为胞质组分。采用BCA法测定蛋白浓度。
2.7 蛋白质印迹分析(Western blotting)
参照此前文献方法[45]进行蛋白质印迹分析[45]。一抗包括:抗JNK抗体(9252)、抗磷酸化JNK(P-JNK)抗体(4668)、抗凋亡诱导因子(AIF)抗体(5318),均购自Cell Signaling Technology公司(美国马萨诸塞州丹弗斯市);抗Bax抗体(sc-7480)、抗第二线粒体衍生的半胱天冬酶激活因子(Smac)抗体(sc-393118),购自Santa Cruz Biotechnology公司(美国加利福尼亚州圣克鲁斯市);抗视神经萎缩蛋白1(OPA1)抗体(612606),购自BD Biosciences公司(美国加利福尼亚州圣何塞市);抗β-肌动蛋白(β-actin)抗体(010-27841),购自富士胶片和光纯药株式会社(日本大阪市)。辣根过氧化物酶(HRP)标记二抗(抗兔IgG或抗小鼠IgG)购自Santa Cruz Biotechnology公司。采用Amersham ECL Select化学发光试剂(Cytiva公司,日本东京市)显影免疫反应条带,通过Amersham Imager 600成像系统(Cytiva公司)检测条带;使用ImageQuant TL软件(Cytiva公司)对条带强度进行定量分析。
2.8 实时定量PCR分析(Quantitative PCR analysis)
采用RNeasy Mini试剂盒(Qiagen公司,荷兰芬洛市)从肝脏组织中提取总RNA。参照此前文献方法[41],通过实时定量PCR检测成纤维细胞生长因子21(FGF21)和过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)的mRNA表达水平。所有结果均以甘油醛-3-磷酸脱氢酶(GAPDH)的表达水平作为内参进行标准化处理。
2.9 统计学分析(Statistics)
所有数据均以“均值±标准差(mean ± SD)”表示。两组间差异采用非配对双尾Student's t检验分析;多组间比较采用单因素方差分析(one-way ANOVA),随后进行Tukey事后检验。使用GraphPad Prism软件(GraphPad Software公司,美国加利福尼亚州圣迭戈市)进行统计学分析。以p < 0.05为差异具有统计学意义。
3 结果(Results)
3.1 饮用富氢水可保护小鼠免受对乙酰氨基酚诱导的肝损伤
为评估氢气的肝保护潜力,小鼠在给予对乙酰氨基酚前先饮用富氢水两周,随后腹腔注射375 mg/kg对乙酰氨基酚或溶媒(生理盐水)(图1A)。与此前研究结果[34]一致,在溶媒处理组中,饮用富氢水可改善脂肪肝的组织学特征(图1B,上图);且溶媒处理的富氢水组小鼠,其血浆丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)基线水平显著低于普通水对照组(图1C,左图;图1D,左图)。对乙酰氨基酚注射6小时后,苏木精-伊红(H&E)染色结果显示小鼠出现严重肝损伤,而饮用富氢水可显著缓解这些病理改变(图1B,下图);此外,富氢水还能显著抑制对乙酰氨基酚诱导的ALT和AST水平升高(图1C,右图;图1D,右图)。上述结果表明,饮用富氢水可保护小鼠免受对乙酰氨基酚诱导的肝损伤。

图1 氢气对乙酰氨基酚诱导的肝损伤具有保护作用** (A)实验流程图:小鼠饮用富氢水或普通水两周,禁食过夜(16小时)后,腹腔注射对乙酰氨基酚(375 mg/kg)或溶媒(生理盐水)。在预设时间点进行检测:注射对乙酰氨基酚1小时后,麻醉小鼠并剖腹暴露肝脏,定量检测肝脏氧化应激水平;3小时后,收集肝脏样本用于mRNA表达分析;6小时后,收集肝脏和血液样本,进行肝损伤评估(组织病理学检查和血浆转氨酶检测)及JNK信号通路分析。(B)肝脏组织H&E染色结果:放大倍数40倍(比例尺500 μm)和100倍(比例尺200 μm)。(C)血浆ALT活性。(D)血浆AST活性。误差线表示均值±标准差(每组n = 8-10)。*p < 0.05。
3.2 富氢水可抑制对乙酰氨基酚处理小鼠的JNK激活及线粒体核酸酶释放
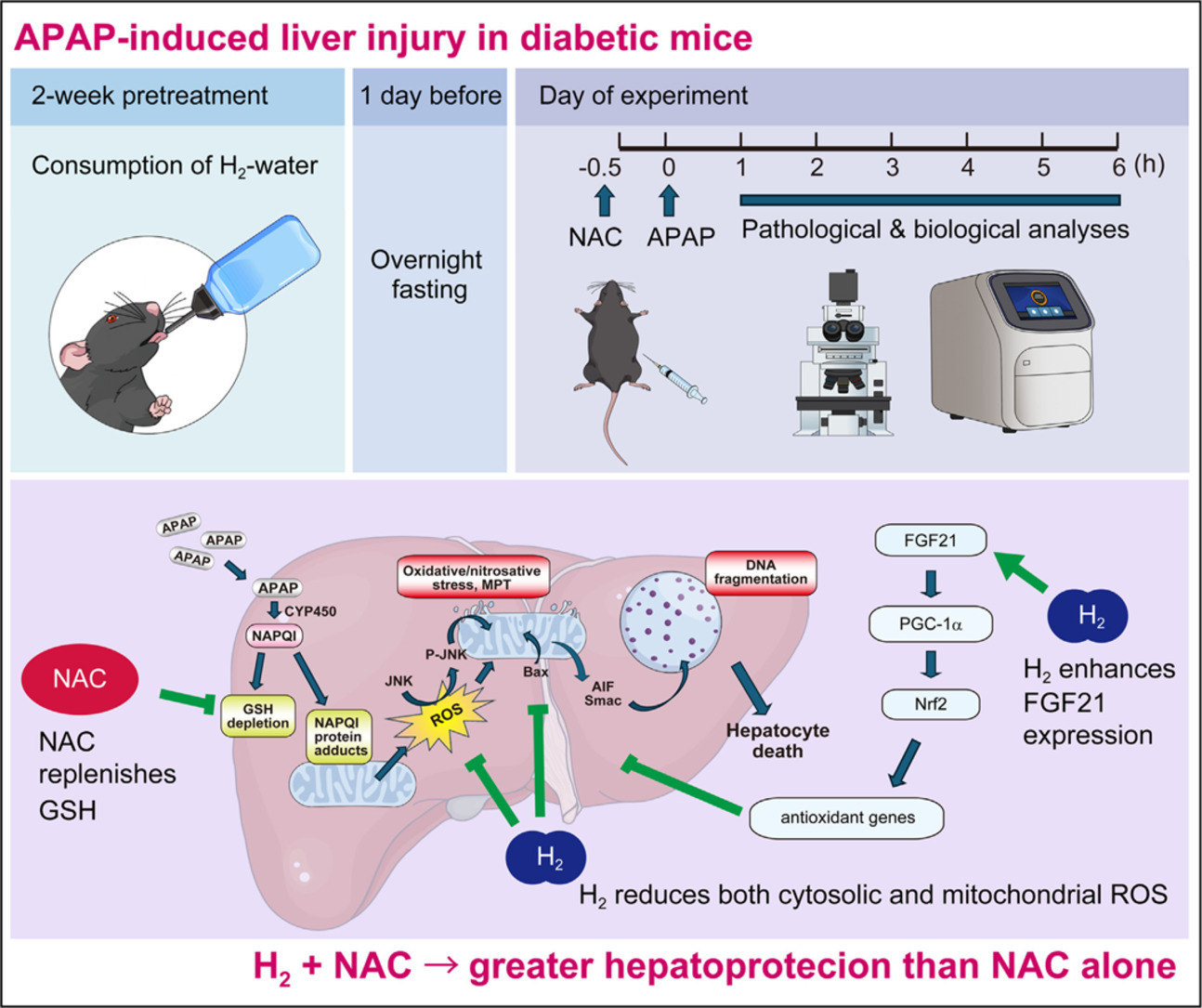
已知对乙酰氨基酚过量后,氧化应激会触发JNK激活[6],因此本研究进一步评估了JNK磷酸化及其向线粒体的转运。在溶媒处理组小鼠中,胞质和线粒体中均未检测到磷酸化JNK(P-JNK)(图2A、2C);而对乙酰氨基酚注射6小时后,胞质中P-JNK水平升高,且出现向线粒体的转运(图2A、2C)。饮用富氢水可显著降低P-JNK水平及其向线粒体的转运(图2B、2D),提示氢气可抑制对乙酰氨基酚诱导的JNK通路激活。
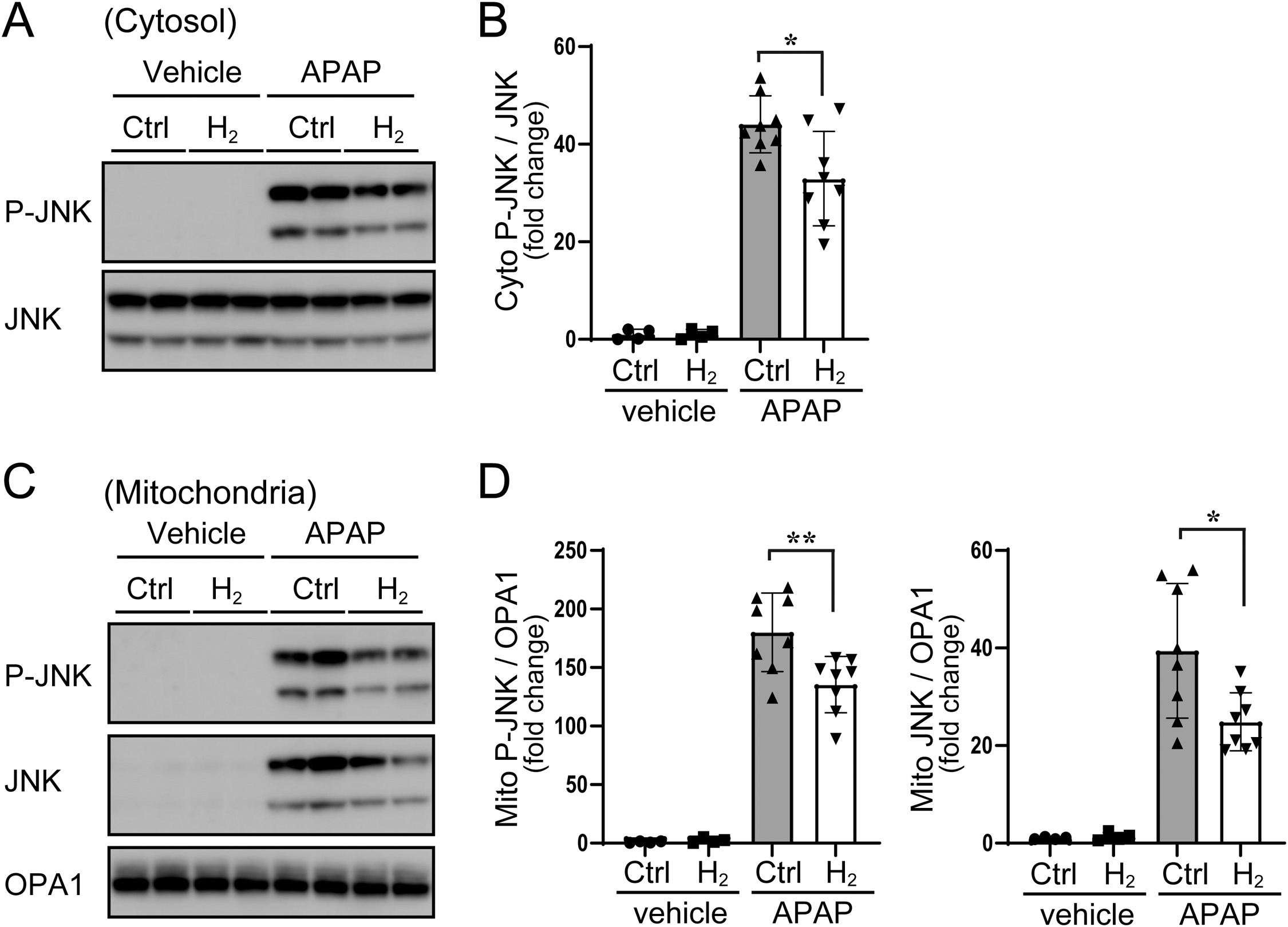
图2 氢气可抑制对乙酰氨基酚过量诱导的JNK磷酸化及线粒体转运** 小鼠在给予对乙酰氨基酚(375 mg/kg)或溶媒前,先饮用富氢水或普通水两周。注射对乙酰氨基酚6小时后收集肝脏样本,分离胞质和线粒体组分。(A)胞质组分中磷酸化JNK(P-JNK)和总JNK的蛋白质印迹结果。(B)胞质中P-JNK/JNK比值的密度定量分析,结果以“相对于溶媒处理的普通水组小鼠的倍数变化”表示。(C)线粒体组分中P-JNK和总JNK的蛋白质印迹结果,OPA1作为线粒体上样内参。(D)线粒体中P-JNK和总JNK水平的密度定量分析(以OPA1为内参标准化),结果以倍数变化表示。误差线表示均值±标准差(每组n = 4-8)。*p < 0.05,**p < 0.01。
JNK激活与Bax蛋白向线粒体转运相关,进而导致线粒体外膜穿孔,并释放凋亡诱导因子(AIF)、第二线粒体衍生的半胱天冬酶激活因子(Smac)等核酸酶[6]。本研究通过检测胞质组分中这些蛋白的水平,评估其从线粒体的释放情况:AIF和Smac是线粒体固有蛋白,正如预期,在溶媒处理组小鼠的胞质组分中未检测到这两种蛋白;而对乙酰氨基酚注射6小时后,可观察到Bax向线粒体转运,且胞质中出现AIF和Smac的释放(图3A、3C)。饮用富氢水可显著抑制Bax向线粒体的转运及这些核酸酶向胞质的释放(图3B、3D)。上述结果表明,富氢水可抑制对乙酰氨基酚过量后JNK的激活及其下游线粒体核酸酶的释放。
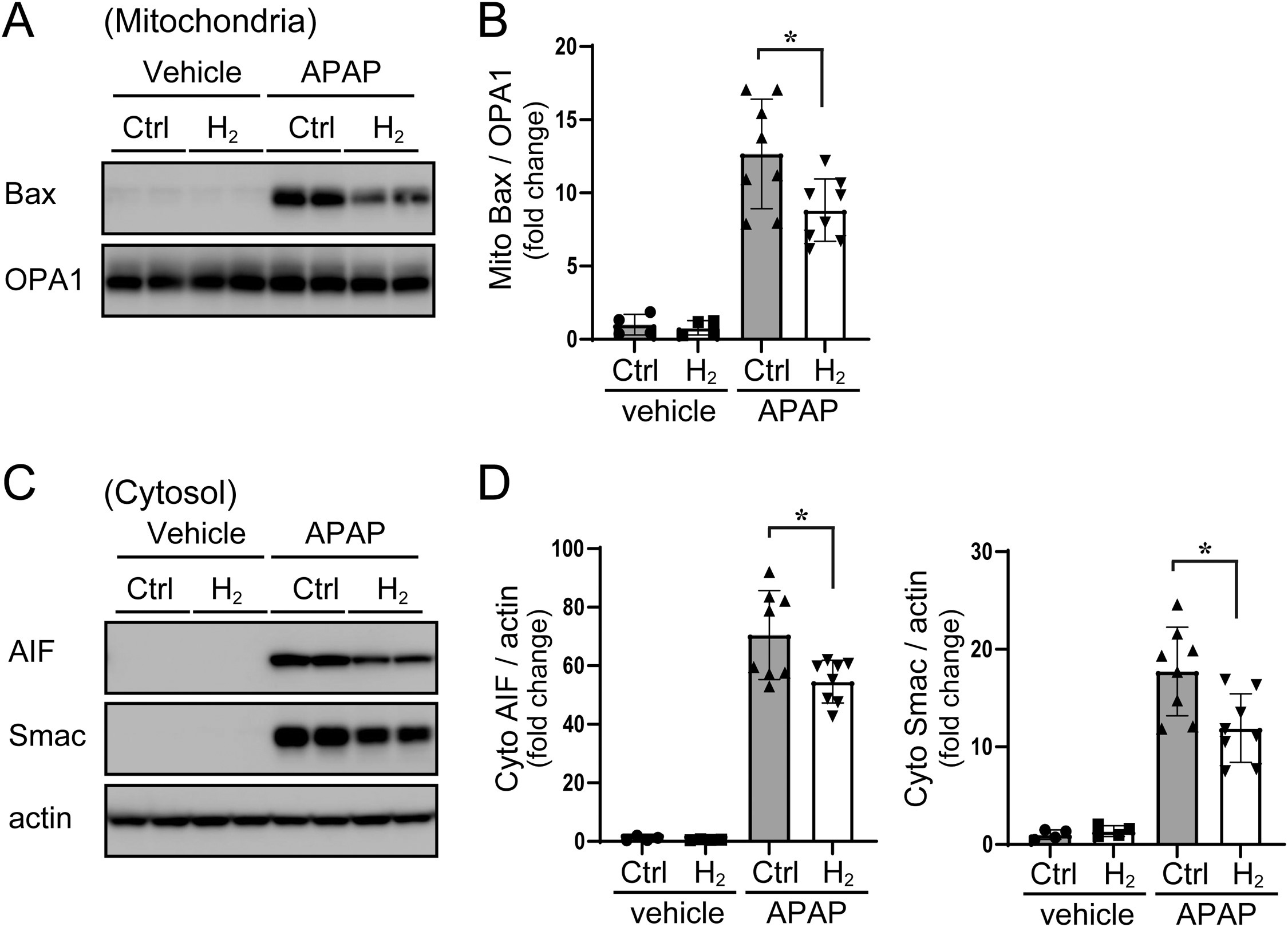
图3 氢气可抑制对乙酰氨基酚过量诱导的Bax转运及核酸酶释放 小鼠在给予对乙酰氨基酚(375 mg/kg)或溶媒前,先饮用富氢水或普通水两周。注射对乙酰氨基酚6小时后收集肝脏样本,分离胞质和线粒体组分。(A)线粒体组分中Bax的蛋白质印迹结果,OPA1作为线粒体上样内参。(B)线粒体中Bax水平的密度定量分析(以OPA1为内参标准化),结果以倍数变化表示。(C)胞质组分中AIF和Smac的蛋白质印迹结果,β-肌动蛋白(β-actin)作为胞质上样内参。(D)胞质中AIF和Smac水平的密度定量分析(以β-actin为内参标准化),结果以倍数变化表示。误差线表示均值±标准差(每组n = 4-8)。*p < 0.05。
3.3 富氢水可增强对乙酰氨基酚过量诱导的FGF21表达
氢气的抗氧化特性已得到广泛认可,但其还具有抗氧化以外的生物学效应,包括调控基因表达。其中,成纤维细胞生长因子21(FGF21)是关键靶基因之一——作为一种肝脏激素,FGF21可改善线粒体功能并保护小鼠免受对乙酰氨基酚诱导的肝毒性。已有研究报道,在对乙酰氨基酚毒性早期(明显肝损伤出现前),FGF21表达即会上调;外源性给予FGF21可减轻肝毒性,而FGF21缺乏则会加剧肝损伤[28,29]。本团队此前研究发现,与瘦型对照小鼠相比,db/db小鼠肝脏FGF21表达水平降低,而饮用富氢水可恢复该蛋白的表达[34,41]。基于上述发现,本研究假设:FGF21表达上调可能是氢气对乙酰氨基酚诱导肝损伤发挥保护作用的机制之一。为验证这一假设,本研究检测了db/db小鼠肝脏FGF21的mRNA水平。与此前结果一致,即使未给予对乙酰氨基酚,饮用富氢水也能提高肝脏FGF21的基础表达水平(图4A)。对乙酰氨基酚处理后,普通水组和富氢水组小鼠的FGF21表达均升高,但富氢水组的表达水平显著更高:相对于基线,普通水组FGF21表达约升高17倍,而富氢水组约升高26倍。为进一步验证该效应,本研究检测了FGF21的下游靶基因——过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)的表达水平。正如预期,对乙酰氨基酚可诱导PGC-1α表达,而氢气可增强这种诱导效应(图4B):相对于基线,普通水组PGC-1α表达约升高4.9倍,富氢水组约升高8.8倍。上述结果表明,富氢水可增强对乙酰氨基酚诱导的糖尿病小鼠FGF21表达及其下游通路激活。 图4 氢气可增强对乙酰氨基酚诱导的肝保护基因表达 小鼠在给予对乙酰氨基酚(375 mg/kg)或溶媒前,先饮用富氢水或普通水两周。注射对乙酰氨基酚3小时后收集肝脏样本。(A)肝脏FGF21的mRNA表达水平。(B)肝脏PGC-1α的mRNA表达水平。数据以“相对于溶媒处理的普通水组小鼠的倍数变化”表示。误差线表示均值±标准差(每组n = 8-10)。*p < 0.05,**p < 0.01。
图4 氢气可增强对乙酰氨基酚诱导的肝保护基因表达 小鼠在给予对乙酰氨基酚(375 mg/kg)或溶媒前,先饮用富氢水或普通水两周。注射对乙酰氨基酚3小时后收集肝脏样本。(A)肝脏FGF21的mRNA表达水平。(B)肝脏PGC-1α的mRNA表达水平。数据以“相对于溶媒处理的普通水组小鼠的倍数变化”表示。误差线表示均值±标准差(每组n = 8-10)。*p < 0.05,**p < 0.01。
3.4 富氢水可减轻对乙酰氨基酚诱导的氧化应激
本团队此前利用表达redox敏感型绿色荧光蛋白(roGFP)的糖尿病小鼠进行研究发现:基线状态下,糖尿病小鼠胞质redox状态与瘦型对照小鼠相当,但对乙酰氨基酚注射1小时后,胞质redox状态显著氧化;而糖尿病小鼠线粒体redox状态在基线时已呈中度氧化,对乙酰氨基酚处理后进一步加剧[31]。本研究中,小鼠在给予对乙酰氨基酚前先饮用富氢水两周,注射对乙酰氨基酚1小时后,利用roGFP生物传感器评估肝脏redox状态——通过检测roGFP在405 nm和470 nm激发光下的荧光强度,计算氧化状态。彩色编码图像显示,对乙酰氨基酚可导致胞质和线粒体均发生显著氧化(图5A,左图;图5B,左图)。定量分析结果表明,富氢水可显著抑制胞质氧化(图5A,右图),同时也能减轻线粒体氧化应激(图5B,右图);值得注意的是,富氢水还可改善基线状态下的线粒体redox状态。上述结果表明,富氢水可减轻对乙酰氨基酚诱导的胞质和线粒体氧化应激。

图5 氢气可减轻对乙酰氨基酚诱导的肝脏氧化应激** 小鼠在给予对乙酰氨基酚(375 mg/kg)或溶媒前,先饮用富氢水或普通水两周。注射对乙酰氨基酚1小时后,麻醉状态下利用roGFP小鼠评估redox状态,检测肝脏在405 nm和470 nm激发光下的荧光强度。(A)胞质redox状态的彩色编码图像及定量分析。(B)线粒体redox状态的彩色编码图像及定量分析。荧光比值(405 nm/470 nm)反映氧化水平。误差线表示均值±标准差(每组n = 6)。*p < 0.05。
3.5 N-乙酰半胱氨酸(NAC)不影响成纤维细胞生长因子21(FGF21)的表达
接下来,我们比较了氢气(H₂)与N-乙酰半胱氨酸对肝脏FGF21表达的影响。小鼠先饮用富氢水两周,随后在给予对乙酰氨基酚(APAP)前30分钟腹腔注射N-乙酰半胱氨酸,该时间点通过预实验确定(图6A)。尽管在临床场景中,N-乙酰半胱氨酸通常在对乙酰氨基酚过量后给药,且许多小鼠研究也采用类似的“给药后处理”方案,但本研究旨在考察N-乙酰半胱氨酸对氧化应激的影响——在本实验模型中,对乙酰氨基酚给药后30分钟内即会产生氧化应激。已有研究表明,早期给予N-乙酰半胱氨酸对小鼠具有保护效果,例如James等人(对乙酰氨基酚给药前即刻给药)和Salama等人(对乙酰氨基酚给药前1小时给药)的研究均证实了这一点[46,47]。基于这些报道,我们通过预实验确定,在本模型中,对乙酰氨基酚给药前30分钟是N-乙酰半胱氨酸的最佳给药时间点。
对乙酰氨基酚给药3小时后,检测FGF21的mRNA水平。结果显示,N-乙酰半胱氨酸对乙酰氨基酚诱导的FGF21表达无显著影响(图6B);类似地,两组间过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)的表达也无显著差异(图6C)。上述结果表明,在糖尿病小鼠中,对乙酰氨基酚过量后,N-乙酰半胱氨酸不影响FGF21基因的表达。
图6 N-乙酰半胱氨酸不影响FGF21基因的表达**
(A)氢气与N-乙酰半胱氨酸联合治疗的实验流程图:小鼠饮用富氢水或普通水两周,禁食过夜(16小时);在给予对乙酰氨基酚(375 mg/kg,腹腔注射)或溶媒(生理盐水)前30分钟,腹腔注射N-乙酰半胱氨酸(300 mg/kg)。在预设时间点进行检测:对乙酰氨基酚给药1小时后,麻醉小鼠并剖腹暴露肝脏,定量检测肝脏氧化应激水平;3小时后,收集肝脏样本用于mRNA表达分析;6小时后,收集肝脏和血液样本,进行肝损伤评估(组织病理学检查和血浆转氨酶检测)。(B)肝脏FGF21的mRNA表达水平。(C)肝脏PGC-1α的mRNA表达水平。数据以“相对于对乙酰氨基酚处理的对照组小鼠的倍数变化”表示。误差线表示均值±标准差(每组n = 8)。††p < 0.01,与对乙酰氨基酚处理组(APAP)相比;p < 0.01,与对乙酰氨基酚+N-乙酰半胱氨酸处理组(APAP+NAC)相比。
3.6 氢气与N-乙酰半胱氨酸对氧化应激的保护作用存在差异
为进一步明确氢气的作用机制,我们比较了其与N-乙酰半胱氨酸对乙酰氨基酚诱导氧化应激的影响。小鼠先饮用富氢水两周进行预处理,N-乙酰半胱氨酸则在对乙酰氨基酚给药前30分钟给予。对乙酰氨基酚给药1小时后,利用redox敏感型绿色荧光蛋白(roGFP)生物传感器评估氧化应激水平。结果显示,氢气可显著降低对乙酰氨基酚诱导的胞质和线粒体氧化应激(图7);与之相反,N-乙酰半胱氨酸虽能有效降低胞质氧化应激,但对线粒体氧化应激无显著影响。
值得注意的是,氢气与N-乙酰半胱氨酸联合处理对氧化应激的降低效果更显著:胞质redox比值方面,N-乙酰半胱氨酸单独处理组为1.65±0.19,联合处理组为1.41±0.18(p = 0.0483);线粒体redox比值方面,N-乙酰半胱氨酸单独处理组为1.75±0.13,联合处理组为1.55±0.16(p = 0.0435)。上述结果表明,氢气与N-乙酰半胱氨酸通过不同的亚细胞机制发挥保护作用,且二者联合使用具有协同效应。
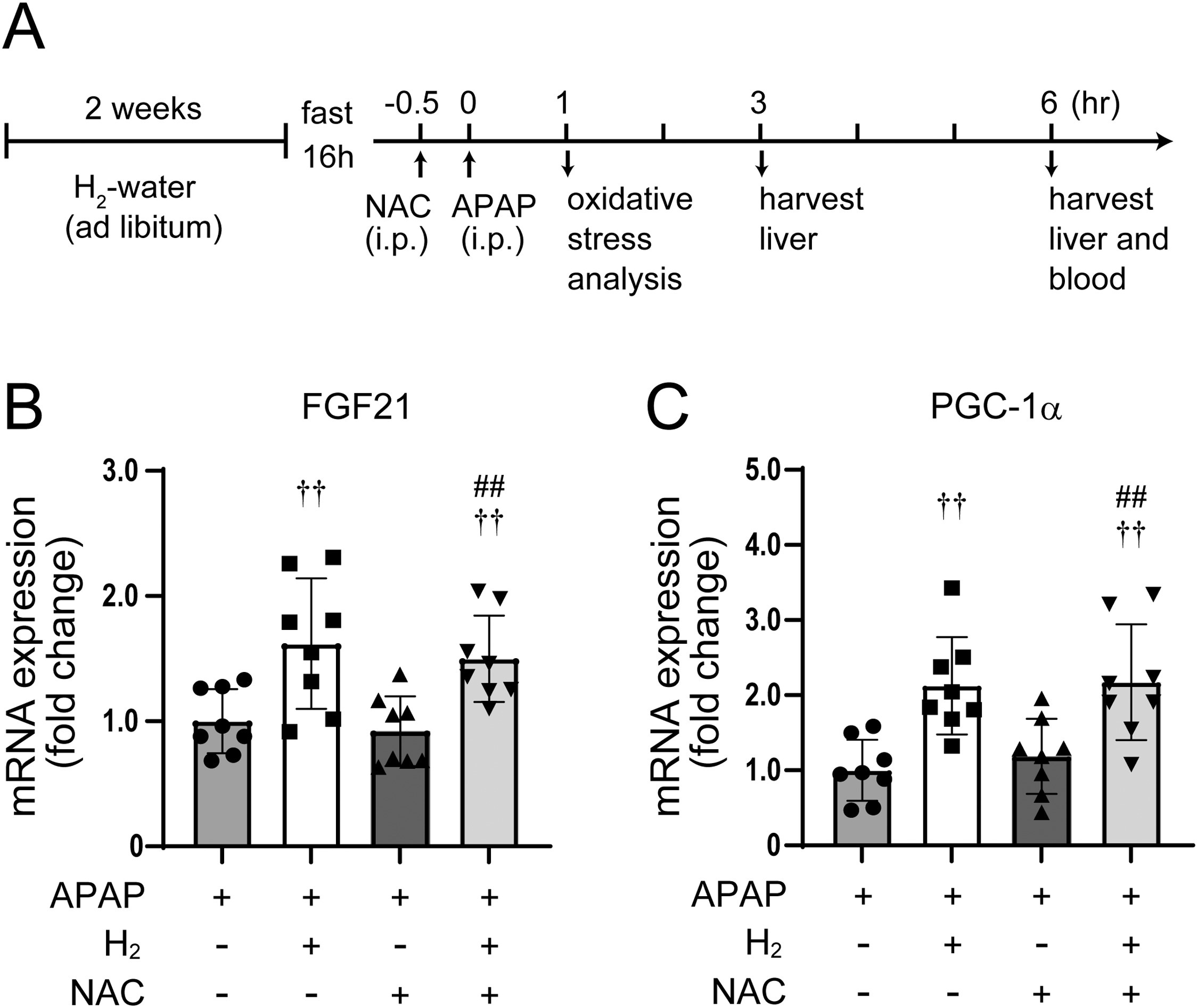
图7 氢气与N-乙酰半胱氨酸对乙酰氨基酚诱导的肝脏氧化应激作用存在差异**
小鼠先饮用富氢水或普通水两周进行预处理;在给予对乙酰氨基酚(375 mg/kg)前30分钟,腹腔注射N-乙酰半胱氨酸(300 mg/kg)。对乙酰氨基酚给药1小时后,麻醉表达roGFP的小鼠,并记录肝脏荧光信号。(A)肝脏的彩色编码图像。(B)肝脏redox状态的定量分析(荧光比值405/470 nm)。误差线表示均值±标准差(每组n = 6)。†p < 0.05,†††p < 0.001,与对乙酰氨基酚处理组(APAP)相比;¶p < 0.05,与对乙酰氨基酚+氢气处理组(APAP+H₂)相比;p < 0.05,与对乙酰氨基酚+N-乙酰半胱氨酸处理组(APAP+NAC)相比。
3.7 氢气与N-乙酰半胱氨酸联合使用对乙酰氨基酚诱导的肝损伤具有更优保护效果
为评估氢气与N-乙酰半胱氨酸的协同作用,我们检测了联合处理后的肝损伤情况。小鼠在给予对乙酰氨基酚前,先自由饮用富氢水(氢气浓度0.6-0.8 mM)两周;N-乙酰半胱氨酸(300 mg/kg)则在对乙酰氨基酚给药前30分钟腹腔注射。对乙酰氨基酚给药当天,富氢水组与普通水组小鼠的平均饮水量分别为25.1±6.3 mL和25.1±5.8 mL。
对乙酰氨基酚给药6小时后,通过组织病理学和生化指标评估肝损伤程度。组织病理学分析显示,氢气与N-乙酰半胱氨酸联合处理在减轻肝损伤方面的效果优于单独使用任一物质(图8A)。血浆丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)水平进一步证实了这种协同保护效应:尽管氢气或N-乙酰半胱氨酸单独处理均能显著降低酶活性,但联合处理的降低效果更显著——ALT方面,N-乙酰半胱氨酸单独处理组为8568±1236 U/L,联合处理组为6141±1565 U/L(p = 0.0025);AST方面,N-乙酰半胱氨酸单独处理组为9680±1376 U/L,联合处理组为6693±1745 U/L(p = 0.0011)(图8B、8C)。上述结果表明,在糖尿病小鼠中,氢气与N-乙酰半胱氨酸联合使用对乙酰氨基酚诱导的肝损伤具有协同保护作用。

图8 与单独使用N-乙酰半胱氨酸相比,氢气与N-乙酰半胱氨酸联合使用对乙酰氨基酚诱导的肝损伤保护效果更优
小鼠在给予对乙酰氨基酚(375 mg/kg)或溶媒前,先饮用富氢水或普通水两周;在对乙酰氨基酚给药前30分钟,腹腔注射N-乙酰半胱氨酸(300 mg/kg)。对乙酰氨基酚给药6小时后,收集血液和肝脏样本。(A)肝脏组织苏木精-伊红(H&E)染色结果:放大倍数40倍(比例尺500 μm)和100倍(比例尺200 μm)。(B)血浆ALT活性。(C)血浆AST活性。误差线表示均值±标准差(每组n = 8-10)。†p < 0.05,†††p < 0.001,与对乙酰氨基酚处理组(APAP)相比;p < 0.001,与对乙酰氨基酚+氢气处理组(APAP+H₂)相比;p < 0.01,与对乙酰氨基酚+N-乙酰半胱氨酸处理组(APAP+NAC)相比。
4 讨论(Discussions)
本研究在2型糖尿病小鼠模型中,评估了氢气对乙酰氨基酚诱导肝毒性的缓解效果。结果表明,饮用富氢水可减轻对乙酰氨基酚过量引起的急性肝损伤,具体机制包括:降低氧化应激、抑制c-Jun氨基末端激酶(JNK)激活及线粒体核酸酶释放、上调具有肝保护作用的激素FGF21的表达。此外,氢气与N-乙酰半胱氨酸联合使用的保护效果优于单独使用N-乙酰半胱氨酸,这提示氢气在糖尿病患者对乙酰氨基酚过量治疗中具有潜在应用价值。
氢气过去一直被认为是一种惰性气体,但在过去二十年中,大量临床前和临床研究证实其具有治疗和预防作用[40],因此受到广泛关注。氢气疗法在多种疾病的治疗中显示出潜力,包括糖尿病和非酒精性脂肪肝(NAFLD)[48,49]。氢气的给药途径多样,包括饮用富氢水、注射富氢生理盐水或吸入氢气。临床研究表明,饮用富氢水可改善2型糖尿病(T2DM)或糖耐量异常患者的脂质和糖代谢[50];类似地,吸入氢气也被证实可改善2型糖尿病患者的血糖控制、血脂水平和胰岛素敏感性[51,52]。对于非酒精性脂肪肝患者,饮用富氢水和吸入氢气均能减少肝脏脂肪堆积、改善肝功能[53,54]。
我们此前的研究发现,在遗传性糖尿病db/db小鼠中,饮用富氢水可降低肝脏氧化应激、改善脂肪肝症状[34]。基于这一观察,我们提出假设:富氢水也可在该糖尿病模型中预防对乙酰氨基酚诱导的肝损伤。正如之前报道的那样,即使未暴露于对乙酰氨基酚,db/db小鼠的血浆ALT和AST水平也高于瘦型同窝小鼠[31]。本研究中,饮用富氢水显著降低了这些酶的基线水平,这提示糖尿病相关的肝损伤得到了缓解。对乙酰氨基酚给药后,富氢水显著抑制了肝损伤标志物的急剧升高。这些结果证实,在糖尿病小鼠对乙酰氨基酚中毒模型中,氢气具有肝保护潜力。
线粒体氧化应激是对乙酰氨基酚诱导急性肝损伤的关键因素[9,10,11]。Mito-Tempo是一种线粒体靶向性超氧化物歧化酶(SOD)模拟物,与亲脂性阳离子TPP+偶联[55],研究证实其可通过选择性清除线粒体活性氧(ROS),对乙酰氨基酚诱导的肝毒性发挥保护作用[26,27,56]。由于分子体积小,氢气能快速扩散穿过细胞膜和线粒体膜[57],清除羟自由基并保护线粒体免受氧化损伤[38],且已有研究表明氢气在多种病理条件下可维持线粒体功能[58]。本研究中,氢气有效抑制了对乙酰氨基酚过量诱导的线粒体氧化应激,并阻止了后续的JNK激活和线粒体核酸酶释放,这进一步阐明了其保护机制。
除抗氧化能力外,氢气还可通过多种途径发挥广泛的生物学效应[39,59]。通过直接清除羟自由基,氢气可阻断自由基链式反应,减少4-羟基-2-壬烯醛(4-HNE)等脂质过氧化产物的生成[38,39]。由于4-HNE在信号转导中作为第二信使发挥重要作用,氢气对其的清除可能有助于恢复包括FGF21在内的基因表达[41]。FGF21是一种肝脏激素,对2型糖尿病、脂肪肝等代谢性疾病具有肝保护作用[60]。研究表明,对乙酰氨基酚过量后,在明显肝损伤出现前,FGF21的表达即会上调[29];外源性给予FGF21可减轻小鼠对乙酰氨基酚诱导的肝损伤[28,29],而FGF21基因敲除小鼠对乙酰氨基酚毒性的敏感性显著增加,这凸显了FGF21在肝保护中的关键作用[29]。在db/db小鼠中,FGF21的表达水平显著低于瘦型对照小鼠,但饮用富氢水可恢复其表达[34]。本研究中,饮用富氢水增强了对乙酰氨基酚诱导的肝脏FGF21表达,这提示该激素的上调是氢气发挥肝保护作用的机制之一。
尽管N-乙酰半胱氨酸是临床批准的对乙酰氨基酚过量解毒剂,但仍需补充或替代治疗药物。N-乙酰半胱氨酸在对乙酰氨基酚毒性早期给药时效果最佳,其主要作用机制是补充谷胱甘肽(GSH)储备,但该药的治疗窗口狭窄,延迟给药会导致疗效下降[20]。本研究结果显示,氢气通过与N-乙酰半胱氨酸不同的机制发挥保护作用,尤其是在降低线粒体氧化应激方面的能力更为突出。利用表达roGFP的转基因小鼠,我们发现富氢水可显著减轻对乙酰氨基酚过量诱导的胞质和线粒体氧化应激;与之相反,N-乙酰半胱氨酸仅能降低胞质氧化应激,对线粒体redox状态的影响极小。尽管已知N-乙酰半胱氨酸可促进线粒体谷胱甘肽水平的恢复[61],但在糖尿病小鼠面临的严重线粒体氧化应激条件下[31],这种恢复效果可能不足以发挥保护作用。此外,只有氢气(而非N-乙酰半胱氨酸)能增强FGF21的表达,这表明氢气除常规抗氧化作用外,还可能作用于其他独特通路。
FGF21是公认的代谢稳态调节因子,可由多种刺激诱导表达,包括地塞米松、果糖和过氧化物酶体增殖物激活受体α(PPARα)激动剂[60,62,63,64]。本研究中N-乙酰半胱氨酸无法调节FGF21表达的结果,进一步证实了氢气与N-乙酰半胱氨酸在作用机制上的差异。氢气与N-乙酰半胱氨酸联合使用的疗效更优,提示二者存在协同或叠加作用——这可能使联合疗法在对乙酰氨基酚诱导的肝损伤治疗中(尤其是在糖尿病患者中)比单独使用N-乙酰半胱氨酸更具优势。
氢气在人体中的安全性已得到充分证实:过去二十多年来,氢气一直被用于预防减压病[65];近期研究也证实,健康人长期吸入氢气具有安全性[66]。此外,美国食品药品监督管理局(FDA)已将氢气归类为“一般认为安全”(GRAS)物质(GRN第520号)[67],这意味着氢气可作为膳食补充剂而非处方药供人食用。在现有给药途径中,饮用富氢水是一种尤其便捷、无创的选择。未来的研究应重点评估氢气与N-乙酰半胱氨酸联合疗法在对乙酰氨基酚过量治疗中的临床适用性,尤其是在肝损伤易感性更高的糖尿病患者中。
5 结论(Conclusion)
在糖尿病小鼠中,氢气通过降低线粒体氧化应激和上调具有肝保护作用的激素FGF21的表达,对乙酰氨基酚过量诱导的肝损伤发挥保护作用。氢气与N-乙酰半胱氨酸联合使用具有协同效应,其保护效果显著优于单独使用N-乙酰半胱氨酸。鉴于饮用富氢水具有安全性和便捷性,这种联合疗法为糖尿病患者对乙酰氨基酚诱导肝毒性的治疗提供了一种有潜力且切实可行的策略。
https://blog.sciencenet.cn/blog-41174-1509738.html
上一篇:首个慢性疲劳综合征血液检测方法问世
下一篇:氢气2%吸入对体外心肺复苏临床试验方案【哈佛】