博文
氢气对失血性休克效果不理想【202501】  精选
精选
||
氢气不是万能的,即使是有效果的研究,也存在不确定性。这一研究发现2%吸入对猪失血性休克效果不理想。要知道,缺血再灌注损伤是氢气的成名作,2%的氢气吸入也是主打剂量。现在的研究是阴性结果,虽然抗氧化和生存率有一点差异,但不足以支持氢气作为一种疗法的价值。
创伤性死亡是年轻人中意外的死亡原因,会造成重大的社会损失。其中,失血性休克是创伤死亡最常见的可预防原因。主动脉球囊阻断复苏术(REBOA),即通过将球囊导管插入主动脉以控制出血并维持重要器官灌注,作为严重失血性休克的一种复苏方法已受到关注。REBOA会因缺血再灌注损伤(IRI)引发氧化应激,进而导致多器官衰竭和死亡,所以需要应对措施。为避免创伤死亡,进行急性复苏、止血治疗以及重症监护以减轻后续氧化应激是很有必要的。
主动脉阻断的强度取决于球囊阻断的部位(1区或3区)。因此,在1区和3区引发缺血再灌注损伤的器官或部位是不同的。在3区REBOA中,由于腹部器官血流得以保留,缺血再灌注损伤仅发生于下肢。而在1区REBOA中,缺血再灌注损伤也会发生在腹部器官,肠道和肝脏尤其容易受累。据报道,部分REBOA可减轻1区REBOA中的缺血再灌注损伤。
因REBOA - IRI导致的腹部器官损伤可因伴有不可逆乳酸性酸中毒的循环衰竭而致命。针对心脏骤停后综合征全身性缺血再灌注损伤的治疗性低温有助于减轻氧化应激。然而,对于需要REBOA的失血性休克患者来说,这种方法不太可行,因为它会引发低温,而低温、酸中毒和凝血功能障碍构成了创伤致死三联征。因此,针对REBOA后缺血再灌注损伤中的氧化应激,需要新的治疗方法。
吸入氢气疗法作为减轻氧化应激的一种治疗方法,其有效性和安全性已有相关报道。一些动物研究表明,氢气具有抗炎作用,并能减少缺血再灌注损伤过程中产生的活性氧。吸入氢气与减少坏死组织、减轻心脏骤停后综合征、急性心肌梗死、对比剂肾病、失血性休克以及脑梗死等情况相关。近期,临床上也报道了氢气疗法在心脏骤停后综合征(PCAS)中的有效性和安全性。心脏骤停后综合征和REBOA后缺血再灌注损伤的共同点在于循环恢复后都会发生广泛的缺血再灌注损伤。预计吸入氢气疗法可应用于REBOA后缺血再灌注损伤的治疗。
本研究旨在确立吸入氢气疗法作为一种新型辅助治疗手段,用于减轻REBOA后缺血再灌注损伤所导致的氧化应激,并探究阻断时长能否延长至超出标准时间(30 - 45分钟)。我们评估了存活时间、生物标志物、肠道缺血的大体及病理表现,以及REBOA所引发的缺血再灌注损伤情况。对吸入氢气疗法减轻肠道缺血的有效性和安全性进行了研究。
材料与方法
概述
本研究是在一家经认证的动物研究实验室开展的。在开展研究前,已获得研究所动物实验委员会的批准。所有方法均按照相关指南和规定执行。从日本千叶县的Sanesu繁育有限公司获取了10头健康的家猪。我们采用了此前研究中的实验模型(该模型构建了失血性休克模型),以尽量减少技术误差和主观偏差的影响。这些动物在纳入实验方案前需隔离至少7天,并禁食24小时,但可饮水。实验时,这些动物年龄为3 - 4个月,体重在30 - 40千克。
动物准备
清晨,在动物笼内给猪肌肉注射0.06毫克/千克的美托咪定(日本日医工株式会社,福岛县)、0.3毫克/千克的咪达唑仑(日本安斯泰来制药公司,东京)以及0.08毫克/千克的阿托品(日本三菱田边制药株式会社,大阪)进行术前用药。在动物手术室确认动物镇静后进行气管插管,随后采用1% - 3%的七氟烷维持麻醉。对动物进行机械通气,潮气量设定为7 - 10毫升/千克,呼吸频率为10 - 15次/分钟,以将呼气末二氧化碳维持在40 ± 5毫米汞柱。在实验过程中,根据氧合情况调节吸入氧浓度。氧合目标是将血氧饱和度维持在95% - 99%。将猪放置在设定为39℃的保温毯上以维持体温。
手术操作及REBOA置入
全身麻醉诱导后,暴露右侧颈部,将动脉导管插入右颈动脉,用于监测近端压力以及采集血液样本。随后在右颈静脉插入中心静脉导管。在右股动脉置入10弗鞘管,以便插入7弗的REBOA导管(Rescue Balloon®;日本东海医疗产品公司,爱知县)。10弗鞘管的侧臂用于监测远端压力。根据球囊充气时远端脉压消失的点来确定REBOA完全阻断。输注醋酸林格氏液,当血压下降时进行推注。将REBOA导管置于胸主动脉,使球囊位置保持在1区。固定REBOA导管,在密切监测远端压力的情况下逐渐给球囊充气。我们进行剖腹术以观察肠道的大体情况,并准备在观察阶段获取肠道样本。
失血性休克诱导
通过右股动脉的10弗动脉鞘管,让所有动物在20分钟内失血总量达30毫升/千克(约失血40%)。根据此前的研究,前半部分血量以2.15毫升/千克/分钟的速度抽取,持续7分钟,其余血量以1.15毫升/千克/分钟的速度抽取,持续13分钟。
氢气吸入
将装有含4%氢气和96%氮气混合气体的气瓶连接到麻醉机的吸气端。依据此前的报道,1% - 2%的氢气浓度是安全有效的治疗范围,因此出于技术可行性考虑,我们采用2%的浓度。全身麻醉诱导后,根据潮气量将氢气浓度设定为约2%。换句话说,在容量控制通气时,氢气/氮气混合气体按照潮气量的一半进行调节。
实验时间进程
在REBOA开始前30分钟(T = -30分钟)引入失血性休克。氢气组在主动脉阻断开始的同时启动氢气吸入,而对照组则继续常规通气。从T = 0到T = 60,用REBOA完全阻断主动脉。在T = 60时对球囊放气,对动物进行观察直至T = 240时实施安乐死。通过给予最大剂量的七氟烷以及静脉注射1毫克/千克的氯化钾对动物实施安乐死。在观察阶段,猪接受液体推注以及最大剂量为0.2微克/千克/分钟的去甲肾上腺素,以维持血流动力学(图1)。如果实验动物在处死前因循环衰竭死亡,则记录其存活时间。
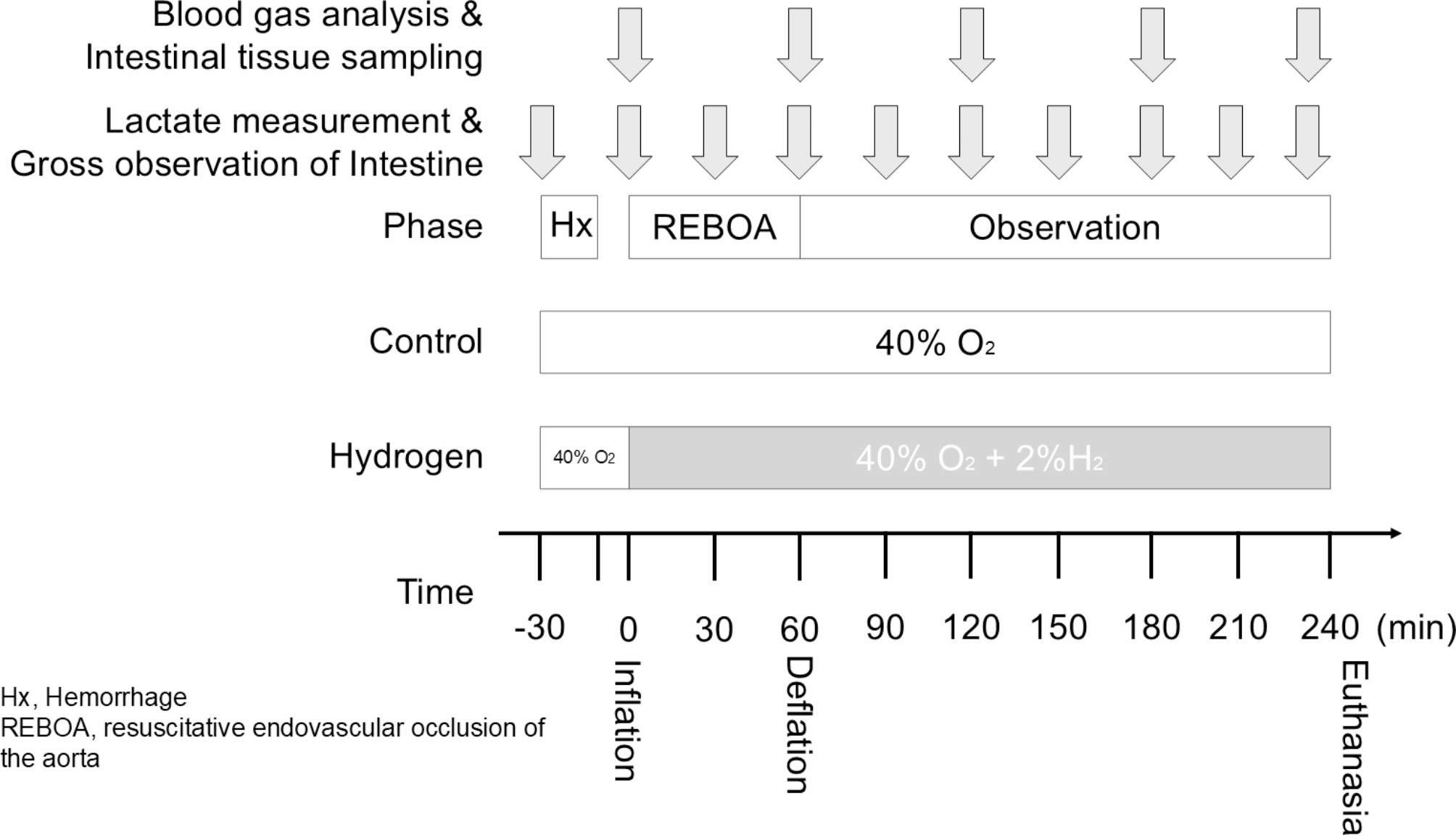
图1实验时间进程。在REBOA开始前30分钟(T = -30分钟)引入失血性休克。氢气组在REBOA充气(T = 0)的同时开始氢气吸入。在T = 60时对球囊放气,对动物进行观察直至T = 240。每60分钟进行一次血气分析和肠道组织采样。每30分钟测量一次血乳酸。
测量与肠道组织取样
在采血前(T = -30)以及从采血开始(T = 0)起每30分钟记录一次血乳酸测量值,并对肠道进行大体观察。在T = 240或动物濒死时(由日本老化控制研究所,日健中外制药有限公司检测)测量血液中的8 - 羟基 - 2’ - 脱氧鸟苷(8 - OHdG,一种氧化应激标志物)。从小肠的三个部位在T = 0、60、120、180和240分钟时进行肠道组织取样。从回肠近端[距盲肠200厘米处]、回肠中部[距盲肠100厘米处]以及回肠远端[距回盲部10厘米处]切取大约20毫米的标本,并在每次取样时收集相邻的近口端肠道部分。对标本的黏膜进行大体观察,并在福尔马林固定后评估病理表现。
肠道组织病理生理变化分级
依据以往报道,肠道组织病理学变化从0级到5级进行分类(补充表1)。绒毛伸展长度定义为视野内三个位置长度的平均值,破坏程度根据主动脉阻断开始前(T = 0)的长度来计算。三名研究人员(YM、YI和YH)选取能在长轴上捕捉到绒毛的视野来测量其长度,进而确定分级。
统计分析
使用适用于Windows系统的GraphPad Prism 6.07(美国加利福尼亚州拉霍亚的GraphPad软件公司)对生物标志物、病理分级以及存活时间进行分析并绘图。采用Kaplan Meier分析法对存活时间进行分析。
结果
对照组和氢气组各有5只动物参与实验。对照组平均体重为37.2千克,氢气组平均体重为37.7千克。两组的基线血气分析结果相似(表1)。对照组中有1头猪在90分钟时死亡,其余猪在整个实验过程中存活。Kaplan - Meier存活分析显示存活时间无显著差异(P = 0.317,对数秩检验)(图2)。在实验期间未观察到与吸入氢气相关的不良事件。
表1 研究动物的基线特征
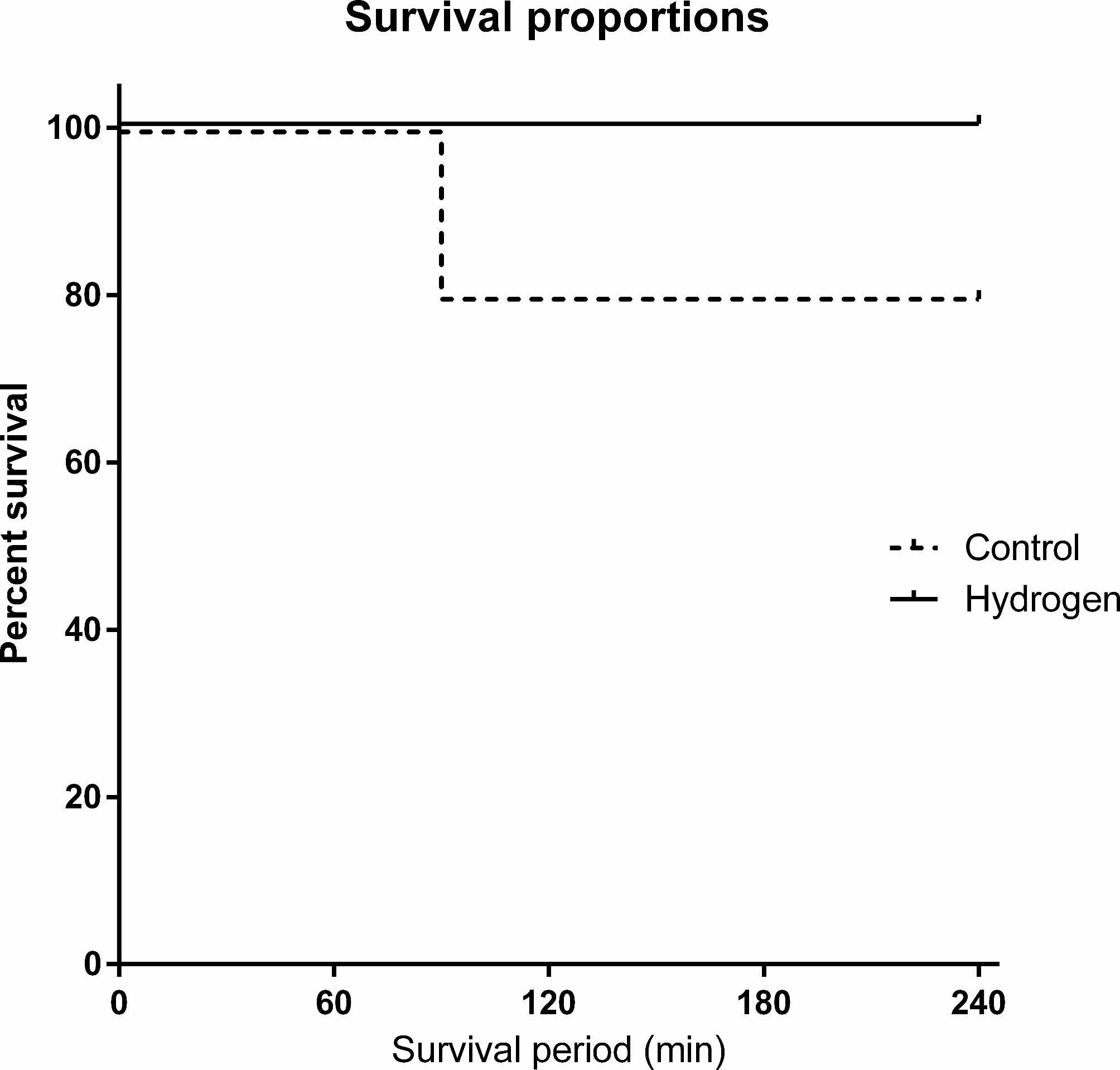
图2存活曲线。对照组中有1头猪在90分钟时死亡,其余猪存活至T = 240。Kaplan Meier存活分析显示无显著差异(P = 0.317,对数秩检验)。
在采血前后(从T = -30到T = 0),对照组和氢气组的平均(标准差)血红蛋白水平分别从11.0(1.5)克/分升下降至8.7(1.4)克/分升以及从12.0(0.9)克/分升下降至9.8(1.0)克/分升(补充1)。乳酸水平从1.2(0.2)毫摩尔/升上升至2.3(1.2)毫摩尔/升以及从1.1(0.3)毫摩尔/升上升至1.6(0.6)毫摩尔/升(从T = -30到T = 0),随后在T = 60时分别达到8.4(2.9)毫摩尔/升和6.3(2.4)毫摩尔/升。乳酸在T = 90时分别达到峰值10.5(4.2)毫摩尔/升和7.6(2.3)毫摩尔/升,之后逐渐下降。尽管随时间变化并无统计学意义,但在阻断期间和放气后的任何时间点,氢气组的乳酸水平往往更低(图3)。钾离子水平在T = 0时分别为4.4(0.3)毫当量/升和4.2(0.1)毫当量/升,随后两组均升高,在T = 60时分别达到6.2(0.7)毫当量/升和5.9(0.4)毫当量/升,在T = 240时分别达到6.6(1.9)毫当量/升和6.4(1.3)毫当量/升(补充2)。两组的钙离子浓度均无明显变化(补充3)。对照组血清8 - OHdG浓度范围为0.12 - 0.32纳克/毫升,氢气组为0.11 - 0.19纳克/毫升(图4)。
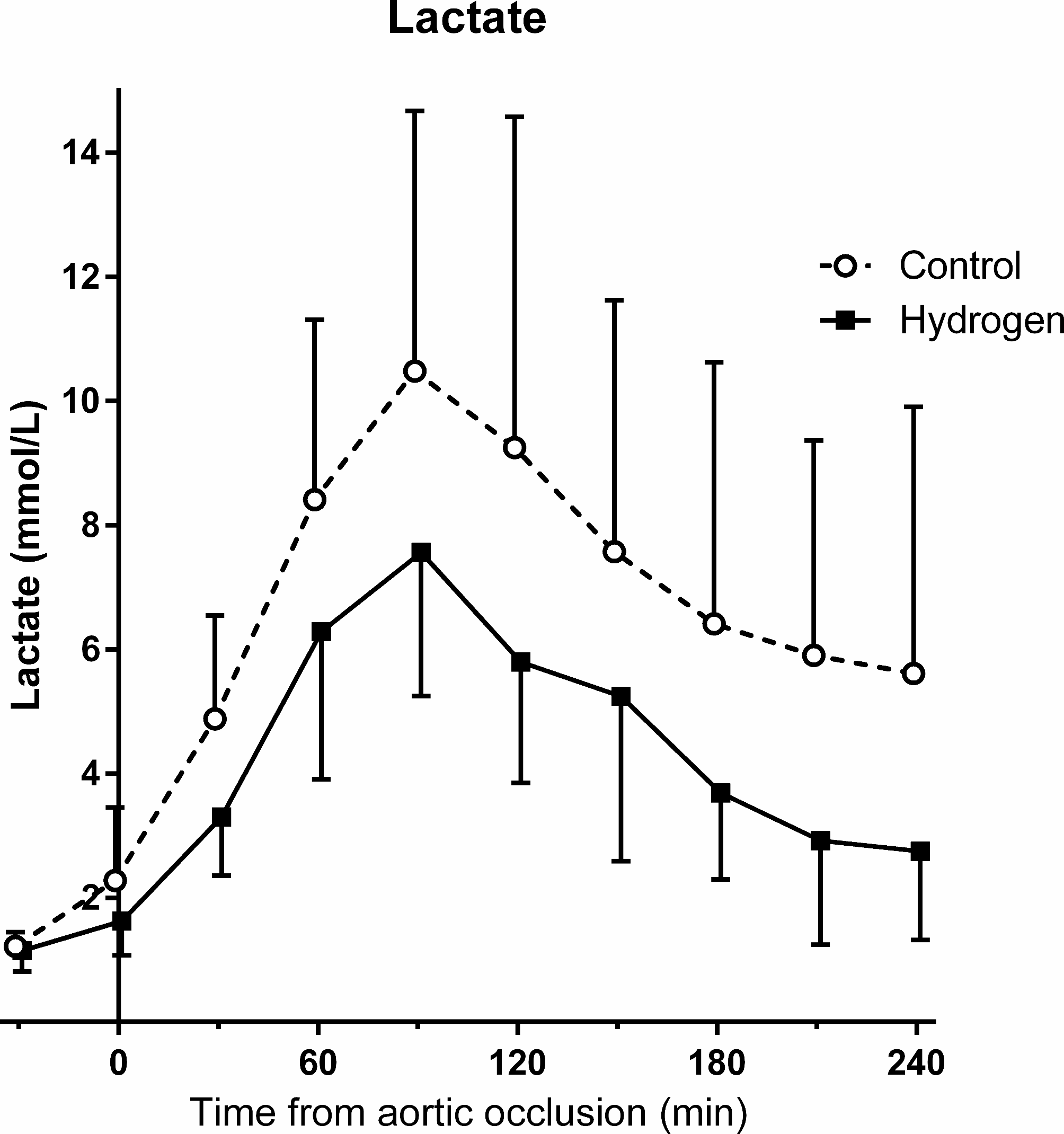
图3血清乳酸水平。在阻断期间和放气后的任何时间点,氢气组的乳酸水平往往更低。
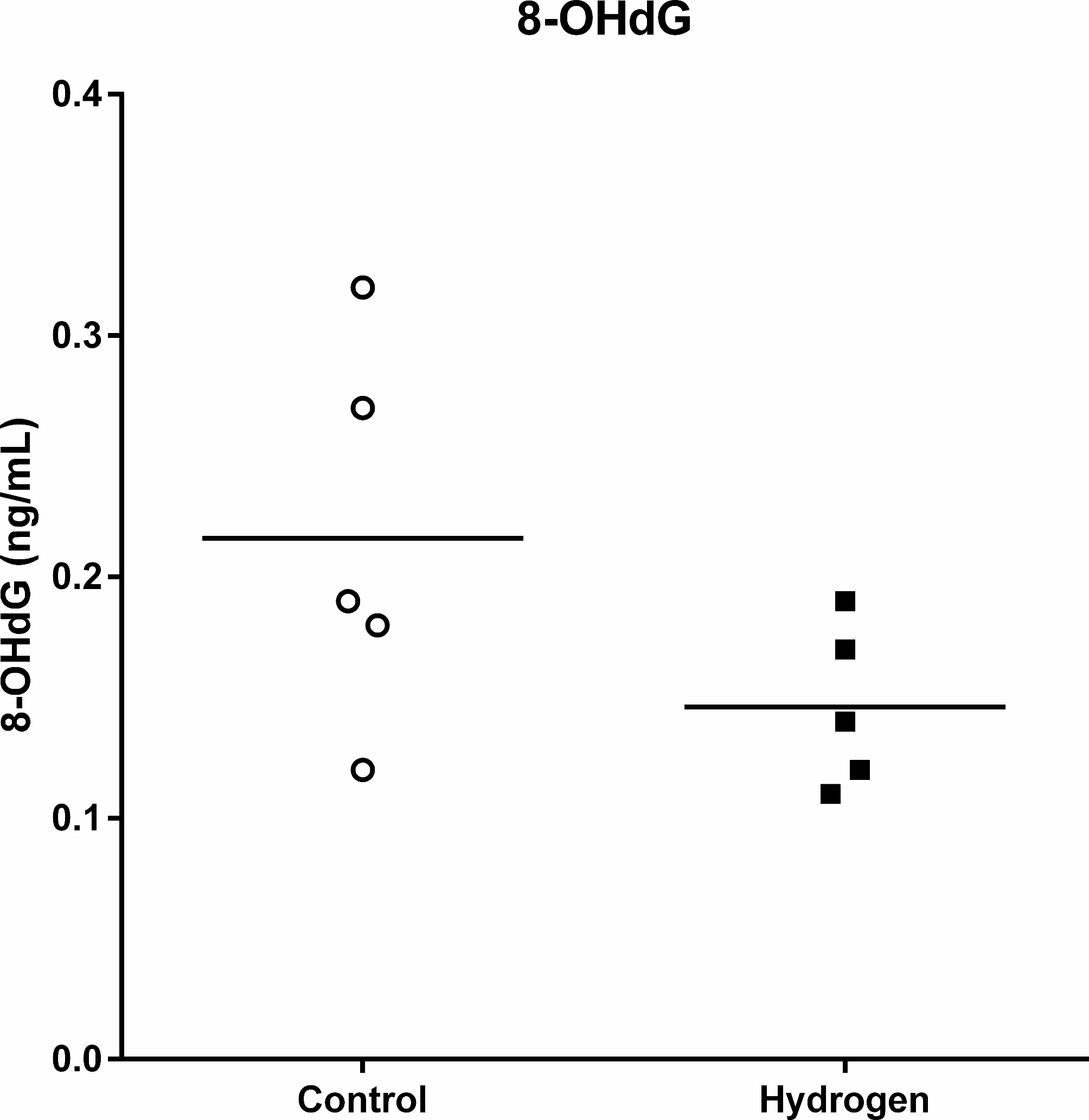
图4血清8 - 羟基 - 2’ - 脱氧鸟苷水平。对照组血清8 - 羟基 - 2’ - 脱氧鸟苷(8 - OHdG)浓度分别为0.12、0.18、0.19、0.27、0.32纳克/毫升,氢气组为0.11、0.12、0.14、0.17、0.19纳克/毫升。
在阻断期间,腹部大体外观变为淡蓝色至白色,放气后恢复正常(补充4)。回肠绒毛在REBOA充气期间以及再灌注后遭到破坏(补充5)。从T = 120到T = 240,氢气组回肠病理分级的变化趋势更低。这种趋势在回肠近端较为明显,但无显著差异(图5,补充图6、7)。
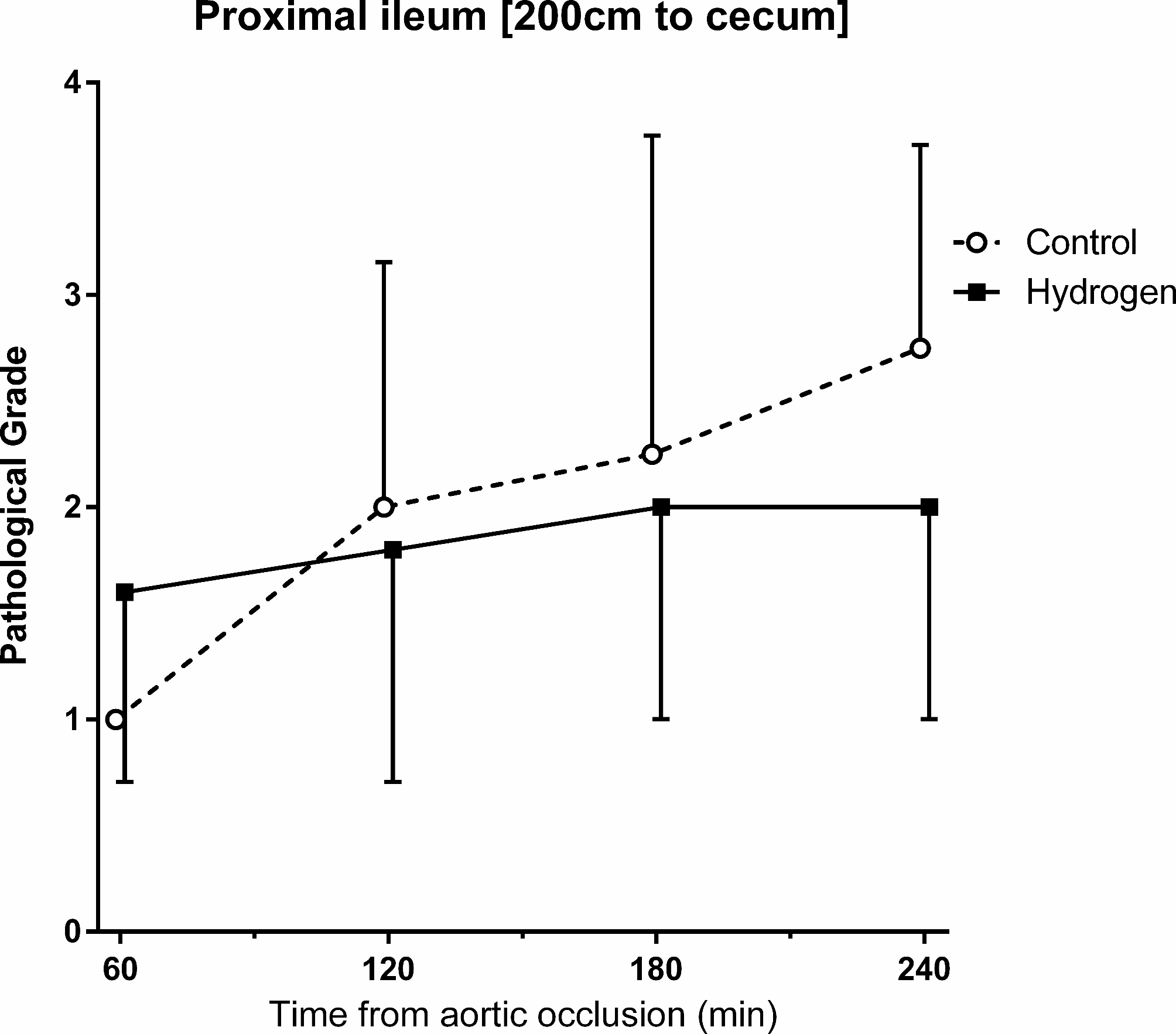
图5回肠的病理变化。从T = 120到T = 240,氢气组回肠近端的病理分级变化趋势更低。在T = 240时,对照组的平均(标准差)分级为2.8(1.0),氢气组为2.0(1.0)。
讨论
我们构建了失血性休克后采用REBOA完全阻断主动脉60分钟的实验动物模型,并观察了后续的缺血再灌注损伤情况。利用该模型,对吸入氢气组和未吸入氢气组的存活时间、乳酸和8 - OHdG等生物标志物以及回肠病理分级变化进行了比较。氢气组的存活时间和存活率虽稍好但无显著差异(对照组与氢气组,4/5与5/5;对数秩检验,P = 0.317)。尽管在血乳酸、8 - OHdG以及病理变化方面观察到稍好的趋势,但两组的各项参数均未显示出显著差异。未出现归因于吸入氢气的不良事件。
据报道,REBOA导致的膈下缺血及缺血再灌注损伤会引发全身性炎症、器官损伤和乳酸性酸中毒。腺苷、利多卡因和镁(ALM)被报道为减轻REBOA - IRI的可能治疗手段。在20%失血性休克且REBOA 45分钟后诱导的猪缺血再灌注损伤模型中,ALM给药降低了血浆细胞因子水平(白细胞介素 - 2、白细胞介素 - 4和白细胞介素 - 10)以及白细胞介素1受体拮抗剂(IL1RN)、哺乳动物雷帕霉素靶蛋白(MTOR)和溶酶体相关膜蛋白3(LAMP3)的肝脏基因表达,但并未改善乳酸水平。在猪心脏骤停模型中,吸入氢气的动物乳酸水平有轻微恶化情况。在本研究中,在40%失血性休克且主动脉阻断60分钟后诱导的猪缺血再灌注损伤模型里,我们观察到氢气组血清乳酸水平升高幅度有减轻的趋势。吸入氢气或许可缓解由1区REBOA导致的广泛器官缺血及缺血再灌注损伤相关的高乳酸血症。
吸入氢气疗法可减轻心脏骤停复苏患者血清中的8 - OHdG浓度以及大鼠肠道缺血再灌注损伤模型中的相关情况。在大鼠心脏骤停复苏模型中,氢气组的存活时间更长。本研究观察到氢气吸入组有8 - OHdG浓度更低以及存活时间更长的趋势,但无显著差异。与其他氧化应激病理情况不同,吸入氢气疗法可能不足以缓解REBOA - IRI中的全身性氧化应激。
在由肠系膜上动脉阻断导致的大鼠肠黏膜缺血再灌注损伤模型中,观察到氢气组有轻度上皮剥脱现象。在本研究中,氢气组的病理变化稍轻,尤其在回肠近端更为明显,但在各部位均未显示出显著差异。因此,吸入氢气疗法可能无法有效缓解REBOA - IRI造成的局部组织损伤。对于吸入氢气的效果以及黏膜损伤程度为何会因小肠部位不同而存在差异,目前尚无合理的解释。
本研究存在若干局限性。首先,在以往关于猪的REBOA实验模型研究中,有报道称在进行复苏的情况下阻断90分钟后仍有存活情况。有可能猪对缺血的耐受性比人类更强,且阻断时长以及后续缺血再灌注损伤的强度与人类不同。由于物种间差异,人与猪模型的结果可能存在潜在的相关性缺失。其次,出血时间以及REBOA部署时间可能比实际创伤情况更短,生理损伤可能更为显著。第三,生物标志物、存活曲线以及病理变化的各项改变均无统计学意义。这种趋势可能也受个体差异以及样本量有限的影响。吸入氢气可能无法有效减轻REBOA后缺血再灌注损伤。尽管存在这些局限性,但仍有必要在吸入氢气方面开展进一步研究,以便为REBOA - IRI的安全性和可行性积累科学证据。
结论
在失血性休克模型中,吸入氢气疗法在REBOA后的存活情况、乳酸水平、8 - OHdG以及肠道黏膜损伤方面未显示出显著差异。尽管其可能会稍微降低死亡率、生物标志物水平以及肠道病理改变,但吸入氢气疗法可能不足以有效缓解REBOA后缺血再灌注损伤。
https://blog.sciencenet.cn/blog-41174-1467061.html
上一篇:关节炎微环境调控的产氢纳米颗粒
下一篇:高被引次数的“早熟”型科研新手数量激增