博文
氢气预防间歇呼停血管损伤研究细节【加拿大2】
||
氢气预防呼吸暂停后血管损伤研究细节【加拿大】
第一部分:富氢水减轻睡眠呼吸暂停模型鼠血管损伤【加拿大硕士论文】1 -
这是加拿大UC的一篇硕士论文实验方法部分。
第2章:材料与方法
2.1 动物实验
间歇性缺氧方案已获得加拿大不列颠哥伦比亚大学动物护理中心的批准(证书编号# A21-0309)。二十只雄性C57BL/6小鼠(6周龄,购自Charles River)在UBC的动物护理设施(临床发现中心,PDC)中适应一周。然后,将小鼠分为四组,分别进行以下处理:1) 间歇性空气和普通水(IARW),2) 间歇性空气和富氢水(HRW Rejuvenation)(IAHRW),3) 间歇性缺氧和普通水(IHRW),以及4) 间歇性缺氧和富氢水(IHHRW)。
2.2 间歇性缺氧实验
小鼠被安置在定制的笼子里,笼子底部均匀分布有孔洞,以允许从所有侧面均匀的空气流动。一个气体控制输送系统调节笼中氮气和压缩空气的流量。吸入氧分数(FiO2)通过流量调节器、氧气传感器和可编程电磁阀的组合控制,允许在广泛的间歇性缺氧设置范围内进行调整。由于小鼠是夜行性动物,它们在光照周期内暴露于间歇性缺氧(IH)。在IH阶段,通过N2气体将FiO2从~21%(环境氧气水平)降至5-6%(最低点),持续30秒,随后是30秒的压缩空气,使FiO2恢复到~21%。每小时有60个循环。IH组的小鼠在进行主要实验前一周逐渐适应低氧水平,最低氧气水平从21%逐步降到18%,到15%,到12%,到9%,再到5%。主要实验开始时,IH组的小鼠每天暴露于间歇性缺氧8小时(上午9点至下午5点),持续8周。对于IA组使用类似的方式,不同的是输送压缩空气。
2.3 HRW制备
HRW Rejuvenation片主要成分为镁(80毫克),其他成分包括苹果酸、葡萄糖、酒石酸、己二酸和硬脂酸钠。元素镁与水反应生成氢气,反应式如下:
Mg + H2O → H2 + Mg(OH)2。
有机酸中和了生成的氢氧化镁,并且还催化反应速率。每个Sodastream瓶(615ml)中放入一片半药片,加入几乎满的热饮用水(留出1/4英寸空间)。瓶子倒置存放在冰箱中24小时后,氢气浓度达到5.3 ppm。然后将HRW小心地倒入动物饮水瓶(250 ml)中。基于HRW两小时半衰期,每4-6小时更换一次HRW,大约在上午9点、下午1点、下午6点、晚上11点和早上5点,以确保一天中的大多数时间里氢气的最低浓度超过1 ppm。
(我的建议是让动物提前学习间隔饮水习惯,每天定时给水,这样能足够好维持氢气的浓度,也符合人类饮用氢水的习惯做法)
2.4 动物监测和安乐死
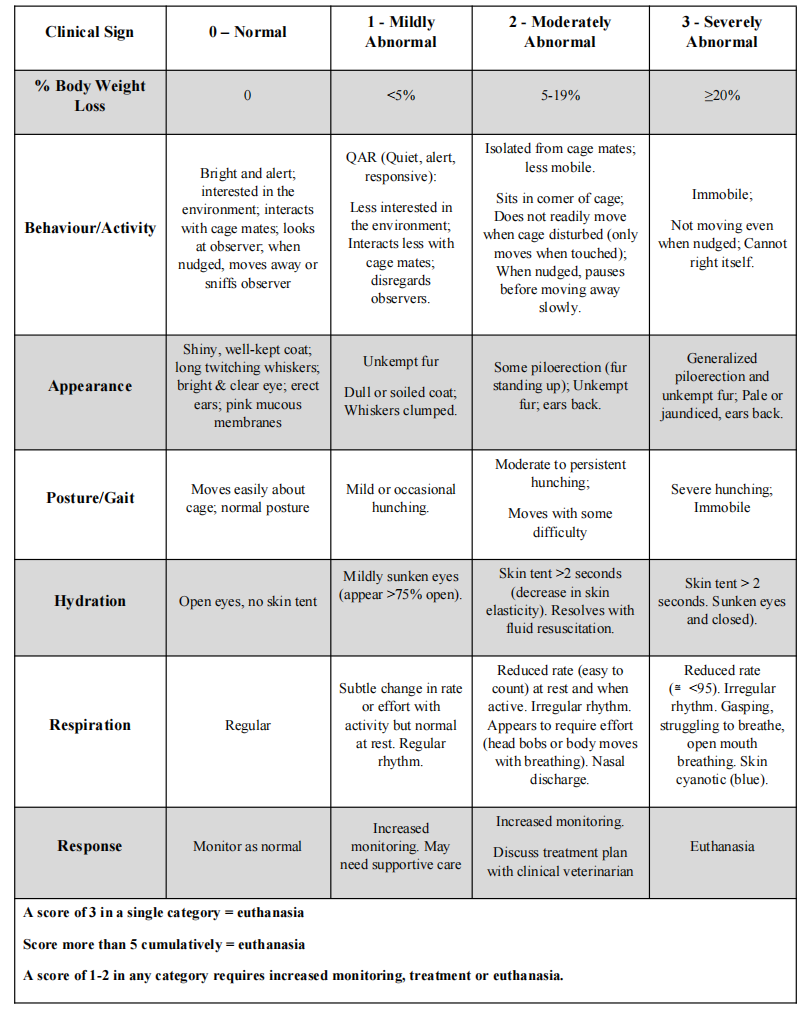
每周两次监测以下参数:体重、行为/活动、外观、姿势/步态、水分摄入、呼吸和反应。任何类别中的评分为1或2(表2.1)会导致增加监测,包括每日称重和支持性护理(例如补充热量和凝胶食物)。任何单一类别中的评分为3或累计评分> > 5在接受适当的支持性护理后,将立即进行安乐死。根据大学动物护理中心(ACC)指南,使用吸入性麻醉剂异氟烷(5%),然后是二氧化碳对动物进行安乐死。
Table 2.1: General monitoring of animals
2.5 记录水消耗量
在8周内随机7天评估每组的水消耗量。通过使用量筒测量上午9点至下午1点、下午1点至下午6点、下午6点至晚上11点、晚上11点至早上5点和早上5点至上午9点之间RW或HRW瓶中水量的变化来计算水消耗量。
2.6 尿液收集
每只动物在正常空气或间歇性缺氧2个月后,放入一个灭菌的干燥空笼中进行尿液收集。动物在干净的笼子里四处走动并排尿。一旦排尿,它们立即被送回到自己的笼子中。用移液管吸取排出的尿液,转移到收集管中,并在4°C下以5000g离心20分钟。收集上清液并储存在-20°C,以便进一步进行酶联免疫吸附试验(ELISA)分析。
2.7 血浆采集
在动物被处死后立即,用肝素化注射器从每只小鼠心脏穿刺抽取约0.7毫升新鲜血液。然后将血液转移到锂肝素涂层管(BD Vacutainer 3 ml)中,并在4°C下以3000g离心10分钟。然后提取血浆并储存在-80°C,以备进一步测量。
2.8 组织采集
小心分离胸主动脉,并将其浸入冰冷的生理盐水溶液(PSS)中备用。收集肾脏并用液氮快速冷冻,然后储存在-80°C以备进一步分析。
2.9 钢丝肌图
将胸主动脉切成2毫米段,安装在钢丝肌图仪上测量等长张力(DMT 620M, Danish Myotechnology, Aarhus, Denmark)。每个肌图仪室含有6毫升PSS(成分为:NaCl (7.68 g/L), KCl (0.37 g/L), NaH2PO4.H2O (0.16 g/L), MgCl2.6H2O (0.24 g/L), NaHCO3 (2.1 g/L), CaCl2.2H2O (0.37 g/L), 葡萄糖(0.99 g/L)),保持在37°C和pH 7.4,持续供应95% O2和5% CO2气体。通过等摩尔替换PSS中的NaCl制备高KCl溶液。动脉环在拉伸到最佳张力(5.5 mN)前平衡20分钟。然后在用80 mM KCl刺激前再平衡15分钟。为了测定内皮依赖性血管舒张,动脉环先用次最大浓度的苯肾上腺素(PE, 1 μM, Sigma)预收缩,然后累积添加乙酰胆碱(ACh, Sigma)的对数浓度(10−9 - 10−5 M)。为了确定基础一氧化氮的产生,构建两条连续的PE浓度-反应曲线:一条在没有L-NAME的情况下,另一条在存在Nω-硝基-l-精氨酸甲酯盐酸盐(L-NAME, 10−4 M, Sigma;L-NAME是内皮型一氧化氮合酶(eNOS)抑制剂)的情况下;通过抑制eNOS,L-NAME减少基础一氧化氮的产生,导致PE引起的血管收缩增加更多。基础一氧化氮的产生通过两条PE曲线之间的差异来确定,以曲线下面积(AUC)比值269,270测量。
2.10 Luminex xMAP
使用Luminex xMAP技术定量小鼠促炎细胞因子,包括IL-6、IL-10和MCP-1。多重分析由Eve Technologies Corp.(Calgary, Alberta)使用Luminex200系统(Luminex Austin, TX, USA)执行。根据制造商协议,使用Eve Technologies的Mouse High Sensitivity Custom-Plex Discovery Assay(MilliporeSigma, Burlington, Massachusetts, USA)同时测量50微升样本中的标记物。这些标记物的检测灵敏度范围为0.06 –9.06 pg/mL。各个分析物的灵敏度值可在MilliporeSigma MILLIPLEX® MAP协议中找到。结果通过特定分析物的珠群荧光强度(FI)值量化,单位为任意强度单位。
2.11 ELISA
使用酶联免疫吸附试验(ELISA)根据制造商说明测量尿中8-羟基-2′-脱氧鸟苷(8-OHdG)(Cedarlane, Burlington ON)、血浆8-异前列腺素(Cayman, Ann Arbor, MI, USA)和血浆不对称二甲基精氨酸(ADMA)(Immundiagnostik AG, Bebsheim, Germany)。
2.12 Western印迹分析
2.12.1 组织匀浆
每一块肾皮质被称重。每毫升细胞裂解缓冲液Ⅱ(Invitrogen, California, USA)中加入2微升的蛋白酶和磷酸酶抑制剂(Pierce, Rockford, USA)储备溶液。对于每块组织,每10毫克组织添加100微升准备好的裂解缓冲液。使用组织匀浆器在冰上以6-8的速度水平研磨两次,每次15秒。之后,将组织匀浆在4℃下以每分钟15,000转离心10分钟。将上清液转移到新的试管中,再次在4℃下以每分钟15,000转离心10分钟。第二次离心得到的上清液用于蛋白质定量和Western印迹分析。
2.12.2 蛋白质定量
通过Bradford测定法确定总蛋白浓度,使用牛血清白蛋白(BSA)生成吸光度与质量浓度的标准曲线。将组织匀浆(每个样本2微升)和BSA标准品(每个浓度2微升)加入400微升的双蒸馏水中,然后与100微升的Bradford试剂混合。在96孔微孔板中加入重复的100微升BSA(0.5 mg/ml, 1 mg/ml, 2 mg/ml, 4 mg/ml, 8 mg/ml和16 mg/ml)和100微升涡旋后的样本,以测定总蛋白浓度。
2.12.3 凝胶加载和蛋白质电泳
样本在低温(约55°C)下加热5分钟。然后将每个样本中的20微克蛋白质加载到6%的聚丙烯酰胺凝胶上(Bio-Rad – 4568044, USA)。HIF-1α通过在含有Tris甘氨酸和十二烷基硫酸钠(Bio-Rad – 1610732, USA)及双蒸馏水的运行缓冲液中运行凝胶分离,并在100伏特下运行90分钟。
2.12.4 蛋白质转移和封闭
将聚丙烯酰胺凝胶、滤纸和硝酸纤维素膜(Bio-Rad – 1620115, Germany)在转移缓冲液(Bio-Rad – 161-0771; USA)中平衡,然后放入Trans-Blot Turbo转移系统(Bio-Rad, USA)中转移7分钟。然后将膜用5%脱脂牛奶(New England Biolabs – 9999S; Canada)封闭1小时。
2.12.5 抗体孵育和成像
将硝酸纤维素膜在冷室中用抗HIF-1α抗体[EPR16897](Abcam)以1:2000的浓度孵育过夜。经过三次洗涤(每次5分钟)后,将膜在室温下用山羊抗兔IgG(H+L)二抗(ThermoFisher Scientific, USA)以1:80,000的浓度孵育1小时。然后用TBS-T再洗三次(每次5分钟)。接着,将膜在室温下用Pierce®高灵敏度链霉亲和素-HRP(Thermo Scientific, Rockford; Illinois, USA)以1:20,000的浓度孵育30分钟。结果以HIF-1α蛋白量与内参蛋白(vinculin)量的比值表示。
2.13 RNA分析
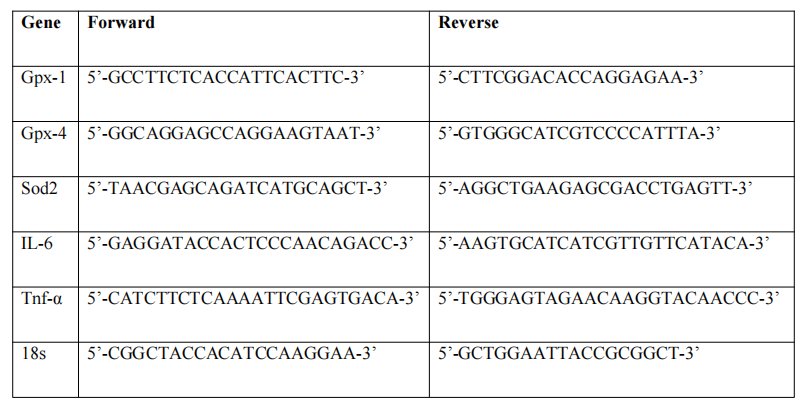
在干燥的冰上移除单个肾脏的三分之二进行RNA分析,然后加入700微升Buffer RLT以稳定组织。在使用前向Buffer RLT中加入70微升β巯基乙醇。然后,通过TissueLyser LT(Qiagen)以40赫兹频率对组织进行90秒的珠磨匀浆。随后,按照AllPrep DNA/RNA/miRNA Universal Kit(Qiagen)的手册处理匀浆后的细胞裂解物。纯化的RNA然后通过iScript cDNA合成试剂盒(Bio-RAD)逆转录为cDNA。然后将cDNA送往UBC的Kelowna实验室测量Gpx-1、Gpx-4、Sod2、IL-6和TNF-α的表达。正向和反向引物如下表所示(表2.2)。基因mRNA表达通过qPCR使用ΔΔCT方法进行相对定量,并以18s作为内参对照。
表2.2:目标基因的正向和反向引物
第2章:统计分析
数据以平均值±标准偏差的形式呈现(n=4-5)。血管功能数据通过Powerlab 4/25和Labchart 7阅读器(AD仪器,澳大利亚)记录并分析。舒张表示为从预收缩到PE(10^-6M)的张力百分比变化。收缩表示为PE(10^-5M)最大收缩的百分比。使用Shapiro-Wilk正态性检验测试每组结果的正态分布。使用GraphPad Prism(版本10)统计软件进行单因素方差分析后接非配对t检验来评估4组之间的差异。P值小于0.05被认为是显著的。
https://blog.sciencenet.cn/blog-41174-1458657.html
上一篇:干燥综合征患者氢疗案例【台湾】
下一篇:减肥药将如何改变世界,许多想不到!《自然》