博文
氢气吸入缓解哮喘鼠呼吸道炎症和氧化应激【韩2024】
||
氢气吸入缓解哮喘鼠呼吸道炎症和氧化应激【韩2024】
本周有4篇氢气医学研究论文,其中2篇是台湾学者的个案报道,一篇来自韩国氢气3%吸入治疗哮喘,一篇来自俄罗斯学者采用4%氢气吸入治疗肺动脉高压。关于氢气吸入研究的一个共同特点是,氢气使用剂量都是比较小浓度。都是对肺部疾病治疗的动物实验研究。关于氢气医学的科学研究,许多人存在误解,一是似乎有动物实验就等于确定效果,例如这两篇关于肺动脉高压和哮喘,动物实验不等于人体试验同样有效,要证明氢气的临床效果,仍然需要进行相应人体试验。二是关于氢气的使用方法,存在两个误解,一是过于相信高剂量,二是过于执着于研究采用的方法。这些都不是可靠的态度。关于氢气医学,正确的态度是,这是一个有前途有意义的研究领域,氢气在医学健康领域的应用潜力巨大,关键就是因为其安全性高,适于作为预防和健康医学,因为受众广泛,即使效果不完全都存在,也具有极其重要价值。这就像运动营养和心理调节,虽然不是人人有效,但几乎人人都可以用。这才是根本。所以,不要太执着效果,不要太执着剂量。重点在于安全,重点在于普世。
气道炎症性疾病,如哮喘,由于其对呼吸粘膜的慢性炎症效应,已成为全球公共卫生关注的问题。氢气(H2)最近因其抗氧化和抗炎特性而被认可。在本研究中,我们使用卵白蛋白(OVA)诱导的BALB/c小鼠过敏性哮喘模型,检查了H2在气道炎症中的治疗潜力。雌性BALB/c小鼠通过OVA致敏和激发来诱导气道炎症,30只小鼠随机分为五组:NT(未治疗),HTC(仅3% H2处理),NC(阴性对照,仅OVA),PC(阳性对照,OVA + 鼻内1 mg/mL沙丁胺醇50 μL),以及HT(H2治疗,OVA + 吸入3% H2)。研究了各种炎症和氧化应激(OS)标志物,如白细胞(WBCs)及其分类计数、肺组织学、细胞因子水平如白细胞介素(IL)-4、IL-5、IL-13、干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、IL-10、活性氧物种(ROS)、一氧化氮(NO)、谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT),以及总免疫球蛋白E(IgE)水平。我们的结果显示,吸入H2显著减少了炎性细胞浸润、OS标志物和促炎细胞因子表达,同时上调了抗氧化酶活性。此外,H2还显著降低了血清IgE水平,这是过敏炎症的标志。总的来说,我们的发现表明,H2吸入是一种有前途的气道炎症治疗方法,提供了一种具有潜在临床应用的新方法。
引言
气道炎症是一个用来描述影响呼吸系统的一组炎症疾病的统称,如哮喘,并对全球公共健康构成重大威胁。2019年,慢性呼吸系统疾病是7110万人过早死亡的根本原因,并导致3240万人残疾。这些疾病的特点是呼吸道黏膜的慢性炎症,导致结构和功能障碍。反过来,这会导致呼吸困难、咳嗽和气短,严重影响患者的生活质量。吸入型糖皮质激素和支气管扩张剂常用于有效管理炎症性气道疾病。然而,它们的长期使用受到副作用和药物耐药性发展的限制。因此,开发新的治疗策略对于改善气道炎症的管理至关重要。
哮喘是一种复杂的肺部炎症状况,特点是气道炎症和嗜酸性粒细胞丰富。包括气道上皮细胞、中性粒细胞、淋巴细胞和嗜酸性粒细胞在内的免疫细胞,在激活时引发几种炎症反应,如活性氧物种(ROS)、一氧化氮(NO)和细胞因子如干扰素-γ(IFN-γ)、白细胞介素(IL)-4、肿瘤坏死因子α(TNF-α)、IL-10、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、IL-5和IL-13。已有研究表明,炎症和氧化应激(OS)显著促进过敏性哮喘的病理生理过程。炎性细胞的过度表达可能增强ROS的产生,导致上皮损伤。反过来,这会触发炎症通路,导致细胞因子传播。此外,气道炎症的病理生理过程与调节炎症细胞浸润和粘液产生的特定功能有关。自由基清除剂或抗氧化剂可能在平衡ROS形成方面有益。众所周知,谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT)对氧气代谢至关重要。在炎性细胞中,嗜酸性粒细胞在受到主要抗氧化酶活性增加的刺激时总是作出反应。此外,嗜酸性粒细胞可以向T细胞呈递抗原,这有助于进一步触发炎症级联反应。接触过敏原会刺激Th2细胞因子(IL-4、IL-5和IL-13),然后激活嗜酸性粒细胞并增加免疫球蛋白E(IgE)的产生。
在过去几年中,氢气(H2)逐渐引起了人们的兴趣,成为一种潜在的新治疗选择,多项研究已经证明了H2在各种疾病中的抗炎和抗氧化特性。H2被描述为一种抗氧化剂,通过抑制过氧亚硝酸盐(ONOO−)和羟基自由基(•OH)的数量来保护细胞免受氧化应激(OS)。此外,H2还表现出抗炎作用,特别是通过其下调促炎细胞因子如IL-1β、IL-6和TNF-α的能力。通过抑制这些关键的炎症介质,H2减少了氧化应激和炎症,从而提供了治疗益处。具体而言,其在缓解气道炎症方面的作用已被证明,表明其在炎症性呼吸系统疾病中的潜力应用。根据Zhang等人的研究,吸入H2降低了哮喘小鼠的肺阻力,逆转了炎症浸润和杯状细胞增生。它还减少了支气管肺泡灌洗液中的总细胞、嗜酸性粒细胞和淋巴细胞;降低了TNF-α、IL-4、IL-13和C-X-C基序趋化因子配体15的水平;并减少了上调的超氧化物歧化酶活性,同时减轻了增加的丙二醛和髓过氧化物酶水平。
对各种疾病的治疗潜力的理解取得了显著进展。然而,它们在气道炎症中的作用仍然理解不足。因此,本研究旨在评估H2在卵白蛋白(OVA)诱导的气道炎症动物模型中的抗炎和抗氧化特性,并探索其作为治疗药物的潜力,目标是推进其在治疗炎症性呼吸系统疾病中的临床潜在应用。
材料与方法
2.1 动物
雌性BALB/c小鼠(8-10周),平均体重为20±2克,购自Orient Bio Inc.(韩国首尔)。实验开始前,小鼠饲养在特定的无病原体设施中,条件包括12小时光照/黑暗周期、温度22±2°C和湿度范围40%至60%。小鼠可以自由获取水和标准实验室饲料。所有实验程序遵循韩国共和国国家动物福利法的指导方针,并由延世大学原州医学院机构动物护理和使用委员会批准(批准号:YWC-230530-1)。
2.2 使用OVA致敏和激发气道炎症
使用Sigma-Aldrich(美国密苏里州圣路易斯)的OVA进行致敏和激发,以建立小鼠气道炎症模型。共30只小鼠随机分为五组,每组六只:NT(非处理)、HTC(仅3% H2处理)、NC(阴性对照,仅OVA)、PC(阳性对照,OVA + 鼻腔内给药1 mg/mL沙丁胺醇50 μL)和HT(OVA + 3% H2吸入)。在第0、7和14天,小鼠通过腹腔注射与明矾混合的OVA进行致敏。随后,从第21到25天,小鼠每天暴露于雾化的1% OVA或磷酸盐缓冲盐水(PBS)30分钟。HTC和HT组的小鼠在OVA或PBS激发后的连续15天内每天吸入3% H2气体30分钟(图1)。
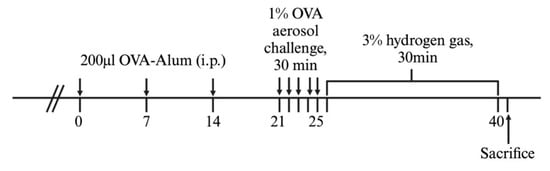
图1. 动物实验流程。
2.3. 氢气给药
氢气生成装置由GOOTZ Co., Ltd.(韩国京畿道水原市)设计和提供,能够产生3%饱和浓度的H2气体。所有实验处理都使用一个透明密封箱,尺寸为32 × 22 × 14 cm3(长 × 宽 × 高)。在每次实验过程中,使用可燃气体探测器(日本Cosmos)监测箱内H2气体的浓度。
2.4. 白细胞及其分类计数
从眼眶后丛采集血液样本,立即放入含有乙二胺四乙酸(EDTA)作为抗凝剂的试管中。使用自动血液分析仪(HEMAVET HV950 FS;美国马萨诸塞州波士顿Drew Scientific Inc.)测定总白细胞计数以及中性粒细胞、淋巴细胞和嗜酸性粒细胞的分类计数。
2.5. 肺组织学
为了进行形态评估,将左肺叶切除并在10%甲醛中固定过夜。固定后,将组织样本脱水,嵌入石蜡中,并使用切片机切成4-6 μm厚的切片。切片脱蜡并用苏木精和伊红(H&E)染色。右肺保存在-80°C以备进一步研究。使用H&E染色的肺切片测量支气管周围炎症的程度。
2.6. 血清中炎症细胞因子的检测
按照制造商的说明,使用珠阵列悬浮多重试剂盒(Bio-Rad, 美国加利福尼亚州圣地亚哥)分析血清中的炎症细胞因子,包括IL-4、IL-5、IL-13、IFN-γ、TNF-α、GM-CSF和IL-10。使用Luminex 200 Bio-Plex系统进行细胞因子分析,原始数据使用五参数逻辑方法进行分析。
2.7. 血清中总ROS和NO水平的测量
按照既定协议,使用氧化2-4-二氯二氢荧光素二乙酸酯(DCFH-DA)(Abcam, 美国马萨诸塞州剑桥)定量血清中的总ROS。将10 μL血清样本加入96孔板,随后加入100 μL 20 μM DCFH-DA。将板在黑暗中孵育30分钟,然后使用DTX-880多模式微孔板读数器(Beckman Coulter Inc., 美国加利福尼亚州富勒顿)在激发波长488 nm和发射波长525 nm处测量荧光。
此外,根据制造商的指南,使用Griess试剂(Biomax Co., Ltd., 韩国首尔)评估血清NO水平。通过将50 μL血清与50 μL Griess试剂I和50 μL Griess试剂II混合来确定亚硝酸盐水平。样品在室温下黑暗中孵育10分钟,然后使用SpectraMax® ABS Plus(Molecular Devices, 美国加利福尼亚州圣何塞)在540 nm处测量光密度(OD)。
2.8. GPx和CAT酶活性水平的估算
使用Cayman试剂盒(Cayman, Ann Arbor MI, 美国)根据制造商的指南评估内源性抗氧化酶(CAT和GPx)的水平。简言之,对于CAT测定,将78 μL样本(10 μL库存液和68 μL测定缓冲液)添加到96孔微孔板中;对于GPx测定,添加50 μL样本(10 μL库存液和40 μL测定缓冲液)。将板孵育30分钟。使用SpectraMax® ABS Plus(Molecular Devices, 美国加利福尼亚州圣何塞)测量CAT(570 nm)和GPx(340 nm)的光密度。CAT和GPx活性分别以nmol/min/mL和mU/mL表示。
2.9. 血清中总IgE水平
从小鼠眼眶后丛采集血液样本。通过以13,000 rpm离心样本5分钟获得血清,并随后储存在-80°C直至进一步分析。使用小鼠IgE ELISA试剂盒(Cusabio, 中国武汉),按照制造商的说明测定血清总IgE水平。使用SpectraMax® ABS Plus微孔板读数器(Molecular Devices, 美国加利福尼亚州圣何塞)在450 nm处读取OD。
2.10. 统计分析
数据以均值 ± 标准差(SD)表示。使用单因素方差分析(ANOVA),随后使用GraphPad Prism(版本10.0;GraphPad, La Jolla, CA, USA)进行事后多重比较检验进行统计分析。统计学显著性设定为p < 0.05。
3. 结果
3.1. H2对气道炎症小鼠模型体重和肺重的影响
为了评估3% H2气体吸入对OVA诱导的炎症气道状况的影响,记录了小鼠的体重和肺重。NT组和NC组之间的体重或肺重没有显著差异(图2A,B)。然而,如图2B所示,NC组的肺重显著高于NT组(p < 0.05)。此外,五个实验组的肺部均未检测到可见的病理变化(图2C)。
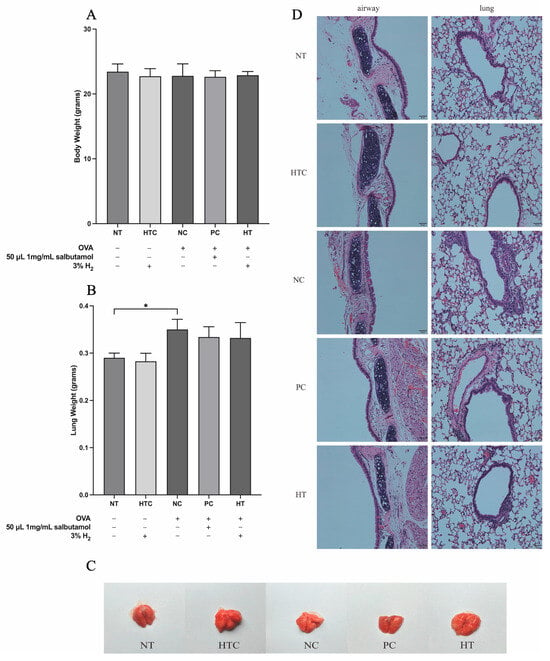
图2. 氢气吸入对小鼠体重和肺重特征的影响。(A)小鼠体重,(B)肺重,(C)肺器官外观,(D)肺组织经苏木精-伊红(H&E)染色后的组织学分析,突出显示了形态特征。数据表示为平均值±标准差(n=5)。统计学显著性表示为* p<0.05。
3.2. 氢气对气道炎症小鼠模型中炎性细胞浸润的抑制作用
哮喘的一个关键特征是免疫细胞的浸润和激活[29]。为了评估3%氢气吸入的效果,我们分析了肺组织学(图2D)并量化了炎性细胞数量(图3)。未治疗组(NT组)和氢气对照组(HTC组)的小鼠肺和气道结构正常,炎性细胞极少。相反,正常对照组(NC组)表现出炎性细胞浸润、肺泡壁增厚和气道结构异常(图2D)。在阳性对照组(PC组)和氢气治疗组(HT组)中,使用沙丁胺醇和氢气治疗后,肺部炎性细胞减少(图2D)。
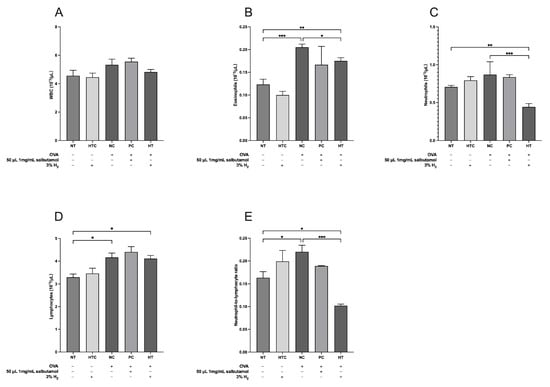
图3. 氢气吸入可调节过敏性小鼠模型血液中的炎性细胞水平。(A)白细胞总数(WBCs),(B)嗜酸性粒细胞,(C)中性粒细胞,(D)淋巴细胞,以及(E)中性粒细胞与淋巴细胞比值(NLR)。数据表示为平均值±标准差(n=5)。统计学显著性表示为* p<0.05;** p<0.01;*** p<0.001。
白细胞(WBCs)在先天性和适应性免疫应答中都发挥着至关重要的作用,其中嗜酸性粒细胞、中性粒细胞和淋巴细胞是过敏性炎症的标志性细胞。中性粒细胞与淋巴细胞比值(NLR)是一个综合参数,它结合了代表先天性炎症的中性粒细胞和作为过敏性炎症调节剂的淋巴细胞。有研究表明,血液中的NLR可以作为反映机体整体炎症和应激水平的指标[31]。白细胞计数分析显示各实验组之间存在显著差异(图3)。具体而言,正常对照组(NC组)的嗜酸性粒细胞水平显著高于未治疗组(NT组)(p<0.001;图3B)和氢气治疗组(HT组)(p<0.05;图3B),而HT组的嗜酸性粒细胞水平又显著高于NT组(p<0.01;图3B)。此外,与HT组相比,NC组的中性粒细胞数量显著减少(p<0.001;图3D)。NC组和HT组的淋巴细胞计数均显著高于NT组(p<0.05;图3C)。我们的结果还显示,与NT组(p<0.05;图3E)和NC组(p<0.001;图3E)相比,HT组的NLR显著降低。这些结果表明,3%氢气吸入可轻微减少卵清蛋白(OVA)诱导的小鼠肺部炎性细胞的浸润。
3.3. 氢气吸入对气道炎症小鼠模型血清炎性细胞因子水平的影响
为了评估3%氢气吸入对血清炎性细胞因子的影响,我们测量了白细胞介素-4(IL-4)、白细胞介素-5(IL-5)、白细胞介素-13(IL-13)、γ干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)和白细胞介素-10(IL-10)的水平(图4)。我们的结果表明,与正常对照组(NC组)相比,氢气治疗组(HT组)吸入氢气后,IFN-γ(p<0.001;图4D)和IL-10(p<0.001;图4G)的水平显著升高。相反,HT组的IL-4(p<0.001;图4A)、IL-5(p<0.001;图4B)、IL-13(p<0.01;图4C)和GM-CSF(p<0.01;图4F)水平显著低于NC组。值得注意的是,与NC组相比,血清TNF-α水平无显著差异(图4E)。综上所述,这些结果表明,3%氢气吸入可有效减轻卵清蛋白(OVA)诱导的气道炎症小鼠模型的血清炎症反应。
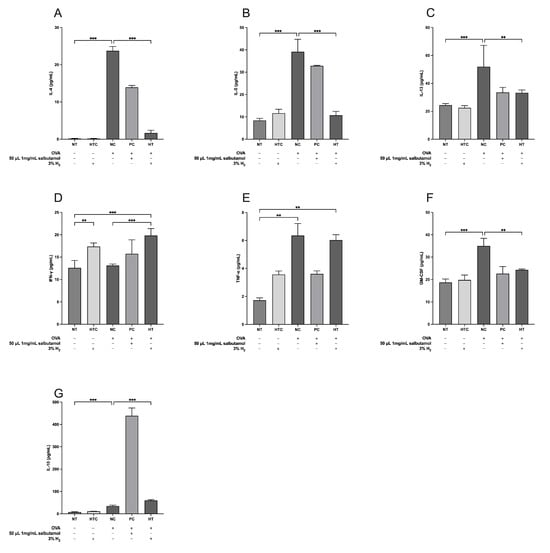
图4. 氢气吸入调节卵清蛋白(OVA)诱导的气道炎症小鼠模型中血清细胞因子水平的表达。(A)白细胞介素-4(IL-4),(B)白细胞介素-5(IL-5),(C)白细胞介素-13(IL-13),(D)干扰素-γ(IFN-γ),(E)肿瘤坏死因子-α(TNF-α),(F)粒细胞-巨噬细胞集落刺激因子(GM-CSF),(G)白细胞介素-10(IL-10)。数据表示为平均值±标准差(n=5)。统计学显著性表示为** p<0.01;*** p<0.001。
3.4. 氢气在预防气道炎症小鼠模型氧化损伤中的作用
OVA诱导的过敏性炎症与小鼠体内氧化应激(OS)水平升高有关。我们评估了血清中活性氧(ROS)、一氧化氮(NO)、谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT)的水平,以评估氢气吸入在气道炎症模型中的氧化还原效应。如图5所示,与未治疗组(NT组)相比,正常对照组(NC组)的ROS和NO水平显著升高(p<0.05)。我们的结果表明,与NC组相比,氢气治疗组(HT组)的NO水平降低(p<0.05;图5B)。此外,NC组的GPx活性显著低于NT组(p<0.001;图5C)。相反,与NC组相比,3%氢气治疗显著提高了HT组的GPx活性(p<0.001;图5C),这表明氢气在气道炎症中具有保护性作用,可对抗氧化损伤。
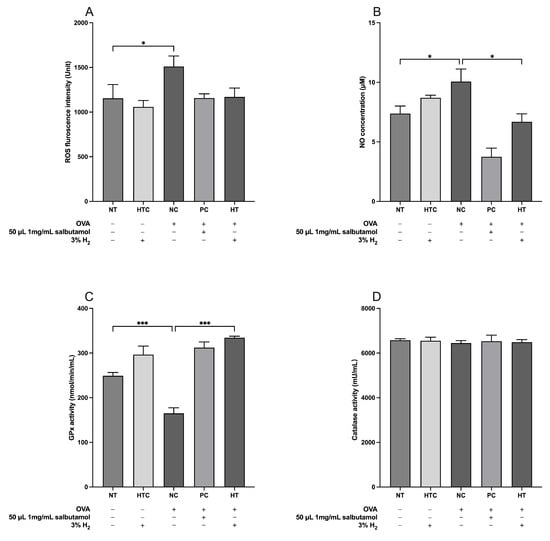
图5. 氢气吸入对气道炎症小鼠模型中氧化还原标志物的影响。(A)活性氧(ROS)、(B)一氧化氮(NO)、(C)谷胱甘肽过氧化物酶(GPx)和(D)过氧化氢酶(CAT)的血清水平。数据表示为平均值±标准差(n=5)。统计学显著性表示为* p<0.05;*** p<0.001。
3.5. 氢气吸入对气道炎症小鼠模型总IgE水平的影响
总IgE的产生与过敏性炎症相关。在本研究中,我们评估了吸入3%氢气对血清总IgE水平的影响。结果显示,与正常对照组(NC组)相比,氢气治疗组(HT组)的血清总IgE水平显著降低(p<0.05;图6)。这一降低表明,氢气吸入可能通过降低IgE水平(过敏性炎症严重程度的指标)来有效减轻小鼠模型中的过敏反应。
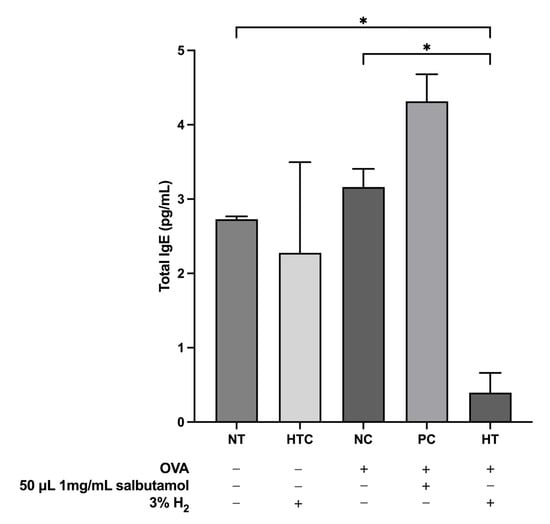
图6. 吸入H2气体降低了OVA诱导的气道炎症小鼠模型血清中的总IgE水平。数据表示为均值±标准差(n=5)。统计学显著性表示为*p<0.05。
4. 讨论
在本研究中,我们评估了3% H2气体吸入在OVA诱导的过敏性哮喘小鼠模型中的抗炎和抗氧化效果。我们的发现表明,H2通过有效减少炎症细胞浸润、降低NO水平、上调抗氧化酶GPx的活性以及增强IFN-γ和IL-10等抗炎细胞因子的表达,表现出显著的抗哮喘特性。此外,H2治疗显著减少了包括IL-4、IL-5、IL-13、GM-CSF和总IgE在内的促炎细胞因子的产生。
哮喘表型有两种形式:低Th2型,特征是非嗜酸性粒细胞炎症、中性粒细胞参与、代谢反应;高Th2型,主要由产生IL-4的Th2细胞驱动,以嗜酸性粒细胞为主。大多数中度至重度哮喘患者表现为高Th2型,并且哮喘长期以来被认为是Th2介导的气道疾病的明确例子,这得到了小鼠模型证据的支持。气道的Th2(类型2)炎症已被证明是小鼠哮喘的主要分子机制。大多数哮喘小鼠模型的过敏性气道炎症是由一次或多次腹腔注射蛋白过敏原(通常是OVA)结合铝佐剂(明矾)引发的,后者作为Th2偏向的佐剂。OVA诱导的过敏性气道炎症小鼠模型展示了人类哮喘的几个特征,包括血清IgE浓度增加、嗜酸性粒细胞浸润以及Th2细胞因子(IL-4、IL-5和IL-13)水平升高。在我们的小鼠模型中观察到了类似的结果,显示在OVA诱导后细胞因子、IgE水平和血清嗜酸性粒细胞浸润的增加。
炎症强度的一个关键决定因素是炎症细胞的数量。总白细胞计数(包括嗜酸性粒细胞、中性粒细胞和淋巴细胞)是全身炎症反应的公认指标,可以用作研究全身炎症与肺功能关系的生物标志物。最近,许多炎症标志物,如白细胞计数、嗜酸性粒细胞计数和NLR(中性粒细胞与淋巴细胞比),显示出作为哮喘指示物的潜力。嗜酸性粒细胞与OVA诱导的气道炎症的发展有关,它们通过自身或与其他促炎途径的相互作用导致损伤、阻塞和支气管高反应性。Jin等人发现,H2气体具有预防过敏性疾病的效应,通过减少血液中的嗜酸性粒细胞数量。中性粒细胞可能在引起呼吸症状方面发挥重要作用,这些症状可能与高反应性相关。在我们的研究中,我们观察到H2吸入减少了OVA诱导的哮喘BALB/c小鼠模型中的中性粒细胞。这一发现与Xiao等人的结果一致。谢及其同事发现,H2治疗减少了脂多糖(LPS)诱导的中性粒细胞进入肺部,从而减轻了肺部炎症。Th2淋巴细胞在产生一系列白细胞介素(IL-4、IL-5、IL-13)和GM-CSF方面至关重要,这些细胞因子促进与其他细胞的通信并维持炎症。NLR是肺病中全身炎症的生物标志物,有潜力提供具有诊断意义的治疗相关生物标志物。Asseri及其同事发现,急性哮喘发作期间儿童的NLR明显高于稳定期哮喘,但对成人没有显著影响。在我们的研究中,NLR显著增加,并且在吸入3% H2后明显下降,这可能反映了中性粒细胞相关的全身炎症。NLR主要用于临床研究,很少有报告关注其在过敏性哮喘小鼠中的应用。临床试验表明,成年动物的淋巴细胞和中性粒细胞之间存在显著差异。小鼠血液含有更高比例的淋巴细胞(75-90%)和较低比例的中性粒细胞(10-25%),而人类血液中的中性粒细胞浓度更高(50-70%),淋巴细胞浓度为30-50%。据我们所知,这是第一次在过敏性气道炎症的哮喘小鼠中报道NLR,但其在哮喘评估中的作用仍然有限。
了解炎症介质在慢性炎症过程中的作用至关重要,因为它们似乎通过指导炎症细胞的定向招募和激活及其在肺部的持续存在来决定炎症反应的特征。IFN-γ增强了TNF-α的作用,并引发炎症诱导的NO,导致炎症部位的组织损伤。有效抑制TNF-α在管理慢性炎症性疾病中非常有利。IL-10是一种具有抗炎特性的细胞因子,影响多种与过敏性哮喘有关的免疫细胞。它抑制嗜酸性粒细胞的功能,刺激IFN-γ的产生,并促进B细胞从IgE扩增。我们的数据揭示,在给予3% H2气体后促进了IFN-γ和IL-10的释放,尽管没有观察到TNF-α浓度的显著变化,但NO水平显著降低。过敏性气道炎症显著受到Th2介导的细胞因子IL-4、IL-5和IL-13的影响,这些细胞因子是一系列反应的细胞靶标。IL-4和IL-5是哮喘性嗜酸性粒细胞气道炎症类型2途径的关键驱动因素。同样,IL-4主要负责过敏炎症和增加黏液产生,这有助于幼稚辅助T细胞分化为Th2细胞,从而促进过敏性疾病的进展,并促进B细胞成熟和向IgE的转变。此外,IL-5与调节(诱导、存活和成熟)嗜碱性粒细胞和嗜酸性粒细胞有关。此外,IL-13与嗜酸性粒细胞增多症有关,它与IL-5共同作用,促进嗜酸性粒细胞的激活和迁移。然而,在过敏性炎症小鼠模型中,GM-CSF固有地刺激嗜酸性粒细胞的积累,从而在过敏性疾病的发展中发挥关键作用。基于我们的发现,H2显著归因于其抗炎和抗哮喘特性。有趣的是,OVA暴露已被观察到提高IgE水平,表明肺部存在过敏或慢性炎症反应。白细胞介素,特别是IL-4和IL-5,负责IgE的合成,刺激嗜酸性粒细胞增多,调节嗜酸性粒细胞功能,并增强粘膜型肥大细胞的增殖[67];然而,吸入H2已被证明能降低IgE水平和抑制炎症反应。
此外,气道氧化还原状态失衡引起的氧化损伤会导致炎症反应、气道重塑和气道高反应性。研究表明,动物中的OVA诱发的气道表现出高水平的ROS,包括过氧化氢(H2O2)、超氧阴离子(O2−)以及由烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶产生的·OH,可能影响气道血管系统,诱导黏液产生和支气管收缩,并增加气道的反应性。已经证明,H2通过降低ROS水平减轻过敏性气道刺激。气道炎症在很大程度上受NO及其产物的影响,尽管代谢物仍不清楚。虽然NO及其衍生物可以是支气管保护性的,但高水平的NO和活性氮物种也可能导致细胞破坏。由于Th2细胞负责嗜酸性粒细胞炎症,已知哮喘性气道的NO水平升高。这些升高的NO水平导致黏液产生、血浆渗出和充血,并间接增强Th2细胞增殖。GPx和CAT是肺中重要的抗氧化酶。GPx在过敏性哮喘的发展过程中对促炎介质的上调至关重要。哮喘患者中GPx活性显著降低。Liang等人显示,应用抗氧化酶可以通过减少ROS形成和增加GPx和CAT的活性显著减少氧化损伤和气道炎症。然而,CAT已被证明通过增强基因和酶活性减少OS。此外,You等人研究了H2气体可能通过抑制ROS和NO水平的升高以及增强抗氧化酶如CAT和GPx的活性来保护气道上皮细胞免受OS的影响,这可能导致潜在的呼吸状况干预。我们的研究揭示,H2气体增加了GPx活性并降低了哮喘小鼠中的NO水平。然而,氢气治疗对ROS和CAT的影响被发现是正常的,这表明吸入H2气体可以防止OS。
H2在自然界中丰富,且无色无味。由于其分子量小,H2可以轻松渗透到细胞内并进入许多细胞器,包括细胞核和细胞质,以执行其生物功能,并且以其在人体代谢中不留下残留物而闻名。此外,吸入是最方便且在早期报告中最广泛使用的应用H2气体的方法。以前的研究表明,吸入1-3% H2可显著减轻氧化损伤。在本研究中,我们使用了过敏性哮喘小鼠模型,结果表明用3% H2治疗气道炎症是安全的、耐受良好的,且无副作用。
本研究评估了过敏性哮喘小鼠模型中的细胞因子和氧化还原反应的血清水平。然而,由于哮喘机制复杂,需要进一步研究H2疗法对其他哮喘表型的影响,例如由尘螨(HDM)引起的中性粒细胞性哮喘。此外,动物模型与患者之间的相关性尚未完全理解。需要进行进一步的临床试验以确定H2对人类呼吸道炎症的治疗效果。
5. 结论
总的来说,本研究的结果提供了有力的证据,表明H2在过敏性气道炎症中具有潜在的治疗作用。观察到炎症细胞浸润减少、气道炎症减轻和IgE生成抑制。本研究支持H2可以作为过敏性哮喘及相关疾病的替代或附加治疗方法的观点。
https://blog.sciencenet.cn/blog-41174-1458321.html
上一篇:脑膜先天淋巴细胞在生命早期指导抑制性神经元
下一篇:与僵尸大学斗争数十年的学术侦探André Hesselbäck