博文
氢化酶及其在人类蛋白质组中的同源物(第三章)
||
读本文先阅读:
氢化酶及其在人类蛋白质组中的同源物(第三章)
3.1 引言
考虑到大约40亿年前哈代地球的活跃化学环境,很有可能第一个膜的形成并非来自有机物质,而是通过矿物的形成,例如马基诺威特(Fe[Ni]S)(Lane, 2010; White et al., 2015; Russell and Ponce, 2020)。在这一时期,地球表面以强烈的火山活动、高温和化学性质不稳定的环境为特征。按照我们今天所知的有机分子并不丰富,使得第一批膜由有机脂质组成的可能性不大(Lane 2010)。这种半透性的无机原生物质膜可能在海底碱性热液喷口附近形成,那里还原的富电子火山碎屑暴露于酸性、富质子的海水中,这一情景可能提供了有机生命所需的化学不平衡和矿物质(Duval et al., 2021)。氢气和二氧化碳对生物化合物的起源也是必需的,Preiner等人(2019)表明,像马基诺威特和磁铁矿这样的矿物会起到前生物氢化酶的作用,促进有机反应。
利用化学渗透质子梯度(Δꝭ(质子动力)= ΔѰ(膜电位)+ ΔpH(质子梯度))产生能量对于有机进化至关重要,并被所有生命领域所采用(Koch and Schmidt 1991; Lane, 2010; Matreux et al., 2023),原核生物利用质膜创建化学渗透梯度。另一方面,在真核生物中,叶绿体和线粒体的内膜提供了形成质子梯度的选择性屏障(Lane, 2010)。由于生物膜在其构象中不包含对电子传输必需的氧化还原活性矿物,因此通常将保留金属簇的辅助蛋白嵌入磷脂双层中。举例来说,铁-硫复合物存在于许多催化酶中,并且由于其广泛的氧化还原电位范围(+5.0(2Fe-2S) --0.7(4Fe-4S) V)(Thomson, 1977; Jafari et al., 2022),它们经常被用于促进电子传输的蛋白质中(如(de)氢化酶、铁氧还蛋白等)。
从进化的角度来看,氢气的离解(H2 → 2H+ + 2e-)极有可能是一个基础功能,为原始细胞功能如能量生产、活性信号分子的形成以及无机离子跨膜运输(例如,K+、Na+、Li+)提供电子(e-)和质子(H+)。例如,NADH/泛醌氧化还原酶或电子传递链(ETC)的复合物I,是OXPHOS级联的第一个蛋白簇。随着每一个过渡步骤,电子的能量被利用,直到它们被转移到泛醌,将底物还原成泛醌醇,一种内源性抗氧化剂(Niki, 1997; Gvozdjáková et al., 2020; Cirilli et al., 2021),(图3.1)。
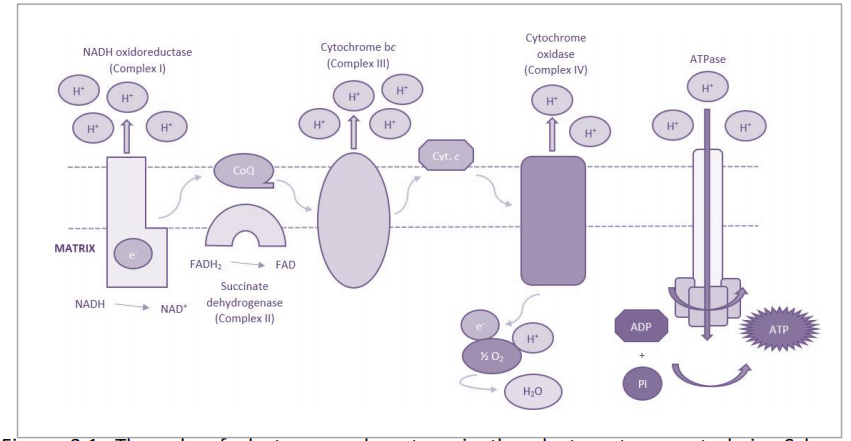
图3.1 电子和质子在电子传输链中的作用。电子传输链的示意图。橙色:电子从NADH/FADH中被提取,并通过辅因子泛醌(CoQ)和细胞色素c在链中传递。浅蓝色:质子通过复合物I、III和IV被泵送过膜。
3.2 真核细胞的进化
真核谱系的进化是一个非常有争议的话题,学术界对此进行了大量讨论(Searcy, 1992; Martin and Müller, 1998; Abhishek et al., 2011; Spang et al., 2019; Imachi et al., 2020)。当代思维揭示了细胞进化的五个主要理论,i) 氢气假说,ii) 逆向流动,iii) 吞噬、纠缠、内源化(E3),iv) Searcy的模型,和v) 互养作用,详见图3.2。
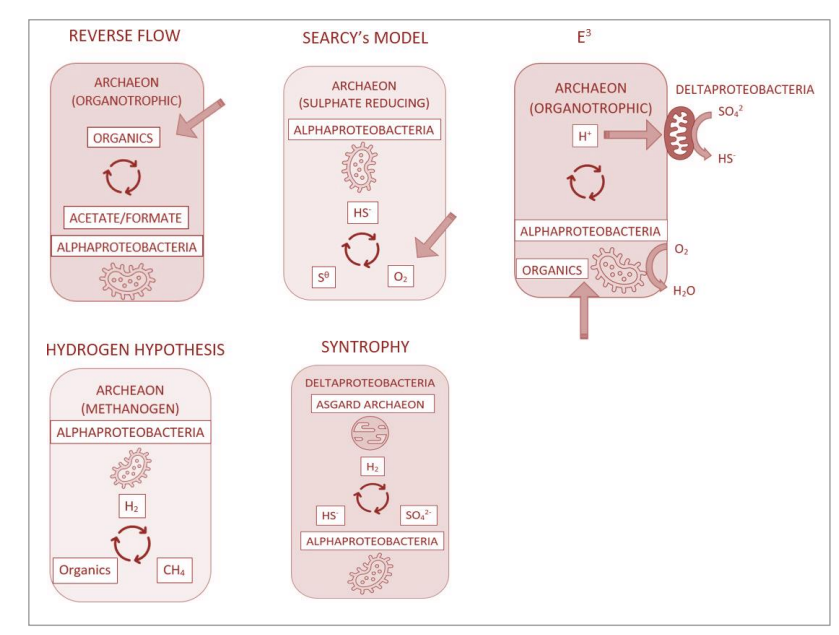
图3.2 可能的共生关系图形描述,导致真核细胞的产生。
原始的氢气假说表明,一种产甲烷的古菌宿主吞没了产生氢气的α-变形菌(Pseudomonadota门下的一类细菌)(Garrity等人,2004),利用氢气供应还原二氧化碳,二氧化碳也是细菌作为代谢副产品释放出来的(Martin and Müller, 1998)。原始的氢气进化理论最近被修改,以解释新发现的古菌分支(以北欧神话中诺尔斯诸神的住所阿斯加德命名),作者(Sousa等人,2016)将宿主的起源从一种产甲烷菌修正为一种自养古菌,这种古菌利用α-变形菌产生的氢气在Wood-Ljungdahl固碳途径中。Spang等人(2019)发展的逆向流动进化模型表明,一种古菌宿主和一种α-变形菌之间存在共生关系,这种关系依赖于还原等价物如氢气,也许是乙酸或甲酸盐,从一种需氧古菌传递到一种兼性需氧α-变形菌(Spang等人,2019)。E3假说描述了一种Asgard古菌与两种共生体之间的代谢关系,一种内化的α-变形菌可能已进化成线粒体,而一种硫还原δ-变形菌的共生关系被推测要么从未完成,要么是短暂的,或者在进化的深渊中丢失了(Imachi等人,2020)。Searcy的真核生物起源模型首次于1992年提出(Searcy, 1992),主张一种无壁古菌如Thermoplasma spp.与一种氢硫化物(H2S)代谢细菌之间的共生关系。最后,互生理论提出了一种硫酸盐还原δ-变形菌宿主、一种器官营养型、释放氢气的Asgard古菌以及一种兼性需氧、硫化物氧化α-变形菌之间的相互依赖的代谢共生关系。在这些杰出的理论中,互生理论将氢气的需求置于理论的中心,并为进一步讨论提供了基础(第3章,第3.5节)。
3.2 氢化酶的普遍存在
由于地球早期大气可能由CO、氢气和CH4等还原性气体组成,因此可以推断,利用铁(Fe)诱导的氢气催化作为一种提供电子和质子用于能量生产的手段,是在数十亿年前进化出来的(Piché-Choquette and Constant, 2019)。因此,从进化的角度来看,氢气可能是早期能量代谢形式中最早被利用的还原剂之一。
氢化酶负责催化氢气的可逆氧化/还原反应(H2 <--> 2H++ e-)。这类酶在所有单细胞和许多多细胞生物中都有发现(例如,植物:拟南芥(AtNar1)。访问号:NM_117739)(Russell, Zulfiqar and Hancock, 2020),并可以被归类到特定的系统发育组中,即铁只、铁-铁和镍-铁(Fe、Fe-Fe和NiFe)(Greening et al., 2016; Piché-Choquette and Constant, 2019)。在这些不同的组中,NiFe氢化酶是最常见的,广泛存在于各种细菌和植物中。NiFe氢化酶可以进一步分为四个类别,i)膜结合氢化酶;ii)固定氮的胞浆氢化酶;iii)使用8-羟基-5-去氮杂黄素(F420)作为低电位氧化还原辅因子的胞浆氢化酶,和iv)对氧气敏感的膜结合能量转化氢化酶。
在这些亚组中,膜结合的iv组氢化酶最类似于线粒体复合物I的活动(Marreiros et al., 2013; Read et al., 2021),因此,这一组特别受到关注。所有特征性的NiFe氢化酶包含一个大亚基,其中含有NiFe活性氢气去质子化位点和一个较小的亚结构,负责容纳多达九个铁硫簇(图3.3)(Vaissier and Van Hooris, 2017)。
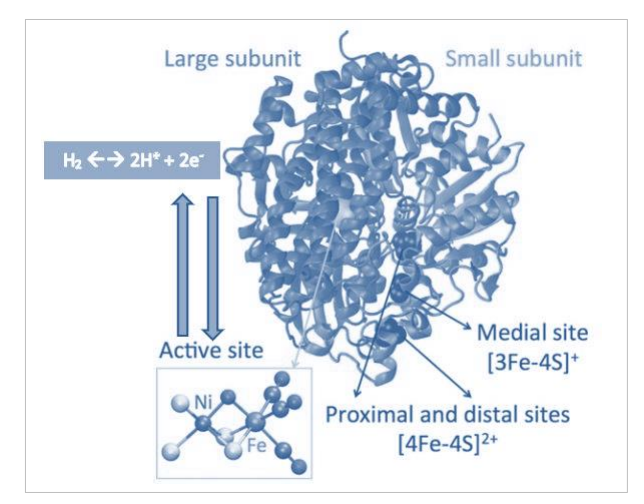
图3.3 NiFe氢化酶(Desulfovibrio fructosivorans - 1YRQ)的晶体结构。图片改编自Vaissier和Van Voorhis(2017)的原作(版权许可由Van Voorhis于12月28日提供)。NiFe氢化酶异质二聚体具有两个独特的亚基:蓝色 - 大亚基,包含NiFe活性位点。粉色 - 小亚基,带有三个铁-硫簇,将电子传递到活性位点。
3.3 NADH/泛醌氧化还原酶/脱氢酶:复合物I
复合物I(图3.4)是电子传输链中最大的酶,它在生命所有领域都有保守的同源物(Friedrich和Scheide, 2000; Vercellino和Sazanov, 2022)。
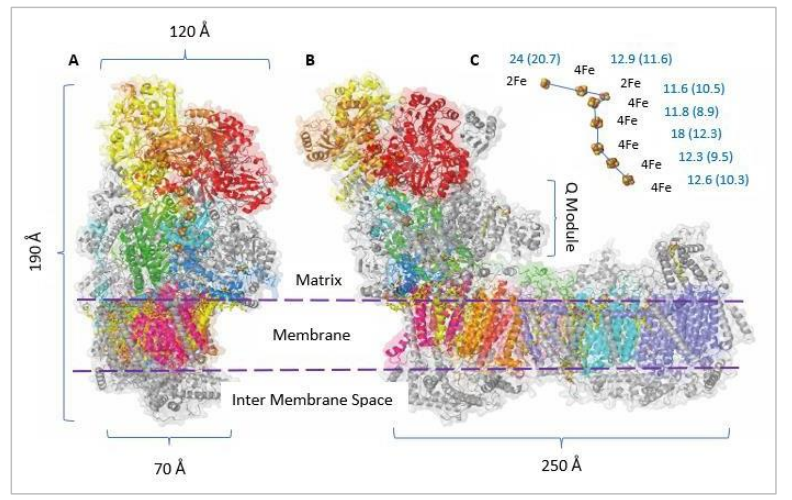
图3.4 线粒体复合物I(Yarrowia lipolytica)的结构和排列。图片来源 - Zickermann等人(2015)(版权许可由Zickermann于03/01/2024提供)。(A) 来自外围臂的视角。(B) 旋转90°以包括膜结合亚基的视角。(C) 在外围臂中4Fe-4S(4Fe)和2Fe-2S(2Fe)簇的排列。中心到中心和边缘到边缘的距离(括号内)以埃为单位。
由于其近乎恒定的氧化还原活性和丰富的电子供应,复合物I是线粒体内主要的活性氧物种O2•-的重要来源。可以设想有两个位点,氧气可以从NADH辅因子获得电子,i) 在黄素单核苷酸模块处,ii) 在泛醌结合位点处。Bazil等人(2014年),通过计算建模确定FMN模块是过氧化氢产生的假定位点。作者进一步推断,FMN处的ROS产生受到泛醌/复合物I界面缺乏泛醌的刺激(Bazil等人,2014)。在这种配置中,泛醌通过的蛋白内通道变得可以被氧气进入,使氧气暴露在一个电子集中且还原为ROS的可能性增加的区域。此外,Q模块处泛醌的不完全还原导致半醌的产生(Gvozdjakova等人,2020年),一种带负电的离子、中间体和自由基化合物。鉴于泛醌/半醌对的氧化还原中点电位(-0.163 V)(Kishi等人,2017年)与氧/超氧化物对的中点电位(-0.16 V)(Wood, 1988年)相似,可以合理假设半醌也能显著促进此区域内O2•-的形成。
3.4 复合物I的泛醌结合域
复合物I的泛醌结合域主要由四个相互依赖的蛋白质亚基组成。在人类中,这些是由线粒体编码的NADH脱氢酶亚基(例如,ND1和ND3)以及由核编码的NADH脱氢酶(泛醌)铁硫蛋白(例如,NDUFS2和NDUFS7)。ND1和ND3位于复合物I的膜部分,与细菌反向转运蛋白同源(Fiedorczuk和Sazanov, 2018年),而核编码的基因是矩阵内外围臂的一部分,据报道它们在NiFe氢化酶中有同源物(Friedrich和Scheide, 2000年;Vignais和Billoud, 2007年;Kampjut和Sazanov, 2022年),这导致了持续的理论,即复合物I的前身是通过将可溶性氢化酶与质子泵膜结合反向转运蛋白结合形成的(Volbeda和Fontecilla-Camps, 2012年;Yu等人,2021年)。
使用3.6 Å分辨率的晶体结构,Zickermann等人(2015年)确定,ND1面向基质的α螺旋与NDUFS2、NDUFS7和ND3相互连接,构建了一个通道,泛醌通过该通道到达对接位点(Zickermann等人,2015年)。泛醌/复合物I接口位于此通道内(Kaila, 2018)。通过各种分析(例如,生物化学、低温电子显微镜(cryo-EM)、遗传)收集的进一步数据强调,泛醌的还原发生在NDUFS2和NDUFS7单元的未指定区域,而ND1和ND3单元形成了主要通道结构(Parey等人,2018年)。然而,其他报告推断ND1也可能参与泛醌的还原(Kurki等人,2000年)。因此,尽管有几份报告说明了核编码的NDUFS2和含(N2) Fe-S的NDUFS7亚基作为氧化还原活动的主要中心的可能性(Grgic等人,2004年;Kampjut和Sazanov, 2020年),泛醌模块内特定酶活性的区域尚未得到明确界定。
3.5 生物信息学查询
为了更好地理解氢化酶与复合物I功能亚基之间可能的进化关系,这项查询关注于三种据称参与了共生假说进化的微生物,即一种δ变形菌(Desulfovibrio carbinolicus)、一种阿斯加德古菌(Candidatus heimdallarchaeota)和一种α变形菌(Rhodobacter sphaeroides)。这里包括的膜结合氢化酶(Mbh)有i) C. heimdallarchaeota, MbhJ(Uniprot# A0A1Q9PFW3)和MbhL(Uniprot# A0A1Q9PFM5),ii) D. carbinolicus, 未命名氢化酶,亚基链长分别为494(Uniprot# A0A4P6HTH3)和258(Uniprot# A0A4P61469)氨基酸,此处分别称为Hyd494和Hyd258,以及iii) R. sphaeroides HupL(Uniprot# Q3J0L7),HupS(Uniprot# 086467),HupU(Uniprot# O86466)和HupV(Uniprot# Q3J0M0)。
为了评估感兴趣的氢化酶蛋白是否在人类蛋白质组中保留了同源性,对三种物种的NiFe氢化酶酶序列进行了初步的基本局部比对搜索工具(BLAST)分析。这项分析确定了与线粒体复合物I的NDUFS2和NDUFS7有>20%序列同源性。还进行了一项生物信息学矩阵分析,识别了复合物I亚基与NiFe氢化酶之间的相似性区域(图3.7和3.11)。然后使用Clustal Ω程序对与人类蛋白质NDUFS2和NDUFS7显示相似性的原核序列进行了比对和分析,相应地见图3.8 - 3.10和图3.12 - 3.14。
3.5.1 NiFe氢化酶的活性位点
对于比较复合物I亚基和NiFe氢化酶的一个感兴趣区域是氢气的还原/氧化活性位点。尽管围绕NiFe活性位点的精确机制存在学术争议,但共识是需要两个金属离子,或共因子甲基四氢甲烷蝶呤(对于仅含铁的氢化酶),才能有效催化氢气的氧化/还原(Tard和Pickett, 2009;Ash、Kendall-Price和Vincent, 2019年)。Shafaat等人(2013年)建议,由于氢气与d6铁过渡金属的低自旋状态具有亲和力,Fe2+离子负责结合氢气,而Ni2+/3+离子裂解分子,提取质子并留下金属结合的氢化物(H-),这可能具有还原/抗氧化潜力(图3.5)。
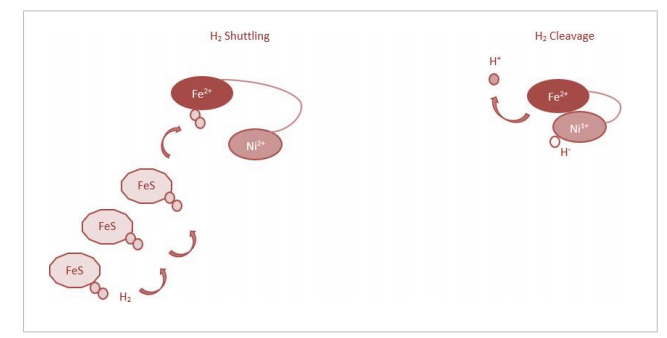
图3.5:假设的NiFe氢化酶活性。氢气裂解的提议机制示意图。左图:通过FeS簇将氢气穿梭至Fe2+。右图:氢气的裂解和保留氢化物。注意:裂解后,Ni2+变为Ni1+。
BLASTP分析将NDUFS2识别为与NiFe氢化酶的大型膜结合亚基最为相似,这些亚基负责氢气的催化活性。为了检查这些位点在NDUFS2中是否得到了良好的保守,对所关注的酶的活性位点和NDUFS2进行了比对(图3.6)。
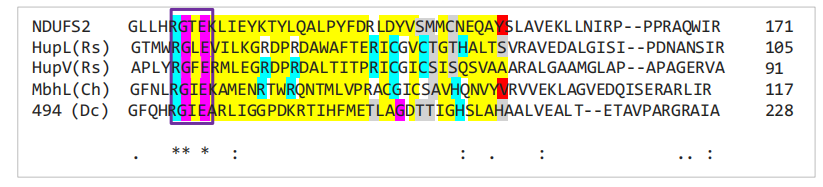
图3.6:氢化酶活性位点序列与NDUFS2的比对。NiFe氢化酶活性位点与线粒体亚基NDUFS2(人类)的序列比对。彩色部分:黄色表示活性位点的非对齐区域。蓝色表示保守的氧化还原活性残基。粉色表示保守的非氧化还原活性残基。灰色表示非保守的,但仍为氧化还原活性的,替代残基。红色突出显示酪氨酸151。框内区域确定了所研究物种中良好保守的区域。
图3.6中的数据发现,此处考虑的氢化酶的活性位点与NDUFS2之间几乎没有同源性。尽管如此,氢化酶中的关键氧化还原活性残基是保守的,这意味着在这一关键酶活动区域保留了形式和功能。可能有些相关性的是活性位点的-RGXE-基序在所有测序的蛋白质中都得到了保留,可能表明NDUFS2与NiFe氢化酶的大亚基之间存在遥远的进化关系。保守的谷氨酸残基(谷氨酸119 - NDUFS2)尤其引人关注,因为它可能与质子传递有关(Ash, Kendall-Price和Vincent, 2019年)。
NDUFS2与C. heimdallarchaeota的MbhL(酪氨酸95)之间保守的氨基酸酪氨酸151进一步引起了人们的兴趣。Kampjut和Sazanov(2020年)进行的NDUFS2晶体结构分析表明,泛醌分子在羊NDUFS2模块的酪氨酸108(对应于人类中的酪氨酸151)的4.5Å范围内对接,因此作为一个潜在的氢气作用位点引起了人们的兴趣。结构分析还确定,组氨酸59和天冬酰胺160(羊),对应于组氨酸112和天冬酰胺182(人),具有质子转位潜力。研究表明,这三个残基之间的质子穿梭机制将产生一个负电荷,增强泛醌结合潜力并降低N2 FeS簇的氧化还原电位,允许反向电子转移(Kampjut和Sazanov, 2020年)。
含有N2的NDUFS7亚基与负责质子转移的NDUFS2之间的配置表明,泛醌结合模块的这一区域很可能负责电子转移。如果氢气分子能阻止线粒体抑制剂如鱼藤酮与Fe-S簇的结合,或防止氧化还原活性硫醇的自氧化,这可以保护形式和功能,从而减少电子泄漏及随后形成的ROS,这将对下游细胞产生重大影响。如果情况确实如此,考虑到复合物I的亚基由于失去了双金属、氧化还原活性中心而极不可能保留氢气催化潜力;氢气是否在支持泛醌结合模块的功能、保护保守功能位点免受氧化或减少ROS形成方面有另一个角色?
3.5.2 NDUFS2(49kDa)
与之前的发现一致(Read等人,2021年),BLASTP分析确定NDUFS2与NiFe氢化酶的大膜结合亚基最为相似,这些亚基负责氢化酶活性。为了更好地了解NiFe氢化酶的其他区域是否可能在NDUFS2中复制,创建了一个序列同源相似性的相似矩阵,称为点图分析(图3.7)。
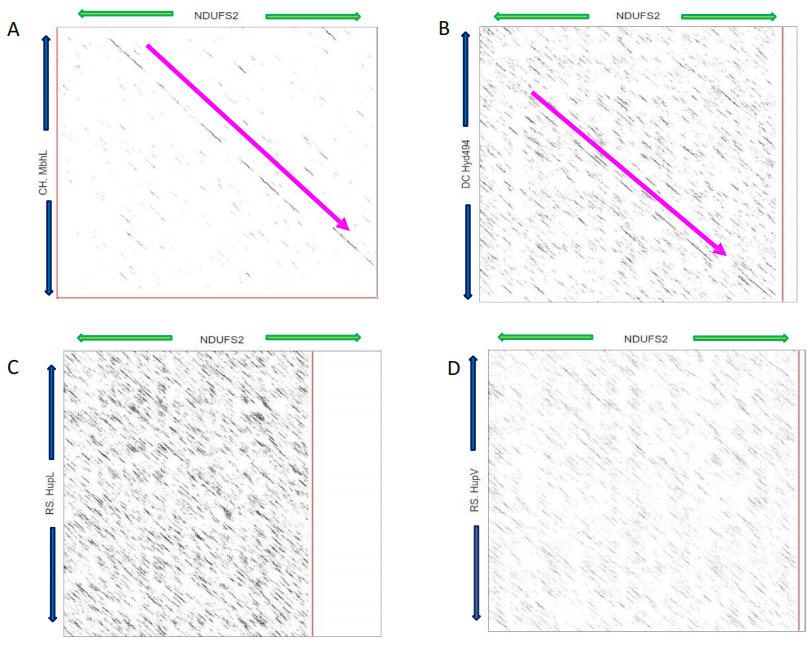
图3.7:NDUFS2和氢化酶的相似矩阵分析。点图分析NDUFS2蛋白(463aa)序列 - X轴,绿色箭头表示序列方向。感兴趣的氢化酶 - Y轴,蓝色箭头表示序列方向。清晰的对齐表明同源区域。(A) C. heimdallarchaeota MbhL B (418aa); (B) D. carbinolicus Hyd494 (494aa); (C) R. sphaeroides HupL (596aa); (D) R. sphaeroides HupV (475aa)。水平红线表示较短的氨基酸序列(NDUFS2)。垂直红线表示氢化酶的较短氨基酸序列。感兴趣区域在图3.7(A-D)中用粉红色箭头标记。
图3.7(A)确定了NDUFS2与C. heimdallarchaeota的MbhL蛋白之间更密切的相似性,如清晰的对角线模式所述。图3.7(B)确定了NDUFS2与D. carbinolicus的大型NiFe氢化酶亚基(Hyd494)之间的一些相似性。图3.7(C/D),分别来自R. sphaeroides序列HupL和HupV,显示与NDUFS2几乎没有同源性。
深入探讨序列相似性,Wirth等人(2016年)建议NDUFS2的β1-β2螺旋在位置88-96(人类)处可能具有氧化还原功能,显示出-HPXAHXVLR-排列。短序列-HPXAHXVLR-中的组氨酸88和组氨酸92被注意到与泛醌醇和NDUFS7的末端4Fe-4S簇(N2)紧密接近,这可能提供所需的氧化还原敏感性以实现向泛醌的电子转移。
对齐证据,图3.8、3.9和3.10还描述了紧接-HPXAHXVLR-基序之前的保守同源性。有趣的是,-GPQHPXA-序列,位置85-91(人类),不仅包含组氨酸88残基,而且有两个氧化还原活性的脯氨酸残基,位置86和89,它们与组氨酸88紧密接近,这可能是氧化还原特异性化学和氢化酶功能的关键因素。沿着序列在位置228-232处,存在另一个保守基序-RPGGV-,尽管它没有被确定为蛋白质修饰的位点,但在此处考虑的氢化酶中得到了很好的保留,因此可能对蛋白质结构和因此的功能至关重要。
使用ScanProsite(www.Expasy.org)对预测的翻译后蛋白修饰位点进行的调查,包括N-糖基化、N-豆蔻酰化和磷酸化位点,注意到在感兴趣区域之间NDUFS2和原核生物研究的NiFe氢化酶之间几乎没有同源性。然而,如果氢气在防止此类功能基团的氧化中发挥作用,它可以优化蛋白质结构和性能,并减少电子泄漏,从而减少或防止氧气还原为超氧化物(O2•-)和随后的ROS生成,这对于维持细胞氧化还原平衡将是极为有利的。
3.5.2.1 Candidatus heimdallarchaeon - NDUFS2
人类蛋白质NDUFS2与C. heimdallarchaeon氢化酶的大MbhL亚基之间的同源性为27%序列一致性,高于NDUFS2与D. carbinolicus的Hyd494(23%)和R. Sphaeroides(<20%)之间的同源性。

图3.8. 人类NDUFS2与C. heimdallarchaeon MbhL氢化酶蛋白(大亚基)之间Clustal比对的短节选。人类NDUFS2部分60-120和178-238,以及Candidatus heimdallarchaeon氢化酶(MbhL)的比对。蓝色/绿色高亮显示感兴趣的保守基序-GPQHP-。组氨酸88加粗并下划线。绿色/黄色高亮显示-HPXAHXVLR-基序。灰色高亮显示-RPGGV-基序。黄色/灰色表示非保守部分。
在NDUFS2和MbhL蛋白共享的显著-GPQHP-和-RPGGV-基序中,-GPQHP-组被良好保留,这可能意味着该区域保留了氧化还原功能,且组氨酸88和/或脯氨酸86和89可能是泛醌部分到完全还原的关键氨基酸。相反,-RPGGV-的唯一氧化还原活性残基精氨酸228未被保留,这促使人们假设这一特定区域对于氧化还原活性可能不重要,尽管是否这一基序具有结构重要性,或者可能受到氢气的影响,尚未明确。
3.5.2.2 Desulfovibrio carbinolicus - NDUFS2
NDUFS2与D. carbinolicus Hyd494之间的23%相似性可被认为是低的,因此不太可能在人类基因组中有同源物(Anderson和Brass, 1998)。然而,或许重要的是,考虑到组氨酸88与N2 FeS簇的接近性,-GPXHP-序列中的组氨酸残基以及邻近的部分,脯氨酸86(图3.9)被保留。由于NDUFS2被认为是关键的氧气感应模块和复合物I活动的调节器(Dunham-Snary等人,2019年),这些残基可能作为氢气活动的重要位点,氢气或许保护这些位点免受自氧化并促进最佳蛋白功能。

图3.9. 人类NDUFS2部分174-233与Desulfovibrio carbinolicus氢化酶Hyd494A的比对。蓝色高亮显示感兴趣的保守基序。组氨酸88和脯氨酸86加粗并下划线。黄色高亮显示-HXXAHXVLR-基序。灰色高亮显示-RPGGV-基序。
对-RPGGV-基序的进一步分析确定了序列相似性,两个氧化还原活性氨基酸,精氨酸228和脯氨酸229,均被完全保留。然而,这些残基是否对电子转移具有重要意义,或者是否是氢气的潜在目标,仍然不清楚,对这些结构进行晶体学分析将是有益的。
3.5.2.3 Rhodobacter sphaeroides – NDUFS2
BLASTP搜索可比序列同源性(图3.10)未得到超过20%相似性的阳性匹配。将NDUFS2与alphaproteobacterium R. sphaeroides的大型摄取氢化酶(HupL和HupV)进行比对,发现与在古菌和deltaproteobacteria中突出的-GPQHP-基序几乎没有同源性,只有脯氨酸86在人类蛋白中被保留。然而,在一些保守的-RPGGV-基序中观察到一些保守性,尽管,氧化还原敏感残基精氨酸228和脯氨酸229似乎不是R. sphaeroides功能酶这一区域的关键。

图3.10. 人类NDUFS2部分73-133和225-260与Rhodobacter sphaeroides氢化酶大亚基(HupL和HupU)的比对。人类NDUFS2与R. sphaeroides HupL和HupU氢化酶蛋白(大亚基)之间Clustal比对的短节选。组氨酸88加粗并下划线。黄色高亮显示-HXXAHXVLR-基序和保守残基。灰色高亮显示-RPGGV-基序的保守残基。
3.5.3 NDUFS7 (30kDa)
点阵图分析NDUFS7与感兴趣的NiFe氢化酶(图3.11),揭示了NDUFS7与C. heimdallarchaeota的MbhL蛋白之间强烈的相关性。
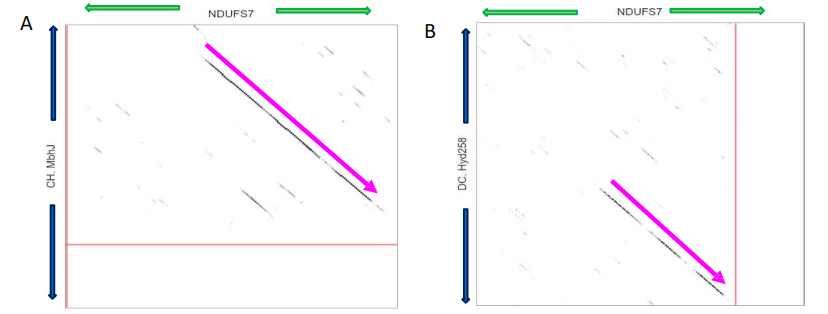
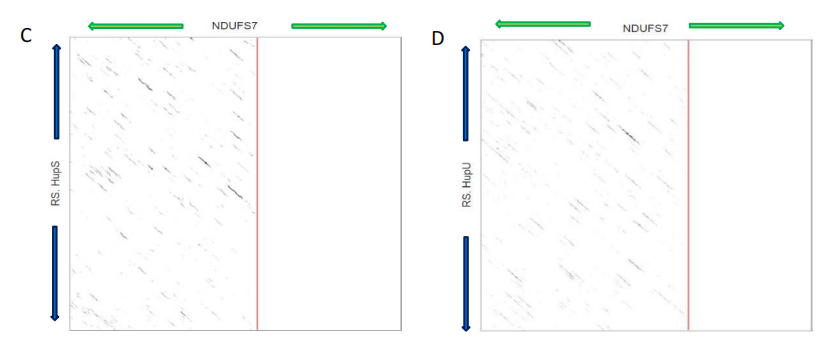
图3.11. NDUFS7和氢化酶的相似性矩阵分析。点阵图分析NDUFS7蛋白(213aa)序列 - X轴,绿色箭头表示序列方向。感兴趣的氢化酶 - Y轴,蓝色箭头表示序列方向。清晰的对齐表明同源区域。(A) D. carbinolicus Hyd258 (258aa)。(B) C. heimdallarchaeota MbhJ (155aa)。(C) R. sphaeroides HupS (369aa)。(D) R. sphaeroides HupU (330aa)。水平红线表示氢化酶氨基酸序列的截断。垂直红线表示NDUFS7氨基酸的截断。粉红色箭头突出显示由于序列相似性而感兴趣的区域。
最近的调查利用质谱和计算机模拟相结合的方法研究了NDUFS7单元,发现牛科精氨酸108和112(人类中为精氨酸111和115)在高度保守的C端-RASPRQ-基序中对于保留泛醌在疏水腔中至关重要(Yoga等人,2020年),尽管这些基序是否直接参与电子转移活动仍然没有答案。-RASPRQ-基序下游是另一个高度保守的序列-CCAVEMM-。-CCAVEMM-基序引起关注,因为它包含四个氧化还原活性残基,从双半胱氨酸残基开始(人类中的半胱氨酸88和半胱氨酸89),以双甲硫氨酸残基结束(人类中的甲硫氨酸93和甲硫氨酸94),两者都含有易于氧化和还原的硫基团,因此是有效的氧化还原介质。双半胱氨酸残基进一步引人入胜,因为这些耦合使得在N2簇还原时可以顺序解离来自氢的质子和电子(Yu等人,2020年),因此可能促进向泛醌的电子转移。如果氢气防止不适当的氧化,或稳定这一区域,那么稳定的电子供应将可用于泛醌完全还原为泛醌醇,从而增强线粒体的即时抗氧化潜力,这将产生显著的下游效应,包括增强膜电位和增加ATP的产生(Kucharská等人,2018年;Zhang等人,2018年)。
在图3.12至3.14详细描述的序列中,有一个高度保守的-IPGCPP-基序(人类中的180-185位),富含氧化还原活性的脯氨酸残基,并在183位置含有一个半胱氨酸巯基残基。拥有如此多的已知参与氧化还原化学的保守残基非常有趣,并且强烈暗示这一区域具有保守功能。有趣的是,-IPGCPP-结构域已知会经历N-豆蔻酰化,这可能对信号转导和固有免疫系统反应更为重要(Wang等人,2021a)。如果氢气与这一特定区域相互作用,可能会影响此类细胞信号传导级联反应,如MAPK途径,负责调节包括NFκB和TNF-α在内的促炎因子的表达以及在哺乳动物中调节凋亡。因此,这一区域可能与理解氢气生物活性的多效性相关。
3.5.3.1 Candidatus heimdallarchaeon – NDUFS7
超过25%的重要性阈值,C. heimdallarchaeon的BLASTP分析显示与NDUFS7有35%的相似性。这里引起兴趣的是,与deltaproteobacterium D. carbinolicus的蛋白质类似,只有半胱氨酸86和谷氨酸89在-CCAVEMMH-短序列中被保留,因此这种特定的排列不太可能保留氢化酶活性。更有可能的是,连续的半胱氨酸残基参与固定Fe簇。蛋白激酶C(PKC)磷酸化位点(-RASPRQS-)在物种间共享更多序列身份。如果氢气在这一区域抑制或促进蛋白磷酸化(第4章,第4.4.2节),这可能显著影响下游细胞信号事件,或许解释了氢气应用的多效性。
-IPGCPP-位点因N-豆蔻酰化而受到关注,也相对保守,这可能表明与氧化还原活性和/或细胞信号传导的重要关联(图3.12)在人类以及古菌中。作为一个高度氧化还原敏感的结构,位于中心的半胱氨酸182可能容易氧化。因此,产生了一个问题,氢气是否可以通过防止半胱氨酸氧化来作为N-豆蔻酰化的调节剂?
 图3.12. 人类NDUFS7部分60-110和125-185与Candidatus heimdallarchaeon氢化酶(MbhJ)的比对。人类NDUFS7与C. heimdallarchaeota MbhJ氢化酶蛋白(小亚基)之间比对的短节选。绿色高亮显示感兴趣的保守基序。黄色高亮显示高度氧化还原敏感的半胱氨酸巯基。
图3.12. 人类NDUFS7部分60-110和125-185与Candidatus heimdallarchaeon氢化酶(MbhJ)的比对。人类NDUFS7与C. heimdallarchaeota MbhJ氢化酶蛋白(小亚基)之间比对的短节选。绿色高亮显示感兴趣的保守基序。黄色高亮显示高度氧化还原敏感的半胱氨酸巯基。
3.5.3.2 Desulfovibrio carbinolicus - NDUFS7
在NiFe氢化酶的小亚基(Hyd258)和NDUFS7之间有35%的相关性,保留了Yoga等人(2020年)强调的-RASPRQS-基序,他们识别出这一区域对于保留结合口袋中的泛醌至关重要。这表明,在deltaproteobacteria中,这一片段可能对维持氢化酶酶的结构和/或功能很重要。此外,序列-RASPRQS被识别为含有丝氨酸113(人类),是PKC磷酸化的目标,因此可能与阐明氢气对蛋白质磷酸化和细胞信号事件的影响有关(第4章,第4.4.1和4.4.2节)。有趣的是,氢气被注意到会影响其他蛋白激酶途径(例如,MAPK)(Han等人,2016;Begum等人,2020),因此了解氢气是否对这一相对良好保守区域的分子活动有任何影响可能非常重要。
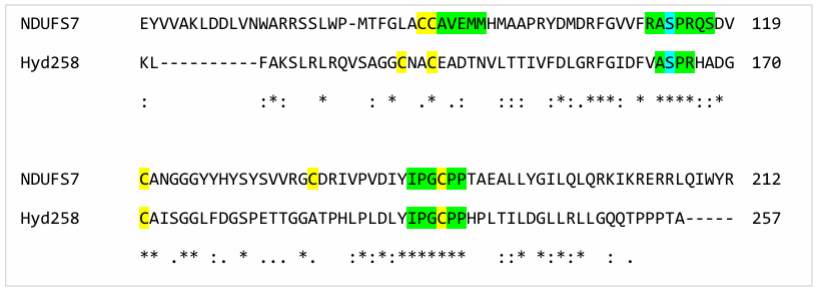
图3.13. 人类NDUFS7部分61-119和180-213与Desulfovibrio carbinolicus氢化酶Hyd258的比对。人类NDUFS7与D. carbinolicus氢化酶Hyd258之间的比对短节选。蓝色高亮显示蛋白激酶C磷酸化位点。绿色高亮显示感兴趣的保守基序。黄色高亮显示高度氧化还原敏感的半胱氨酸巯基。
在下游-CCAVEMM-基序中,很明显这一序列在D. carbinolicus中不是同源的,尽管人类的半胱氨酸86被保留下来,可能仍在氧化还原和氢生物化学中具有功能作用。-IPGCPP-基序,包含预测的N-豆蔻酰化位点-GCPP-,完全保守,进一步引起兴趣的是,这一区域是否对于氢化酶遗迹的位置或功能至关重要,因此与NDUFS7的电子传递功能相关,进而与复合物I的活性相关。
3.5.3.3. Rhodobacter sphaeroides – NDUFS7
BLASTP搜索表明,R. sphaeroides的NiFe氢化酶与线粒体复合物I的NDUFS7亚单位之间<20%的同源性。此处的观察结果表明,HupS蛋白与NDUFS7的进化关联略高于HupU,因为在-CCAVEMM-序列的双重半胱氨酸残基88-89以及-IPGCPP-基序中的氧化还原活性残基半胱氨酸283和脯氨酸280、284及285的排列中,有氧化还原活性基团保守的迹象,这些被认为是N-豆蔻酰化的目标。有趣的是,只有-RASPRQS- PKC磷酸化位点的丙氨酸111在R. sphaeroides的两个小氢化酶亚单位中都保守。关键的是,磷酸化的目标,丝氨酸113,在这些特定的NiFe氢化酶中不存在(数据未显示),表明这些特定的NiFe氢化酶与NDUFS7之间在形态和功能上几乎没有相似之处。
 图3.14. 人类NDUFS7部分60-112和143-185与Rhodobacter sphaeroides氢化酶小亚单位HupS和HupU的比对。人类NDUFS7与R. sphaeroides的小氢化酶亚单位之间的比对短节选。绿色高亮显示感兴趣的保守基序。黄色高亮显示高度氧化还原敏感的半胱氨酸巯基。
图3.14. 人类NDUFS7部分60-112和143-185与Rhodobacter sphaeroides氢化酶小亚单位HupS和HupU的比对。人类NDUFS7与R. sphaeroides的小氢化酶亚单位之间的比对短节选。绿色高亮显示感兴趣的保守基序。黄色高亮显示高度氧化还原敏感的半胱氨酸巯基。
3.6. 总结
第3章的数据显示,由于缺乏功能性的Ni-Fe双核金属核心(图3.6),人类最接近的NiFe氢化酶同源物不太可能保留经典的氢化酶活性。相反,可能在NDUFS7模块内的N2 FeS簇中发生氧化还原活动,该簇位于泛醌结合位点的紧邻处(Zickerman等人,2015)。可以假设质子通过NDUFS2和一个氧化还原调节通道,电子通过N2簇(NDUFS7)/组氨酸88(NDUFS2)相互作用转移到泛醌。在显著性阈值以上(Anderson和Brass,1998),表明保留功能的相似性,在Asgard古菌(图3.12)和本研究中考虑的δ菌(图3.13)的小氢化酶亚单位与NDUFS7之间观察到。然而,由于这个亚单位负责电子的穿梭而不是最终的氢的质子化/去质子化,NDUFS7也不可能产生或氧化氢气。是否氢气能够通过另一种机制支持此类亚单位的最优功能还有待阐明。
https://blog.sciencenet.cn/blog-41174-1450374.html
上一篇:免疫系统的性别差异
下一篇:世界第一次移植全眼球存活成功