博文
氢水缓解哮喘的肠道菌群机制研究【长海医院】  精选
精选
||
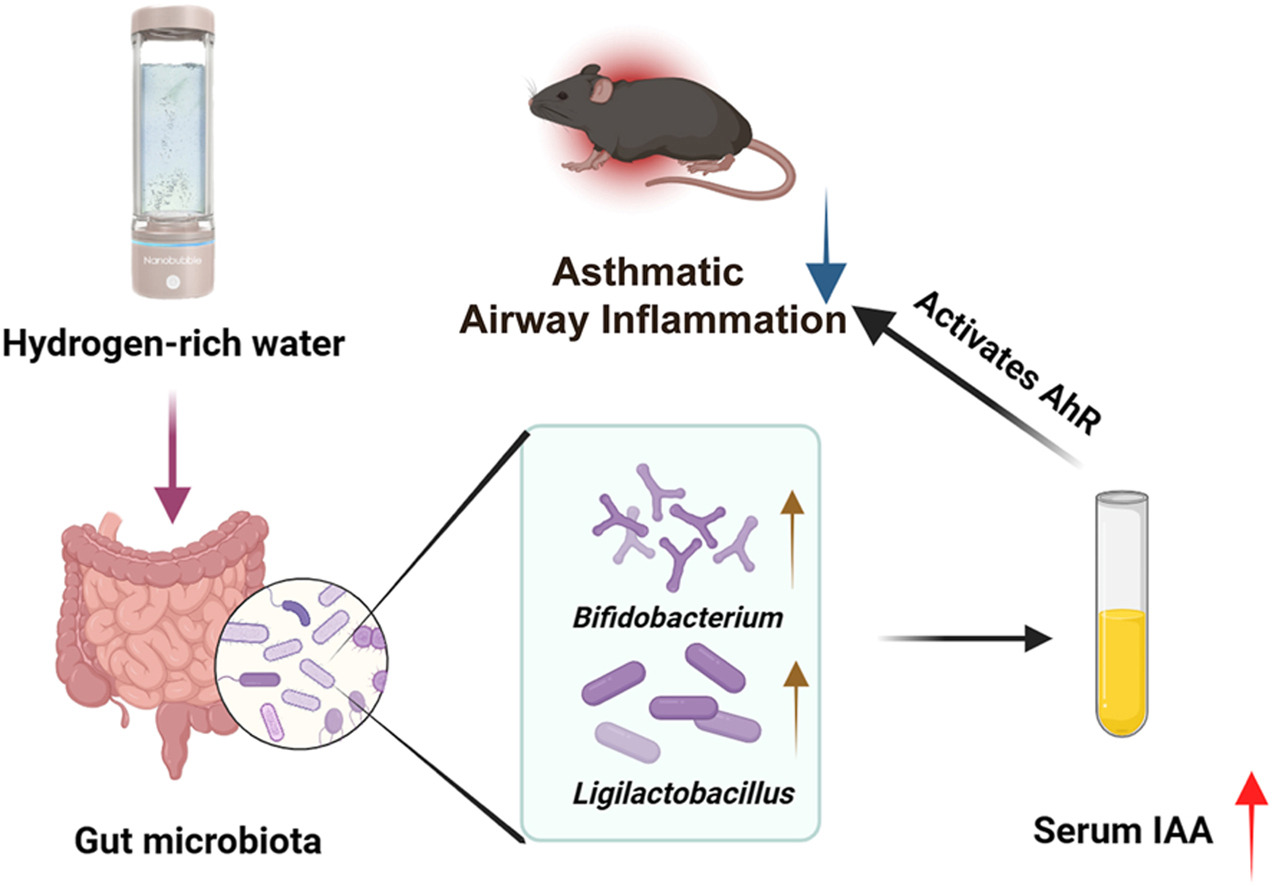
本文最近发表在国际顶级杂志《自由基生物医学》上,主要对氢水缓解哮喘气道炎症的肠道菌群机制进行了探讨,发现饮用氢水小鼠肠道内菌群产生的代谢产物色氨酸代谢物IAA能激活芳香烃受体,减少IL-13诱导的BEAS-2B细胞损伤。这一研究系统全面,不仅有利于理解氢气的生物学效应机制,也将氢水用于哮喘治疗和将来的临床试验提供了研究证据和重要理论基础。
海军军医大学附属长海医院是国内从事氢气医学研究的重要研究机构,长海医院的麻醉科、烧伤科、肾内科、神经内科、内分泌科、胸心外科、脑外科、骨科、耳鼻喉科、眼科、妇产科、呼吸科、整形科、检验科、急救科、消化科和全科医学科等十余科室先后开展氢气在一氧化碳中毒、烧伤、器官移植、器官缺血、各类炎症相关疾病的研究。
研究单位:海军军医大学附属长海医院
亮点:
富氢水缓解哮喘中的气道炎症
富氢水部分逆转哮喘小鼠的肠道菌群失衡
富氢水通过肠道菌群调节微生物衍生的色氨酸代谢物IAA的水平
IAA激活芳香烃受体并减少IL-13诱导的BEAS-2B细胞损伤
摘要:
富氢水(HRW)是一种含有高浓度氢气的饮料,因其在哮喘中的抗氧化、抗凋亡和抗炎特性而被研究。本研究调查了HRW对肠-肺轴的潜在治疗影响。我们使用16S rRNA和血清代谢组学检查了HRW干预后哮喘小鼠肠道菌群和血清代谢物的变化,随后进行了验证实验。
研究结果显示,HRW通过增加乳酸杆菌和双歧杆菌的丰度以及提高微生物衍生的血清代谢物吲哚-3-乙酸(IAA)的存在来影响肠道菌群。体内外实验均显示,HRW对哮喘小鼠气道炎症的保护作用可能与肠道菌群有关,IAA可能通过芳香烃受体(AhR)信号通路在减轻哮喘气道炎症中发挥作用。总之,HRW可以修改肠道菌群,增加双歧杆菌的丰度,提高微生物衍生的IAA水平,并激活AhR,这可能有助于缓解哮喘中的炎症。
背景
支气管哮喘是一种非传染性慢性呼吸系统疾病,其特征为肺部淋巴细胞、嗜酸性粒细胞、中性粒细胞和肥大细胞的浸润。这种疾病影响了全球超过3亿人,并预计到2025年将增加到4亿人。哮喘患者经常出现如喘息、气短、胸闷或咳嗽等症状,这些不仅严重影响患者的生活质量,还可能危及生命。根据免疫反应的类型,哮喘可以分为2型高反应性或2型低反应性两种。其中50-70%的哮喘患者属于2型高反应性,主要病理生理特征是2型炎症因子(IL-4、IL-5、IL-13)和IgE水平升高。目前临床上主要使用吸入性糖皮质激素(ICS)和β2受体激动剂来治疗2型高反应性哮喘。然而,一些患者仍然无法有效控制病情,不得不选择全身性使用糖皮质激素或针对IL-4、IL-5、IL-13和IgE的生物制剂,这带来了严重的副作用和经济负担。因此,迫切需要更多可获取且经济实惠的策略来预防和治疗哮喘。
氢气在疾病中的生物学作用历史上一直被忽视,因为其在水和身体中的溶解度低,且人体难以吸收。然而,2007年《自然医学》杂志报道了氢气可以通过选择性抗氧化机制治疗大鼠脑缺血再灌注损伤。自那以后,为了扩大氢气的使用范围,开发了氢氧混合气体、使用含氢溶液进行透析以及饮用富含氢气的水(HRW)。HRW是通过高压溶解、电解水和纳米气泡溶解氢气生成的高浓度氢气水,通常浓度达到0.6 mM(1.2 ppm)或更高。HRW因其便携性和使用安全性而广受认可。众多研究已证明HRW在多种疾病中具有抗氧化、抗凋亡和降低炎症因子水平的作用。哮喘是由固有(第二类先天淋巴细胞)和适应性(辅助T细胞2型)免疫系统驱动的炎症反应,因此HRW在其中也具有潜在的治疗作用。
肠道-肺轴失调与支气管哮喘的发展密切相关。一些研究表明,乳酸菌和双歧杆菌可以减少哮喘中的炎症。微生物产生的色氨酸代谢物具有多种生理作用,包括调节适应性和固有免疫系统,并通过结合芳香烃受体(AhR)影响哮喘。此外,最近的动物研究发现,HRW通过调节肠道菌群在化疗引起的神经性疼痛、DSS诱导的结肠炎和阿尔茨海默病中具有显著的抗炎效果。HRW对哮喘炎症的有益影响也可能部分归因于肠道菌群及其代谢物。然而,仍缺乏充分解释特定肠道菌群属和代谢物在此过程中作用的研究。
我们的研究指出,HRW在缓解由尘螨引起的哮喘小鼠气道炎症方面有效。为了调查HRW对肠道菌群组成和宿主代谢组的影响,我们对小鼠的肠道菌群进行了16S rRNA测序分析,并检查了血清代谢组。结果显示,HRW调节了肠道菌群,特别是增加了双歧杆菌的数量,并提高了微生物衍生的血清代谢物吲哚乙酸(IAA)的水平。通过体内外实验,我们发现肠道菌群在介导HRW的保护作用中发挥了重要作用,这通过粪便菌群移植(FMT)得到了证实。HRW促进了来自肠道微生物的色氨酸代谢产物吲哚乙酸(IAA)的产生,该物质通过激活AhR减少了与哮喘气道炎症相关的炎症和免疫反应。
2. 材料与方法
2.1 动物
从海军军医大学动物中心(中国上海)购买的六周龄雄性C57BL/6小鼠,在无菌条件下饲养(遵循12小时光照/黑暗循环),经过一周的适应期。实验方案经海军军医大学第一附属医院医学研究伦理委员会批准,整个过程按照相关指南和规定进行。
2.2 HDM诱导及动物处理
使用我们之前报告的方法[31]建立HDM诱导的哮喘小鼠模型。简而言之,小鼠在第0天通过腹膜内注射100 μg HDM(Greer Laboratories, Inc., Lenoir, NC, U.S.A.)或生理盐水(作为对照)进行首次致敏。在第14和21天,小鼠通过气管内挑战100 mg HDM或生理盐水。HRW是通过将300 mL纯净水注入氢氧分离型氢气分子发生器(Nanobubble Technology Co., Ltd., Shanghai, China)并开启氢气生产模式20分钟产生的。每次HRW制备后,使用分子氢测试仪对HRW进行两次测试,结果均大于1.2 ppm。在从第14到21天的挑战期间,通过口服灌胃给小鼠施用HRW(0.25 mL/10g)。在第23天,收集新鲜粪便样本用于肠道微生物群分析。通过眼球取血获得血液样本,并分离血清进行检测。
2.3 组织病理学分析和血清指标测试
将肺样本在4%甲醛中固定过夜,然后包埋在石蜡中。组织被切成4 μm厚的切片,并用苏木素和伊红(H&E)以及高碘酸-希夫(PAS)染色。使用全景切片扫描仪(3DHISTECH Co., Ltd., Hungary)扫描肺组织切片。一位不了解动物状况的病理学家描述了围绕细支气管和血管的炎性细胞浸润、黏液分泌和杯状细胞化生。使用Image-Pro Plus 6.0软件(Media Cybemetics Co., Ltd., U.S.A.)分析围绕细支气管的PAS染色阳性像素点,并计算PAS阳性区域的百分比。使用不同的酶联免疫吸附测定(ELISA)试剂盒(Elisa Biotech Co., Ltd., Shanghai, China)检测血清中的免疫球蛋白E(IgE)、白细胞介素(IL-1β、IL-4、IL-5、IL-6、IL-10、IL-13、IL-17、IL-22)、肿瘤坏死因子(TNF)-α、干扰素-γ(IFN-γ)和吲哚-3-乙酸(IAA)的水平。
2.4 FMT治疗
如Bárcena等人所描述的[32],对于FMT治疗,从供体组(HDM+HRW组)收集的新鲜粪便被放入无菌管中,立即悬浮并稀释在脱氧盐水中(0.2 g/mL),然后通过无菌纱布过滤以去除颗粒物,用于接种小鼠。在HDM第一次气管挑战前三天,给予抗生素鸡尾酒(ABX:含有1 g/L氨苄西林、0.5 g/L新霉素、0.5 g/L万古霉素和1 g/L甲硝唑,每天口服灌胃0.2 mL,禁食6小时后给予)以耗尽肠道微生物群。
2.5 小鼠干预研究与IAA HDM+IAA组,其中HDM诱导的小鼠模型小鼠每天接受腹腔注射IAA(Sigma-Aldrich, St. Louis, MO, USA),剂量为50 mg/kg体重。本研究中使用的IAA剂量基于先前发布的数据[33]和我们的初步实验。这个剂量被确定对小鼠是安全的。
2.6 代谢组学分析
血清样本在30 Hz下均质化,加入含内标物的甲醇以获得用于上机分析的样品提取物。所有样品提取物等量混合后用于LC-QTOF-MS/MS实验。通过与多个数据库(Metlin、HMDB、KEGG和MWDB)的信息结合来识别提取物中的代谢物,并通过三重四极杆(QQQ)扫描进行定量。然后筛选出差异性代谢物进行后续分析。
2.7 细胞培养和处理
BEAS-2B细胞在37°C、5% CO2条件下,使用补充了10%胎牛血清和1%青霉素溶液的DMEM高糖培养基在六孔板中培养。为了诱导类似哮喘气道炎症的细胞损伤,本实验使用了IL-13(Peprotech, 10 ng/μL)。细胞用PBS、IL-13(10 ng/μL)、IL-13(10 ng/μL)+ IAA(Sigma-Aldrich, I3750, 10 μmol/L)以及IL-13(10 ng/μL)+ IAA(10 μmol/L)+ CH-223191(Sigma-Aldrich, C8124, 10 μM)处理24小时,分为CON、IL-13、IL-13+IAA和IL-13+IAA+CH-223191组。
2.8 蛋白质印迹法
收集总细胞蛋白,金属浴100℃加热10分钟,取上清液样本,转膜并封闭。使用以下抗体进行蛋白质印迹分析:抗AhR(Abcam, ab308215, 1:500)、抗CYP1A1(Abcam, ab126887, 0.3 μg/mL)、辣根过氧化物酶(HRP)标记的抗β-肌动蛋白(Abcam, ab20272, 1:5000)、HRP标记的山羊抗兔IgG(Servicebio Co., Ltd., Wuhan, China, GB23303, 1:3000)、HRP标记的驴抗山羊IgG(Servicebio, GB23404, 1:10000)。
2.9 实时定量PCR
收集细胞并放入1.5mL EP管中,加入适量Trizol进行裂解,然后转移、离心并进行琼脂糖凝胶电泳。使用DEPC水归零管,通过核酸浓度测定RNA的浓度和纯度。随后使用逆转录试剂盒将RNA逆转录为cDNA。设置实时PCR系统并将其放置在荧光定量PCR仪器上。使用相对表达计算公式获得溶解曲线。反应产生溶解曲线,并使用相对表达公式确定每个样本的相对定量结果。
2.10 统计分析
使用GraphPad Prism版本9.5.0(GraphPad Software, San Diego, USA)进行统计分析。统计测试的选择基于数据分布和方差属性的适当假设。多组(两组以上)的显著性评估使用单因素方差分析(ANOVA)和Dunnett事后检验(参数)或Kruskal-Wallis H检验和Dunn多重比较检验(非参数)。使用RStudio v3.5.1(RStudio Inc., Boston, USA)进行冗余分析(RDA)和Spearman相关性分析,以评估哮喘中气道炎症相关指标与相关细菌属或代谢物变量之间的关系。P < 0.05被视为统计学显著(在执行多次测试时对多重比较进行调整)。
3. 结果
3.1 氢气水缓解HDM诱导的哮喘小鼠气道炎症
为了探索氢气水(HRW)的效果,通过灌胃给予HDM诱导的哮喘小鼠1周的HRW(图1A)。实验结束时,肺组织的苏木精-伊红(H&E)染色显示HRW减少了气道和血管周围区域的炎性细胞浸润,并减少了肺泡腔内自由巨噬细胞和粒细胞的数量。高碘酸-希夫(PAS)染色揭示HRW显著减少了小鼠气管中的黏液分泌和杯状细胞化生(PAS染色阳性区域)(图1B)。使用Image-Pro Plus 6.0软件分析发现,哮喘小鼠在HRW处理后PAS阳性染色像素数量显著减少(P < 0.001)(图1C)。黏蛋白5AC是急性哮喘发作期间黏液中主要的大分子蛋白质[34],免疫荧光染色显示HRW显著降低了哮喘小鼠气道周围的黏蛋白5AC表达(图1D)。值得注意的是,与HDM组相比,HRW给药显著降低了血清中炎症因子(IL-4、IL-5、IL-13)和IgE的水平(图E-H)(P < 0.001),这些被认为与哮喘发展的分子机制密切相关[35]。这些结果证明HRW可以有效缓解哮喘小鼠的气道炎症。
3.2 HRW调节HDM诱导的哮喘小鼠肠道菌群
最近的研究表明,微生物-肠-肺轴在慢性呼吸系统疾病中具有重要意义[36-39],因此我们通过在研究结束时收集的粪便样本进行16S rRNA基因测序来检查HRW对肠道菌群组成的影响。与HDM组相比,HRW并未影响香农指数(P = 0.614)(图2A)和辛普森指数(P = 0.126)(图2B),表明HRW无法通过α多样性分析改变物种丰富度和物种均匀度。基于布雷-柯蒂斯算法的主坐标分析(PCoA)揭示了每个组肠道菌群组成的独特聚类(P = 0.001)(图2C)。分析了不同分类水平上肠道菌群的相对丰度。图2D-E显示了门和属水平上前10个微生物群落,表明在哮喘小鼠模型建立后及HRW干预后肠道菌群发生了显著变化。前35个属的热图分析显示,HRW处理后肠道菌群的组成发生了实质性变化,呈现出向更健康状态转变的趋势(图2F)。此外,使用线性判别分析效应大小(LEfSe,美国哈佛大学Huttenhower实验室)评估主要分类群的相对丰度。根据线性判别分析(LDA)分数> 4的原则,LEfSe分析确定了五个显著分化的门:放线菌门、疣微菌门、拟杆菌门、放线菌总科和变形菌门。在属水平上,有五个显著分化的属,对照组显著富集Dubosiella和Parasutterella,HDM组富集Akkermansia,而HDM+HRW组富集双歧杆菌(图2G)。
3.3 HRW对HDM诱导的哮喘小鼠肠道菌群在门水平和属水平上的影响
在门水平上,与对照组相比,放线菌门(P = 0.002)、放线菌总科(P = 0.01)和拟杆菌门(P = 0.0178)减少(图3A-C),而哮喘模型小鼠(HDM组)中的疣微菌门(P = 0.0027)增加(图3D)。HRW给药显著增加了放线菌门的相对丰度(P = 0.007)(图3A)。在属水平上,与对照组相比,哮喘小鼠(HDM组)中的Parasutterella(P = 0.009)、双歧杆菌(P = 0.003)和Dubosiella(P = 0.03)减少,Parabacteroides(P = 0.0008)和Akkermansia(P = 0.0068)增加(图3E, F, G, I, J)。HRW给药显著增加了双歧杆菌(P = 0.006)和Ligilactobacillus(P = 0.002)的丰度,并减少了Parabacteroides的丰度(P = 0.0292)(图3F, H, I)。冗余分析(RDA)和相关性热图分析显示,Parasutterella、双歧杆菌和Dubosiella与哮喘指标呈负相关,表明多种肠道菌群参与了缓解哮喘小鼠炎症的过程(图3K-L)。
3.4 HRW显著富集HDM诱导的哮喘小鼠中的色氨酸代谢物
近期研究表明,肠道菌群失调影响血液代谢组,并与哮喘风险相关[40]。为探究HRW缓解哮喘小鼠气道炎症是否与血清代谢组变化有关,我们使用液相色谱-四极杆飞行时间串联质谱(LC-QTOF-MS/MS)平台对各组小鼠的血清进行了非靶向代谢组学分析。通过基于Q-Trap平台的多反应监测(MRM)准确定量了代谢物。主成分分析(PCA)显示三组小鼠间血清代谢组存在明显差异(图4A)。通过差异代谢物聚类热图分析,识别出三组间显著的差异代谢物(图5B)。正交偏最小二乘判别分析(OPLS-DA)得分图展示了基于血清代谢特征的组别明显分离。OPLS-DA模型显示出极好的分类和预测能力,如截距R2Y和Q2超过0.9所示(图4C)。使用火山图筛选VIP > 1.0、FC > 2或< 0.5且P < 0.05的代谢物。结果显示,在建立哮喘小鼠模型后,有39个代谢物上调,305个代谢物下调。HRW干预后,85个代谢物上调,34个代谢物下调。其中50个代谢物在HDM组中下调而在HDM+HRW组中上调,这些代谢物被鉴定为关键代谢物(图4D,表S1-3)。为探究HRW对哮喘小鼠代谢通路的影响,进行了京都基因与基因组百科全书(KEGG)通路富集分析。超几何检验分析揭示HRW显著富集了色氨酸代谢和胆汁分泌通路,并对色氨酸代谢影响最为显著(P = 0.00053)(图4E,表S4)。进一步的分析聚焦于色氨酸代谢通路(ko00380)的代谢物热图。值得注意的是,吲哚-3-乙酸(IAA)被识别为该通路中的关键代谢物(图4F,表S3)。根据先前的研究,IAA是色氨酸衍生的一种细菌代谢物,作为AhR的特异性配体,是AhR通路的主要激活剂[41],因此我们假设HRW对IAA的调节作用可能影响AhR信号通路的激活水平。因此,我们测试了与AhR信号通路相关的血清细胞因子表达水平[41]。我们的结果显示HRW显著增加了血清中IAA的水平(图S1A),并降低了包括IL-1β、IL-6、IL-17、IL-22和TNF-α在内的促炎细胞因子的表达水平(图S1B, C, E, F, G),同时增加了包括IL-10和INF-γ在内的抗炎细胞因子的水平(图S1D, H)。进行了Spearman相关性分析以检查差异色氨酸代谢物与AhR相关炎症因子以及哮喘中炎症相关标记物之间的关系。结果显示IAA与哮喘炎症相关标记物及AhR信号通路的促炎细胞因子呈负相关。相反,IAA与AhR信号通路的抗炎细胞因子呈正相关(图S1I)。分析差异色氨酸代谢物与主要肠道菌群的关系揭示了IAA与Parasutterella、双歧杆菌和Dubosiella呈正相关(图S1J)。
3.5 FMT转移了HRW对哮喘气道炎症的保护作用
我们对哮喘小鼠的肠道微生物组和血清代谢物的分析表明,HRW影响了肠道微生物组成,导致双歧杆菌的富集以及血清中色氨酸代谢产物IAA的增加。近期研究强调了肠-肺轴与慢性呼吸疾病之间的显著联系[42],这表明粪便微生物移植(FMT)可能是恢复疾病治疗中肠道微生态的潜在策略。因此,我们将HRW处理的哮喘小鼠的粪便微生物通过每日灌胃的方式移植给了接受者哮喘小鼠,持续1周(图5A)。结果显示,与哮喘小鼠相比,FMT后哮喘小鼠的气道炎症显著缓解,包括气道和血管周围炎性细胞浸润减少,以及PAS染色阳性区域减少(图5B)。我们还发现,FMT减少了哮喘小鼠气道周围的黏蛋白5AC的表达(图5C)。FMT显著增加了血清中代谢物IAA的水平(图5D),并降低了哮喘相关细胞因子IL-4、IL-5、IL-13、TSLP的水平(P<0.001)(图5E-H),以及生物标志物IgE的水平(P<0.001)(图5I),同时增加了抗炎细胞因子IL-10和INF-γ的水平(P<0.001)(图5J-K)。令人惊讶的是,我们发现FMT转移了HRW对哮喘气道炎症的保护作用。
3.6 微生物衍生的IAA减轻了HDM诱导的哮喘小鼠的气道炎症
代谢组学研究表明,IAA水平与哮喘炎症指标呈负相关,为了验证IAA在减少哮喘气道炎症中的作用,我们给哮喘小鼠进行了补充微生物衍生代谢物IAA的腹腔注射(图6A)。与哮喘小鼠相比,IAA减轻了气道炎症,包括减少了气道和血管周围的炎性细胞浸润,以及减少了PAS染色阳性区域(图6B)。如预期的那样,IAA还减少了哮喘小鼠气道周围的黏蛋白5AC的表达(图6C)。
小鼠血清检测结果证实,接受IAA腹腔注射后,哮喘小鼠血清中的IAA水平显著增加(P<0.001)(图6D),我们还发现IAA能显著降低血清中IL-4(P=0.01)、IL-13(P=0.002)和TSLP(P<0.001)的水平(图6E, G, H),但未能显著降低IL-5(P=0.44)和IgE(P=0.05)的水平(图6F, I),但这足以证明IAA降低了哮喘关键机制涉及的重要指标。我们还发现,IAA能提高抗炎因子IL-10的水平(P=0.001)(图6J),但未能显著提高INF-γ的水平(P=0.10)(图6K)。总之,这部分实验确认了微生物衍生的IAA减轻了哮喘小鼠的气道炎症。
3.7 IAA通过激活AhR信号通路减轻哮喘气道炎症
我们在上述研究中已经确认了IAA减轻了哮喘气道炎症。以前的研究报告称,微生物衍生的IAA是AhR的配体,它激活AhR信号通路并与多种炎症通路交叉对话[43],可能参与减轻哮喘气道炎症。
人支气管上皮细胞(BEAS-2B)分泌多种典型的促炎因子,如IL-6、IL-8、IL-33、TSLP等,这些因子的表达涉及哮喘的发病机制[44]。在体外实验中,我们利用IL-13诱导BEAS-2B损伤以模拟哮喘气道炎症,并在与IAA共培养后,IL-6、IL-8、IL-33和TSLP的mRNA表达显著降低,而在加入AhR拮抗剂CH-223191后反弹,Western Blot检测也显示IAA增加了AhR和CYP1A1的表达,并可被CH-223191抑制,这证实了IAA通过激活AhR信号通路减轻了IL-13诱导的BEAS-2B细胞损伤。总之,我们证明了IAA通过激活AhR信号通路减轻了哮喘气道炎症。
4. 讨论
哮喘是全球影响超过3亿人的慢性呼吸道疾病[2],其特点是气道的慢性炎症,涉及嗜酸性粒细胞、淋巴细胞、中性粒细胞、气道上皮细胞和肥大细胞等多种细胞[45]。哮喘治疗的基石通常包括使用吸入性糖皮质激素和支气管舒张剂来有效管理病情随时间的发展[6]。然而,许多哮喘患者由于携带药物不便或难以坚持使用等原因而遇到遵循处方用药计划的障碍[7],这可能导致某些患者发展为难治性哮喘,凸显了需要更实惠和方便的治疗策略的必要性。
在过去的几十年中,动物和人类研究已经证实氢富水(HRW)在多种非肿瘤性疾病中具有抗炎、抗凋亡和抗氧化作用[46]。关于其作用机制,初步认为氢的主要细胞内靶点是线粒体,氧化的Fe-卟啉被确定为氢消除活性氧的目标。此外,氢可以激活Nrf2受体,对心血管健康和抗衰老有益处[46]。在实践中,人们通常是通过饮用HRW来获取氢气。然而,氢气通过血液直接到达远处器官可能是一个挑战,这表明HRW可能通过其他机制发挥作用。
最近大量研究发现肠道与肺部之间存在远距离双向调控机制,即“肠肺轴”,其中肠道菌群及其代谢产物起着重要作用[47]。基于肠肺轴的肺部疾病的诊疗研究引起了研究者的关注[42,48,49]。刘等人进行的随机对照试验显示,在接受常规治疗的同时补充益生菌双歧杆菌Probio-M8后,哮喘患者肠道潜在益生菌动物双歧杆菌、长双歧杆菌和Prevotella sp. CAG增加,Parabacteroides distasonis和Clostridiales菌减少。血清代谢物中的十二烷酸、色氨酸和鞘磷脂水平升高,可能通过激活多个抗炎途径缓解哮喘[50]。同时,已经明确证明HRW中的氢调节肠道中的菌群结构并影响代谢途径。这种调节改善了宿主的生理功能,可能有助于减轻各种疾病的发生和发展[30,51,52]。在我们的研究中,我们还发现HRW调节了肠道微生物组的结构,提高了Ligilactobacillus和双歧杆菌的相对丰度,丰富了双歧杆菌。在血清代谢物水平上,我们发现HRW富集了色氨酸代谢途径,IAA可能是具有生物学效应的微生物来源的关键代谢物。通过文献回顾和生物信息学分析,我们发现更多的双歧杆菌将更多色氨酸代谢产生IAA,通过激活AhR信号通路缓解肺部哮喘气道炎症。我们的研究为哮喘中的肠肺轴提供了新的视角,并为氢医学领域带来了新的发现。
AhR是周期性昼夜蛋白(PER)-AHR核转位子(ARNT)-单一心蛋白(SIM)超家族转录因子的成员,据认为AhR是屏障部位免疫反应的重要组成部分[53],与上皮细胞更新、屏障功能完整性和免疫细胞反应有关。AhR信号通路的激活可以在过敏性疾病[54]、新型冠状病毒肺炎[55]和病毒感染中肺屏障破坏[56]中发挥作用,我们的研究也证实了激活AhR信号通路可减轻哮喘气道炎症。肠道菌群如双歧杆菌和乳酸杆菌可以连续代谢色氨酸形成吲哚衍生物,如色胺、IAA、吲哚-3-甲醛等[41],可以作为AhR的天然配体,从而激活AhR信号通路以减轻哮喘气道炎症,这为开发针对AhR信号通路的益生菌和药物以减轻哮喘气道炎症开辟了可能性。
虽然我们的研究取得了显著的成果,但仍存在一些局限性,例如依赖于宏观基因组测序来收集有关肠道微生物组的额外生物信息,以及对所涉及机制的深入探索不够。未来,我们打算加强研究工作。尽管如此,这些发现已经为未来的哮喘研究提供了有价值的见解。
总之,我们的研究表明,富氢水通过影响肠道微生物组成、增加血清中代谢物IAA的水平,并激活AhR信号通路,能够减轻哮喘气道炎症。这项研究为氢气医学领域带来了新的见解,并为开发益生菌和针对AhR信号通路的药物以缓解哮喘气道炎症提供了可能的方向。
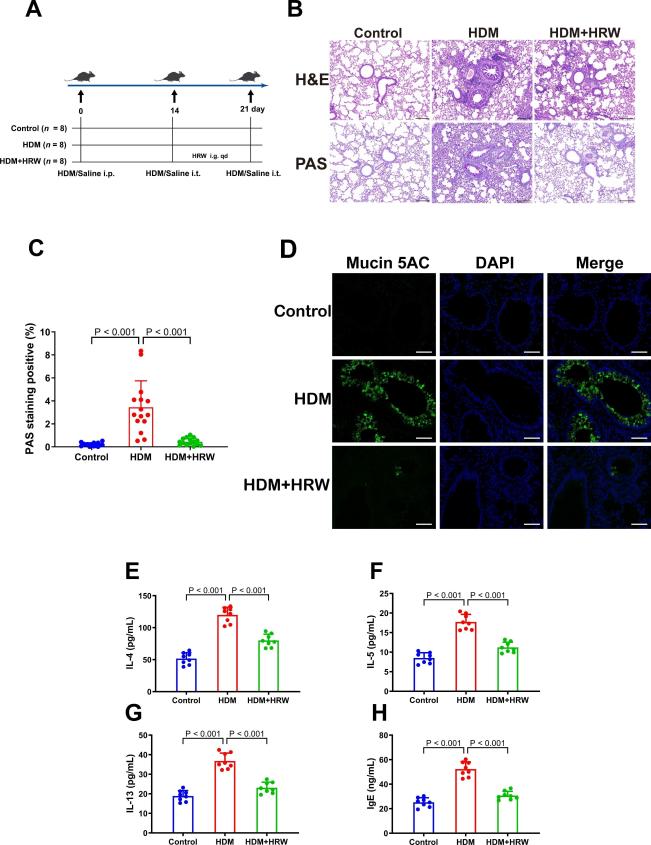
图1:HRW给药缓解了哮喘小鼠的气道炎症。
(A)研究设计:小鼠在第0天首先用HDM或盐水(作为对照)进行腹膜内致敏。在第14天和第21天,小鼠通过气管内挑战接受100 mg HDM或盐水。在14至21天的挑战期间,通过口服灌胃给予小鼠HRW(0.25 mL/10g)。(B)肺组织的H&E和PAS染色的典型显微照片(比例尺:100 μm)。(C)气管周围PAS染色阳性像素的百分比(n = 3,每个高倍视野五个)。(D)各组Mucin 5AC的免疫荧光染色图像(比例尺:50 μm)。(E-H)血清中炎性细胞因子(IL-4、IL-5、IL-13)和生物标志物IgE的水平(n = 8)。结果表示为平均值±标准差。P值通过单因素方差分析与Dunnett事后检验确定。
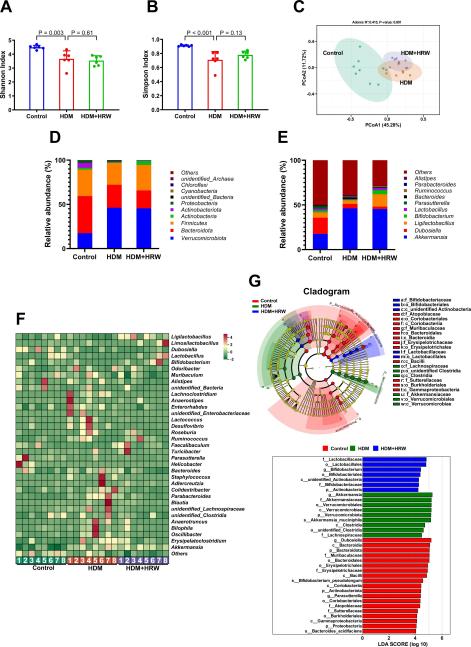
图2:HRW调节了HDM诱导的哮喘小鼠中的肠道微生物失衡。
(A)不同组的香农指数和(B)辛普森指数(n = 6)。(C)三组肠道微生物的布雷-柯蒂斯PCoA分析(n = 8)。(D)在门水平上发现的前10个微生物分类群。(E)在属水平上发现的前10个微生物分类群。(F)基于LDA(LDA > 4)的控制组、HDM组和HDM+HRW组之间前35个属的热图分析(n = 8)。(G)进化分支图和分布直方图基于LDA(LDA > 4)(n = 8)。
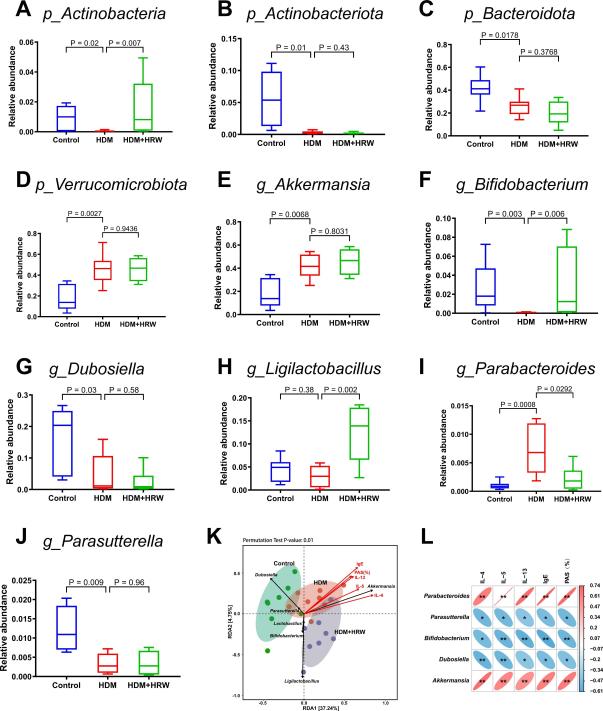
图3:三组中主要肠道微生物在门水平和属水平的分布情况。
(A)-(D)在门水平上选择的细菌(n = 6-8)。(E)-(J)在属水平上选择的细菌(n = 6-8)。(K)与哮喘气道炎症相关的主导差异菌属和指标的RDA分析(n = 8)。(L)差异优势属与哮喘气道炎症相关标志物关联的热图(n = 8)。P值<0.05被认为具有统计学意义。红色表示正相关(相关R值>0),蓝色表示负相关(相关R值<0)。*P < 0.05, **P < 0.01。
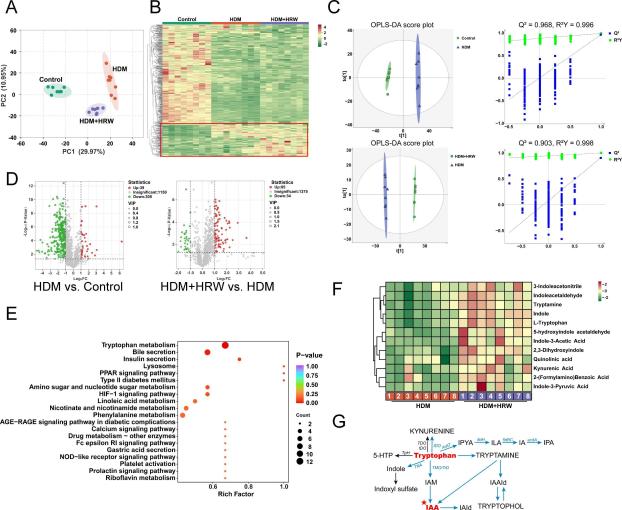
图4:HRW显著丰富了HDM诱导的哮喘小鼠中的色氨酸代谢物
(A)三组小鼠血清代谢组的PCA分析。(B)三组间不同代谢物的聚类热图。(C)Control组对HDM组、HDM组对HDM+HRW组的OPLS-DA得分图及其置换测试。(D)HDM组对Control组、HDM+HRW组对HDM组的火山图(FC > 2或< 0.5, VIP > 1, P < 0.05视为显著差异)。(E)HDM+HRW组与HDM组之间的差异代谢物的KEGG途径富集分析。(F)HDM+HRW组与HDM组之间的色氨酸代谢途径差异代谢物的聚类热图。(G)色氨酸代谢途径的简化图,其中IAA为微生物来源的AhR配体。AhR:芳烃受体;IDO:吲哚胺2,3-双加氧酶;TDO:色氨酸2,3-双加氧酶;5-HTP:5-羟色氨酸;ArAT:芳香族氨基酸氨基转移酶;IPYA:吲哚-3-丙酮酸;fldH:苯乳酸脱氢酶;ILA:吲哚-3-乳酸;fldBC:苯乳酸脱水酶;IA:吲哚丙烯酸;acdA:酰基辅酶A脱氢酶;IPA:吲哚-3-丙酸;TpH:色氨酸羟化酶;TNA:色氨酸酶;TMO:色氨酸2-单加氧酶;TrD:色氨酸脱羧酶;IAM:吲哚-3-乙酰胺;IAA:吲哚-3-乙酸;IAld:吲哚-3-醛;IAAld:吲哚-3-乙醛醛。
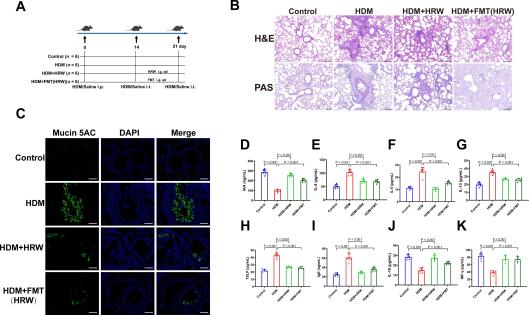
图5:FMT转移了HRW对哮喘气道炎症的保护作用。
(A) 研究设计:如前所述建立哮喘小鼠模型,在挑战期间第14-21天通过灌胃给予FMT,并在FMT前三天给予ABX以消除肠道微生物组。(B) 肺组织的H&E和PAS染色的典型显微照片(比例尺:100 μm)。(C) 每组的Mucin 5AC免疫荧光染色图像(比例尺:50 μm)。(D-K) 血清中的IAA水平、哮喘相关的促炎细胞因子(IL-4、IL-5、IL-13、TSLP)、抗炎细胞因子(IL-10、INF-γ)和IgE(n = 5-6)。结果表示为平均值±标准差。P值通过单因素方差分析与Dunnett事后检验确定。
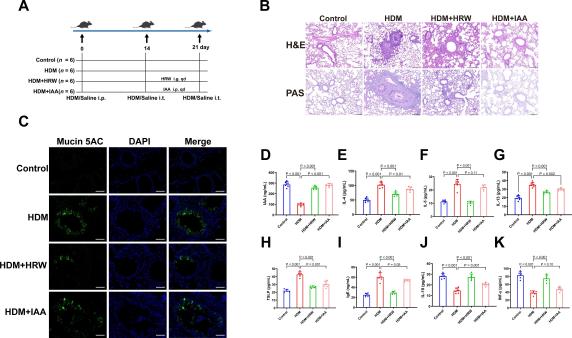
图6:微生物来源的IAA缓解HDM诱导的哮喘小鼠的气道炎症。
(A) 研究设计:如前所述建立哮喘小鼠模型,在挑战期第14-21天每天通过腹膜内注射50 mg/kg的IAA。(B) 肺组织的H&E和PAS染色的典型显微照片(比例尺:100 μm)。(C) 每组的Mucin 5AC免疫荧光染色图像(比例尺:50 μm)。(D-K) 血清中的IAA水平、哮喘相关的促炎细胞因子(IL-4、IL-5、IL-13、TSLP)、抗炎细胞因子(IL-10、INF-γ)和IgE(n = 5-6)。结果表示为平均值±标准差。P值通过单因素方差分析与Dunnett事后检验确定。
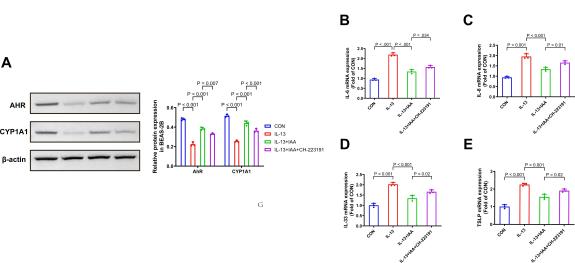
图7:IAA通过激活AhR信号通路减轻哮喘气道炎症。
(A) 使用IL-13诱导BEAS-2B细胞的炎症,以模拟哮喘气道炎症,在用IAA和AhR受体拮抗剂CH-223191处理后,通过蛋白质印迹检测AhR和CYP1A1蛋白的表达。(B-E) 各组BEAS-2B细胞中IL-6、IL-8、IL-33和TSLP mRNA的表达。结果表示为平均值±标准差。P值通过单因素方差分析与Dunnett事后检验确定。
图S1:(A-H) 各组小鼠血清中与AhR信号通路相关的IAA、促炎细胞因子(IL-1β、IL-6、IL-17、IL-22、TNF-α)和抗炎细胞因子(IL-10、INF-γ)的表达水平。(I) 色氨酸途径的差异代谢物与气道炎症标志物(IL-4、IL-5、IL-13、IgE、PAS(%))及AhR信号通路的细胞因子(IL-1β、IL-6、IL-10、IL-17、IL-22、INF-γ、TNF-α)的Spearman相关热图分析。P值<0.05被认为具有统计学意义。绿色表示正相关(相关R值>0),蓝色表示负相关(相关R值<0)。(J) 不同优势细菌与色氨酸途径代谢物的关联图。结果表示为平均值±标准差。P值通过单因素方差分析与Dunnett事后检验确定。*P < 0.05, **P < 0.01, ***P < 0.001。
图S2:各组BEAS-2B细胞蛋白Western bolt的原始图像(n = 3)。
图S3:主导肠道菌群、差异色氨酸代谢物和哮喘炎症相关指标的网络图。
绿色圆圈:主导肠道微生物;红色三角形:差异色氨酸代谢物;黄色菱形:哮喘炎症相关指标。红线:正相关;蓝线:负相关;灰线:无显著性。表S1:HDM组与对照组小鼠血清中显著不同的代谢物。
表S2:HDM+HRW组与HDM组小鼠血清中显著不同的代谢物。
表S3:在建立哮喘小鼠模型后下调的代谢物和HRW处理后上调的代谢物,同时指出它们在KEGG数据库中的ID(表明这些代谢物具有生物学效应)。
表S4:对HDM+HRW组与HDM组之间的差异代谢途径进行超几何分布计算,并计算超几何检验的P值。
表S5:qRT-PCR的引物序列。
https://blog.sciencenet.cn/blog-41174-1447024.html
上一篇:内源性神经活动诱导轴突连接机制
下一篇:不同浓度氢水干预的高尿酸血症临床试验