博文
凝胶可保护治疗性蛋白质免于失活《自然》  精选
精选
|
这种方法不仅是药物运输的重要策略,也将是许多生物分子的保存方法,例如我们生物学实验经常使用的各种抗体都是容易被破坏的蛋白质,如果采用这种方法,或许能大大减少运输和存储费用。
在2023年销量前十的药物中,超过一半是治疗性蛋白。然而,这些药物有一个缺点:它们对温度敏感,因此需要在整个从生产到使用的旅程中保持持续的低温。满足这一需求需要严格的基础设施、程序和技术——统称为冷链管理。然而,这种管理既昂贵又资源密集,限制了一些国家获得救命治疗药物(如胰岛素)的机会。Bianco等人在《自然》杂志上发表文章,提出了一种创新且简单的策略,将蛋白质储存并递送于凝胶中。他们的方法所需资源最少,为低收入国家的冷链管理挑战提供了一个潜在的解决方案。
像许多其他蛋白质一样,胰岛素具有很高的聚集倾向——从而失去其生物活性——并且对温度、光和振动敏感。胰岛素的注射溶液通常通过仔细配方来稳定,例如与添加剂和pH缓冲剂混合,但它们仍然需要低温存储(约2-8°C)和小心处理。因此,需要一种方便的胰岛素储存方法来绕过这些昂贵的限制。一个最佳的方法将消除对温度控制的需求,并产生一种在运输过程中能够容忍适度振动的胰岛素形式。它还需要便宜且易于制备,符合安全规定,并保留胰岛素的生物活性。
通过添加简单的稳定化合物,可以保护胰岛素的注射溶液免受热和机械应力的影响。例如,据报道有一种稳定剂由一个聚合物分子组成,该分子通过非共价相互作用连接到一个化学基团,像锁和钥匙一样配合在一起。这种稳定剂可以在37°C下防止连续搅拌的胰岛素聚集100小时,但它不可避免地会干扰蛋白质的生物功能,延长其作用时间。另一种由两个分子领域组成的聚合物——一个由水溶性单体形成,另一个由疏水性单体形成——可以在37°C下防止连续搅拌的商业胰岛素制剂聚集6个月。然而,任何涉及添加新稳定剂的胰岛素保存策略都需要仔细评估其长期安全性。
作为替代方案,使用富含水的凝胶系统(水凝胶)储存药物——它由一个扩展的、自组装的分子网络组成,可以捕获和限制药物,从而保护它们免于聚集。通常,含有多达99.5%水分的水凝胶被认为是理想的药物递送系统,因为它们与柔软的生物组织相似。然而,从传统水凝胶中释放药物通常需要一个化学触发器或引起凝胶膨胀的刺激。此外,药物分子在凝胶网络中的受限扩散意味着这些分子可能需要很长时间(0.3-30小时)才能逃逸。
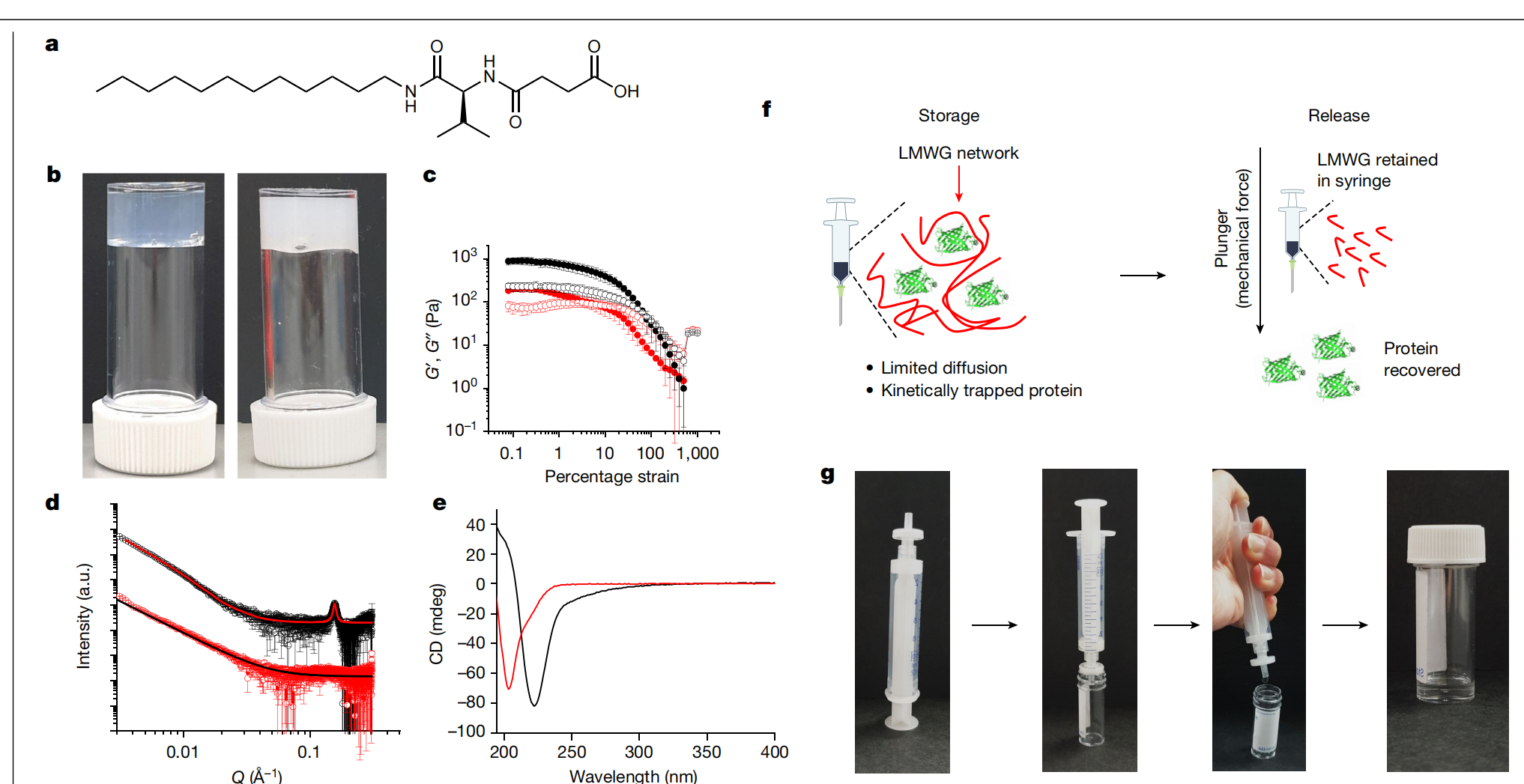
Bianco等人现在报告了一种用于储存蛋白质的凝胶系统,该系统避免了使用添加剂和稳定剂,并通过利用水凝胶的一个特征:其较差的机械强度,巧妙地解决了药物释放问题。作者使用了一个小肽分子作为胶凝剂(见论文图1a),它在19ºC和大约中性pH值的水溶液中瞬间自组装,形成由纤维扩展网络组成的凝胶。通过向溶液中添加钙盐可以增加凝胶的机械强度。
作者们观察到,当大分子如蛋白质被添加到溶液中时,它们会被捕获在形成的凝胶纤维之间的空间里。值得注意的是,通过使用注射器将凝胶推过过滤器,可以轻松地将这些被困住的分子作为溶液回收(图1)。注射器施加的压力会压碎凝胶,不溶的凝胶碎片被过滤器截留;只有大分子的溶液能够通过。
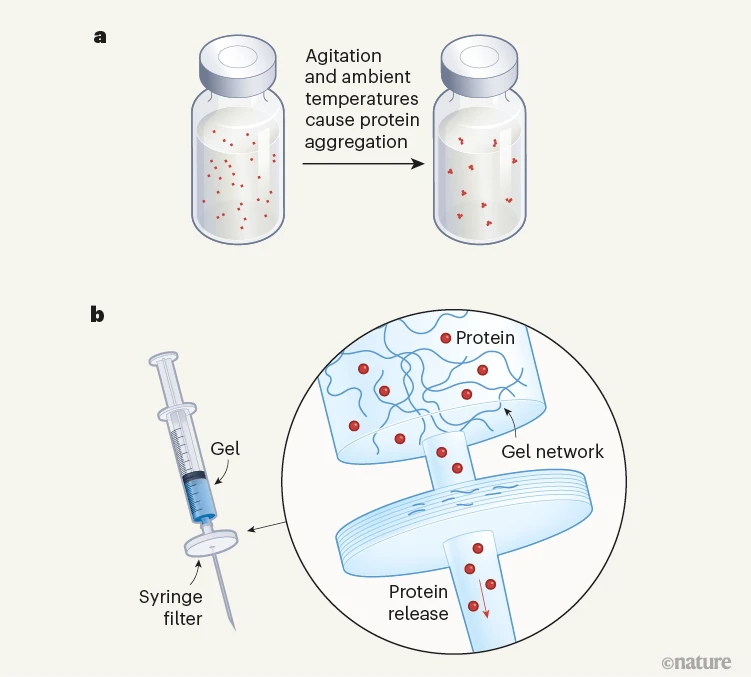
图1 | 一种用于储存和稳定蛋白质的基于凝胶的系统。a, 许多蛋白质在环境温度下并且受到搅动时会聚集成团块,从而失去其生物活性。这对于像胰岛素这样的治疗性蛋白来说是个问题,因此它们需要在持续低温条件下运输和存储。b, Bianco等人报告了一种自组装的富含水的凝胶,它将蛋白质困在其分子网络中,防止了由热和振动引起的聚集。当使用注射器将凝胶推过过滤器时,凝胶的分子网络在施加的压力下解体。蛋白质被释放并以溶液形式流过过滤器。这种基于凝胶的系统有可能消除运输和储存治疗性蛋白所需的昂贵冷藏系统的需求——这对资源匮乏的地区特别有益。
Bianco和同事们确定了封装胰岛素的凝胶化条件,浓度为每毫升3.2毫克,与商业胰岛素制剂的浓度相当。值得注意的是,在凝胶经过高速搅动(每分钟600转)6小时、温度为25°C后,可以通过注射器过滤回收得到纯净的、基本上未聚集的胰岛素溶液。相比之下,同样条件下的无凝胶溶液发生了广泛的胰岛素聚集。
作者们通过使用他们的基于凝胶的系统来储存另一种大型蛋白质β-半乳糖苷酶(β-gal),展示了其多功能性。即使在凝胶封装的β-gal在50ºC下孵育7天后,当以溶液形式回收时,该蛋白质几乎保留了全部(约97%)的生物活性。此外,从经过英国邮政服务发送、在包裹中度过2天的凝胶中回收得到了100%活性的β-gal——这提供了强有力的证据,证明作者们的系统在没有冷链的情况下进行医疗分销是可行的。
尽管新的蛋白质储存系统的设计引人注目且具有创新性,但胰岛素的稳定化仅在相对较短的六小时内得到了证明。此外,凝胶中可以储存的最大胰岛素量尚未确定。鉴于对浓缩胰岛素制剂日益增长的需求,这非常有趣,这些制剂在微型化胰岛素泵中有潜在应用。因此,需要进一步研究这种基于凝胶的储存系统中胰岛素的长期稳定性和最高浓度限制。还需要进一步重复测试从凝胶中回收胰岛素,以确保在医疗应用中可以可靠地递送一致剂量的蛋白质。
Bianco及其同事的工作为使用自组装凝胶储存治疗性蛋白打开了大门,并提供了通过简单的注射器操作快速从凝胶中提取纯净药物溶液的方法。潜在的应用不仅限于胰岛素储存。一个感兴趣的领域是稳定疫苗——例如用于对抗COVID-19的信使RNA疫苗和针对麻疹、腮腺炎和风疹的疫苗,两者都需要冷链管理。这类凝胶还承诺安全地储存和运输危险化学品,包括液体(如燃料),对于这些物质,传统的储存和运输方法构成安全风险。
长期存在的挑战是如何配制蛋白质和疫苗,以在储存和运输过程中保持其功能,并消除冷链管理带来的负担。目前的解决方案必须实用,能够通过临床相关的触发器释放或应用蛋白质。先进的生物疗法在低温下分发,消耗大量能源,限制了低资源国家公平分配的可能性,并将正确储存和处理的责任转嫁给用户。冷链管理是当前蛋白质运输的最佳解决方案,但需要大量的基础设施和能源。例如,研究实验室中一个-80°C的冰箱每天消耗的能量与一个小家庭的能耗相当。75%的生物(蛋白质或细胞)疗法和所有疫苗都需要冷链管理;自2015年以来,临床试验中冷链管理的成本增加了约20%,反映了这种复杂性。现在需要定制配方和赋形剂,广泛使用海藻糖、蔗糖或聚合物,这些物质通过替代表面水分子稳定蛋白质,从而在热力学上使变性变得不太可能;这使得冻干蛋白和冷冻蛋白成为可能。例如,人乳头瘤病毒疫苗需要铝盐佐剂才能发挥作用,但这些佐剂使其对冻融不稳定,导致供应链非常复杂和昂贵。其他想法涉及硅化和蛋白质的化学修饰。简而言之,蛋白质稳定化是一个挑战,没有通用解决方案。在这里,我们设计了一种坚硬的水凝胶,即使在50°C下也能防止蛋白质热变性,并且与现有技术不同,可以通过从注射器机械释放来提供纯的、无赋形剂的蛋白质。大分子可以以高达10wt%的负载量加载,而不影响释放机制。这种独特的稳定化和无赋形剂释放协同作用提供了一种实用、可扩展和多功能的解决方案,以实现低成本、无需冷链且公平地在全球范围内输送疗法。
考虑到蛋白质热失活的途径显示,不可逆聚集而不是化学降解或展开,是活性丧失的主要机制。例如,简单机械刺激(摇晃)胰岛素会导致聚集成淀粉样纤维并失去功效和生物利用度,而且基因治疗Zolgensma只有14天的货架期,不能被搅动,必须保持在2-8°C。显然,这是更广泛使用的障碍。重组人干扰素β的聚集导致多发性硬化症患者的免疫原性。新兴的基于抗体的疗法在其生命周期的所有阶段都存在聚集问题,需要进行复杂的配方过程。
其他人开发了带有海藻糖侧链的合成聚合物用于蛋白质稳定化,使蛋白质既能冻干又能加热稳定,但是偶联降低了活性。然而,对于许多治疗应用来说,使用多步合成化学和提纯共价连接聚合物并不实用,并且需要为每种材料寻求监管批准,大大增加了临床转化的障碍。这是一个广泛的问题,意味着任何储存的蛋白质最终都是与稳定剂混合递送的,而不是理想的蛋白质缓冲液溶液。基于聚乙二醇(PEG)的完全可逆水凝胶已经出现,以保护各种蛋白质免受热应激,并且信使RNA制剂已在可溶性基质中稳定化。同样,防止冰晶生长的冷冻配方抑制了蛋白质聚集。然而,在每种情况下,这些凝胶都是基于新化学实体(因此对人类使用构成重大障碍),可能需要化学刺激(pH,糖)来释放蛋白质,实际上必须由用户进行剂量控制,并且释放蛋白质需要超过1小时。虽然这些策略很有效,但结果导致蛋白质与形成凝胶的成分混合,这些成分在适合人类使用之前需要单独批准并严格评估其安全性。即使是基于PEG的材料也对频繁暴露有免疫学担忧。
理想的生物制剂储存和运输解决方案将(1)移除或减少冷链需求;(2)具有广泛的适用性;(3)在递送的蛋白质溶液中零或最小赋形剂;(4)不需要复杂的化学触发器来释放;(5)容忍高达100mg/ml的高负载量。在这里,我们使用一种简单的低资源策略解决了这些问题。我们展示了低分子量超分子凝胶网络可以物理包裹蛋白质,从而防止不可逆聚集,因此在至少4周内能在高达50°C的温度下保持功能。通过施压推动凝胶溶液通过注射器过滤器时,会释放出纯的非聚集均匀和功能性蛋白质,所有赋形剂都被过滤器截留,确保只递送蛋白质和缓冲液。这与以前的方法根本不同,以前的方法需要化学触发器或稀释,因此不提供纯蛋白质。
可以通过低分子量凝胶剂(LMWG)的自组装形成凝胶。这些是小分子,它们自组装成长纤维结构,纠缠形成三维网络。这些凝胶往往非常坚硬但在低应变下断裂。这种在低应变下的断裂被广泛描述为这些系统的一个缺点。然而,在这里我们利用这一看似失败的特点作为一个独特的优势,以实现传统凝胶不可能实现的均匀蛋白质递送的机械触发器。
https://blog.sciencenet.cn/blog-41174-1443462.html
上一篇:人等宿主如何控制体内微生物组的机制
下一篇:氢气在缺血/再灌注损伤中的保护作用【2024综述】