博文
唤醒沉睡的巨人:单链 DNA 结合 Schlafen 11 启动先天免疫反应
|
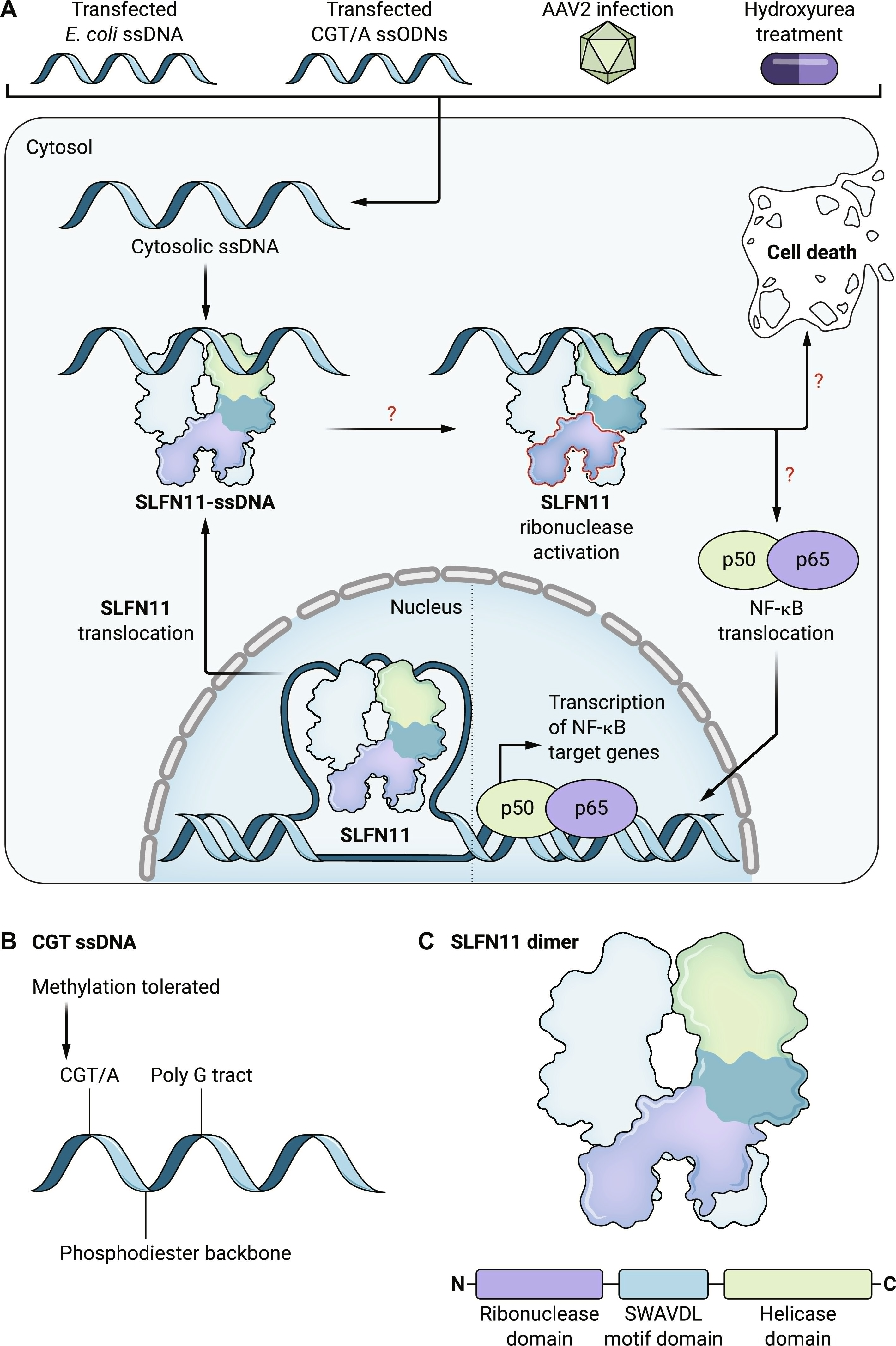
图1. ssDNA-SLFN11相互作用模型,启动NF-κB通路激活、细胞因子转录反应和细胞死亡。
(A) 在稳态条件下,SLFN11位于核内,在某些情况下可以与染色体DNA结合。通过转染、感染或化疗处理存在于细胞质中的ssDNA通过其解旋酶域与SLFN11结合。随后,SLFN11的核糖核酸酶活性通过未知机制引发细胞死亡和NF-κB通路激活(以及下游启动细胞因子转录)。(B) SLFN11刺激型ssDNA的特性。(C) SLFN11蛋白结构域架构。
人们对先天免疫系统的理解来源于Janeway提出的模式识别理论(1)。Janeway预测存在种系编码的模式识别受体(PRRs),它们检测病原体相关分子模式(PAMPs)以启动促炎反应。在考虑代表PAMPs的分子特征时,Janeway提出了几个标准。
首先,PAMPs是微生物的普遍存在成分,这将确保用有限的宿主编码的PRRs广泛覆盖微生物检测。
其次,PAMPs对微生物的生活方式至关重要,因此在很大程度上不能容忍变化,这可能有助于逃避PRR检测。
最后,PAMPs对微生物来说是独特的,从而防止在它们缺失时激活PRR。
这些标准似乎对PAMPs的自然选择施加了严格的限制,因为迄今为止确定的PAMPs由相对少数的独特分子组成,并且几种PAMPs代表多个PRR家族成员的配体。例如,细菌脂多糖(LPS)、鞭毛素亚单位、双链DNA和RNA都是结构上不相关的PRR家庭成员的配体。然而,单链DNA(ssDNA)被一个单一的、位于内体的受体Toll样受体9(TLR9)识别。是否在胞质中存在类似的PRR来检测这种PAMP尚不清楚。
在《科学免疫学》这一期中,(中国医学科学院)Zhang等人(2)探讨了胞质ssDNA作为PAMP的可能性,并确定了Schlafen(SLFN)11为其PRR(图1)。“Schlafen”来自德语单词“睡觉”,SLFN家族的蛋白质因其在细胞中过表达时的细胞周期停滞特性而得名(3)。Slfn基因的表达受干扰素调控,各种免疫细胞产生SLFNs,暗示其在免疫中具有广泛作用。SLFN11已被涉及多种免疫过程,包括通过其tRNA核糖核酸酶活性抑制HIV复制和启动癌细胞死亡。SLFN11还被证明可以结合ssDNA(4, 5),但SLFN11结合ssDNA后是否能启动信号转导途径尚不清楚。Zhang等人鉴定了ssDNA在传递到细胞质中后具有免疫刺激性的特定品质。他们将直接ssDNA结合映射到SLFN11的解旋酶域,然后释放其核糖核酸酶活性以启动免疫信号传导。这项工作表明,胞质ssDNA是一种比之前认识的更强大的免疫刺激物,SLFN11,可能连同其他SLFN家族成员,可能代表一类新的PRRs。
Zhang等人从理解一些核酸感知PRRs,包括TLR9,可以以序列特异性方式检测它们的配体开始他们的工作。因此,为了确保深度序列覆盖,他们通过转染将来自热变性大肠杆菌基因组DNA的ssDNA处理HEK293细胞。他们还用羟基脲处理HEK293细胞,以引起宿主衍生的ssDNA在胞质中积累。两种处理都导致细胞死亡增加,以及包括Tnf丰度增加在内的炎症性细胞因子转录反应增加。为了确定响应ssDNA的最小特征,Zhang等人用一组称为寡脱氧核苷酸(ODNs)的24核苷酸ssDNA模拟物转染细胞。几种转染的ODNs能够再现用大肠杆菌ssDNA或羟基脲处理观察到的增加的细胞因子转录反应和细胞死亡增加。在多种细胞类型中,通过胞质递送ODNs后,细胞因子转录反应和细胞死亡增加,这些反应与NF-κB通路激活增加相一致。这些发现表明存在一种由ssDNA激活的先天免疫信号转导途径。
张等人接着研究了胞质ssDNA固有免疫反应的序列要求。他们首先从观察到的大多数ODNs在其库中是惰性的这一现象中获得序列特异性的第一个线索。此外,一个具有刺激性ODN(即ODN60)的反向互补序列的ODN未能改变细胞因子反应和细胞生存能力。使用ODN60作为模型,作者进行了系统的突变分析,以确定免疫刺激所需的序列。最优的ODN包含一个紧接在T(最好是)或A之后的5′CG序列,在这个CGT/A序列的下游是一个多G段。CGT/A序列或多G段的任何单个碱基的突变都降低了ODNs刺激细胞因子转录反应和细胞死亡的能力。
发现CG序列很有趣,因为TLR9也检测含有CpG基序的ssDNA,其中p表示连接C到G的磷酸酯键,可以是磷酸二酯(PO)或磷硫酰(PS)链接。与TLR9能够检测PO-或PS-链接的CpG ODNs不同,当使用PS链接时,对胞质CGT ODNs的细胞反应被消除,与PO链接相比。因此,典型的TLR9激动剂、含PS的CpG ODNs在胞质递送后刺激细胞因子转录反应的能力很弱。这些刺激性ODNs之间的另一个区别在于CpG基序的甲基化状态。尽管TLR9检测需要未甲基化的CpG基序(6),但对胞质CGT ODNs的细胞因子转录反应不受CpG基序甲基化的影响。此外,尽管在CGT基序下游需要一个多G段来感知胞质中的CGT ODNs,但类似的多G段预计会消除TLR9对ssDNA的检测(7)。甲基化的CpG和富含G的DNA区域被认为是为了防止TLR9异常感知宿主DNA,但在胞质感知ssDNA的背景下,这些属性是被容忍的,甚至是必需的。我们推测SLFN11,胞质CGT ssDNA的传感器(下文讨论的数据),由于其已知的核定位和染色质结合能力,进化为识别ssDNA的宿主样特征(即甲基化的CpG基序和富含G的序列)。CGT ssDNA可能只有在首先竞争过SLFN11与染色体DNA的结合后才能结合SLFN11。SLFN11在核中结合CGT ssDNA然后可能促使SLFN11重新定位到胞质,正如张及其同事所观察到的。SLFN11优先结合染色体DNA可能因此作为一种负调节机制,防止胞质定位和随后的免疫反应。然而,未来的研究需要测试这些假设。总的来说,这些观察表明ssDNA作为不同PRRs的PAMP具有可变的属性。
张等人接下来寻求定义介导对胞质CGT ssDNA反应的PRR。作者最初使用HEK293细胞,这些细胞对胞质ssDNA有反应,但缺乏TLR9和双链DNA传感器cGAS的表达,暗示了一种独立于TLR9和cGAS的机制。通过使用基于全基因组CRISPR-Cas9的筛选,作者确定SLFN11对于CGT ODN诱导的细胞死亡、NF-κB通路激活和细胞因子转录反应是必需的。SLFN11还对所有检查的细胞类型中由胞质CGT ODNs、来自大肠杆菌的胞质ssDNA、羟基脲处理以及腺相关病毒(AAV)感染引起的免疫反应是必需的。重要的是,SLFN11通过pull-down和免疫沉淀测定与ODN60相互作用,但不与其反向互补序列或任何CGT基序突变体相互作用。因此,SLFN11对于胞质CGT ssDNA的免疫刺激特性是必需的。
SLFN11可以分为三个结构域:一个含有核糖核酸酶活性的N末端结构域,一个含有SWAVDL基序的连接结构域和一个C末端解旋酶结构域。胞质PRRs,RIG-I和MDA5,使用解旋酶结构域来检测它们的核酸配体。类似地,SLFN11的C末端解旋酶结构域足以在体外结合CGT ODNs(亲和力为3至4nM)并在细胞内与CGT ODNs相互作用。然而,只有全长SLFN11与CGT ODNs相互作用同时启动NF-κB通路激活,这表明SLFN11 N末端的特征可能有助于启动先天信号传导。内源性表达缺乏核糖核酸酶活性的SLFN11(即E209A-SLFN11)的细胞与CGT ODNs相互作用,但未能启动免疫信号传导。表达WT-SLFN11而非E209A-SLFN11的CGT ODN处理细胞显示出II型tRNA切割增加,这是SLFN11核糖核酸酶活性的一个已知目标。尚不清楚核糖核酸酶活性或tRNA切割如何促进这些免疫反应。这些集体发现表明,CGT ssDNA结合到SLFN11的解旋酶结构域,然后授权N末端核糖核酸酶活性启动免疫信号传导。
张等人观察到,鼠源SLFN9而不是其他检测过的鼠源SLFNs,在细胞内与CGT ODNs相互作用并功能性地补充了Slfn11−/−细胞。因此,作者首先通过静脉注射将包裹在脂质纳米颗粒中的CGT ssDNA递送到肝脏,从而检查了SLFN9在体内感知CGT ssDNA中的作用。在肝脏中,SLFN9而不是TLR9,对于响应CGT ssDNA增加的细胞因子转录反应是必需的。接下来,作者将WT或Slfn9−/− B16-F10肿瘤植入小鼠体内,然后在肿瘤内注射CGT ssDNA。与携带Slfn9−/−肿瘤的小鼠相比,携带WT肿瘤的小鼠接受CGT ssDNA治疗后显示出减少的肿瘤负荷。这些发现共同表明,CGT ssDNA在体内刺激免疫反应,并且SLFN9对这些反应是必需的。 关于SLFN11如何介导ssDNA诱导的先天免疫的重要问题仍然存在。先天免疫信号通常是在形成超分子组织中心(SMOC)时启动的,涉及三个不同类别的蛋白质:PRR、适配器和效应器(8)。以TLR9为例,直接在内涵体中检测到含有CpG基序的ssDNA导致受体二聚化,随后招募适配器蛋白TIRAP和MyD88至TLR9的胞质面向尾部。MyD88然后促进SMOC的形成和迅速招募及随后激活效应蛋白,如IRAKs,最终导致NF-κB通路的激活。 尽管我们对SLFN11如何介导张及其同事观察到的免疫反应知之甚少,但我们可以预见SLFN11介导的免疫不会类似于上述典型的PRR-适配器-效应器模型。我们可以相当确定地预测这一点,因为SLFN11的核糖核酸酶活性对下游信号传导是必需的。很少有PRR也是酶。然而,确实存在违反典型PRR-适配器-效应器模型的PRR-酶的例子。例如,双链DNA传感器cGAS结合DNA并形成高级寡聚复合物。然而,cGAS并不利用寡聚来招募适配器蛋白,而是cGAS的寡聚增强了其合成第二信使分子的能力,这反过来又结合到STING蛋白上以激活其适配器功能。在另一个例子中,LPS传感器caspase-11、caspase-4和caspase-5结合LPS,这促使它们的寡聚和caspase催化活性。这些激活的caspases切割gasdermin D蛋白以启动细胞死亡,并且在最近的工作中,有些可以在特定背景下切割IL-1家族细胞因子成其生物活性形式(9, 10)。在上面的任何一个示例中,cGAS和结合LPS的caspases在配体结合后形成寡聚体。类似地,当SLFN11结合到ssDNA时,表现出稳定的二聚体状态,并且ssDNA结合与核糖核酸酶活性有关(5)。未来的研究应该阐明SLFN11 ssDNA结合、其二聚体稳定性和核糖核酸酶活性是如何与下游先天信号传导联系起来的。
尽管自从Janeway关于模式识别理论的文章发表以来已经过去了35年的激烈发现,我们对先天免疫背后的精确PAMPs和PRRs的知识仍然不完整。张及其同事现在为一种新的PAMP-PRR伙伴关系增加了证据。
https://blog.sciencenet.cn/blog-41174-1438615.html
上一篇:白垩纪蚂蚁的触角可能会让它们使用信息素“说话”
下一篇:衰老细胞的正面生理作用【警】