博文
纳米医学的发展趋势
|
胶体纳米颗粒(NPs)正在被开发用于疾病治疗和诊断——例如,作为mRNA的载体、诱导前列腺癌光热辐射的试剂,或磁共振成像(MRI)的对比剂。然而,NPs在临床实践中的应用仍然较低。使用它们的限制之一在于如何将NPs特定地传递到它们的目标位置,并控制它们何时生效以及何时从体内清除。这与控制它们的生物分布(NPs在体内的去向)和药动学(随时间变化的局部特性和剂量)有关。根据它们的应用,要求各不相同,但通常来说,改善的生物分布将减少副作用(例如,对非目标组织的),而改善的药动学将降低所需剂量并减少潜在的长期毒性(例如,通过改善清除率)。然而,尽管大多数NP与细胞和组织相互作用的机制已被揭示,但定量细节却缺失了。
NPs与细胞的相互作用(因而也影响它们的生物分布和药动学)应与NPs的理化性质相关,如大小、电荷和形状。然而,NPs通常不是均质实体,而是由不同化合物组成,例如载体基质和对比剂或药物剂。此外,NPs可能会因溶解、降解和/或凝聚(粘在一起)而发生变化。因此,当测量生物分布时,必须考虑到化合物和时间依赖性的NPs理化性质的变化。
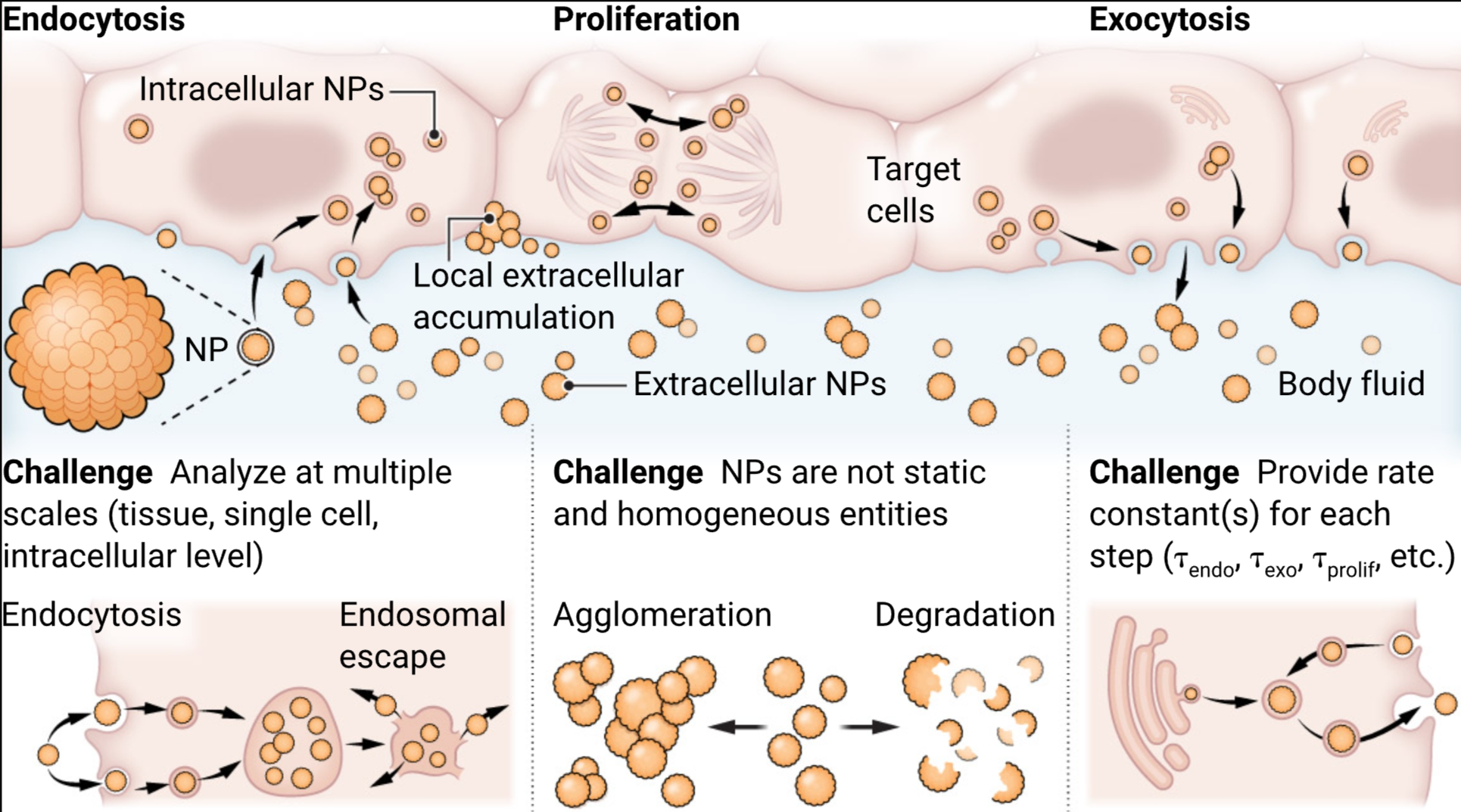
纳米颗粒(NPs)与细胞的相互作用也不是一步到位的。在体内给药后(例如,通过静脉、口服和肺途径),存在多种吸收和排泄途径,这些途径根据给药方式而异(见图)。一些NPs将停留在血液或淋巴等各种体液中,扩散到组织的特定部位或被吸收,但不进入细胞。NPs被细胞吸收和排出的一般过程也为生物分布和药动学的复杂性水平做出了贡献。对于器官摄取,注入血液中的NPs需要穿过由微血管内皮细胞形成的屏障。对于肾脏排泄,NPs必须穿过肾脏中的肾小球过滤屏障才能进入尿液。在细胞层面,NPs穿过细胞膜,通常通过内吞作用(4)和外排作用(5)实现,尽管也存在其他途径(6)。在细胞复制时,NPs还会在子细胞之间分布(7)。最后,为了到达细胞质,内吞的NPs必须穿越内体膜的屏障。
在许多治疗和诊断的场景中,NPs必须克服这些障碍。例如,通过静脉给药将mRNA与NPs一起输送到器官,涉及进入目标器官组织(即,穿越血管屏障),然后是目标细胞(即,通过内吞作用穿越细胞膜),接着是内体逃逸(即,穿越内体膜),才能在细胞质中发挥作用(8)。原则上,每个途径都可以用一个或多个速率常数来描述。了解这些速率常数以及它们如何依赖于NPs的理化性质,可以预测不同类型的NPs从进入体内到可能通过尿液或粪便排出的命运。因此,可以根据输送方法、靶点和排泄时间来定制NPs的理化性质。对于某些途径,如NPs的内吞作用(9)和在增殖细胞中的分离(7),有大型数据集可用,并且已经使用统计概率分布模型预测了细胞内NPs的分布。然而,关于外排作用与NPs的理化性质(如烃基封端基团的类型)相关的定量数据集只有少数几个例子(10)。还有一个模型预测了与NPs表面能量相关的尺寸依赖性外排作用的速率常数(5)。
纳米颗粒(NPs)的生物分布,以及它们从体液进入细胞并随后被清除的过程,是影响其疗效和毒性的重要因素。需要克服的重要挑战包括分析不同复杂性层次;理解NPs的理化性质随时间的变化;以及表征吸收和排泄途径(包括在细胞层面上的内吞作用、细胞分裂和外排作用)。对这些途径进行全面的定量描述(例如,与NPs的理化性质相关的速率常数)是必要的,以改进NP设计并将它们定制到预期的应用中。
这类数据集如何有用的一个例子是在基于被动靶向的治疗策略优化中(11)。被动靶向依赖于这样一个假设:直径约100纳米的NPs足够小,可以离开异常通透或“漏斗”的肿瘤血管(血管逃逸),进入肿瘤组织,并且又足够大以至于不会通过淋巴系统从肿瘤间质液中移除。通过了解NP尺寸依赖的血管逃逸和被间质液移除的速率常数,可以调整递送性能,从而允许优化NP尺寸。尽管对于某些治疗,如光热疗法(照过的NPs产生热量杀死细胞),NPs在目标组织的间质液中的存在就足够了,其他基于NP的治疗方法,如mRNA的递送,只有在NPs进入细胞质后才有效(8)。在这种情况下,了解根据NPs的理化性质的内吞作用和内体逃逸的速率常数对于优化递送是很重要的。
应考虑NPs从体内清除,以避免潜在的长期毒性。例如,可以通过从细胞外排作用、进入血管系统和随后的肾脏清除来实现排泄。然而,外排作用和肾脏清除仅对几纳米直径的非常小的NPs有效(12, 13)。在被动靶向策略的情况下,首选约100纳米的NPs进行递送,这表明需要有限的清除来避免毒性。改进的设计可能是复合NPs,将较小的NPs嵌入基质中形成适合被动靶向的更大NPs。在基质内的小NPs进行细胞内递送后,基质的降解会释放足够小的可以通过外排作用的小NPs(这些NPs被称为“集群炸弹”)(14)。对于足够小的NPs,重新进入血流(而不是重吸收)可以在几分钟内发生,这允许肾脏清除。关于纳米药物的大部分工作集中在递送部分(即将NPs带入肿瘤),但从肿瘤微环境重新进入血流(即将NPs带出肿瘤)也是避免长期毒性的关键。
因此,根据NPs的理化性质,涉及组织、细胞和细胞内所有途径的速率常数的数据集可以指导NPs的设计,使它们具有适当的属性以优化递送和排泄。不同步骤可能需要不同的属性。原则上,这样的数据集可以通过几种不同的技术来确定。在细胞内水平上,电子显微镜和光学显微镜很有帮助,因为它们具有足够的分辨率来可视化细胞内NPs转运过程。在组织水平上,质谱法经常用来获取NPs给药后不同时间点的活体生物分布的快照。
考虑到例如肾脏清除可能的快速清除时间尺度不到1小时,以及测量会破坏样本,原位成像将是更可取的。MRI对于同时记录几种不同元素的生物分布是具有挑战性的,因此不是监测多组分NPs的最佳选择,它不允许亚细胞分辨率。核成像,特别是单光子发射计算机断层扫描(SPECT)和正电子发射断层扫描(PET),允许并行和原位记录几种元素的活体生物分布,但分辨率有限,不适合在细胞水平上成像。X射线荧光成像(XFI)可能是未来的一个选项(15),因为大多数元素提供对比度;即不需要标记,并且可以实现从亚细胞规模的纳米聚焦成像到更大分辨率的各种范围。主要障碍仍然是在成像过程中可能的辐射损伤。此外,像组织中的光学近红外成像一样,XFI也受到散射效应的影响。然而,可以通过非各向同性散射(即散射信号不是随机的而是具有角度依赖性)减去背景,为未来深入组织内部的成像铺平道路(15)。此外,为了将NPs的位置分配到不同的细胞室,也应该开发基于XFI的免疫染色。
https://blog.sciencenet.cn/blog-41174-1431431.html
上一篇:孤独!该如何科学面对?
下一篇:大鼠神经元干细胞修复小鼠大脑