博文
氢水减少SMP30/GNL敲除小鼠脑片超氧离子产生【氢医学经典】  精选
精选
|
氢水减少SMP30/GNL敲除小鼠脑片超氧离子产生【氢医学经典】
氢气是一种公认的抗氧化剂,能够防止急性氧化应激。为了阐明氢气在大脑中的作用机制,我们向无法合成维生素C(VC)的衰老标志蛋白-30(SMP30)/葡糖酸内酯酶(GNL)敲除(KO)小鼠投喂富氢纯水(H2)。众所周知,VC也是一种强大的抗氧化剂。这些KO小鼠被分为三组,分别接受H2、VC或纯净水(H2O)的投喂,持续33天。H2和H2O组的VC水平不到VC组的6%。随后,通过实时生物成像系统估计了这些组别的脑切片在缺氧-再氧化处理过程中的超氧阴离子生成,该系统模拟活体脑组织,并使用Lucigenin作为超氧阴离子的化学发光探针。与H2O组相比,经历缺血-再灌注的H2组形成的超氧阴离子显著减少了27.2%。因此,富氢纯水在脑切片中起到抗氧化剂的作用,防止了超氧阴离子的生成。
Nagata K, Nakashima-Kamimura N, Mikami T, Ohsawa I, Ohta S. Consumption of molecular hydrogen prevents the stress-induced impairments in hippocampus-dependent learning tasks during chronic physical restraint in mice. Neuropsychopharmacology. 2009 Jan;34(2):501-8.
活性氧(ROS)的产生和抗氧化防御系统的减少是氧化应激的主要原因[1]。氧化应激与阿尔茨海默病和帕金森病、心血管疾病、糖尿病以及老化等生理退化有关。来自各种来源的ROS暴露导致有机体发展出多种防御机制,如酶促和非酶促抗氧化剂。超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶是主要的酶促抗氧化剂,而维生素C(VC)、维生素E(α-生育酚)和谷胱甘肽是非酶促抗氧化剂的主要形式。然而,VC在大脑中尤其重要,因为大脑的VC含量比其他组织丰富。
尽管大多数有机体已经发展出了抗氧化防御系统,但并非所有过量的ROS都被解毒。1997年,Shirahata等人报告称,电解还原水(溶解了大量氢气的水)具有保护DNA免受氧化损伤的能力。最近,Ohsawa等人]发现氢气通过选择性还原羟基自由基(OH)来发挥治疗性抗氧化剂的作用。我们还描述了在补充富氢纯水后,患有2型糖尿病或葡萄糖耐量受损的患者脂质和葡萄糖代谢的改善。这些发现强烈表明氢气具有体内抗氧化能力,并提供保护,免受与许多疾病相关的氧化应激。然而,氢气在体内清除ROS的具体机制仍不清楚。
1991年,我们最初确定衰老标志蛋白-30(SMP30)为一种特殊蛋白质,其表达随着年龄的增长以不依赖雄激素的方式减少。此外,我们建立了SMP30/GNL敲除(KO)小鼠,由于SMP30是GNL的替代名称,GNL是VC生物合成途径中的一个因子,这些小鼠无法体内合成VC。我们最近的研究表明,当喂食VC缺乏饮食时,SMP30/GNL KO小鼠会发展出坏血病。此外,SMP30/GNL KO小鼠的大脑中氧化应激增加,而不影响其他抗氧化酶如超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶的状态[14]。因此,SMP30/GNL KO小鼠是研究抗氧化剂如何专门清除ROS而不影响其他抗氧化酶的强大工具。
在本研究中,我们发现富氢纯水在VC耗竭的SMP30/GNL KO小鼠的脑切片中清除了超氧阴离子。我们使用的实时生物成像超氧阴离子系统表明,氢气作为一种抗氧化剂,在体内特异性地消除了大脑中的超氧阴离子。
材料和方法
富含氢的纯净水。
纯净水通过以下流程生产:经过(1)反渗透/超滤装置,(2)离子交换树脂,和(3)超滤膜(纯净水:pH 6.9±0.05;电导率0.7±0.2μS/cm)。然后通过将氢气直接溶解到纯净水中制备富含氢的纯净水,其物理性质如下:pH 6.7±0.1,低电导率(0.9±0.2μS/cm),高溶解氢含量(1.2±0.1mg/L),低溶解氧含量(0.8±0.2mg/L),以及极度负的氧化还原电位(−600±20mV)。为了防止氢气损失,将富含氢的纯净水密封在300mL铝箔袋中,并存放在室温下。
SMP30/GNL敲除小鼠。使用之前描述的基因靶向技术生成了SMP30/GNL敲除小鼠[13]。雌性KO(SMP30/GNL−/−)小鼠与雄性KO(SMP30/GNLY/−)小鼠交配,以产生全为雄性和雌性的KO小鼠。SMP30/GNL KO小鼠的基因型如前所述[13]确定。SMP30/GNL KO小鼠在30天龄断奶后,随即分组,自由摄取富含氢的纯净水(H2),VC水(VC)或纯净水(H2O)33天。H2组饮用富含氢的纯净水,VC组饮用含有VC(1.5g/L)和10μM乙二胺四乙酸(EDTA)的纯净水,而H2O组饮用不含H2和VC的纯净水。装有H2、VC和H2O的玻璃水瓶每天更换两次,直到实验结束。所有小鼠都喂食VC缺乏饮食(CL-2,CLEA Japan,东京,日本)。在整个实验过程中,动物维持在12小时光照/黑暗周期的控制环境中。使用实验室动物的所有实验程序均经Toho大学和东京都老年医学研究所动物护理和使用委员会批准。
脑组织准备和VC测量。
从所有小鼠中迅速取出大脑并放置在组织切割机上。将切得300μm厚的冠状切片转移到冰冷的Krebs–Ringer溶液中(124mM NaCl, 5mM KCl, 2mM CaCl2, 1mM MgCl2, 1.2mM KH2PO4, 26mM NaHCO3 和 10mM glucose),并用95% O2/5% CO2平衡。为了VC测量,将脑切片在含有1mM PMSF的10mM Tris–HCl(pH 8.0)中使用玻璃-Teflon匀浆器进行均质化,并在4°C下以21,000g离心30分钟。获得的上清液立即与5%偏磷酸盐混合,并在−80°C保存直至使用。样品用0.1%二硫苏糖醇处理,以将脱氢抗坏血酸还原为抗坏血酸,并通过使用Atlantis dC18 5μm柱(4.6×150mm, Nihon Waters, 东京, 日本)的HPLC进行分析。流动相为50mM磷酸盐缓冲液(pH 2.8),0.2g/L EDTA,2%甲醇,流速为1.3mL/min,使用带有+0.6V玻璃碳电极的电化学检测器记录电信号[16],[17]。在这种脑组织制备中,通过使用高效液相色谱(HPLC)-电化学检测法来测量总VC,如前所述[15]。
使用实时生物成像系统对缺氧-再氧化过程中脑切片中超氧化物的动态化学发光成像。为了估计缺氧-再氧化过程中超氧化物自由基形成的动态变化,我们之前开发了一个实时生物成像系统[18],[19]。在这里,我们通过化学发光发射分布成像确定了超氧化物自由基的形成,为此将完整的脑切片在充满氧气的Krebs–Ringer溶液的室中预孵育,该溶液含有2mM N,N′-二甲基-9,9′-二氨基二吡啶二硝酸盐(Lucigenin)(Sigma, St. Louis, MO, USA),在34°C下预孵育45分钟。预孵育45分钟后,将脑切片在同一氧气环境(95% O2/5% CO2)下的成像室中再孵育120分钟。然后将条件变为缺氧状态(95% N2/5% CO2)15分钟,返回到有氧环境,并再次孵育长达120分钟。在氧气、缺氧然后再次氧化的过程中,每15分钟获取一次脑切片图像,最长至255分钟(17帧)。所有帧中的图像亮度由相同的标尺表示。
统计分析。
结果以均值±SEM表示。实验组之间的统计差异概率由Student’s t检验或ANOVA确定,视情况而定。对于一元和二元ANOVA,我们使用KaleidaGraph软件(Synergy Software, Reading, PA, USA)。统计差异被认为在p < 0.05时显著。
结果
富含氢的纯净水对体重的影响
在30天龄断奶后,将SMP30/GNL KO小鼠分为三组,分别喂食富含氢的纯净水(H2),VC水(VC)或纯净水(H2O)。为了研究H2、VC或H2O给药对生长的影响,我们比较了体重变化(图1)。在实验期间,所有三组SMP30/GNL KO小鼠增加了相同的体重量。即,H2、VC和H2O给药组在63天龄时的体重分别为26.1±0.5、25.0±1.1和24.9±0.9克。
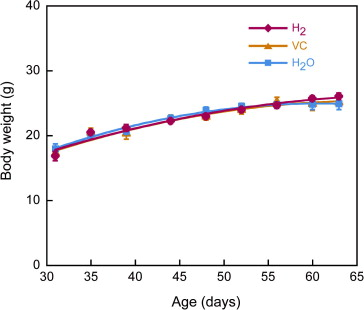
图1. 给予H2、VC或H2O的SMP30/GNL敲除小鼠的体重变化。在30天龄断奶的SMP30/GNL敲除小鼠被分为三组:分别接受富含氢的纯净水(H2)、VC水(VC)或纯净水(H2O)。测量它们的体重,并绘制平均变化值,直到动物达到63天龄。数值以10只动物的均值±标准误差表示。
摄入富含氢的纯净水后大脑中的总维生素C水平
接下来,我们确定了摄入H2、VC或H2O的SMP30/GNL敲除小鼠在达到63天龄时大脑中的总VC含量。来自H2和H2O给药组的大脑中VC值不到SMP30/GNL敲除小鼠VC受体的6%(见图2)。来自H2、VC和H2O给药组的脑切片中的总VC水平分别为0.3±0.1、5.5±0.4和0.3±0.1微克/毫克蛋白。

图2. SMP30/GNL敲除小鼠大脑中H2、VC和H2O给药组的VC水平。在30天断奶后,将自由摄取H2、VC或H2O的小鼠分组,持续33天。装有H2、VC和H2O的玻璃水瓶每天更换两次,直到实验结束。数值以五只动物的均值±标准误差表示。与VC组相比,∗p < 0.01。
在活体大脑模型中缺氧-再氧化过程中的过氧化物形成
为了确定富含氢的纯净水是否能保护大脑免受活性氧(ROS)的产生,我们使用实时生物成像系统测量了缺氧-再氧化处理过程中的过氧化物形成,其中Lucigenin作为化学发光探针在脑组织中使用。从开始孵育到255分钟后,每15分钟获取一次化学发光发射图像,包括氧化、缺氧和再氧化阶段。SMP30/GNL敲除小鼠的H2、VC和H2O给药组脑切片中过氧化物形成的时效曲线如图3A所示。过氧化物的形成在缺氧条件(95% N2/5% CO2)下显著减少,然后在持续120分钟的氧化状态下增加。所有三个组的过氧化物形成在缺氧30分钟后达到最大值,然后逐渐减少并返回到基线水平。在H2、VC和H2O给药组中,再氧化期间最大时间的过氧化物形成分别为7.45±0.45、5.36±0.35和9.95±0.74计数/像素,每15分钟读数一次。再氧化期间的过氧化物形成计算为135-180分钟时间段的平均值(见图3B)。在再氧化条件下,仅H2和H2O组形成的过氧化物水平分别比VC组高出1.9倍和1.4倍(见图3B)。此外,给予H2组的过氧化物形成比H2O给药组显著低27.2%。图4显示了在基础、缺氧和再氧化条件下脑切片的化学发光典型图像。过氧化物的形成在大脑各个区域异质分布,并在缺氧-再氧化处理过程中没有显著变化。
(从实验过程看,氢气使用在活体,脑片研究在体外,不是一个时间,此时检测的脑片中应该是没有氢气的,或者含有非常少的氢气,这种情况下的作用,更可能是氢气对脑组织产生的间接效应!)
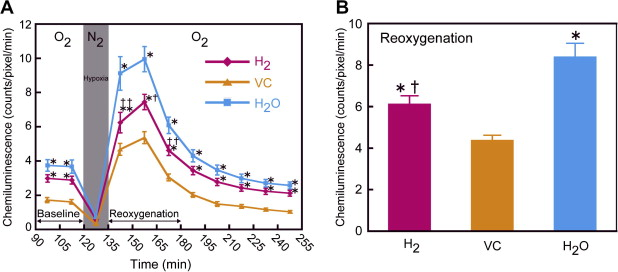
3. 在氧化和缺氧-再氧化过程中脑切片的化学发光强度变化。(A) 来自H2、VC和H2O给药组的脑切片在含氧(95% O2/5% CO2)的Krebs-Ringer培养基中与2 mM Lucigenin一起孵育120分钟(0-120分钟)。然后,将切片在缺氧状态(95% N2/5% CO2)下孵育15分钟(120-135分钟),并返回到含氧气氛中孵育120分钟(135-255分钟)。每15分钟获取一次过氧化物依赖性化学发光强度的值,并以每15分钟读数的计数/像素表示。(B) 在再氧化期间的过氧化物形成是从135到180分钟的平均计算值。数值以10只动物的均值±标准误差表示。与VC组相比,∗p < 0.01 和 ∗∗p < 0.05;与H2O组相比,†p < 0.01 和 ††p < 0.05。
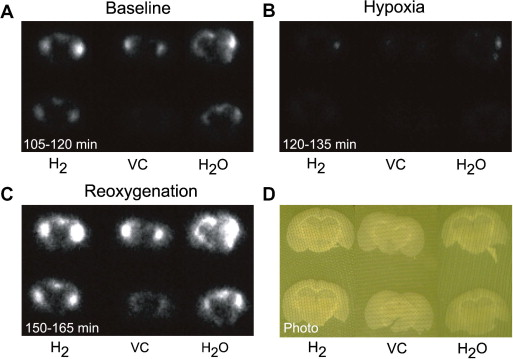
图4. 在基础、缺氧和再氧化条件下脑切片的化学发光典型图像。图像获取时间为(A)氧化(105-120分钟),(B)缺氧(120-135分钟),然后是(C)再氧化(150-165分钟)。(D)各图像中亮度由同一区域和刻度表示。
讨论
在本研究中,我们证明了富含氢的纯净水的投用显著减少了脑切片中过氧化物的形成。这些脑组织来自VC阴性SMP30/GNL敲除小鼠,并在使用实时生物成像系统进行缺氧-再氧化处理期间进行了检查,其中Lucigenin作为检测过氧化物的化学发光探针。这一结果反映了在缺血期间脑切片中ROS生成的减少,并与Ohsawa等人的报告一致,表明氢气通过选择性减少·OH而起到治疗性抗氧化剂的作用。在缺血期间,大量的ATP消耗导致尿分解产物次黄嘌呤和黄嘌呤的积累,随后在再灌注和氧气流入时,它们被黄嘌呤氧化酶代谢产生大量过氧化物和·OH。我们在这里展示了,与单独饮用纯净水的小鼠相比,饮用富含氢的纯净水的小鼠在缺氧后再次氧化时形成的过氧化物减少了27.2%(见图3)。我们推测,这种过氧化物减少的机制是氢气在特定条件下如体内缺血和再灌注下能够减少·OH和过氧化物。这种推测背后的事实是,氢气可以轻易穿透细胞膜并保护DNA免受ROS的损害,从而影响基因转录。另一种可能性是氢气穿透线粒体并直接减少过氧化物的产生。
最近我们报告了,来自衰老加速小鼠(SAM)的C57/BL6品系、Wister大鼠和鸽子的脑组织中的过氧化物依赖性化学发光强度随年龄增长明显增加。这种与年龄相关的过氧化物依赖性化学发光增加速率与这些动物的最大寿命呈负相关;然而,在老化过程中,脑中的超氧化物歧化酶(SOD)活性未发生变化。这些发现强烈表明,活性氧可能是决定老化过程的信号。在这里,我们使用了不能在体内合成VC的SMP30/GNL敲除小鼠作为衰老和氧化应激的模型,并发现,在缺乏VC补充的情况下,脑切片在缺氧-再氧化处理期间增加了过氧化物的产生(图2, 图3)。众所周知,VC是一种强效的抗氧化剂,能在体外清除过氧化物;然而,证明这一效果在体内实际发生的证据较少。
在我们手中,活性氧依赖性化学发光在大脑中呈现不均匀分布(图4),尽管强度在白质中比灰质要高。这种异质性在氧化和缺氧-再氧化期间没有显著变化。然而,由于Okabe等人通过组织化学定位分析发现白质中的SOD活性低于灰质,我们在白质中观察到的更强的化学发光强度可以通过后者较弱的SOD活性来解释。
随后,Fukuda等人报道吸入氢气抑制了由缺血-再灌注引起的肝损伤,Hayashida等人报道吸入氢气限制了由心肌缺血-再灌注伤害引起的心肌梗死范围。我们的结果支持并扩展了这些发现,证明了富含氢的纯净水减少了由缺血-再灌注在脑切片中引起的过氧化物形成。这些数据强烈表明,富含氢的纯净水具有有益的抗氧化效果,增加了对许多生理退化状态下普遍存在的过度氧化应激的抵抗力。
https://blog.sciencenet.cn/blog-41174-1429587.html
上一篇:氢气对肝缺血损伤的治疗作用【经典】
下一篇:氢水预防拘束应激小鼠海马损伤【经典论文】