博文
释氢珊瑚钙对甲基苯丙胺戒断表现的作用
||
论文摘要
甲基苯丙胺(METH)的滥用会对中枢神经系统造成不可逆的损害,并导致包括抑郁在内的精神症状。值得注意的是,METH诱导的高温是这些症状发展的一个关键因素,因为它会加剧METH诱导的神经毒性。然而,高温在METH诱导的抑郁样行为中的作用需要进一步阐明。在本研究中,我们在正常环境温度(NAT)或高环境温度(HAT)下用不同剂量的METH处理了小鼠。我们发现,HAT在METH处理后促进了高温,并在小鼠METH诱导的抑郁样行为中发挥了关键作用。有趣的是,在NAT下,慢性METH暴露(10 mg/kg,7天或14天)或递增剂量(2-15 mg/kg,3天)的METH处理未能诱导出抑郁样行为。然而,HAT加剧了METH对海马突触可塑性的损害、对氧化应激的反应以及神经炎症。分子氢作为一种抗氧化剂和抗炎剂,已被证明在广泛疾病中具有预防和治疗的适用性。氢化珊瑚钙(CCH)是一种人工制造的富氢粉末,当暴露于水中时会逐渐产生氢气。在此,我们发现CCH预处理显著减轻了METH诱导的高温,并且在METH暴露后给予CCH也抑制了METH诱导的抑郁样行为,并减少了海马突触可塑性的损伤。此外,CCH有效地降低了乳酸脱氢酶的活性,并减少了海马中丙二醛、TNF-α和IL-6的产生。这些结果表明,CCH是一种有效的富氢剂,对于METH滥用者的治疗具有潜在的治疗适用性。
研究亮点:
高温在METH诱导的抑郁样行为中发挥关键作用。
高环境温度加剧了METH诱导的抑郁行为。
CCH预处理抑制了METH诱导的抑郁样行为。
CCH减少了METH诱导的海马突触可塑性损伤。
CCH在治疗METH滥用者方面具有潜在的治疗适用性。
Wang X, Tong B, Hui R, Hou C, Zhang Z, Zhang L, Xie B, Ni Z, Cong B, Ma C, Wen D*. The Role of Hyperthermia in Methamphetamine-Induced Depression-Like Behaviors: Protective Effects of Coral Calcium Hydride. Front Mol Neurosci. 2022 Jan 4;14:808807. *通讯作者,文迪教授来自河北医科大学法医学系。
甲基苯丙胺(METH)是一种在全球广泛滥用的精神活性物质。长期或大剂量使用METH会导致心血管、消化和免疫系统的严重异常,尤其是对中枢神经系统(CNS)造成不可逆的损害。因此,METH滥用者易患神经退行性疾病,如帕金森病、阿尔茨海默病和亨廷顿病,并通常表现出各种精神症状,如抑郁和精神分裂症。
研究表明,多巴胺氧化应激、兴奋毒性和神经炎症是METH诱导神经毒性的最重要机制。此外,高温也是一个关键因素,METH引起的高温以剂量和环境温度依赖的方式发生。单次中等或高剂量的METH可引起核心体温迅速升高,并维持数小时,这种持续的高温加剧了METH诱导的氧化应激、兴奋毒性和神经炎症。在METH给药后6天取出的小鼠脑样本中,通过免疫组织化学指标酪氨酸羟化酶、多巴胺转运体、胶质纤维酸性蛋白和c-Fos确认,暴露于热环境会增加METH的神经毒性。然而,高温在METH诱导的精神症状中是否起作用仍不清楚。
越来越多的证据表明,用抗氧化剂和抗炎药物治疗是有效减少METH诱导的神经毒性并发症发生率的有效干预策略。氢气作为一种针对多种疾病的新颖保健产品,因其独特的抗氧化能力——选择性清除高度细胞毒性氧自由基以及其抗炎特性而日益流行。我们之前的研究发现,通过自由饮用富氢水(HRW)摄取的氢气显著抑制了METH诱导的空间记忆障碍(在Barnes和Morris水迷宫测试中)。此外,富氢盐水(HRS)注射减轻了低剂量METH诱导的行为敏化症状。到目前为止,饮用或沐浴富氢水以及吸入氢气已被用作向人体给药氢气的途径。然而,这些方法几乎不会导致氢气的长期有效积累,因为其在水溶解度低。氢化珊瑚钙(CCH)是由珊瑚钙在高温下与氢反应制成的多孔粉末,当暴露于水时会逐渐产生氢气。先前的研究报道,在5-10 g CCH/L悬浮液中产生的氢气最大浓度接近600 ppb。此外,这种氢气至少可以稳定释放24小时,然后其生成逐渐下降。因此,我们假设使用CCH产生纯氢的管理可能会缓解高温并预防高剂量METH暴露引起的类似抑郁行为。
在这项研究中,动物在不同环境温度下接受METH处理,以研究高温在METH诱导的类似抑郁行为中的作用,并通过尾部悬挂试验(TST)、强迫游泳试验(FST)和运动试验(LMT)进行评估。此外,还探讨了CCH对METH诱导的高温和类似抑郁行为的影响。由于海马神经元损伤在突触可塑性调节中起关键作用,并在抑郁症机制中起重要作用,进行了海马的Golgi染色,并通过检测乳酸脱氢酶(LDH)、丙二醛(MDA)、IL-6和TNF-α水平来测量氧化应激和神经炎症指标。
一、材料和方法
动物
从中国北京维通利华实验动物技术有限公司订购了390只C57BL/6小鼠,初始体重20-22克(8周龄)。所有小鼠均可自由进食和饮水,并被保持在一个控制气候的环境中,温度恒定在(22 ± 1°C),湿度大约为60%,光照周期为12小时(早上7:00熄灯)。所有实验程序均经河北医科大学当地动物使用委员会批准,并按照《国立卫生研究院实验室动物护理和使用指南》执行。
药物
DL-甲基苯丙胺(METH)由中国北京市公安局提供。氢化珊瑚钙(CCH)由上海泉仁生物科技有限公司(中国上海)提供。METH的母液(1g/mL)溶解在0.9%无菌盐水中,CCH在使用前悬浮在纯水中。在每次实验中,将METH的浓度调整至每公斤体重10 mL的适当注射量。
行为测试
尾部悬挂测试
行为测试的程序与先前的研究一致。使用了四个明亮的20 cm × 20 cm × 35 cm白色有机玻璃场地进行TST。每只小鼠的尾巴用胶带固定在距离箱子顶部3厘米处的钩子上,胶带距离尾巴尖端1厘米,持续时间为6分钟。不动性定义为被动悬挂时四肢或身体无运动,且测量最后5分钟的不动时间。行为测试通过录像带记录下来,并使用Noldus视频跟踪软件(荷兰瓦赫宁根)进行分析。为了防止视觉和听觉互动,动物们被彼此隔离。每个测试之间用75%酒精清洁场地。
强迫游泳测试
四个直径为10厘米、高为23厘米的透明树脂圆筒内装满了15厘米深的23-25°C温水以进行FST。每只小鼠被放入一个圆筒中并录像6分钟以记录不动时间。使用Noldus视频跟踪软件测量并分析最后5分钟的不动时间。不动性定义为除了保持身体不至于下沉所必需的四肢或身体运动外,无任何运动。测试期间,为了防止视觉和听觉互动,小鼠们被彼此隔离。每个测试后都用新鲜水替换用过的水。
运动测试
将小鼠放置在明亮的40 cm × 40 cm白色有机玻璃场地中。记录小鼠的运动和位置。在一个5分钟的单次会话中记录场地内的总移动距离,用于测量小鼠的运动能力。每个测试之间用75%酒精清洁场地。
实验设计
环境温度对甲基苯丙胺诱导的高温和类似抑郁行为的影响
本研究使用先前研究中描述的药物暴露方案和剂量。如图1A所示,两批分别处于正常环境温度(NAT)22°C和高环境温度(HAT)28°C的小鼠,分别接受四次10 mg/kg METH的腹腔注射,每次注射间隔2小时,连续1天或3天。最后一次METH注射后2小时,动物被放回正常环境温度(22°C)的家中笼子。在第一次和第二次METH注射后1小时,记录每只小鼠的核心体温。同时,在第一次METH注射后24小时测量核心体温和体重。在METH暴露后的第7天和第14天测试类似抑郁的行为。所有小鼠按以下顺序进行测试:LMT、TST和FST。

图1. 甲基苯丙胺(METH)暴露以环境温度和剂量依赖的方式诱导高温和类似抑郁的行为。(A) 药物处理和行为测试的时间线。(B) 高环境温度加剧了METH诱导的高温(左)和体重减轻(右)。给予小鼠四次METH(10 mg/kg 腹腔注射)治疗,每次间隔2小时。箭头表示药物暴露。在第一次METH处理后的0、1、3和24小时测定体温,并在药物治疗后24小时计算体重减轻。(n = 15, 15, 15 和 13)(C)在高环境温度(28°C)下,METH暴露(a: 10 mg/kg × 4次注射 × 1天;b: 10 mg/kg × 4次注射 × 3天)在小鼠中诱导了类似抑郁的行为。行为测试包括运动测试(LMT)、尾部悬挂测试(TST)和强迫游泳测试(FST),在METH处理后的第7天(T1)和第14天(T2)进行(a: n = 15 和 15 对于 NAT,n = 15 和 13 对于 HAT;b: n = 10 和 9 对于 NAT,n = 12 和 13 对于 HAT)。数据以均值 ± 标准误差表示。
药物暴露方案和剂量对甲基苯丙胺诱导的类似抑郁行为的影响
随后,研究了不同药物暴露方案和剂量对METH诱导的类似抑郁行为的影响(图2A)。两批小鼠分别在7天和14天内接受了14次和28次10 mg/kg METH注射(每天两次,间隔2小时)。一批小鼠在3天内接受了四次15 mg/kg METH注射,间隔2小时,另一批小鼠在3天内接受了逐渐增加的剂量(2, 2, 5, 5, 5, 5, 10, 10, 10, 10, 15 和 15 mg/kg)的METH。这些实验均在22°C的正常环境温度下进行。在METH暴露后的第7天和第14天测试了类似抑郁的行为。
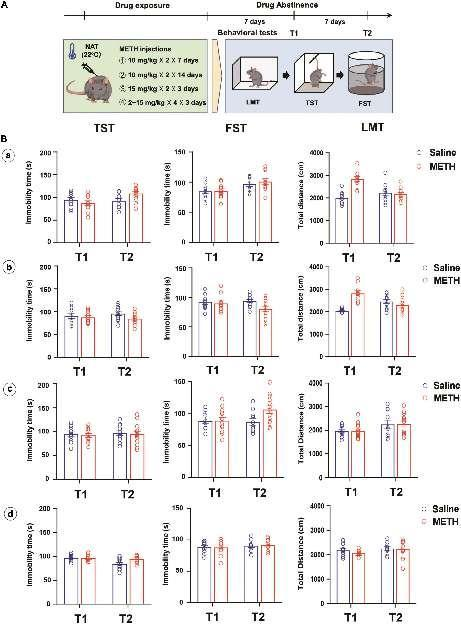
图2. 在正常环境温度(22°C)下,较长期(10 mg/kg × 2, 7和14天),更高剂量(15 mg/kg × 4, 3天)或逐渐增加剂量(2–15 mg/kg, 3天)的METH治疗方案未能在小鼠中诱导类似抑郁的行为。(A) 药物处理和行为测试的时间线。(B) 对小鼠进行不同的METH治疗程序(a: 10 mg/kg × 2, 7天; b: 10 mg/kg × 2, 14天; c: 15 mg/kg × 4, 3天; d: 2, 2, 5, 5, 5, 5, 10, 10, 10, 10, 15 和 15 mg/kg,共3天),并在METH暴露后的第7天(T1)和第14天(T2)测试类似抑郁的行为和运动能力(a: n = 10和11; b: n = 10和12; c: n = 10和13; d: n = 10和10)。数据以均值 ± 标准误差表示。
由氢化珊瑚钙对甲基苯丙胺诱导的高温和类似抑郁行为的影响
在METH暴露(10 mg/kg,一次)前1小时,将小鼠用CCH(100和200 mg/kg,灌胃途径[i.g.])预处理,CCH悬浮于0.2毫升纯水中。核心体温每20分钟测量一次,持续2小时。为了探究CCH对METH诱导的类似抑郁行为的影响,小鼠接受METH(10 mg/kg × 4)治疗3天,然后每天两次给予纯水(0.2 mL, i.g.)或CCH(100和200 mg/kg, i.g.)。在METH暴露后的第7天和第14天通过TST、FST和LMT测试类似抑郁的行为。
甲基苯丙胺暴露和氢化珊瑚钙给药对海马突触可塑性及氧化应激产物和炎症细胞因子水平的影响
小鼠接受METH(10 mg/kg × 4)治疗3天,然后每天两次给予纯水(0.2 mL, i.g.)或CCH(100和200 mg/kg, i.g.)。进行Golgi染色以检查METH暴露和CCH给药对海马突触可塑性的影响。解剖海马组织,通过商业试剂盒检测氧化应激产物(MDA和LDH)和炎症细胞因子(TNF-α和IL-6)的水平。
Golgi染色
使用Golgi染色来检测海马神经元树突棘的变化。使用Genmed医用技术有限公司(中国上海)生产的商业化Golgi染色试剂盒。将小鼠用异氟醚麻醉并用1×PBS溶液和4%甲醛固定。取出这些小鼠的大脑,用纯水洗涤,然后在黑暗中浸泡2周,接着转移到30%蔗糖溶液中48小时。使用振荡切片技术进行矢状切片(80∼100μm厚)。每五片中选取一片,每只小鼠总共选择三片。Golgi染色后,在显微镜下观察树突棘的变化,并由两位独立观察者计算树突棘的数量。
TNF-α, IL-6, 丙二醛和乳酸脱氢酶水平的测定
通过酶联免疫吸附测定(ELISA)检测海马组织中TNF-α和IL-6的水平。实验按照产品说明(ABclonal技术有限公司,中国武汉)进行。使用硫代巴比妥酸(TBA)测定试剂盒和2,4-二硝基苯肼比色测定试剂盒(Beyotime技术有限公司,中国上海)按照制造商的协议确定MDA和LDH的水平,它们是脂质过氧化的标志物。完成药物治疗后,收集每组六只小鼠的海马组织并储存在−80°C直到分析。进行实验时,将组织在PBS缓冲液中均质化并离心以收集上清液。使用Bicinchoninic Acid (BCA)蛋白测定试剂盒(Solarbio,北京)测试总蛋白含量。以每微克蛋白质的纳摩尔(nmol/mg)为单位测量TNF-α, IL-6, MDA和LDH的水平。
数据分析
数据以均值±标准误差(SEM)表示。使用方差分析(ANOVA),包括单向、双向、三向ANOVA以及混合ANOVA(重复测量设计)进行统计分析。Bonferroni的事后检验被用来评估组间差异。使用未配对的双尾Student’s t检验来比较两个独立组。统计显著性的阈值设定为P < 0.05(GraphPad, v.8.0, CA, United States)。
二、研究结果
动物
最初购买了390只C57BL/6小鼠。关于METH处理后的意外死亡,特别是在高温环境下,每个组的小鼠数量在实验设计中不一致。总共有24只小鼠在METH处理过程中死亡,6只小鼠因为灌胃注射失败而死亡,还有5只小鼠由于一般状态差和运动测试中的活动量低而被排除。因此,共有355只实验动物被纳入数据分析。
高环境温度加剧了甲基苯丙胺引起的高温症和体重减轻
在常温(22°C)和高温(28°C)环境下,小鼠每隔2小时接受四次10 mg/kg METH的处理,对照组小鼠接受四次生理盐水(10 mg/kg)注射。如图1B所示,在高温环境下METH暴露导致了严重的高温症(左)和更大的体重减轻(右)。混合ANOVA(重复测量)显示METH处理对体温有显著影响(F1,54 = 57.29, P < 0.001)以及环境温度(F1,54 = 15.06, P < 0.001),并且METH处理与环境温度之间存在显著的相互作用(F1,54 = 5.68, P = 0.021)。此外,双向ANOVA揭示了METH处理(F1,54 = 89.03, P < 0.001)、环境温度(F1,54 = 19.86, P < 0.001)以及METH处理与环境温度之间的相互作用(F1,54 = 17.01, P < 0.001)对体重减轻的主要影响。事后比较表明,与常温环境相比,高温环境下给予METH时体重减轻更为严重(P < 0.001)。
甲基苯丙胺暴露以环境温度和剂量依赖的方式诱导抑郁样行为
研究调查了高温对抑郁样行为的潜在影响。在常温(22°C)和高温(28°C)条件下,小鼠接受了METH处理(10 mg/kg × 4次注射),并在7天(T1)和14天(T2)后进行了包括LMT、TST和FST在内的行为测试。如图1C所示,常温下METH处理并未在TST(T1: P = 0.782;T2: P = 0.390)和FST(T1: P = 0.442;T2: P = 0.365)中诱导出任何抑郁样行为。然而,与高温同时给予的METH处理在METH暴露后的7天(T1)内诱导出了抑郁样行为,无论是在TST(P < 0.001)还是FST(P < 0.001)中,但在T2测试中恢复(TST: P = 0.808;FST: P = 0.394)。所有的LMT结果显示,在T1和T2测试中各组之间没有显著差异(常温: P = 0.753和P = 0.209;高温: P = 0.456和P = 0.853)。
接下来,我们将METH处理的剂量提高到10 mg/kg × 12次注射(在3天内)。当METH处理在常温下进行时,行为测试的结果在T1(TST: P = 0.568;FST: P = 0.611)和T2(TST: P = 0.707;FST: P = 0.938)测试中也显示组间无差异。然而,与高温同时给予的METH处理至少持续了14天的长期抑郁样行为。FST和TST测试的结果表明,在T1(TST: P < 0.001; FST: P < 0.001)和T2(TST: P < 0.001; FST: P < 0.001)测试中,盐水组与METH组之间存在显著差异。此外,无论是在T1还是T2过程中,常温和高温下的METH处理都未影响动物的运动能力(常温: P = 0.749和P = 0.979;高温: P = 0.797和P = 0.460)。
有趣的是,我们在非活动测试(NAT)中使用了不同的甲基苯丙胺(METH)暴露方案和剂量,目的是诱发类似抑郁的行为。如图2B所示,长期(a和b)、高剂量(c)或逐渐增量的METH暴露方案(d)均未能成功诱发小鼠的类似抑郁行为和运动障碍,除了在小鼠线性运动测试(LMT)中行走的总距离之外,该距离在METH处理7天或14天以及药物戒断7天后相比对照组小鼠有所增加(P < 0.001)。
氢化珊瑚钙生成氢气抑制甲基苯丙胺诱导的体温过高和类似抑郁行为
鉴于在酸性条件下,氢化珊瑚钙(CCH)与水相互作用会导致逐渐生成氢气,我们在METH处理前后通过胃内给药CCH,以分别研究氢气对METH诱导的体温过高和类似抑郁行为的预防和治疗作用。小鼠预先使用CCH(100和200 mg/kg,胃内给药)处理,然后在室温(HAT,28°C)下1小时后接受METH注射(10 mg/kg,腹腔注射)(图3A)。在接下来的2小时内,每20分钟测定一次核心体温。如图3B所示,CCH预处理显著减弱了METH诱导的体温过高。双向方差分析(ANOVA)表明,药物处理(F3,35 = 4.007,P = 0.015)和时间(F3.256,114 = 35.58,P < 0.001)对体温有显著的主要影响,以及药物处理和时间之间的相互作用(F18,210 = 4.90,P < 0.001)。此外,单向ANOVA显示在METH处理后60分钟时,各组体温存在显著差异(F3,35 = 14.06,P < 0.001)。事后比较表明,METH处理小鼠的体温升高(P < 0.001),而CCH预处理在200 mg/kg剂量下对METH诱导的体温升高具有抑制作用(P = 0.002),但在100 mg/kg剂量下则没有(P = 0.801)(图3C)。

图3. 氢化珊瑚钙(CCH)给药抑制甲基苯丙胺(METH)诱导的体温过高和类似抑郁行为。(A)CCH预处理、METH暴露和核心体温测定的时间表。(B)在METH(10 mg/kg,腹腔注射)注射后2小时内,每20分钟测定一次核心体温(n = 6,10,12,和11)。箭头表示药物治疗。(C)分析METH处理后60分钟时的体温。(D)METH暴露、治疗性CCH给药和行为测试的时间表。(E)CCH给药对METH诱导的类似抑郁行为的影响(每组n = 8)。数据表示为平均值±标准误。
为了研究CCH对METH诱导的抑郁的治疗作用,我们在METH注射(10 mg/kg × 4 × 3天,腹腔注射)后给予小鼠连续7天(每天一次)的CCH(100和200 mg/kg,胃内给药)治疗(图3D)。如图3E所示,单因素方差分析(ANOVA)的结果显示,各组在TST中的不动时间(F3,28 = 18.74,P < 0.001)和FST中的不动时间(F3,28 = 39.34,P < 0.001)之间存在显著差异。事后比较表明,100 mg/kg(TST:P = 0.002;FST:P < 0.001)和200 mg/kg(TST:P < 0.001;FST:P < 0.001)的CCH对METH诱导的类似抑郁行为具有显著的治疗作用。此外,各组在LMT中的总距离没有显著差异(F3,28 = 1.473,P = 0.2432)。
氢化珊瑚钙逆转甲基苯丙胺诱导的海马突触可塑性损伤并减轻氧化应激和神经炎症程度
高尔基染色显示,METH在小鼠中引发了海马突触可塑性损伤,这种变化在HAT下给予METH时更为严重(P = 0.027,图4A)。双向方差分析(ANOVA)表明,METH处理(F1,8 = 176.20,P < 0.001)和环境温度(F1,8 = 13.52,P = 0.006)对棘突数量有显著的主要影响,但METH处理和环境温度之间没有相互作用(F1,8 = 3.353,P = 0.104)。
此外,甲基苯丙胺(METH)以时间依赖的方式诱导氧化应激和神经炎症。单因素方差分析(ANOVA)表明,METH处理对丙二醛(MDA)水平(NAT:F3,20 = 271.0,P < 0.001;HAT:F3,20 = 137.8,P < 0.001)、乳酸脱氢酶(LDH)(NAT:F3,20 = 90.15,P < 0.001;HAT:F3,20 = 26.56,P < 0.001)、肿瘤坏死因子TNF-α(NAT:F3,20 = 69.17,P < 0.001;HAT:F3,20 = 196.2,P < 0.001)和白介素IL-6(NAT:F3,20 = 9.96,P < 0.001;HAT:F3,20 = 78.03,P < 0.001)均有显著的主要影响。HAT加剧了METH诱导的MDA、TNF-α和IL-6水平的异常变化(统计数据如图4B所示)。有趣的是,在METH处理后的每个时间点,NAT组和HAT组之间的LDH活性没有差异(图4B)。如图4C所示,单因素方差分析(ANOVA)的结果显示,各组在棘突数量上存在显著差异(F3,28 = 18.74,P < 0.001)。事后比较表明,CCH给药有效逆转了METH诱导的海马突触可塑性损伤(CCH100:P < 0.001,CCH200:P < 0.001,与METH组相比)。MDA(F3,20 = 115.50,P < 0.001)、LDH(F3,20 = 50.66,P < 0.001)、TNF-α(F3,20 = 73.14,P < 0.001)和IL-6(F3,20 = 81.24,P < 0.001)含量测定的结果也显示出相似的结果(图4D)。事后比较还表明,CCH给药对METH诱导的MDA(CCH100:P < 0.001,CCH200:P < 0.001)、LDH(CCH100:P < 0.001,CCH200:P < 0.001)、TNF-α(CCH100:P = 0.05,CCH200:P < 0.001)和IL-6(CCH100:P < 0.001,CCH200:P < 0.001)的增加具有抑制作用。因此,可以断定,CCH给药显著逆转了METH暴露引起的海马突触可塑性损伤,并减轻了氧化应激和神经炎症。
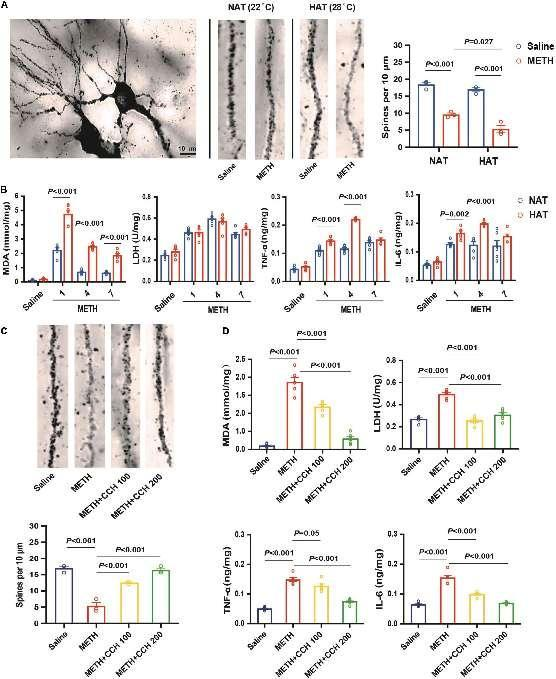
图4. 氢化珊瑚钙给药抑制甲基苯丙胺(METH)诱导的海马突触可塑性损伤、氧化应激和神经炎症。(A)HAT加剧了METH诱导的海马突触可塑性损伤。METH处理后,海马神经元棘突数量显著减少,特别是在HAT给药的情况下。标尺=10微米。(B)METH在海马中诱导时间依赖性的氧化应激和神经炎症。HAT加剧了METH诱导的MDA、TNF-α和IL-6水平的升高,但并未改变LDH的活性。(C)CCH给药减轻了METH诱导的海马突触可塑性损伤。(D)CCH给药抑制了METH在海马中诱导的氧化应激产物和炎性细胞因子的分泌。数据表示为平均值±标准误(高尔基染色每组n=3;MDA、LDH、TNF-α和IL-6水平测定每组n=6)。
三、讨论
在本研究中,我们首次展示了高温对甲基苯丙胺(METH)诱导的小鼠抑郁样行为的作用。研究结果显示,高温环境(28°C)加剧了METH诱导的高温反应,并在METH诱导的抑郁样行为中发挥了关键作用。其次,我们进一步阐明了氢化珊瑚钙(CCH)对METH诱导的高温反应和行为异常的影响。CCH处理显著抑制了METH诱导的海马突触可塑性损伤,并减弱了海马中氧化应激产物和炎症细胞因子的增加。因此,我们的研究表明,作为有效的富氢剂,CCH是治疗METH诱导的精神障碍的一种新颖而有效的治疗方法。
众所周知,频繁使用精神刺激剂会导致行为和认知活动的增加,并且还可能导致严重的精神症状。这些症状,如精神病、抑郁症和焦虑症,预示着药物复吸,并显著增加了自杀行为和死亡风险。先前的研究已经揭示,苯丙胺类精神刺激剂的戒断和重度抑郁障碍在人类中有着显著的行为相似性。此外,慢性或亚慢性METH暴露的戒断会在几种动物模型中诱发焦虑和抑郁样行为。慢性METH使用的剂量和持续时间分别为2至10 mg/kg和7天至8周。此外,经常使用一个狂欢剂量(5–10 mg/kg × 4,每2小时一次)和急性大剂量给药(20–40 mg/kg)来研究其神经毒性。Fonseca等人(2017年)报道,单次神经毒性剂量的METH(30 mg/kg)在小鼠中诱导了持久的抑郁行为。然而,本研究发现,多次重复的10 mg/kg METH注射范式以环境和剂量依赖的方式诱导了抑郁样行为。我们还考虑到METH诱导的高温是抑郁样行为发生的一个重要因素。在先前的研究中,作者将“中性”定义为24–27°C,将“温暖”定义为28–37°C。实际上,28°C不能被视为高温,但我们发现当环境温度高于28°C时,大多数动物在METH暴露后死亡。因此,我们在本研究中将28°C定义为高温,结果显示高温(28°C)加剧了METH诱导的高温反应,并导致抑郁样行为。开放场测试中总距离没有显著变化表明METH诱导的抑郁样行为不影响运动活动。有趣的是,相同的METH注射范式在常温(22°C)下以及慢性METH治疗(10 mg/kg,7或14天)或逐渐增加剂量的METH暴露(2 ∼ 15 mg/kg,3天)未能诱导抑郁样行为。然而,METH戒断后行为测试的时间差异也是一个与矛盾行为结果相关的关键因素。的确,本研究的一个主要缺陷是它没有观察到这些METH处理小鼠在7天内较早的抑郁样行为。
氢气作为一种选择性抗氧化剂,最初由Ohsawa等人(2007年)报道。到目前为止,它已经显示出作为一种新型治疗剂对广泛疾病的明显潜力,特别是氧化应激介导的疾病。我们之前发现,氢气显著减轻了吗啡戒断小鼠的焦虑样行为,并且能够在一定程度上抑制低剂量METH诱导的行为致敏的获得和传递(Wen等人,2020年)。饮用或沐浴富含氢的水以及吸入氢气是向人体施用氢气的流行方法,而在实验研究中,常用的方法包括富含氢的盐水注射、随意饮用富含氢的水,以及吸入氢气来向动物输送氢气。然而,由于氢气在水中的溶解度低,通过饮用富含氢的水或者富含氢的盐水注射在特定时间点实现高浓度和长期积累并不容易。因此,我们只评估了氢气对低剂量METH诱导的行为异常和神经毒性的抑制效果。最近的研究证明,与体外和体内的富含氢的水相比,CCH给药释放的氢气水平更可靠、更强。此外,Ueda等人(2011年)报告说,CCH通过增强海马中基础内源性抗氧化能力发挥抗氧化活性。与上述结果一致,我们发现CCH给药显著减轻了大量重复METH处理诱导的严重高温,并在不改变小鼠运动的情况下抑制了FST和TST中的抑郁样行为。之前有研究报告称,氢气增强了低温并防止了LPS诱导的全身炎症中的低血压和发热。他们发现氢气导致血浆中肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)和前列腺素E2(PGE2)的激增减少,并通过改变下丘脑PGE2的产生发挥了足够强的抗炎作用以预防发热。众所周知,抑郁情绪和快感缺失是重性抑郁障碍的核心症状。FST和TST是用于评估实验室动物绝望行为的常见测试。除了上述结果外,我们还研究了METH暴露和CCH治疗对快感缺失样行为的影响,并在蔗糖偏好测试中得到了一致的结果(见补充图1)。值得注意的是,过去的大多数研究使用口服摄入CCH或CCH富集饮食喂养来进行CCH给药。然而,由于药物处理和体温测定的时间限制,本研究涉及了胃内给药CCH处理。同时,我们认为长期给予胃内注射可能对动物造成压力,并会对行为测试产生影响,因此仅给予7天的胃内CCH处理,然后进行随后的行为测试。我们还确定了CCH处理对运动和抑郁样行为的影响,以及海马氧化应激和炎症指标的影响(见补充图2)。此外,珊瑚钙(CC)被用作对照治疗,以排除其他成分的治疗效果(见补充图3),结果显示CC的处理不影响METH诱导的抑郁样行为。之前的数据还显示,CCH处理后血清总Ca2+水平没有变化(Hou等人,2016年)。因此,我们认为CCH的保护效果依赖于来自CCH的氢气而不是其他成分。
尽管抑郁症状和甲基苯丙胺(METH)戒断具有共同的神经生物学症状,但我们对METH诱导的抑郁样行为可能机制的探索集中在METH诱导的神经毒性以及海马突触可塑性损伤的参与上。最近的研究发现,海马体积减小和神经元丢失是抑郁症的显著特征。越来越多的证据也支持在抑郁症状中存在海马突触可塑性的改变。因此,人们提出METH诱导的氧化应激产物和炎症因子的增加,导致突触蛋白合成减少和结构损伤,最终引发抑郁症状。同样,高温加剧了热应激(HAT),并且在HAT条件下,METH处理的小鼠海马中丙二醛(MDA)、乳酸脱氢酶(LDH)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)显著增加。高尔基染色显示,当METH在HAT条件下给予时,海马突触可塑性相应地遭受严重损伤。此外,CCH给药显著减轻了METH诱导的海马突触可塑性损伤,并降低了小鼠海马中的MDA、LDH、IL-6和TNF-α水平。
然而,本研究有两个局限性。首先,尽管目前的数据揭示了CCH对METH诱导的严重高温的抑制作用,但是否影响下丘脑或产生外周效应从而在METH处理的小鼠中引起温度变化还需要进一步探索。此外,由于CCH在人体中毒性的证据有限,未来研究应仔细调查可能的毒性。
四、结论
在本研究中,我们揭示了高温在METH诱导的抑郁样行为中起关键作用。此外,还证明了CCH释放的氢气有效缓解了METH诱导的高温和抑郁样行为,这一功能可能是通过调节氧化应激和神经炎症介导的海马突触可塑性损伤来实现的。总之,基于我们目前的研究,可以得出结论,CCH作为一种保护性的抗氧化治疗,可能有助于减少METH滥用者精神症状的风险。
https://blog.sciencenet.cn/blog-41174-1429154.html
上一篇:物理储氢技术进展
下一篇:干细胞化CAR T复苏新策略