博文
先天免疫力使记忆持续存在  精选
精选
|
在小鼠中发现了一群在记忆形成过程中参与先天免疫系统机制的神经元。令人惊讶的是,炎症信号可能为长期记忆铺平道路。
记忆如何持久?西班牙超现实主义画家萨尔瓦多·达利(Salvador Dalí)在他的名著《记忆的持久性》(The Persistence of Memory)中思考了这个问题。他还在《记忆持久性的瓦解》中探讨了记忆丧失状况的悲惨后果。随着全球人口老龄化以及阿尔茨海默病和相关形式的痴呆的诊断增加,使记忆持续的机制引起了神经科学家的注意。然而,是什么让在短短几秒钟内编码的短暂经历能够在一生中一次又一次地重播仍然是一个谜。在《自然》杂志上,Jovasevic及其同事1通过描述对记忆至关重要的分子机制,将关键的一环纳入这个难题,并标记出新的神经元群。
在 1950 年代,一名被称为 HM 的男子通过手术切除了部分大脑的颞叶,试图治疗他的癫痫,但他无法形成新的记忆。从那时起,科学家们就把目光投向了海马体——从H.M.大脑中移除的区域之一——作为许多类型记忆的中心2.
神经科学家现在专注于确定海马体中的神经元群如何对记忆诱导刺激做出反应。开创性的工作表明,记忆形成需要一组称为印记的神经元3.Engram神经元的特征在于一组称为直接早期基因的基因的表达,这些基因在学习后被迅速诱导。目前的工作揭示了一组神经元,这些神经元在学习后几天显示出先天免疫信号的激活(图1)。
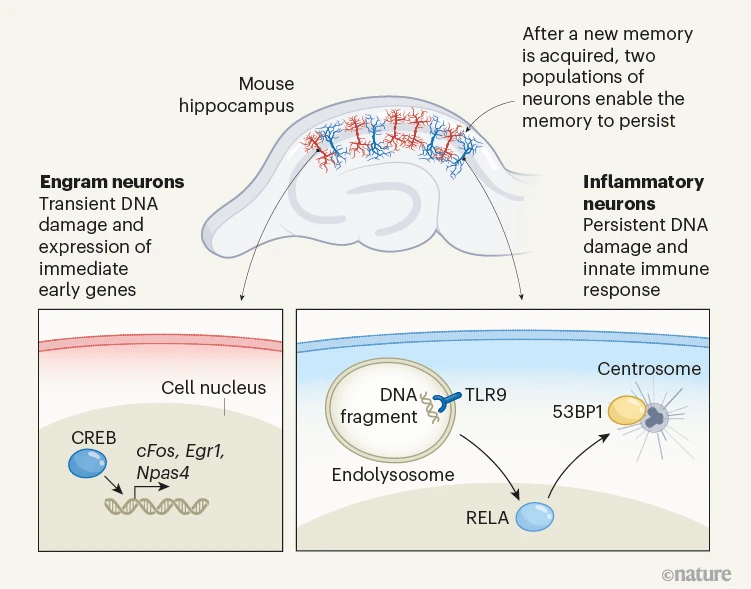
图1 |神经元对记忆的形成和持久性至关重要。Jovasevic 等人研究了小鼠大脑中一个称为海马体的区域中的神经元,该区域负责记忆和学习。在记忆获取之后,属于称为 engram 的群体的神经元表达一组直接的早期基因(如 cFos、Egr1 和 Npas4),这一过程由转录因子 CREB 介导8.这与伴随神经元活动的瞬时DNA损伤有关5.这种反应对于长期记忆的形成很重要3.Jovasevic 等人。发现了一个独特的神经元群体,这些神经元对DNA损伤表现出炎症反应,这种反应在记忆获取后持续数天。炎症信号传导由一种称为TLR9的先天免疫系统蛋白质介导,该蛋白质可检测已掺入称为内溶酶体的细胞区室的DNA核外片段。作者还发现,转录因子RELA是受损DNA定位到称为中心体的细胞结构所必需的,其中蛋白质53BP1介导DNA修复。破坏这些机制导致小鼠无法检索与恐惧相关的记忆,这表明印记神经元和炎症神经元对于记忆的持续存在都是必不可少的。
Jovasevic及其同事评估了情境恐惧条件反射后小鼠的基因表达,其中小鼠学会了将小电击与新环境联系起来。他们比较了预处理后4天(最近记忆时间点)和预处理后21天(远程记忆时间点)的小鼠,发现小鼠的海马体在最近的记忆时间点显示出炎症迹象,表明蛋白质Toll样受体9(TLR9)激活信号传导。TLR9 触发细胞胞质溶胶中 DNA 的先天免疫反应,这通常由细菌病原体引起4.作者表明,在神经元中,这种炎症是由持续的DNA损伤和神经元自身核基因组中TLR9激活的DNA片段的释放引起的。
已知快速诱导即刻早期基因表达需要快速修复的双链 DNA 断裂5.然而,Jovasevic 等人。发现,在与表达直接早期基因 cFos(印记的标记物)的神经元群大不相同的情况下,DNA 损伤持续 4 天。从海马神经元中删除Tlr9基因,从而删除对核外DNA的先天免疫反应,阻止了小鼠回忆长期记忆。这些结果表明,TLR9对双链DNA断裂的感知是一种多功能的分子过程,在记忆和先天免疫中都很活跃。
至关重要的是,Jovasevic 等人。提供了对 TLR9 下游导致内存持久性的机制的见解。作者观察到,尽管大多数双链DNA断裂可以迅速修复,但那些持续存在的双链DNA断裂显示出对中心体的特殊定位 - 一种细胞结构,以其在细胞分裂中的作用而闻名,但它也在DNA损伤反应中发挥着越来越重要的作用。定位于中心体的 DNA 形成 DNA 损伤反应复合物,其中还包括蛋白质 53BP1,这是双链 DNA 断裂修复的关键介质。作者表明,从海马神经元中去除Tlr9可以防止中心体DNA损伤和DNA修复复合物的积累,这表明TLR9信号在神经元中的一个关键功能是维持基因组完整性。
作者还证明,去除一种名为RELA的蛋白质 - NF-κB转录因子家族中最丰富的成员,也是TLR9诱导的炎症信号传导的关键下游介质 - 会干扰中心体DNA修复机制的积累,表明RELA通过53BP1将TLR9激活与DNA修复联系起来。与行为记忆类似,免疫记忆是由经验塑造的。2022 年一项关于先天免疫反应的研究表明,NF-κB 信号传导编码有关细胞当前状态及其历史的信息6.这项早期研究与当前工作之间的相似性表明,先天免疫反应的分子介质在神经元和免疫细胞中都具有相关的记忆功能。
这项研究最重要的贡献之一是深入了解了DNA损伤(记忆诱导刺激的快速后果)与与长期记忆相关的持续细胞变化之间的联系。与Jovasevic等人同组的研究人员。先前发现,在远程记忆时间点,海马神经元的基因表达谱支持称为初级纤毛和周围神经元网的细胞结构的形成,这对于远程记忆的检索是必不可少的7.在目前的工作中,作者证明了TLR9和RELA都是两种结构形成所必需的。这些结果提供了记忆的获取和长时间可靠存储记忆的能力之间的分子联系。
尽管通过鉴定这些炎症神经元提供了实质性的见解,但相关问题仍然存在。例如,这些神经元赋予了记忆的哪些属性?它们如何与engram神经元相互作用?作者推测,炎症神经元可能在记忆的稳定性和灵活性中起关键作用,但印记神经元可以回忆起记忆。也许 engram 神经元产生初始记忆信号,而这项工作中发现的炎症神经元支持和雕刻记忆,使其持久存在。
然而,这些神经元在获取、巩固或检索记忆过程中的活动或功能特性仍未确定。需要记录整个记忆过程中的电活动和炎症神经元的选择性操作,以更好地了解细胞对记忆持久性的贡献。同样,有必要定义学习后诱导炎症反应的时间尺度。Jovasevic及其同事对单细胞中基因表达的分析只是表征这些炎症神经元中诱导的分子过程的第一步,令人惊讶的是,在该实验中既没有观察到Tlr9也没有观察到Rela表达。
要真正了解这些神经元的本质,确定如何选择神经元参与印记或炎症群体至关重要。对 engram 神经元的研究表明,转录因子 CREB(记忆中活动诱导的基因表达的启动子)的基线表达为单个神经元的招募做好准备8.炎症人群可能存在类似的机制。DNA损伤史是否会使某些神经元在学习后容易出现持续的DNA损伤和TLR9的激活?先前的工作概述了体细胞(非遗传性)突变(由活性转录过程中积累的DNA损伤引起)如何标记人类神经元的发育谱系并影响其成熟功能9.
最后,这些炎症神经元的意外性质提出了紧迫的问题,因为DNA损伤在衰老和神经退行性变中起着关键作用。TLR9 的激活也已知会导致神经退行性变,主要通过小胶质细胞(中枢神经系统的免疫细胞)进行10.为什么在神经元中,TLR9的激活对记忆的形成至关重要,而在小胶质细胞中,它会产生神经退行性变——记忆的对立面?是什么将有害的DNA损伤和炎症与记忆所必需的DNA损伤和炎症区分开来?在衰老和神经退行性疾病的背景下,这些机制是如何被破坏的?这些机制是否会导致伴随许多神经发育障碍的认知缺陷?
回答这些问题需要付出很多努力。正如达利用他标志性的超现实主义风格来描绘记忆及其不稳定性一样,约瓦塞维奇等人发现的分子机制也可能是这样。可能支撑着记忆的持久性和瓦解性。
https://blog.sciencenet.cn/blog-41174-1427546.html
上一篇:氢气通过抑制细胞膜NR2B磷酸化和氧化应激,降低了难治性癫痫持续状态大鼠的脑电图活性和神经元死亡
下一篇:帕金森患者吸氢的效果