博文
冷大气等离子体:现代医学的有力工具
|
IJMS | Free Full-Text | Cold Atmospheric Plasma: A Powerful Tool for Modern Medicine (mdpi.com)
冷大气等离子体在临床研究中的使用主要局限于慢性伤口的治疗,但其在广泛的医学领域的应用现在是许多分析的目标。因此,其应用范围很可能在未来得到扩展。冷大气等离子体已被证明可以减少微生物负荷,而不会对健康组织产生任何已知的显着负面影响,这应该会增强其在任何微生物感染部位的可能应用。它还被证明具有抗肿瘤作用。此外,它对干细胞和其他培养细胞具有增殖作用,并且高度增加的一氧化氮水平对这种增殖具有非常重要的作用。冷常压等离子体的使用也可能对癌症患者的免疫治疗产生有益影响。最后,等离子体装置的使用可能不仅限于表面结构,因为目前开发足够微型的微等离子体装置的努力很可能导致其在皮下和内部结构中的应用。本研究总结了有关冷等离子体作用机制的现有文献,并分析了其目前在体内和体外的使用,主要在再生和牙科医学以及肿瘤学领域。
关键词:冷大气等离子体;伤口愈合;肿瘤学;再生医学;等离子体
Braný, D.; Dvorská, D.; Halašová, E.; Škovierová, H. Cold Atmospheric Plasma: A Powerful Tool for Modern Medicine. Int. J. Mol. Sci. 2020, 21, 2932. https://doi.org/10.3390/ijms21082932
1. 引言
威廉·克鲁克斯(William Crookes)于1879年通过通过电压线圈施加高压来实验电离放电管中的气体,从而建立了等离子体科学的基础。电离气体被命名为辐射物质。近五十年后的1927年,欧文·朗缪尔(Irvin Langmuir)[1]提出了当前的等离子体术语。在过去的几十年里,等离子体已被应用于许多领域,包括医学[2,3,4]。等离子体通常被定义为由多原子气体分子分解或从单原子气体壳层中去除电子而产生的电离气体[5]。然而,由于以下严格的定义,并非每种含有带电粒子的电离气体都可以被视为等离子体[5,6,7]:(1)等离子体必须具有大分子中性(准中性)。在等离子体中没有外部干扰的情况下,产生的净电荷为零。因此,等离子体包含(几乎)相同密度的带正电和带负电的粒子;(2)等离子体必须具有德拜屏蔽,其中等离子体中的带电粒子被布置成有效地屏蔽德拜长度距离内的静电场。这被定义为等离子体内其他带电粒子感受到单个带电粒子的电场影响的距离的量度;(3)等离子体频率。如果等离子体失去其平衡条件,由此产生的内部空间电荷场会促进集体粒子运动,从而倾向于恢复原始电荷中性。这种运动的特点是自然振荡频率,称为等离子体频率。因此,等离子体可以定义为“一种准中性气体,含有许多相互作用的自由电子和电离原子和分子,它们具有由长程库仑力引起的集体行为”[7]。此外,等离子体中的带电粒子运动会产生电场并产生电流和磁场[6]。
等离子体也可分为高温组、热组和非热组[7,8]。所有粒子(电子和重粒子)在高温等离子体中具有相同的温度,因此它们处于热平衡状态。在热(准平衡等离子体)中,只有等离子体内的热平衡区域。最后,非热(非平衡)等离子体具有不处于热平衡状态的粒子。这种等离子体被称为“冷等离子体”[7,8]。
高温或热等离子体的电子密度和电离度高于冷等离子体,冷等离子体的电离率仅为1%[5,6,7]。在电离不良的等离子体中,电荷-中性相互作用主导了多种库仑相互作用[6]。此外,尽管电子-电子碰撞在冷等离子体中实现了热力学平衡,并且它们的温度远高于离子和中子的温度,但它们不能将其动能转移到更大的粒子上[6]。
高温等离子体可达108K,如在太阳核心中发现的。热等离子体温度约为 2 × 104K,这在雷暴闪电中观察到。最后,在人工创造的条件下,非热等离子体温度可以达到300-1000K,如荧光灯管[8,9]。冷等离子体放电可以在低压和大气压下实现[2,3,10]。
1960年代后期,低压冷等离子体首次应用于对表面进行净化,这种处理在某些方面被证明比传统灭菌更有效[11]。相比之下,直到1990年代后半期才发现冷大气等离子体(cold atmospheric plasma, CAP)在减少微生物负荷方面的益处[12,13]。然而,CAP为现代医学提供了比低压产生的冷等离子体更好的替代方案。CAP应用也是一个比低压等离子体更容易使用的过程,因为它可以从便携式设备产生,这使得比低压冷等离子体所需的大型真空发生系统更容易接触到受影响的细胞和组织。此外,大多数类型的低压等离子体发生系统都非常昂贵[11]。将任何身体部位放置在这个系统中并使其暴露于等离子体放电也是不切实际的,几乎是不可能的。此外,所有动物和人体组织都含有水,在低压条件下存在水是不可取的[11]。最后,虽然低压等离子体放电可以调节,但其特性与常压等离子体产生的放电有很大不同和更强,一般不适合应用于人体或动物细胞或组织。然而,在低压下产生的冷等离子体可用于医学。例如,它在“快速灭菌”、植入物和组织工程产品表面修饰中的应用[11]。
虽然CAP不能达到低压等离子体的灭菌和去污能力[11],但它仍然能有效降低微生物负荷[14,15]。最重要的是,CAP的作用不那么强烈,可以直接应用于细胞和组织[3,4],并且其降低微生物负荷的能力使其成为替代抗生素和对抗抗生素耐药性增加的细菌菌株的良好选择[3]。CAP生成器件的另一个巨大优势是其相对较低的制造成本[3,4]。因此,便捷、高效和更便宜的 CAP 设备很可能会减轻传统治疗对卫生预算造成的财务负担。
等离子体放电主要通过形成紫外线辐射、诱导活性氧(ROS)和氮(RNS)以及产生电流来降低细菌的活力[4,16,17,18,19,20,21,22]。等离子体放电产生的氧基物质包括羟基 (OH)、过氧化氢 (H2O2)、超氧化物(O2−•)、羟基自由基(•OH)、单线态氧(1O2)和臭氧(O3) [23,24]。氮基物质是一氧化氮(•NO),二氧化氮(•NO2)、四氧化二氮(N2O4)、三氧化二氮(NO3)、一氧化二氮(N2O)和过氧亚硝酸盐(ONOO-)[23,24]。反应性物质可以通过等离子体-空气相互作用或等离子体-液体相互作用形成。羟基自由基和一氧化氮通常是由等离子体-空气相互作用形成的,亚硝酸盐、硝酸盐和 H2O2等离子体-液体相互作用形成的寿命相对较长[23,24]。例如,当培养基中的细胞暴露于等离子体时,就会发生后一种相互作用[25]。此外,CAP 还会产生带正电的离子,例如 N2+ [22]和电子[20]。
然而,原核细菌细胞不同于真核人和动物细胞,肿瘤细胞不同于健康细胞。此外,所有细胞在体外条件下都可以发挥不同的作用,并且它们对生物体组织中的细胞的反应也不同。这凸显了在这些细胞类型以及体外和体内条件下对CAP设备产生不同反应的可能性[26]。然而,通常认为低剂量等离子体处理可刺激细胞活力并增强增殖、分化和迁移,而高剂量应诱导细胞凋亡[26]。
临床实践中使用的等离子体设备旨在避免对健康细胞造成危险。它们经过多步骤检测,目前没有显著的副作用[4,27,28]。然而,临床实践中适当的CAP剂量必须严格控制,这种控制取决于治疗类型。例如,必须仔细调整等离子体源和处理对象之间的距离。Nastuda等[29]报道,即使管喷嘴和人体皮肤之间相差1厘米,等离子喷射的效果也可能有很大差异。作者发现,当皮肤-喷嘴间隙从15毫米减少到5毫米时,等离子体扩散和流经人体组织的电流存在显着差异。此外,不能假设CAP应用在分子水平上没有一些最小的负面影响。所有这些发现和可能性都有待持续分析,但目前的结果表明,CAP的许多益处超过了未经证实的不良反应[3,4,12]。最后,由于大多数CAP研究是在过去15年中刚刚进行的,因此未来在临床实践中使用CAP可能会有更多的可能性和更大的益处[3,4,12]。虽然CAP可用于美容手术[30,31,32],但本文总结了CAP在更严重的医疗条件下的使用。这些尤其包括急性和慢性伤口以及口腔细菌感染和肿瘤治疗。同时,我们探索了等离子体在再生医学和生物工程中的潜力。
临床使用和实验测试的CAP器械分为三大类:1.基于直接放电的设备,2.基于间接放电的设备,以及3.)混合型[4,33,34]。
直接介电势垒放电 (DBD) 发生在高压电极和接地电极之间。电极可以同时或单独覆盖电介质层,或者介电材料可以放置在电极之间的空间中。DBD设备也必须仅使用交流或脉冲高压充电,以确保电容耦合。在初始气体击穿后,这些器件中的电子和离子被介电势垒“阻止”。然后,离子和电子的电场将电场与外部源隔离开来。如果保持这种状态,则会导致放电损耗,必须改变外部电压以保持放电。当施加增加的交流电压时发生击穿,当达到最大电压时放电活动停止。此外,在使用脉冲操作 DBD 的同一时期会发生两次击穿。初始击穿是由高压脉冲引起的,电荷载流子产生的电场足以在电压降低时引起进一步的击穿。这表现为“向后放电”[35,36,37]。DBD 器件有多种变体和设计,其中最实用和最适合医疗应用的是浮电极 DBD (FE-DBD)。从技术上讲,FE-DBD设备不包含接地电极,取而代之的是受影响的细胞或组织。DBD 设备提供更高的强度、更适应性和可控的放电。它们还可以仅在空气中产生等离子体,而无需载气。然而,放电区域相对有限,因为它必须位于两个电极之间,并且必须保持恒定的距离;这需要光滑、平坦的表面[4,33,34]。
间接放电由通常称为等离子射流、等离子笔或等离子割炬的设备产生。这些装置类似于间接放电装置,因为它们由两个在它们之间产生等离子体放电的面向电极组成,但在这里,载气引导等离子体放电。因此,放电不会影响两个电极之间的物体,而是沿气流方向进行。虽然这允许目标物体位于设备外部并且受影响的区域是可调节的,但产生的 ROS 和 RNS 种类较少,并且放电比 DBD 设备更难控制。最后,间接器件产生的等离子体在所有紫外线范围内都更强,但与DBD器件不同的是,它们不产生电流。
混合等离子体设备结合了这些原理,但目前仅在实验水平上应用。这些器件通过在接地的网状电极上组合微放电来产生放电。放电均匀,对两个电极之间的物体没有影响,器件相对容易控制。然而,这些设备对部件磨损和随后劣化的敏感性略高。这在潮湿环境中以及与处理过的细胞和组织直接接触后尤为明显[4,33,34]。
有三种特定类型的等离子体器械经临床实践认证[11]。第一个经过认证的设备是 kINPen MED 等离子笔(INP Greifswald/neoplas tools GmbH,德国格赖夫斯瓦尔德)。第二个是基于介电等离子放电技术的PlasmaDerm VU-2010 DBD设备(CINOGY Technologies GmbH,Duderstadt,德国),最新的认证设备是SteriPlas等离子炬设备(Adtec Ltd.,伦敦,英国)。然而,还有几种经过各种修改的设备已经在实验室和实验条件下进行了测试,正在等待可能的临床应用认证。
最后,等离子体应用本身可以是直接的,也可以是间接的。在直接等离子体应用中,细胞系在体外暴露于等离子体放电,动物模型和人体组织在体内暴露于放电。相反,受等离子体影响或活化的介质或溶液用于间接应用。然后将其用于细胞培养或直接注射到测试对象中,例如小鼠异种移植物[38]。此外,长期物种包括硝酸盐、亚硝酸盐和H₂O₂通常保存在等离子体活化培养基(PAM)中[39]。
2. 使用冷等离子体治疗慢性和急性伤口
CAP的抗菌作用在1990年代得到证实,这导致其在医学上的应用[12]。2007年最初的临床试验将等离子体装置用于面部年轻化手术[40]。CAP在再生医学中的应用最初旨在通过减轻细菌感染来加速急性和慢性伤口愈合,因为感染会显著减缓愈合过程[4,10,27]。Isbary等[41]进行了首次随机试验。这些作者研究了CAP对慢性溃疡伤口微生物感染缓解的影响,并证实了感染显着减少而没有副作用。两年后,他们报告说,两分钟的CAP治疗足以降低微生物负荷并改善慢性溃疡愈合[42]。两项研究都包括静脉、动脉、糖尿病和创伤性溃疡,无论细菌类型如何,都观察到细菌感染减少。慢性腿部溃疡相对常见,尤其是静脉溃疡,累及全球人口的2%[43,44]。溃疡的减少和治愈是复杂的,需要长期护理。此外,15%的患者有永不愈合的溃疡,高达71%的患者有复杂缓解[43,44]。细菌感染是溃疡复杂治疗的主要原因,溃疡中存在的许多菌株对常规抗菌治疗的耐药性越来越强[45,46]。因此,研究的重点是冷等离子体在溃疡治疗中的应用。一项关于CAP治疗的随机研究纳入了14例患者[47]。一半的患者接受常规手术治疗,其余患者同时接受CAP治疗。两组每三周进行一次治疗,持续八周,然后是为期四周的观察期。尽管两组的动脉溃疡均减少,但CAP组的改善速度更快,可观察到。随后,一项类似研究分析了CAP对50例压疮患者的影响[48]。受试者被分为标准治疗组和联合CAP干预组,每周进行一次治疗,持续八周。第一周后,CAP组的改善(包括细菌载量降低)已经明显更大。
在Wistar大鼠模型中也记录了CAP在减少压疮方面的益处。实验产生的溃疡用CAP治疗60秒,每天3次,持续5天[49]。等离子体暴露后,导致快速再上皮化、血管生成、胶原合成和组织机械强度增加。Guo及其同事[50]研究了CAP对各种慢性伤口的影响,包括坏疽性脓皮病、巨大生殖器疣和糖尿病足溃疡。坏疽性脓皮病患者以前曾接受过抗生素治疗,但未成功。每 2 天照射一次病灶 5 分钟,所有病灶总照射 60-80 分钟。第三天渗出量明显降低,6个暴露周期使病变完全干燥和收缩。该患者又接受了 6 个月的治疗,没有缓解。第二位患者在抗生素治疗后坏疽性脓皮病有所改善,然后接受了这种 CAP 方案的治疗。8 次 CAP 治疗后病变完全消失。在 4 个月的随访期间再次没有发现复发。此外,一名足部溃疡两个月的糖尿病患者在四次重复 CAP 治疗后出现溃疡愈合。
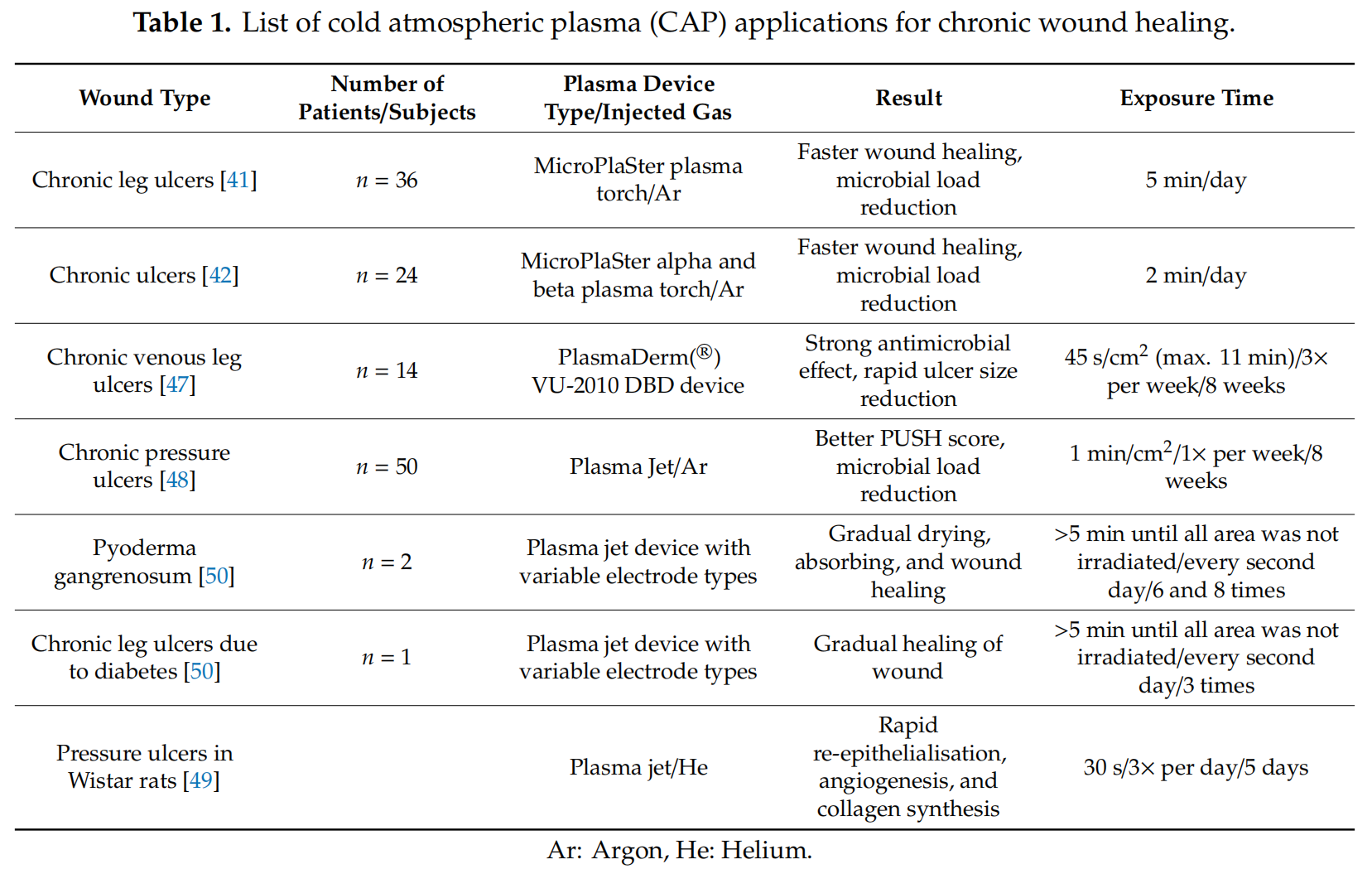
最后,两项独立研究报告了CAP装置与常用奥克替尼定消毒剂同时使用治疗慢性腿部溃疡的可能性。作者认为,与单独使用冷等离子体和这种消毒相结合应该比单独使用效果更好[51,52]。表1列出了用于慢性伤口愈合的CAP应用。
表 1.冷大气等离子体 (CAP) 在慢性伤口愈合中的应用列表。
使用CAP的主要目的是提供一种现代形式的伤口消毒。然而,由于皮肤微循环增加、单核细胞刺激、角质形成细胞和成纤维细胞增殖以及细胞迁移,CAP治疗已被证明对伤口愈合有益[26,27]。其中,角质形成细胞和成纤维细胞在伤口愈合后期尤为重要[26]。
CAP应用对角质形成细胞和成纤维细胞增殖的积极作用已在体外细胞系中得到证实[53]。HAcaT 角质形成细胞系和 MRC5 成纤维细胞系即使在短暂的 CAP 暴露后也具有增加的迁移率。这涉及分子水平间隙连接蛋白活性的降低,以及贴壁连接和细胞骨架动力学的变化,同时 E-钙粘蛋白和整合素下调。该研究还研究了小鼠模型中的体内等离子体效应,作者证明观察到的伤口愈合是由于NO、紫外线辐射、ROS和RNS的形成和作用[53]。其他几项研究也证实了CAP对角质形成细胞活性的影响。CAP暴露后,这些细胞中的β1-整合素表达同时增加,E-钙粘蛋白和EGFR表达降低[54]。此外,应用CAP后,角质形成细胞的ROS水平显著升高,这导致了各种细胞适应机制[55]。超过260个基因,包括编码细胞因子、生长因子和抗氧化酶的基因,被差异表达。此外,参与调节细胞发育和分化的HSP-27细胞保护性热休克蛋白也高表达[55]。Schmidt等[56]指出,p53级联反应应该是角质形成细胞中冷浆细胞相互作用的主要枢纽。作者还认为ATM和ATR氧化还原传感器具有更高的活性,并且MAP激酶信号应调节p53信号。
最近的一项研究[57]在CAP影响的成纤维细胞和角质形成细胞之间建立了有趣的“串扰”。这些细胞的共培养模型表明,等离子体暴露启动了更高的 HIPPO 通路活性,并且该通路 YAP 的转录共激活因子显着上调。此外,该通路的下游效应子和YAP靶基因CTGF和CYR 61[58]的表达更高,但这只见于成纤维细胞。然而,这种增加的表达可以通过使用抗氧化剂来逆转。最重要的是,只有当 HaCat 角质形成细胞与 CAP 处理的成纤维细胞条件培养基一起孵育时,它们才会增加角质形成细胞的迁移率。最后,作者推测成纤维细胞分泌的 CTGF 和 Cyr61 通过旁分泌信号激活角质形成细胞。这一说法的证据包括,即使不存在 CAP 处理的成纤维细胞,HaCat 细胞系在暴露于重组 CTGF 和 Cyr61 后也具有更大的迁移率。
有趣的是,动物小鼠模型中的冷等离子体加速了二度和三度烧伤的伤口愈合。这主要是由于血管生成增加。在分子水平上,NO的形成加速,PDGFRβ和CD31促血管生成标志物的表达增加。TGFβ1活性和VEGFA/VEGFR2信号刺激也增加[59,60,61]。在大鼠皮肤暴露于硫酸后化学烧伤的大鼠模型愈合中也证明了积极的CAP效应。在这里,每天接触 CAP 40 秒可加速愈合。21 天后,CAP 处理的伤口几乎消失了,而未经处理的伤口仍然清晰可见。作者还指出,CAP治疗伤口的生化特征发生了变化。这在以下氧化应激标志物的水平变化中很明显。CAP组丙二醛水平升高,还原谷胱甘肽、谷胱甘肽过氧化物酶和过氧化氢酶水平低于未受影响的对照组、等离子体改性聚氨酯伤口敷料组和自然伤口恢复组。在21天的治疗期间,这些组的白细胞动力学和补体成分3和纤维蛋白原的产生不同。自然伤口恢复组的白细胞计数通常最高,CAP组的白细胞计数最低。纤维蛋白原和补体成分3浓度在自然伤口恢复组中同样最高,在CAP治疗组中最低[62,63]。Betancourt-Angeles等人随后证明,冷等离子体加速了人类烧伤愈合[64]。三分钟的CAP应用后疼痛和瘙痒得到缓解,16小时后再重复应用三分钟,显着加速愈合和新组织的形成。这是一项病例报告研究,作者没有在等离子体给药期间或之后研究分子机制。然而,先前的研究支持血管生成和生长因子激活已经发生的预期。
还研究了 CAP 对不同急性伤口的影响。一项研究涉及不同大小的下肢皮肤移植患者。患者被分为两组,一组接受安慰剂,另一组接受CAP治疗。最终结果显示,CAP组患者在CAP应用后的第二天愈合过程要好得多[65]。
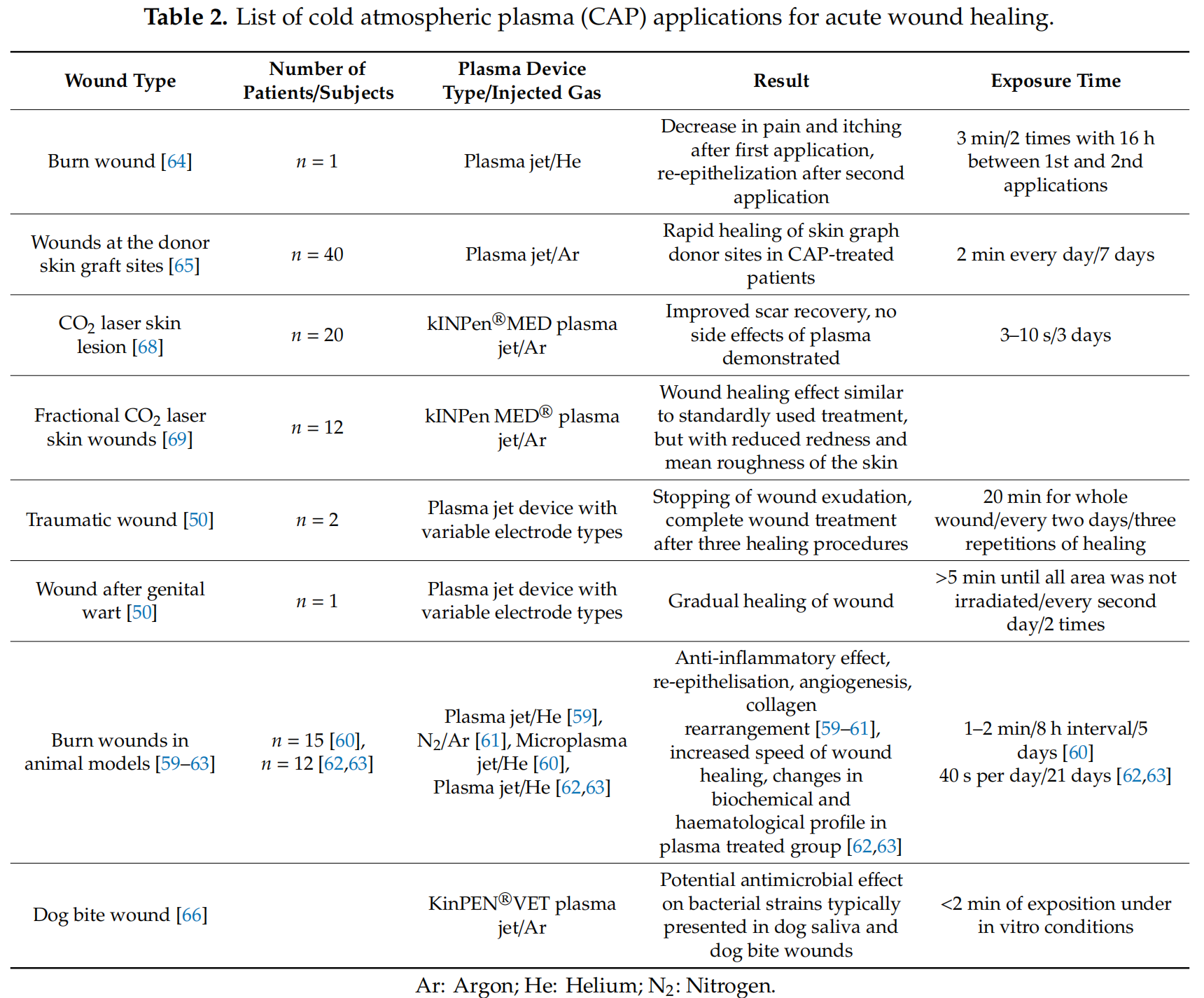
另一项有趣的研究调查了等离子体应用于狗咬伤的潜力[66]。在这里,作者分析了CAP对狗唾液中常见的以下细菌菌株的影响:中间葡萄球菌、金黄色葡萄球菌、犬链球菌、铜绿假单胞菌、多杀性巴氏杆菌和大肠杆菌。CAP对所有这些细菌都具有很强的体外抗增殖作用。然而,菌株之间存在一些差异,这取决于细菌生长阶段和治疗时间。作者先前的类似研究[67]显示,CAP的整体净化效果低于聚己二胍和生理盐水灌洗。然而,这些差异在统计学上并不显着,并且使用的消毒剂不会影响整个愈合过程。因此,进一步的分析将有助于建立关于CAP用于治疗狗咬伤的明确结论。然而,可以预期,目前在这些急性伤口中应用CAP的潜力将会增加,特别是当这些细菌菌株的耐药性增加使治疗复杂化时。另一项研究涉及接受自愿激光烧蚀皮肤病变的健康志愿者。然后用CAP治疗他们造成的伤害,作者计划在3天内间隔30秒进行CAP治疗,足以改善伤口愈合[68]。Nishijima等[69]的进一步研究研究了冷等离子体加速由二氧化碳分数激光产生的急性表面伤口愈合的能力。这些伤口的标准临床治疗方法是局部软膏使用,包括类固醇、凡士林、碱性成纤维细胞生长因子喷雾剂和含有富勒烯的凝胶[69]。研究志愿者被分为四组:(1)不治疗,(2)CAP治疗,(3)使用含有戊酸倍他米松的软膏,以及(4)使用碱性成纤维细胞生长因子喷雾剂。虽然两组的整体伤口愈合没有显著差异,但CAP组的皮肤发红和平均粗糙度减少最多。Gao等[50]研究了冷等离子体对两种创伤性伤口的影响。第一位患者使用了糖皮质激素和莫匹罗星的不适当自我治疗,导致自残继发性湿疹,伴有渗出和结痂。每隔一天用 CAP 治疗 20 分钟,伤口渗出停止,连续三轮治疗后可见伤口愈合。第二位患者的伤口已接受抗生素治疗,但没有成功,连续三轮CAP应用后观察到伤口完全愈合。最后,这项研究纳入了一名接受 CAP 治疗的巨性尖锐湿疣患者。患者在免疫抑制药物治疗期间患有这种疣三个月,这导致整体免疫力下降。去除疣后,用 CAP 治疗消融部位 40 分钟,然后在再过三天后重复。重复两次后完全愈合。表2列出了用于急性伤口愈合的CAP应用。
表 2.冷大气等离子体 (CAP) 在急性伤口愈合中的应用列表。
3. 牙科医学中的冷等离子体
标准清洁程序和口腔消毒基于激光设备的使用、机械感染去除或使用抗菌溶液。然而,前两种手术可能会对组织造成热损伤或机械损伤。使用CAP设备可以显著降低这种风险[70]。CAP的另一个优点是,它的放电可以相对容易地应用于不平坦的表面和难以接近的口腔部位。从足够微型的装置中排出的分泌物也可以直接施加到牙管[71]。最后,与液体抗菌溶液相比,CAP可应用于离散的口腔部位,CAP治疗后未发现使用微生物溶液的不良副作用[70,72]。
此外,牙科生物膜中经常存在的细菌菌株具有越来越大的耐药性。忽视牙齿生物膜的去除可导致严重疾病,包括吸入性肺炎、心内膜炎和其他全身性疾病[73,74]。Delben等[73]证明,CAP的应用对白色念珠菌和金黄色葡萄球菌具有显着的抗菌作用,这些细菌通常存在于牙科生物膜中。CAP装置对微生物负荷的降低也与青霉素G或氟康唑给药相当。一项类似重点研究证实了冷等离子体对牙菌斑中广谱细菌的抗菌作用,其中最重要的是变形链球菌[75]。此外,CAP对培养细胞系的体外抗增殖作用大于标准氯己定消毒剂的使用[75]。
一些研究还调查了 CAP 设备在减少牙科管中微生物负荷方面的应用。在这里,电子显微镜扫描显示,在应用离体CAP5分钟后,细菌生物膜消失至1mm深度[76]。Armand等[77]随后在100颗拔牙和消毒的牙齿样本中模拟了粪肠球菌感染。这种细菌在发炎的耳道中相对常见[78]。He/O2正如电子显微镜扫描(SEM)所证实的那样,等离子体在降低微生物负荷方面最有效,并且He等离子体的疗效与光动力疗法大致相同。然而,作者指出,由此产生的效果很大程度上受到牙科管形状的影响。直管的影响更大。Shahmohammadi Beni等[79]随后对CAP应用于口腔的可能性和局限性进行了有益的研究。其中,他们讨论了与口腔表面结构相关的CAP应用,并特别关注OH自由基的扩散。
除了消毒外,CAP 在牙科医学方面还有其他已证明的好处。Dong等[80]记录了等离子体通过增加其与其他牙齿结构的结合强度对浅表牙本质具有积极作用。此外,CAP的应用应对加强纤维增强柱和复合芯材之间的联系产生积极影响[81]。冷等离子体对口腔中的钛结构也有显着影响。在这里,CAP应该增加亲水性,并增加钛表面的粗糙度[82]。这两个方面都可以改善成骨细胞的细胞粘附、增殖和分化,这三个因素可以提供更快的骨整合[83]。虽然使用CAP增加的粗糙度会引起更大的细菌积累[84],但CAP的抗菌能力可以最大限度地减少这种负面影响。这些方面使 CAP 设备非常适合治疗种植体周围炎症。CAP还影响锆结构。Yang等[85]记录了CAP施用后微生物负荷减少,亲水性增加,CAP施用后锆石结构拓扑结构没有变化。最后,一项关于三种设备对牙菌斑影响的研究提供了有趣的结果。特别值得注意的是,目前尚无公认的牙菌斑细菌菌株对CAP治疗具有耐药性[86]。CAP在体外和离体条件下对牙科和口腔结构的影响列于表3。
表 3.体外和离体条件下冷大气等离子体(CAP)对牙和口腔结构的应用效果列表。

4. 使用CAP激活干细胞和祖细胞的增殖
预计CAP还可以影响干细胞增殖,这些细胞可以用于再生医学和医学工程。然而,只有少数分析关注这种可能性。Park等人的一项研究表明,CAP装置确实诱导了脂肪组织(ASC)干细胞的增殖,而不会以任何方式影响其生命特性[87]。这些作者报告说,早在CAP治疗后72小时,干细胞增殖就高出1.57倍。该研究还报道了CAP诱导的NO的影响[87]。CAP装置干细胞增殖的正增加证实了这一点,通过应用NO清除剂而大大减少。此外,当未暴露于CAP的ASC细胞用DETA-NONOate NO供体处理时,它们的增殖率高于对照细胞,但增殖率明显低于受CAP影响的细胞。这些结果表明,NO浓度的增加是增殖增加的一个非常重要的因素,但它很可能不是唯一的因素。
应用 CAP 后,在骨祖细胞 MC3T3-E1 细胞中未观察到细胞毒性或其他负面影响。此外,CAP诱导的NO水平累积。该NO被引入细胞内空间,其在培养细胞中的水平可以得到控制。在这些条件下,随后诱导了早期成骨分化,即使在没有促成骨生长因子的情况下也能实现这一点[88]。关于CAP对骨分化影响的进一步研究再次讨论了其对MC3T3-E1小鼠成骨细胞前体系的影响[89]。在那里,CAP对成骨分化的刺激作用与在成骨分化培养基中测定的刺激作用相当。作者还观察到CAP影响后分子级联反应的显着变化。虽然PI3K/AKT和MAPK信号转导减少,但成骨基因RUNX2、OCN、COL1和ALP的表达增加。此外,CAP还影响了FOXO1的去磷酸化,而FOXO1对成骨细胞的增殖和氧化还原平衡很重要,也是骨形成的一个非常重要的控制因素[90]。尽管祖细胞系在某些方面与干细胞不同,但不可忽视的是,当CAP治疗启动骨分化时,这种类似的机制也可能发生在干细胞中。
还分析了CAP对从牙周韧带(hPDL-MSCs)分离的人间充质干细胞的影响。同样,没有观察到阴性或细胞毒性作用。此外,这种 CAP 处理抑制了 hPDL-MSC 迁移并诱导脱离,而不会损失整体细胞活力。然而,尽管细胞活力不受影响,但作者指出,在应用CAP后,细胞的群体倍增时间延长。最重要的是,CAP在这种情况下促进了成骨分化[91]。
使用CAP还可以启动造血干细胞和骨髓干细胞的增殖。与未经处理的细胞相比,这两种细胞系的增殖几乎翻了一番[92]。作者还观察到,典型干细胞标志物CD44和CD105的表达在骨髓细胞系中几乎是五倍,并且OCT4,SOX2和NANOG基因在两种细胞系中的表达增加。最后,作用于G1-S细胞周期转换的基因的表达也增加,可以推测CAP的应用可以影响该细胞周期阶段[92]。
有趣的是,CAP的作用可能包括启动干细胞和生物材料的结合,以及其有益的直接应用于细胞。例如,Alemi等[93]评估了冷等离子体应用是否能改善软骨组织工程中的干细胞和生物材料支架粘附。他们发现CAP增强了支架表面的亲水性,这显着减小了接触角并有助于初始细胞结合。
神经退行性疾病和创伤性中枢神经系统损伤目前难以治疗。然而,神经干细胞 (NSC) 可以改善它们的治疗,并且一些研究已经调查了 CAP 诱导的 NSC 增殖。他们发现,CAP治疗后,C17.2-NSC小鼠NSC增殖和分化速度明显加快[94]。此外,近75%的神经干细胞在暴露于CAP后分化成神经元细胞系,这一比例大于特定生长因子所达到的百分比。应用CAP后从NSC分化的神经元具有较高的β微管蛋白III蛋白表达水平,这被认为是该细胞类型的典型标志物[95]。然而,最近的研究表明,高β-微管蛋白III表达在其他干细胞类型中也很典型[96]。此外,该研究的作者仅观察到NSC与少突胶质细胞的中度分化,典型的O4蛋白标志物表达仅略高[97]。这些作者随后发现,星形胶质细胞在受累细胞和非受累细胞之间的分化方面没有差异,其典型的GFAP蛋白标志物仅表达极少[94,98]。Jang等[99]也表明CAP对神经干细胞增殖有积极作用,他们记录了以下机制:(1)等离子体相中被激发的原子氧引发了ROS和RNS的形成,(2)它们随后与细胞外液相中的反应性原子相互作用形成NO,从而诱导了线粒体复合物IV中可逆的细胞色素c氧化酶抑制。这导致线粒体O增加2−生产,最后(3)由O形成的胞质过氧化氢2−去突变作为细胞内信使特异性激活 Trk/Ras/ERK 信号通路。在这里,作者认为线粒体O2和胞质 H2O2必须协同作用,因为实验性胞质 H2O2增加不仅不足以引发分化。然而,某些方面,主要是酪氨酸激酶受体信号传导中特定位点的磷酸化是如何发生的,仍然未知。最后,CAP诱导的神经分化与以前使用的神经分化诱导剂(包括视黄酸和白藜芦醇)相比具有优势。这种CAP处理使神经突能够更快地达到最大长度,分化效率提高,并且几乎70%的分化神经元被鉴定为儿茶酚胺能DA神经元。
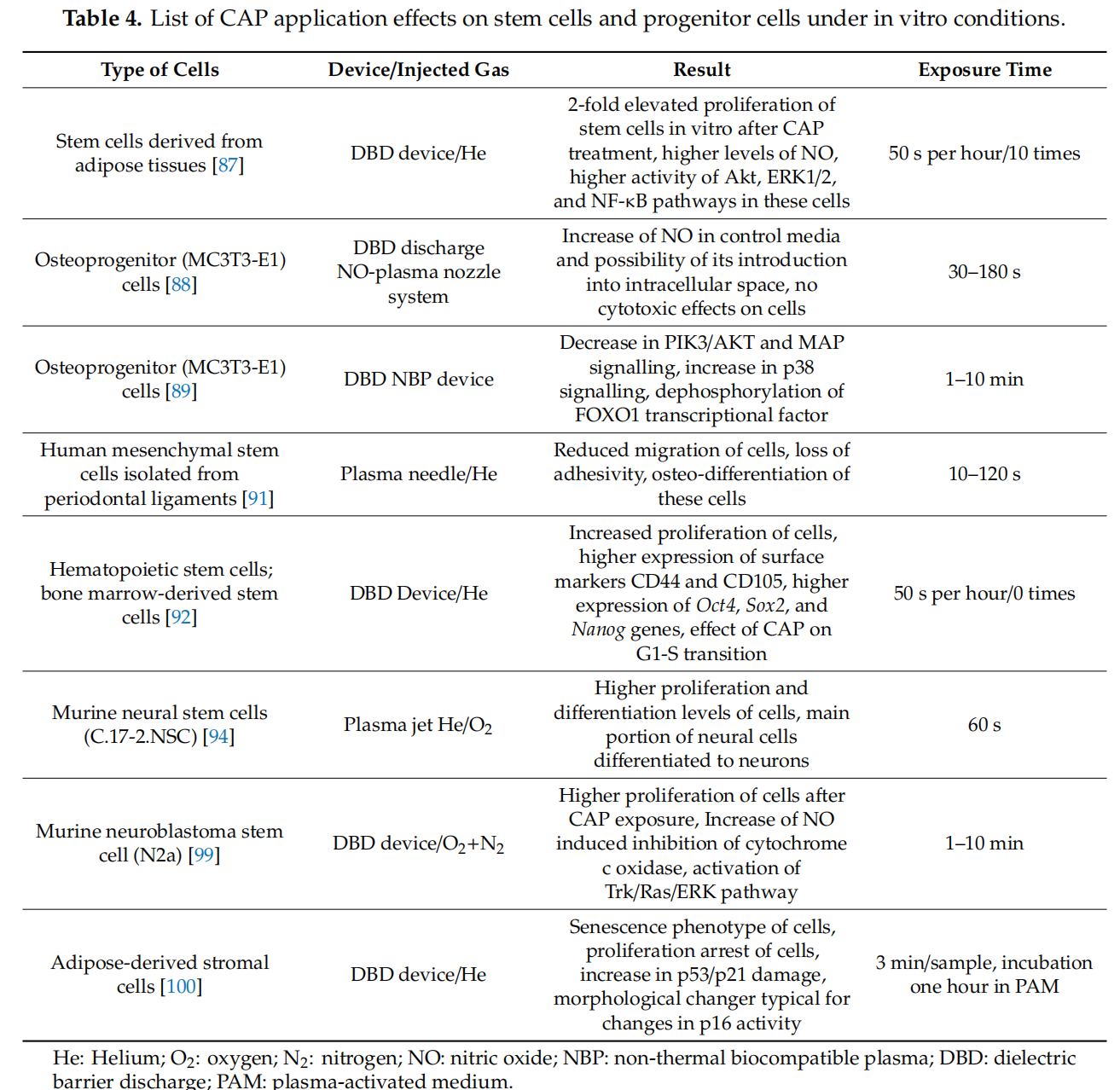
Bourdens等[100]提供了与先前研究不同的结果。这些作者记录说,尽管人类真皮成纤维细胞和脂肪来源的基质细胞在暴露 3 分钟后没有失去活力,但这些细胞发展出与糖酵解开关和线粒体含量增加相关的衰老表型。最重要的是,作者指出,观察到的增殖停滞伴随着p53/p21损伤的增加。尽管如此,细胞系仍保持了一些功能特性,例如分化潜力和免疫调节作用。关于衰老细胞在伤口愈合中的作用的讨论导致作者声称,旨在在某些细胞中引发少量短暂衰老的CAP暴露可以被认为是增强组织再生的。然而,这种说法的真实性需要进一步分析。CAP应用在体外条件下对干细胞和祖细胞的影响见表4。
表 4.CAP应用在体外条件下对干细胞和祖细胞的影响列表。
5. CAP对真皮组织以外其他组织影响
虽然等离子体放电治疗在很大程度上集中在真皮结构上,但将其应用于深度嵌入的器官和结构也有显着的好处。一项关于CAP在非真皮结构再生中的应用的研究评估了鼻粘膜再生[101]。缺乏这种结构会带来严重的问题,其再生既复杂又耗时。此外,目前尚无有效方法在严重损伤或手术干预后加速其再生[101]。
在体外和体内条件下,可以观察到冷等离子体使用对鼻粘膜再生的潜力。尽管体外分析是在BEAS-2B支气管上皮细胞系上进行的,但这些细胞系与鼻粘膜细胞非常相似,并且再生并发症的严重程度相似。CAP应用于支气管细胞可增加细胞增殖和迁移[101]。这种迁移是通过增加EGFR受体活性和EMT信号传导来实现的。最后,在小鼠模型中记录了短暂体内CAP应用后鼻粘膜的快速恢复[101]。
还注意到 CAP 装置对 S9 支气管上皮干细胞的进一步影响。CAP的使用引发了蛋白质表达谱的差异,其对细胞的长期和短期暴露影响也不同[102]。进一步确定 CAP 装置对这些细胞的影响包括 (1) 诱导 Nrf2 介导的氧化和内质网应激反应,(2) PPAR-α/RXR 激活,(3) 过氧化物酶体的产生,以及 (4) 在 CAP 给药后的第一个小时内预防细胞凋亡。矛盾的是,CAP最初是这些细胞的应激因子,但随后引发了显着的细胞增殖以及细胞组装和组织。
在从动物模型中分离出的几种神经细胞类型的再生中也发现了积极的冷等离子体效应[103]。虽然CAP在体外刺激神经元再生和星形胶质细胞生长,但剂量的进一步增加会导致细胞培养活力的丧失。因此,对于浅表和深层结构的治疗,需要精确确定 CAP 暴露的强度和持续时间。
6. 使用CAP治疗肿瘤
CAP 是更有效的肿瘤治疗的有前途的选择。然而,它对癌细胞的最终影响非常有趣。癌细胞产生较多的ROS和RNS,尽管这会增加其增殖活性,但更高水平的ROS和RNS会导致细胞凋亡[104]。然后,CAP将其增加到对癌细胞致命的水平。这种影响是由其抗氧化系统的变化和双链断裂引起的,但健康细胞应该可以忍受这种增加[92]。肿瘤细胞也有更多的水通道蛋白[105],这促进了ROS和RNS渗透到细胞中[106]。ROS和RNS扩散到细胞中的程度也会受到膜脂质结构的影响[107]。癌细胞的胆固醇水平通常较低,这使得细胞更容易受到过氧化的影响[108,109]。膜脂质过氧化导致细胞膜形成更多的孔隙,使ROS和RNS可以更大程度地扩散[109]。所涉及的机制摘要表明,CAP对肿瘤细胞的应用会引发各种细胞反应。这种反应性物质的增加是引发肿瘤细胞死亡的主要触发因素。这里的特异性反应是细胞凋亡、生长抑制、细胞周期停滞、DNA和线粒体损伤,甚至免疫原性细胞死亡[110]。然而,实际结果是剂量依赖性的[111,112,113]。
Keidar等人进行了一项初步实验,以测试CAP在肿瘤治疗中的应用。他们最初观察到,在应用CAP后,皮肤黑色素瘤细胞系与培养血管分离,这导致它们的数量减少,而健康细胞系仍然粘附[114]。作者对小鼠皮下肾肿瘤的研究表明,小肿瘤在应用CAP后被消融,更晚期的肿瘤大小减小。Kaushik等[115]随后通过评估等离子体放电对T98G、A549、HEK293和MRC5细胞系的影响,证明了ROS对肿瘤细胞死亡率的影响。作者表明,与癌细胞系相比,HEK293和MRC5非恶性细胞的活力受到的影响最小。ROS 和 H2O2由等离子体放电产生的改变了线粒体膜电位。这启动了内在的凋亡途径,导致整体促凋亡基因表达增加,抗凋亡基因表达降低。在蛋白质水平上,ERK1/2/MAPK细胞信号活性也发生了变化。由此产生的效果可以用ROS清除剂逆转。
癌细胞在代谢水平上也与健康细胞不同。在这里,癌细胞代谢重编程将简单的碳同化为大分子,尤其是脂质、蛋白质和核酸大分子。这导致了肿瘤细胞可用于生长和增殖的中间代谢物[116,117,118]。Xu等[119]研究了CAP对癌细胞代谢活性改变的影响。他们的KEGG和GC-TOFMS分析强调,白血病细胞具有不同的丙氨酸、天冬氨酸和谷氨酸代谢。作者还记录了CAP应用后癌细胞中谷氨酰胺酶活性的降低。这减少了谷氨酰胺向谷氨酸的转化。谷氨酸缺乏与谷氨酰胺积累同时导致白血病细胞增殖甚至细胞死亡的抑制[119]。
对细胞系和动物模型的研究一再证明了 CAP 装置的益处及其抗肿瘤活性。一项研究报道,胶质母细胞瘤细胞系在等离子体处理后失去活力[120]。该研究还表明,先前对替莫唑胺烷化剂具有抗性的细胞系重新获得了对替莫唑胺烷化剂的敏感性[120]。此外,一些作者报道,CAP暴露导致其他类型的脑肿瘤细胞系失去活力并诱导细胞凋亡[121,122,123]。
等离子体放电后肺癌 TC-1 细胞系中已记录诱导细胞凋亡。在成纤维细胞系中也有记录,但程度明显较小[124]。然而,最后一项研究的主要好处是表达了最小化等离子体设备尺寸的概念,以便在更深的病变和结构中更容易使用 CAP。本文中,细胞凋亡诱导是由直径为 125 至 440 μm 的装置产生的等离子体放电触发的。μCAP装置[125]已直接用于小鼠脑肿瘤,也用于胶质母细胞瘤细胞系的体外治疗。在后一种情况下,从 70 μm 装置排出的等离子体增加了 ROS 和 RNS 水平,这导致 U87MG 胶质母细胞瘤细胞活力显着降低。最重要的是,该装置还能够通过颅内窥镜管将等离子体放电施加到小鼠大脑中,从而抑制肿瘤生长[125]。然后,作者优化了设备参数,以最合适的脑和乳腺肿瘤治疗[126]。
体内等离子体效应已在皮下注射 4T 乳腺细胞系的动物模型中得到证实。来自这些细胞系的小鼠体肿瘤生长暴露于直径为 250 μm 的 CAP 装置的等离子体放电。重要的是,等离子体给药 3 分钟实现了与化疗相当的肿瘤生长减少。在分子水平上,促凋亡和抗凋亡基因活性的比例也发生了显著变化[127]。
Mashayekh等[128]随后研究了CAP对小鼠模型的体内影响以及体外对黑色素B16/F10细胞系的影响。他们的工作表明,大多数细胞系的活力丧失,动物模型肿瘤明显萎缩。在CAP处理3分钟后,细胞系结果在48 h内达到,体内肿瘤缩小与化疗相当。总之,首次进行了CAP对皮肤肿瘤治疗影响的分析,因为等离子体最容易直接应用于真皮结构。例如,G361 黑色素瘤细胞在应用 CAP 后失去活力并从表面分离。这些细胞具有较低的整合素和 FAK 表达,并改变了肌动蛋白丝结构。这一结果支持了等离子体促进的细胞死亡可能与整合素-ECM相互作用有关的假设[129]。使用与抗FAK抗体结合的金纳米颗粒的等离子体也可以选择性地增加CAP对黑色素瘤细胞系的抗增殖作用[130]。
还对MCF-7乳腺癌细胞系进行了分析。初步结果表明,由于细胞凋亡增加,CAP处理后细胞活力降低[22]。Ninomiya等[131]随后证明,CAP诱导了50%的癌性乳腺细胞系的损伤,无论它们是侵袭性MB-231还是非侵袭性MCF-7细胞系。最后,在源自人乳腺细胞转移的细胞系中也发现了CAP的抗增殖作用[131]。
对 HCT-116、SW480 和 LoVo 结肠癌细胞系进行了进一步研究。这些细胞在应用CAP后失去了活力[132],这种效应伴随着细胞迁移率的降低和B-连环蛋白磷酸化的程度升高。此外,尽管CAP装置被认为可促进高达70%的B16和COLO320结直肠细胞系的细胞凋亡,但对巨噬细胞系对照组没有影响[133]。Ishaq等[134]随后报道,CAP治疗通过激活Nox2-AKT1通路增加了各种结直肠细胞系的凋亡。作者还证明,尽管HT29细胞系在很大程度上对ROS介导的癌症死亡具有抗性,但这种抗性可以通过抑制Nrf2 / Srx信号传导来降低。最后,CAP暴露对多细胞肿瘤球体具有抗增殖作用,多细胞肿瘤球体应以剂量依赖性方式模拟肿瘤微环境。在CAP暴露后观察到球状体Ki67的缺失和累积的DNA损伤[135]。
体外实验结果还表明,CAP的应用应该有益于颈部和头部癌症。虽然该区域的肿瘤相对更容易切除,但这种手术通常是侵入性的,CAP 应该会减少这种影响。Guerrero-Preston等[136]发现CAP也以抗增殖方式作用于这些细胞。尽管这些作者认为这是由非凋亡过程引起的,但对比研究表明,抗增殖作用来自凋亡级联激活[137,138]。
一些研究还评估了 CAP 在子宫颈肿瘤中的应用,主要是在 HeLa 细胞上。在CAP处理后,由于ROS增加以及JNK和p38通路的后续变化,观察到这些细胞的凋亡过程[139]。进一步观察到的这种效应的机制是膜脂质氧化导致细胞崩溃[140]。此外,Tan等[141]采用了一种电极直径约为1μm的微器件,这种微器件选择性地诱导了特别是HeLa细胞的凋亡,而不影响邻近细胞。
还评估了 CAP 设备应用于白血病细胞系的可能性。然而,CAP在临床条件下的假设应用仍不清楚,确定其应用的最佳方法需要进一步研究。在这里,也可以考虑使用CAP活化液体。然而,CAP在THP-1白血病细胞系中以剂量依赖性方式诱导体外细胞死亡[142]。CAP应用也会导致不受控制的坏死细胞死亡[143]。然后,作者在暴露于 CAP 后 45 秒建立了诱导细胞凋亡,并且在治疗超过 50 秒后观察到坏死。最后,两项独立研究也证实了对胰腺细胞的抗增殖作用[144,145]。
在临床环境中,CAP治疗也直接应用于人类肿瘤[146]。这项研究涉及六名晚期颈部和头部癌症患者。其中两名患者在应用 CAP 后初始肿瘤大小缩小。尽管一名患者至少获得了部分缓解和改善,但另一名患者复发并死亡。两名患者报告没有CAP治疗副作用,但其余四名患者口干加重。最重要的是,四名患者报告疼痛显着减轻。然而,这些患者处于终末期,在研究结束时,有五名患者已经去世。虽然冷等离子体应用没有逆转病程,但它总体上有积极作用,没有明显的伤害或副作用。
等离子体放电已被证明直接和间接影响细胞培养基[25],这促使人们考虑使用CAP激活的等离子体或其他液体来降低肿瘤细胞的活力。等离子体活化培养基 (PAM)、等离子体活化乳酸林格氏液 (PAL) 和其他等离子体活化溶液的最大优点是它们可以储存相对较长的时间。人们还认为,活性液体可以相对容易地应用于内部结构。CAP激活的培养基通常诱导ROS、RNS和H细胞凋亡2O2内容[147]。然而,由此产生的影响可能是细胞特异性的,并且取决于细胞系中水通道蛋白的含量等参数[148]。
在应用CAP诱导的培养基后,在胶质母细胞瘤细胞系中特别观察到凋亡形态学变化。在分子水平上也观察到效应半胱天冬酶3/7活性增加和AKT激酶表达降低[122]。当胃癌细胞系受到PAM影响时,也获得了类似的结果[149]。这些细胞开始显示出与细胞凋亡相关的形态变化。PAM暴露2小时后,半胱天冬酶3/7活性升高,患组膜联蛋白V阳性细胞比例显著高于对照组。实验组的ROS也较高,但这可以通过ROS清除剂消除。此外,在 1 × 10 处接种的细胞4每口孔显示出一定程度的对PAM的抵抗力,但在暴露超过两分钟后消退。在这些耐药细胞中,有更多高表达的CD44变体9。这种变异在还原谷胱甘肽的合成中很重要,而还原谷胱甘肽对于自由基中和和对应激信号的适当反应是必需的[150]。
CAP治疗后,对紫苏莱酮和顺铂耐药的卵巢癌细胞系的细胞活力下降了近30%[151]。作者还分析了CAP对小鼠异种移植物的影响。最初将几种含有无血清培养基和基质胶的化疗耐药细胞系接种到小鼠中,然后接种 200 μL 等离子体活化培养基和未经处理的对照 RPMI-1640 培养基。与对照水平相比,根据细胞系的不同,肿瘤在第一次 CAP 注射后的 29 天内分别减少了 66% 和 52%。此外,PAM应用于四种类型的胰腺肿瘤系也增加了ROS水平。这导致细胞凋亡,这可以通过ROS清除剂逆转[145]。该研究还评估了 PAM 对小鼠异种移植物的效率,并在 28 天后注意到肿瘤质量显着缩小。此外,作者Nakamura等[152]发现,体内PAM培养基暴露于不同的小鼠异种移植模型可抑制ES2癌细胞的腹膜播散。
除PAM外,PAL还可用于抗肿瘤治疗。PAL在体外条件下通过增加ROS水平和降低细胞粘附来诱导胰腺细胞系的细胞凋亡。在体内小鼠异种移植模型中,PAL对这些细胞系的腹膜结节也有抗肿瘤作用[153]。此外,PAL应用对A549肺癌细胞系具有很强的抗增殖作用[154]。在这项工作中,CAP应用引发了与NF-κB-Bcl2分子通路下调相关的线粒体功能障碍[154]。作者认为PAL对肿瘤细胞系的最终抗增殖作用应该比PAM更强。然而,这一考虑有待商榷,需要进一步分析。无论结果如何,PAL的主要优势在于,由于目前培养的培养基不能用于医疗,因此它可能更容易应用于未来的临床试验[154]。尽管这为当前方法提供了适当的替代方案,但仍需要进一步研究。最后,PAM对肿瘤细胞影响的分析也应继续进行,尽管在临床试验中使用PAM可能存在并发症。这些分析可能会发现对临床程序有益的其他现象和原理。
CAP最先进的用途之一是其在癌症免疫治疗中的应用。这是可能的,因为癌症的发病及其病程会受到人体免疫系统的显着影响。免疫系统的调节能力特别克服了癌细胞抑制免疫反应的能力[155]。这些调节包括使用各种细胞因子、基于细胞的疗法和免疫检查点阻断[147]。此外,一些放疗和化疗程序会触发免疫原性细胞死亡(immunogenic cell death, ICD)[156,157]。被放疗或化疗损伤或改变的细胞会产生“损伤相关分子模式信号”(DMP)。然后,DMP分子引导免疫系统破坏这些细胞。最重要的是,一些研究还表明,CAP会诱导ICD,并导致随后的巨噬细胞刺激[38,158,159]。
Miller等[160]和Almeida[161]描述了等离子体在免疫治疗中的详细原理和可能性。特别是,Lin等[162]的研究表明,CAP应在A549肺癌和耐放射性鼻咽癌细胞系中体外诱导ICD。其中,细胞外ATP分泌后进行ICD巨噬细胞刺激。此外,CAP增加了细胞外ROS水平,从而增加了钙网蛋白的产生。基于 CAP 的免疫疗法也是多形性胶质母细胞瘤治疗的一种有前途的选择。这是一种侵袭性很强的癌症,免疫系统下调[161]。最后,Cheng等[163]强调了以下几点:1.)30 s CAP刺激巨噬细胞导致IL-6和IL12的产生增加,抗炎细胞因子IL-10的产生减少,以及2.)暴露于 CAP 后,小鼠脾脏分离的 T 细胞系中 IL-2 和 IFN-g 的产生增加。作者试图模拟体内条件,因为他们移除了小鼠模型淋巴结并将其暴露于CAP。然后,他们从对照组和受影响的淋巴结中分离出CD4 + T细胞。来自受影响淋巴结的细胞功能增加,表现为IL-2和IFN-g的产生增加。作者的工作最终显示了将受CAP影响的T细胞转移到淋巴结的小鼠的强烈抗肿瘤作用。CAP应用对可变肿瘤细胞系的影响见表5。
表 5.冷大气等离子体 (CAP) 在肿瘤治疗中的体外应用列表。

7. 结论
CAP在现代临床实践中具有广泛应用的巨大潜力。已经进行的分析表明,冷等离子体应用在许多医学领域都是有益的,对健康细胞没有明显的负面影响。然而,CAP应用可能会产生潜在的有害元素,因此应在专家指导下以适当的剂量使用。此外,CAP的使用不应仅限于表面结构,因为技术的进步可能会使能够将等离子体放电应用于内部结构的更小的设备成为可能。
除了癌症治疗外,这些 CAP 程序很可能在治疗内部组织方面被证明是有益的。然而,目前对冷等离子体效应的分析仍然只关注细胞系和动物模型。尽管这些实验更容易获得和更容易进行,但在人类患者的癌症和再生医学研究中更广泛地测试CAP效应是很重要的,并且应该被证明是有益的。在再生医学和肿瘤学的常规临床实践中引入CAP的潜在应用可以大大减轻这些治疗的经济负担和成本。最重要的是,CAP 治疗方案对患者的侵入性和压力较小。
https://blog.sciencenet.cn/blog-41174-1426608.html
上一篇:怀孕让人老,分娩逆年龄!
下一篇:氢气:人类疾病治疗中的新选择