博文
甲状腺素β受体激动剂治疗脂肪肝获FDA批准
|
近日,Madrigal Pharmaceuticals官宣了一则好消息,Resmetirom(MGL-3196)已获得FDA的突破性疗法认定,用于治疗带有肝纤维化的非酒精性脂肪性肝炎(NASH)患者。
这是脂肪肝的首款药物,虽然来自新型减肥药对脂肪肝治疗的冲击非常巨大,但这种药物的上市仍然值得关注,且可能具有独特优势。毕竟是通过完全不同的激素受体途径发挥作用。其中临床数据显示对低密度脂蛋白的抑制作用,提示未来有可能会作为高胆固醇血症的辅助治疗药物,由于这是完全不同的激素途径,不同于他汀类药物,对心血管事件的预防作用也值得期待。这需要在四期临床数据中获得证据。
Resmetirom是一款靶向肝脏的甲状腺激素受体(THR)-β口服选择性激动剂。甲状腺激素通过激活肝细胞中的β受体,在肝功能中发挥核心作用,影响从血清胆固醇、甘油三酯水平到肝脏中脂肪病理性积聚等一系列健康参数。THR-β被激活后可以通过调节线粒体活性,促进肝脏脂肪的分解和控制正常线粒体的水平。Resmetirom具有高选择性,能够在肝脏部位被特异性摄取。在前期的动物和临床实验中,Resmetirom已被证明安全性和耐受性良好,对THR-α受体无活性,不会影响骨骼或心脏参数,以及不会影响甲状腺轴激素。
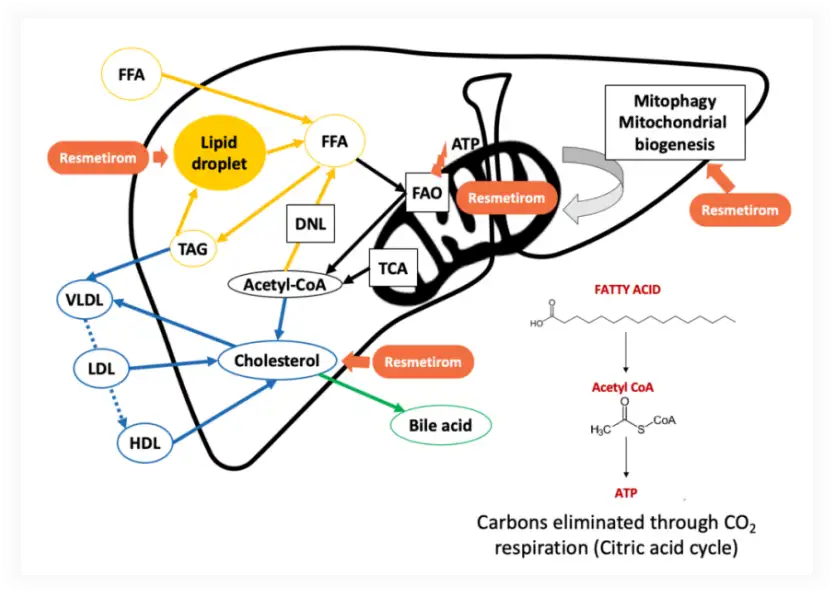
Resmetirom在肝脏中发挥重要作用
MAESTRO-NASH试验是一项为期52周、超过950名患者参与、包含一系列肝活检的3期临床试验。分析显示,与安慰剂相比,Resmetirom在每日口服剂量80毫克和100毫克两个剂量下均达到两个主要终点及潜在临床显著效果:
NASH症状缓解以及非酒精性脂肪肝活动评分(NAS)降低≥2分,且肝纤维化无恶化(两种剂量下均p<0.0001);以及肝纤维化至少改善一个阶段,且NAS无恶化(两种剂量下分别p=0.0002,p<0.0001);关键次要终点LDL-C的下降显著超过安慰剂组。
据美国食品药品监督管理局(FDA)官网披露,3月14日该局批准了马德里加尔制药公司(Madrigal)的瑞美替罗(Rezdiffra,活性成分为resmetirom)联合饮食和运动,用于治疗患有中重度肝纤维化的非肝硬化非酒精性脂肪性肝炎(NASH)/代谢功能障碍相关脂肪性肝炎(MASH)成人患者。这是获得FDA批准的首款NASH疗法,是该领域一项重要里程碑。
“瑞美替罗获批应用后,在全球产生的价值将超300亿美元。若在国内上市,相关的产值也将达300亿元人民币。”上海医学会肝病分会候任主委、同济大学附属同济医院二级教授、消化内科主任杨长青接受记者采访时表示,FDA的临床试验要求严格,二期三期纳入的样本量很大。因此一旦在FDA获批,对全球药物市场都能起到指向性作用。
来自学术界的警示:纤维化相关疾病药物太难,不能过于乐观!
The Lancet Gastroenterology & Hepatology杂志对该临床试验的评价应该能代表学术界的看法。
The Lancet Gastroenterology Hepatology. Resmetirom for NASH: balancing promise and prudence. Lancet Gastroenterol Hepatol. 2024 Apr;9(4):273. doi: 10.1016/S2468-1253(24)00049-9. PMID: 38460531.
非酒精性脂肪肝炎(NASH,也称为代谢功能障碍相关脂肪性肝炎,MASH)伴随纤维化的药物开发一直是一项充满挑战的工作。Obeticholic acid(一种法尼醇X受体激动剂,也是第一个拥有支持性III期组织学数据的纤维化NASH药物)因疗效一般和安全问题(包括药物引起的肝损伤)被FDA拒绝批准。Selonsertib(一种凋亡信号调节激酶1抑制剂)、elafibranor(一种PPAR α/δ激动剂)和cenicriviroc(一种趋化因子受体2型和5型拮抗剂)在III期试验中均未能显示出益处。
最新的III期试验MAESTRO-NASH提供的为期52周的组织学数据显示,在NASH和F1至F3纤维化患者中,选择性甲状腺激素受体β激动剂resmetirom可能有不同的效果。每日一次80毫克和100毫克剂量的resmetirom在主要终点方面均优于安慰剂,这些主要终点包括不恶化纤维化情况下NASH的消退以及至少提高一个阶段的纤维化改善且NASH无恶化。重要的是,它对LDL胆固醇有积极影响,并且体重或葡萄糖稳态没有重大变化——这些特点对于F1至F3纤维化的患者来说是个好兆头,因为在这些患者中,心血管事件是导致死亡的主要原因。尽管各组间严重不良事件的发生率相似,但resmetirom与治疗开始后不久出现的腹泻和恶心有关,两个药物组中有50%的患者在4周内报告了事件,而安慰剂组约为30%。总共有7.7%的resmetirom 100毫克组的患者因不良事件中止了治疗,相比之下,resmetirom 80毫克组为2.8%,安慰剂组为3.4%。Resmetirom还显著增加了总雌二醇、睾酮(尽管不是游离睾酮)和性激素结合球蛋白的水平。
尽管结果令人鼓舞,但MAESTRO-NASH的结果提出了重要的问题,或许最首要的是关于resmetirom(或任何假定的NASH药物)整体风险和效益的不确定性。这样的评估必须权衡药物的有效性、安全性、耐受性和成本,鉴于需要长期治疗的必要性。在第52周,安慰剂调整后的两个主要终点之一的响应率是适度的,尽管随着治疗时间延长可能会观察到更大的益处。当这种疗效与预期相对较低的肝脏相关事件发生率一起考虑时,我们必须对长期安全性保持高标准,特别是如果拟议的适应症涵盖F1和F2纤维化。
为期52周的组织学数据满足了FDA和EMA早期批准的要求,基于这些替代终点合理地可能预测临床效益。完全批准需要在MAESTRO-NASH中经过总共54个月的治疗后,显示其对所有原因死亡率、肝脏移植(仅FDA)、肝功能失代偿事件、MELD评分或肝硬化的组织学诊断等复合终点的有效性。这些结果不仅将提供一个关于药物价值的更明确的画面,还将增加对52周组织学结果替代性的宝贵见解。
大多数III期NASH药物试验共有的试验设计特点也为药物在临床上的应用提出了几个难题。监管机构和支付方是否需要在处方前或监测治疗期间进行肝活检?鉴于普通人群中NASH伴有纤维化的高发病率,是否会要求初级保健筛查潜在患者并以公平的方式开具药物?观察到的治疗效应和安全性是否具有外部有效性,特别是考虑到种族或民族、性别或性别、年龄、共病或同时治疗等方面不同的患者群体?
尽管定价尚未宣布,但resmetirom的高昂成本将是医疗保健系统的一个重大难题。需要估算成本效益,其中包含所有resmetirom临床试验的完整疗效和安全数据,全面考虑竞争风险,并解决现实世界使用的不同情景。高昂的药物价格、诊断障碍和治疗限制都可能加剧目前大多数国家普遍存在的NASH健康不平等问题。
2024年首个获批的NASH药物的前景令人兴奋。然而,我们不应让这种可以理解的热情分散我们对resmetirom净效益和长期价值的冷静评估,也不应忽视为初级保健和肝病学准备迎接NASH药物进入临床带来的颠覆性变革。
背景学习
Vidal-Cevallos P, Murúa-Beltrán Gall S, Uribe M, Chávez-Tapia NC. Understanding the Relationship between Nonalcoholic Fatty Liver Disease and Thyroid Disease. Int J Mol Sci. 2023 Sep 27;24(19):14605. doi: 10.3390/ijms241914605. PMID: 37834051; PMCID: PMC10572395.
非酒精性脂肪性肝病 (NAFLD) 患者甲状腺功能减退症的患病率很高 (22.4%)。甲状腺激素 (THs) 通过促进脂质的输出和氧化以及从头脂肪生成来调节肝脏中的许多代谢活动。它们还可以控制肝脏胰岛素敏感性并抑制肝脏糖异生。由于甲状腺功能障碍在脂质和碳水化合物代谢中的重要性,甲状腺功能障碍与NAFLD的发病机制有关似乎是合理的。与这种关系有关的机制包括高促甲状腺激素 (TSH) 水平、低 TH 水平和慢性炎症。TH受体(THs)-β对THs的反应活性在甲状腺功能减退症诱导的NAFLD的发病机制中至关重要。因此,开发了一种口服活性选择性肝脏THR-β激动剂Resmetirom(MGL-3196),并已被证明可以降低肝脏脂肪含量,并作为次要终点改善非酒精性脂肪性肝炎。用THR-β激动剂治疗NAFLD似乎很有前途,目前正在开发和研究其他激动剂。本综述旨在阐明有关这种关系的病理生理学和流行病学证据,以及THs和选择性肝THR β激动剂治疗对肝脂质代谢的影响。

1 背景
非酒精性脂肪肝病(NAFLD)和甲状腺疾病在全球范围内都极为普遍,据报道,多达22.4%的NAFLD患者同时患有这两种疾病[1,2,3]。原发性甲状腺功能减退症,以下简称为甲状腺功能减退症,是一种以TSH浓度超出参考范围为特征的疾病;它可以是明显的或亚临床的。明显甲状腺功能减退症定义为TSH水平高且游离甲状腺素(T4)水平低于参考范围,而亚临床甲状腺功能减退症则定义为TSH水平高于参考范围,但游离T4水平在人群参考范围内[4]。在碘充足的国家,明显甲状腺功能亢进症的患病率从0.2%到1.3%不等[4],在欧洲的估计发病率为每年每10万人中有51例[5]。明显甲状腺功能减退症的估计患病率在欧洲从0.2%到5.3%不等,在美国从0.3%到3.7%不等[4]。
NAFLD的定义是在组织学分析中>5%的肝细胞存在脂肪变性,或者在使用质子磁共振波谱或定量脂肪/水选择性磁共振成像评估时>5.6%[6],此外还缺乏其他导致肝脏脂肪积聚的原因(如酒精、遗传状况、药物等)[7]。全球NAFLD的估计患病率为25%[8]。最近,这种疾病的命名发生了变化。已经达成了共识,使用“代谢功能障碍相关脂肪性肝病”(MASLD)这一术语,它要求存在肝脏脂肪变性和至少一个心脏-代谢风险因素[9]。尽管已经确定了这一新定义,但以前的研究工作在其纳入标准中使用了NAFLD;因此,我们在本文中将继续使用NAFLD这一术语。
下丘脑-垂体-甲状腺轴在许多代谢途径中发挥着重要作用,特别是那些涉及脂质和碳水化合物的途径。NAFLD被描述为代谢综合征的肝脏表现。因此,长期以来人们一直假设并研究甲状腺功能减退症和NAFLD之间的关系。本综述旨在阐明这种关系的病理生理学和流行病学证据,以及甲状腺激素(THs)和选择性肝脏TH受体(THR)-β激动剂对肝脏脂质代谢的影响。
2. 病理生理学
甲状腺激素(THs)通过调节葡萄糖和脂质代谢,在身体的多个系统(肝脏、脂肪组织、神经、心血管和肌肉骨骼系统)中调节许多代谢活动。在肝脏中,它们促进脂质的输出和氧化,以及新的脂肪生成,控制肝脏胰岛素敏感性,并抑制肝脏糖异生。上述THs的所有作用通过两种机制控制:首先,THR直接作用于基因表达;其次,与核受体联合作用,如过氧化物酶体增殖物激活受体(PPAR)、肝X受体和胆汁酸信号通路。THR有两个主要亚型:α和β。THR-α在大脑、白色脂肪组织和心肌房中表达。棕色脂肪组织包含两种亚型,而THR-β是肝脏和心室中的主要亚型,在垂体腺中调节TH对TSH产生的行动[10]。
由于其在脂质和碳水化合物代谢中的重要性,甲状腺功能障碍在NAFLD发病机制中的参与似乎是合理的。许多机制已经涉及到这种关系:TSH水平、低TH水平和慢性代谢反应(图1)[11]。
图1显示了甲状腺和肝脏之间的生理关系。甲状腺激素(T3和T4)的产生受到下丘脑和垂体活动的调节,通过甲状腺刺激激素(TSH)。T3活性在肝脏、脂肪组织以及神经、心血管和肌肉骨骼系统中影响许多功能,通过调节葡萄糖和脂质代谢。这些通过不同组织中的甲状腺激素受体(THRs)发生。甲状腺激素受体-α(THR-α)在大脑、白色脂肪组织和心肌房中表达。在肝脏中,TSH通过PPAR途径和激活固醇调节元件结合转录因子1c促进肝脏脂肪生成。TSH还降低了肝脂蛋白脂肪酶的活性,从而促进了肝脏甘油三酯的积累,这通过基因转录的调节增加了肝脏糖异生。TSH还降低了3-羟基-3-甲基戊二酰辅酶A(HMGCoA)还原酶的磷酸化,从而诱导高胆固醇血症。THs的减少与肝脏摄取游离脂肪酸的减少有关,这导致通过下调肉碱棕榈酰转移酶-1a(Cpt1a)而使肝脏中甘油三酯积累。肝脂酶也减少,这有助于肝脏中甘油三酯的积累。HMG-CoA还原酶:3-羟基3-甲基戊二酰辅酶A,PPAR:过氧化物酶体增殖物激活受体,SREBF1c:固醇调节元件结合蛋白1。
高TSH水平
高水平的血清促甲状腺激素(TSH)是甲状腺功能减退症(无论是明显的还是亚临床的)的典型生化改变,因此理解其在甲状腺功能减退症诱导的非酒精性脂肪肝病(NAFLD)发病机制中的作用至关重要。
TSH与其在肝细胞表面的受体结合,刺激过氧化物酶体增殖物激活受体α(PPARα)途径和固醇调节元件结合转录因子1-c的活化,从而促进肝脏脂肪生成[12,13]。高水平的TSH还与肝脏脂蛋白脂酶活性降低有关,从而促进肝脏甘油三酯积累[11,13]。
TSH通过调控编码速率控制酶的基因转录来增加肝脏糖异生。TSH增强了肝脏中cAMP调控的转录共激活因子-2的表达,进而刺激葡萄糖-6-磷酸酶和细胞质磷酸烯醇式丙酮酸羧激酶的表达。这些促进了草酰乙酸向磷酸烯醇式丙酮酸的脱羧作用,以及葡萄糖-6-磷酸水解成游离葡萄糖和无机磷酸盐[14]。由于TSH水平较高导致的碳水化合物代谢调控改变可能导致胰岛素抵抗和2型糖尿病,从而可能增加NAFLD的风险。最后,TSH可以降低HMGCoA还原酶的磷酸化,从而引发高胆固醇血症[13]。
最近的一项描述性横断面研究对2452名受试者进行了研究,发现TSH ≥ 2.5 μIU/mL与NAFLD风险增加1.5倍相关,并且调整了混杂变量后,与肝脏纤维化风险增加了1.8至2.5倍。该研究还发现,在TSH ≥ 2.5 μIU/mL的人群中,根据FLI评分定义的NAFLD患病率更高,与TSH < 2.5 μIU/mL的人群相比[15]。这些数据为NAFLD与TSH水平升高之间的关系提供了流行病学证据,而前面提出的病理生理学总结可能解释了为什么亚临床甲状腺功能减退症也与NAFLD流行病学相关联,不需要低水平的甲状腺激素(THs)就能发生这些代谢变化[12]。
低甲状腺激素水平
低TH水平出现在明显的甲状腺功能减退症中。它们通常以组织依赖的方式调节脂质代谢,并取决于它们作用的受体。三碘甲状腺原氨酸(T3)和甲状腺素(T4)由甲状腺产生,其生产由下丘脑和垂体中央控制[16]。在外围,THs的活性由多种机制控制。
首先,由TH转运蛋白控制THs进入目标细胞,例如单羧酸转运蛋白8、单羧酸转运蛋白10或有机阴离子转运多肽1c1,它们在不同的器官中有不同的表达[17]。其次,脱碘酶(DIO1、DIO2和DIO3)是催化THs转化的细胞内酶。T4被DIO1转化为活性形式的T3。T3和T4被DIO3和DIO2转化为非活性形式(rT3和T2);这对所有组织都是如此[13,16,17]。
TH作用的最后步骤取决于THR(THR-α和THR-β异构体),如前所述。这些通过直接配体结合介导THs的遗传效应[17],这导致THR的构象变化和共激活复合物的释放,从而导致转录的启动。THs还可以通过它们对转录因子的影响来调节基因转录,例如叉头框蛋白O、磷脂酰肌醇3-激酶和αvβ3整合素[18,19,20]。
慢性炎症与激素相互作用
肝脏中脂质的积累也因肥胖和低静息能量消耗(REE)而增加,这两者都与甲状腺功能减退有关。最近一项对肥胖非糖尿病女性的回顾性研究比较了原发性甲状腺功能减退患者和正常甲状腺功能患者在左旋甲状腺素(LT4)治疗下的REE。研究发现,即使在用LT4治疗并对体重指数、年龄、体成分和身体活动量进行调整后,甲状腺功能减退患者的REE仍然降低。这突显出甲状腺功能减退的代谢异常不仅仅局限于T4血液水平[27]。
肝脏中脂质的积累随后会导致慢性炎症状态,这可能会导致非酒精性脂肪肝炎(NASH)和纤维化。这是由肝内三酸甘油酯积累引起的肝胰岛素抵抗,以及甲状腺功能减退患者对葡萄糖的β-胰岛细胞敏感性降低所致[13,16]。
这些患者还描述了氧化应激和活性氧物质的产生。它们与游离脂肪酸浓度升高和线粒体功能障碍有关,后者产生自由基,进而激活促炎细胞因子(肿瘤坏死因子-α和转化生长因子-β)和星状细胞[11]。已经证明活性氧物质会减少脱碘酶的活性,这可能会进一步损害THs的激活,从而维持这一循环[16]。
甲状腺功能减退患者的瘦素水平较高,这是一种调节食欲并通过去磷酸化胰岛素受体底物-1增强肝胰岛素抵抗的激素。在甲状腺功能减退患者中发现了脂联素水平的降低,这也与肝胰岛素抵抗的增加有关。然而,这一观察结果仍存在争议,因为其他研究未能发现甲状腺功能与脂联素水平之间的关联[11,16,28]。
https://blog.sciencenet.cn/blog-41174-1425585.html
上一篇:植物有感觉吗?
下一篇:直接面向消费者的微生物组测试行业存在的问题