博文
张锋团队成功操作细胞分子注射器
|
研究人员借助一种天然分子“注射器”,这是一些病毒和细菌用来感染宿主的工具,将其用于将功能蛋白质输送到培养的人类细胞中。
“惊人”的分子注射器将蛋白质运送到人体细胞中 (nature.com)
“这太令人惊讶了,”北京中国医学科学院病原体生物学研究所的微生物学家冯江说。“这是一个巨大的突破。”
该技术于2023年3月29日发表在《自然》杂志上,可提供一种管理基于蛋白质的药物的新方法,但在用于人体之前需要更多的测试。通过进一步优化,该方法也可用于提供CRISPR-Cas9基因组编辑所需的组件。CRISPR是强大的基因编辑工具,通过基因编辑有希望治疗包括遗传病在内的许多疾病,但是,CRISPR的医学应用目前受到将功能分子试剂输送到细胞内的限制。
“基因编辑的主要瓶颈之一是传递,”该研究的共同作者张锋教授说,张锋是麻省理工学院布罗德研究所和马萨诸塞州剑桥哈佛大学的分子生物学家,也是CRISPR-Cas9技术的早期先驱。张锋说,有限的选择限制了大多数临床试验编辑肝脏,眼睛或血细胞中的基因组,因为这些细胞可以使用当前的递送方法到达。“我们没有看到大脑或肾脏疾病得到解决的原因是因为我们没有良好的输送系统。
当张和他的合作者寻找将蛋白质运输到人体细胞的方法时,微生物学家正在更多地了解一组不寻常的细菌,这些细菌使用分子尖峰刺穿宿主细胞膜上的一个洞。然后细菌通过穿孔运输蛋白质并进入细胞,利用宿主的生理机能对它们有利。
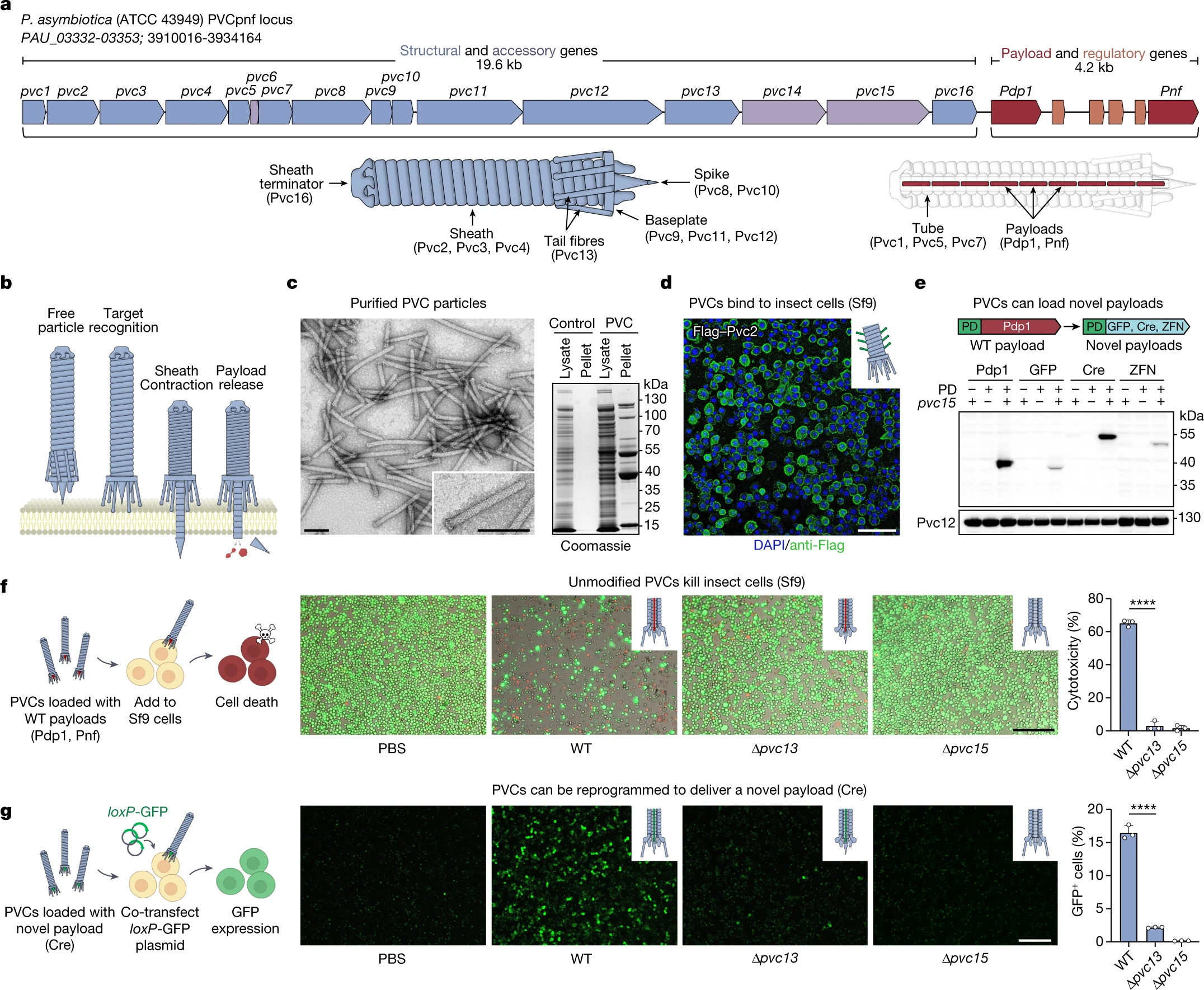
去年,张锋和他的同事报告说,他们可以在生物发光细菌Photorhabdus asymbiotica中操纵这种类似注射器的系统,将他们从哺乳动物,植物和真菌中选择的蛋白质加载到注射器中。通常,细菌生活在线虫内,并使用其注射器将毒素运送到被线虫感染的昆虫细胞中。毒素杀死昆虫,线虫吃掉遗骸。“这种细菌可以被视为杀死这种昆虫的雇佣枪,”共同作者,剑桥麻省理工学院的分子生物学家Joseph Kreitz说。
在张的实验室里,Kreitz和他的合作者正在研究如何设计P. asymbiotica分子注射器,以便它能够识别人类细胞。他们专注于注射器中称为尾纤维的区域,该区域通常与昆虫细胞上发现的蛋白质结合。利用预测蛋白质结构的人工智能程序AlphaFold,研究小组设计了修改尾部纤维的方法,使其能够识别小鼠和人类细胞。“一旦我们有了图像,就很容易修改它以供我们使用,”Kreitz 说。“那是一切走到一起的那一刻。”
然后,他们将各种蛋白质装载到注射器中,包括Cas9和可用于杀死癌细胞的毒素,并将它们输送到实验室中生长的人类细胞和小鼠的大脑中。
Kreitz说,该系统无法运输CRISPR-Cas9基因组编辑所需的mRNA指南,但该团队正在开发实现这一目标的方法。他补充说,该系统能够将Cas9运送到细胞中的事实说明了该技术的灵活性,因为Cas9蛋白比注射器的通常货物大约五倍。
注射器的故事让人想起像张这样的研究人员开发CRISPR-Cas9的方式 - 许多微生物在自然界中依赖的系统来防御病毒和其他病原体 - 用作基因组编辑技术,耶路撒冷希伯来大学的计算微生物学家Asaf Levy说。与CRISPR-Cas9研究的早期类似,细菌注射器仅由少数实验室进行研究,它们在微生物生态学中的作用才刚刚开始被理解。
然而,它们可能会对医学产生变革性的影响,利维说。“这个东西的进化是相当惊人的,”他说。“事实上,你可以设计有效载荷和特异性,这是非常酷的。”
Programmable protein delivery with a bacterial contractile injection system | Nature
摘要
内共生细菌已经进化出复杂的递送系统,使这些生物能够与宿主生物学相互作用。一个例子是细胞外收缩注射系统(eCIS),是注射器样大分子复合物,通过驱动细胞膜的尖峰将蛋白质有效载荷注射到真核细胞中。最近,eCIS被发现靶向小鼠细胞 ,提高了这些系统可用于治疗性蛋白质递送的可能性。然而,eCIS是否可以在人类细胞中发挥作用仍然未知,这些系统识别靶细胞的机制知之甚少。在这里,我们表明,Photorhabdus毒力盒(PVC)的靶标选择(一种来自昆虫致病细菌Photorhabdus asymbiotica的eCIS)是由PVC尾纤维的远端结合元件对靶受体的特异性识别介导的。此外,使用尾部纤维的计算机结构引导工程,我们表明PVC可以重新编程以靶向这些系统非天然靶向的生物体 - 包括人类细胞和小鼠 - 效率接近100%。最后,我们表明PVC可以加载不同的蛋白质有效载荷,包括Cas9,碱基编辑器和毒素,并且可以在功能上将它们输送到人体细胞中。我们的结果表明,PVC是可编程的蛋白质递送装置,可能应用于基因治疗,癌症治疗和生物控制。
https://blog.sciencenet.cn/blog-41174-1382347.html
上一篇:慢性疼痛的研究需要重视
下一篇:疼痛神经末梢对免疫哨兵细胞的多模态控制