博文
Nat Synth:中国科学院上海有机所施世良/青岛科技大学孙博报道动态动力学不对称酮的烯丙基化、炔丙基化和丁烯基化反应
|
2024年6月25日,中国科学院上海有机所施世良与青岛科技大学孙博合作在Nature Synthesis期刊上发表了一篇题为“Dynamic Kinetic Asymmetric Allylation, Propargylation and Crotylation of Ketones using Copper Catalysis”的研究成果。
该成果报道了铜催化消旋酮的动态动力学不对称烯丙基化、炔丙基化和丁烯基化反应,一步高效构建含有连续手性中心的手性叔醇结构。
论文通讯作者是孙博、施世良;第一作者是孙博。

含有连续两个手性中心的叔醇结构广泛存在于生物活性分子中。有机金属试剂对α-手性酮的非对映选择性亲核加成是合成该结构普遍的方法,然而其具有明显的局限性:(1) α-手性酮合成困难,且反应过程中可能消旋;(2) 反应的非对映选择性较难预测;(3) 采用化学计量的格氏试剂等金属试剂,反应条件苛刻,官能团兼容性差等。因此,通过对简单易得的消旋酮的动态动力学不对称加成反应是合成α,β-手性叔醇更为理想的方法。
通过动态动力学拆分(DKR)过程,从消旋原料一步构建含有连续两个手性中心的手性产物,具有便捷、高效、高步骤经济性等优点。然而,DKR过程的顺利完成具有苛刻的要求:(1) 消旋原料的两种对映异构体能够进行快速消旋化;(2) 消旋原料的其中一种构型异构体与手性配体生成产物的速率远大于另一种构型;(3) 消旋原料的两种对映异构体相互转化的速率远大于生成产物的速率。虽然酮的DKR不对称氢化反应已有所发展,但只能构建手性仲醇结构。采用碳亲核试剂与酮的不对称碳碳成键反应可用于构建连续手性中心的手性叔醇结构,但该类反应往往局限于α-酮酯类型的活泼底物,且报道的亲核试剂类型也很少。
羰基的烯丙基化和炔丙基化是有机合成中应用最广泛的碳碳成键反应之一。由于产物中的烯烃和炔烃官能团易于进行快速转化,不对称烯丙基化和炔丙基化成为构建手性叔醇的重要方法。烯丙基或炔丙基的有机金属试剂对α-手性酮的非对映选择性亲核加成是构建α,β-手性叔醇结构最直接的方法,但该方法的非对映选择性较难控制。因此,发展高效和高立体选择性消旋酮的不对称烯丙基化、炔丙基化和丁烯基化反应构建含有连续多个手性中心叔醇结构的方法是化学合成领域的重要挑战性研究前沿。
在这项工作中,施世良/孙博团队合作报道了消旋酮(α-氨基/芳基/烷基)高效的不对称烯丙基化、炔丙基化和丁烯基化反应。手性配体/铜催化体系实现了动态动力学转化过程的速率匹配、手性识别和非对映、对映选择性控制。该反应具有优秀的底物范围(>100个例子)和高立体选择性(up to >20:1 dr, 99% ee),官能团兼容性好,产物结构中的烯烃和炔烃易于快速衍生化。该工作为高效合成复杂手性叔醇提供了新方法(图1)。
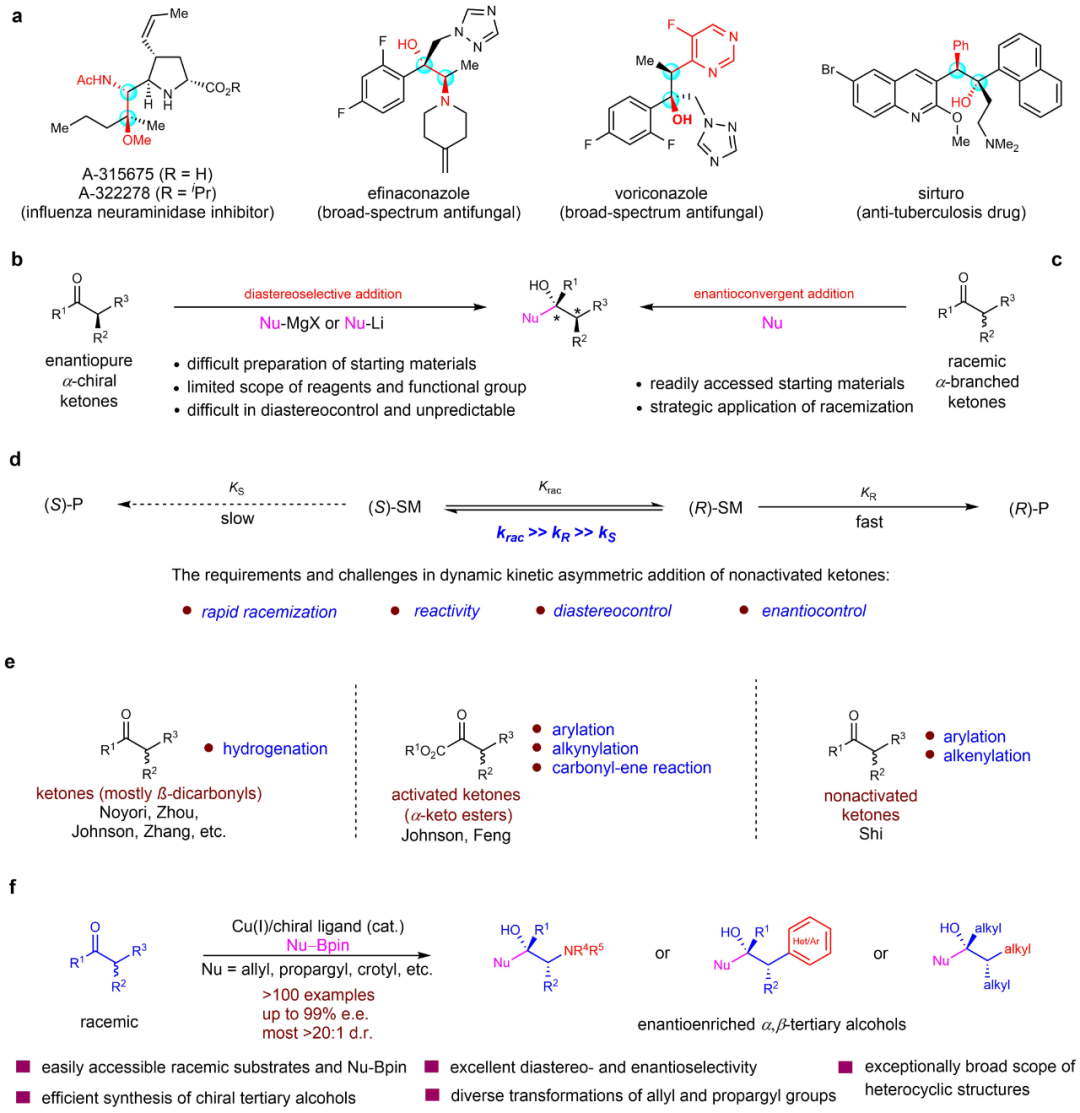
图1:背景介绍。
首先作者对消旋α-氨基酮底物范围进行探索,反应条件适应于各种类型的酮,包括N-开链酮4a-4m,N-杂环酮4n-5f,环酮5g-5l,取代烷基酮5m-5r,均取得了较好的结果。对于带有烯烃、炔烃、醚、羟基、酯、磷酸酯、酰基等官能团的α-氨基酮,在反应中均表现出很好的官能团兼容性,且保持较高的立体选择性(图2)。
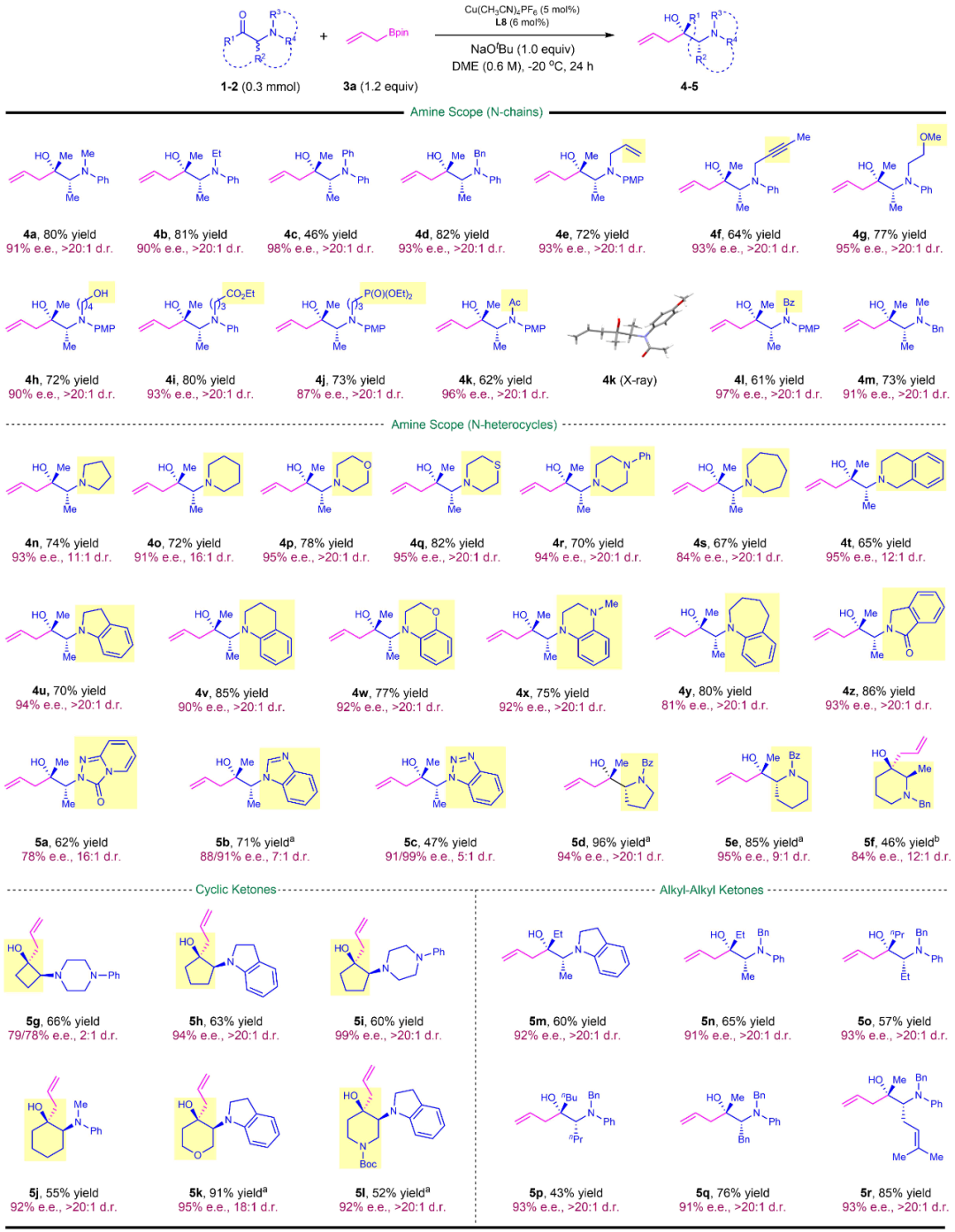
图2:α-氨基酮的不对称烯丙基化底物范围。
在相同的反应体系下,作者对消旋α-芳(杂环)基酮进行底物拓展,包括开链芳基酮7a-7g,芳基环酮7h-7m,杂环环酮7n-7w。最高以99% ee的对映体选择性、85%的收率得到目标产物。对于极具挑战性的α,α-二烷基酮7x-8c,其不对称烯丙基化反应也得到了较好的结果(图3)。
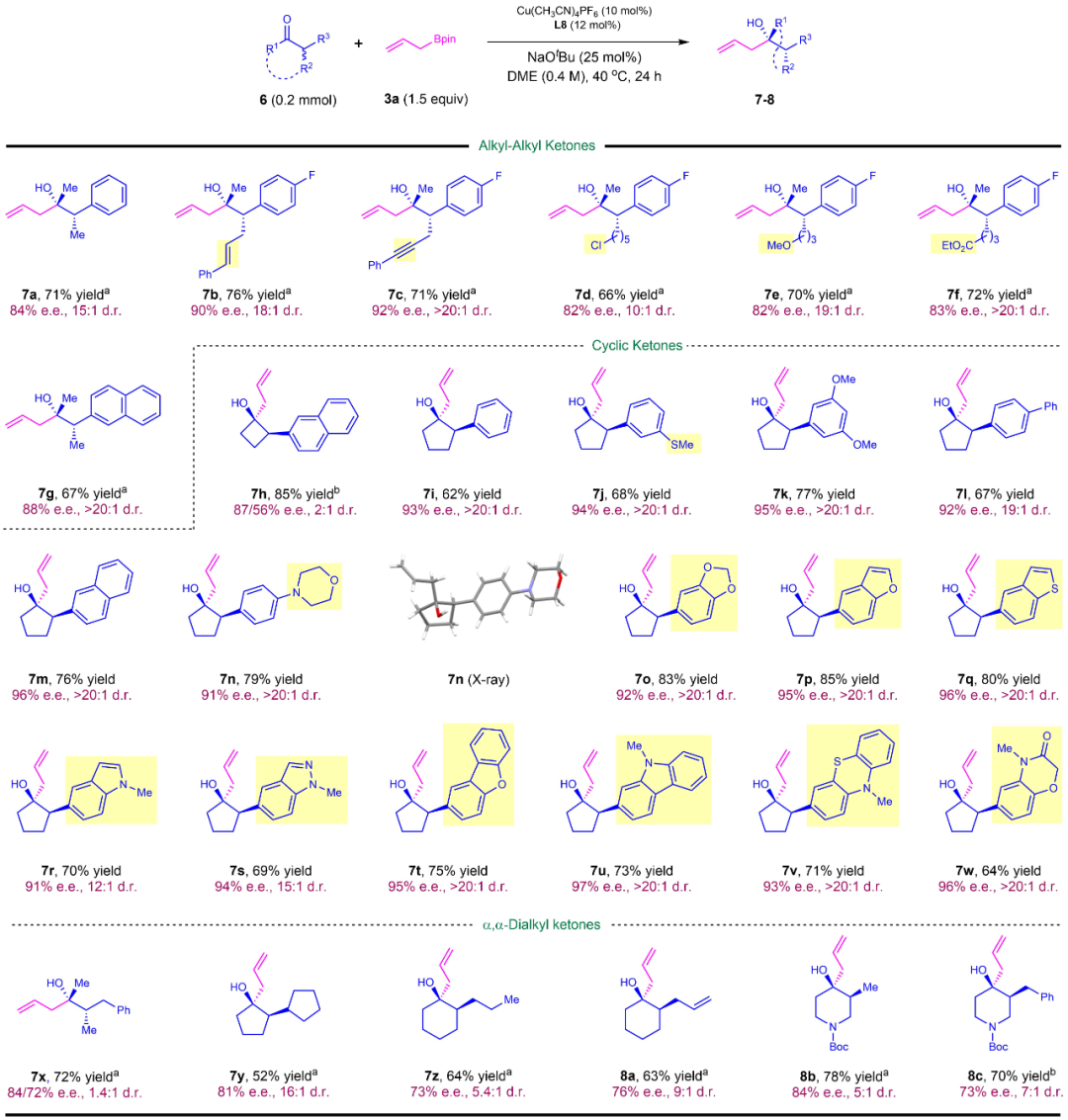
图3:α-芳(杂环)基酮的不对称烯丙基化底物范围。
此外,作者实现了各种类型酮的不对称炔丙基化和丁烯基化反应。在炔丙基化反应中,通过手性配体高效手性识别及控制,得到高区域选择性和高立体选择性的手性叔醇。作者还考察了含有取代基的烯丙基硼酸酯的不对称丁烯基化反应。该反应同样具有较好的立体选择性,得到含有连续三个手性中心的手性叔醇结构(图4)。
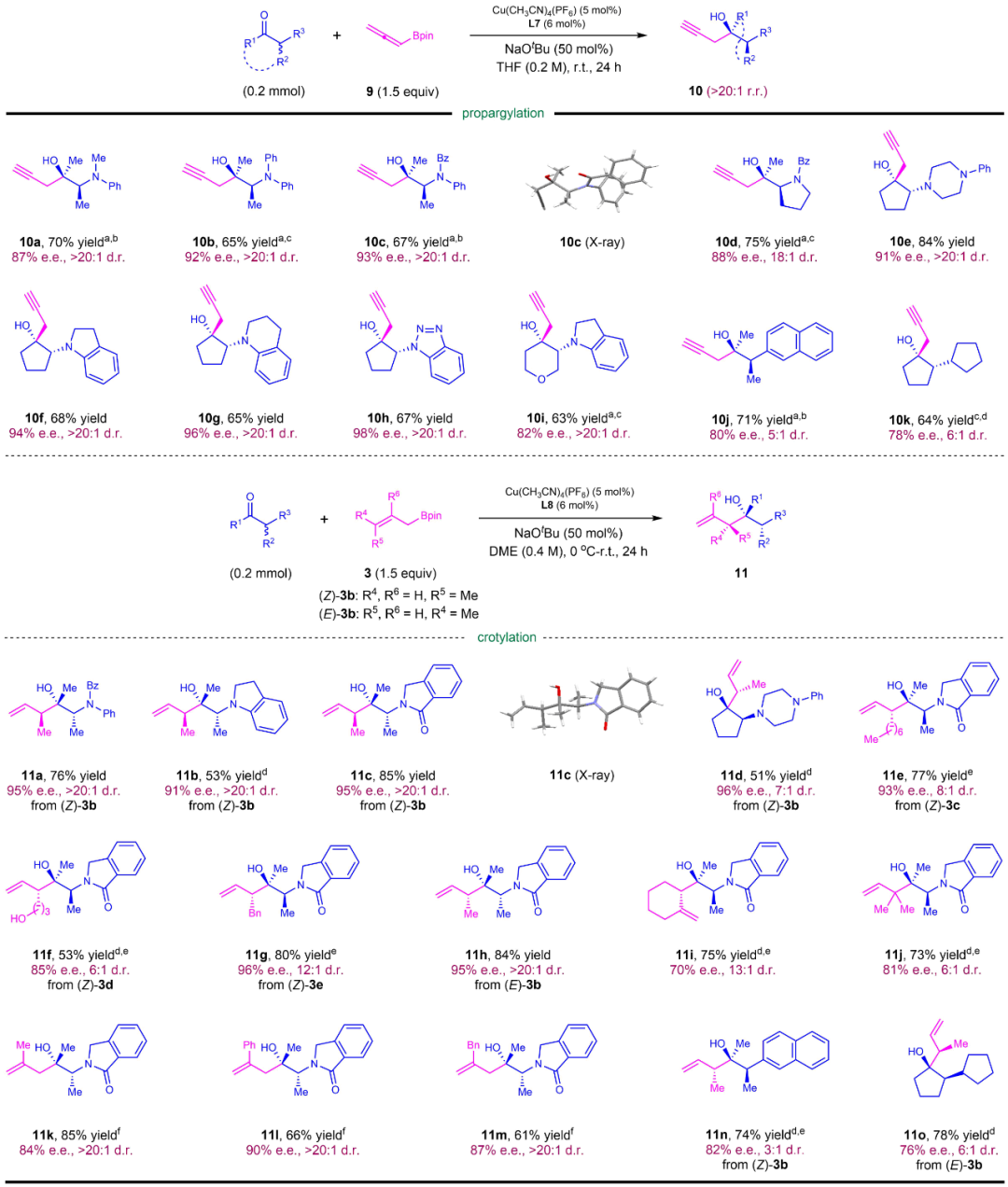
图4:不对称炔丙基化和丁烯基化底物范围。
机理实验表明,在铜催化消旋酮的动态动力学不对称反应中,(R)-α-酮与手性膦配体(L8)匹配,高选择性地生成目标产物;(S)-α-酮与手性配体(L8)不匹配,生成产物的速率及选择性均远低于(R)-α-酮;(R)与(S)-α-酮在反应条件下能够快速消旋化。推测反应的机理为:首先烯丙基硼通过转金属得到烯丙基铜物种,随后与手性配体相匹配的(R)-α-酮进行亲核加成,最后经过转金属及质子化得到目标产物和铜催化剂,产物的非对映选择性符合Felkin-Anh模型(图5)。该铜催化体系中,碱的用量和手性配体的选择是实现严格的反应速率匹配和高立体选择性控制的关键。
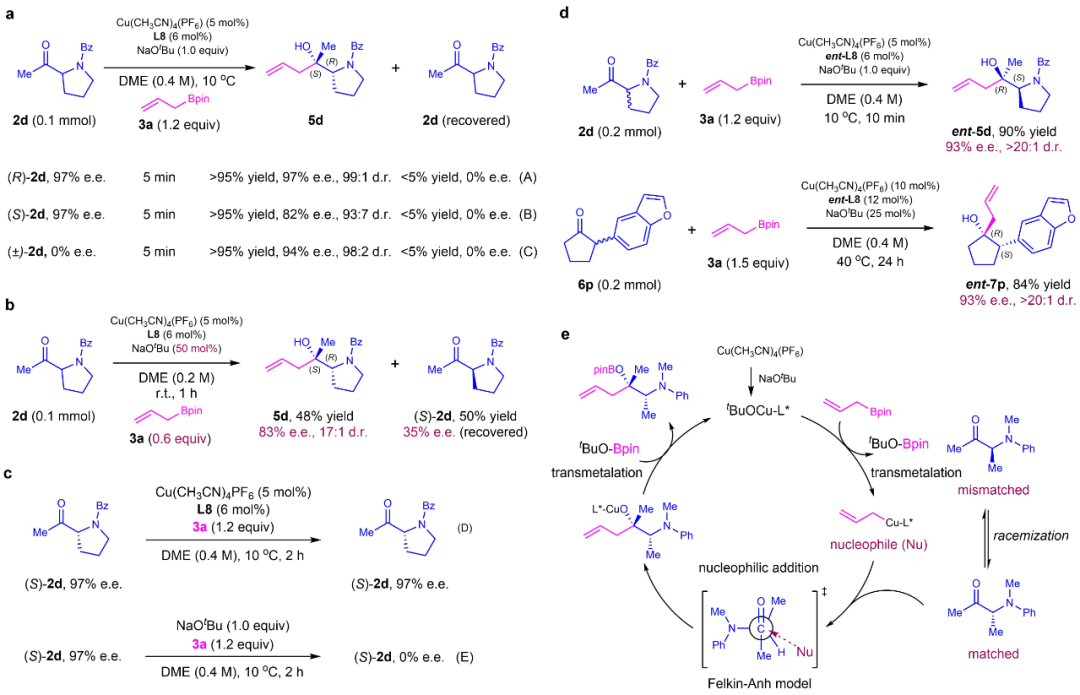
图5:机理研究。
该工作得到了国际学术界的高度关注,美国杜克大学Steven J. Malcolmson教授受邀在Nature Synthesis期刊“News & Views”专栏撰写题为“Shattering the mirror with copper catalysis”的亮点文章(Nat. Synth. 2024, DOI: 10.1038/s44160-024-00589-3),推介了施世良/孙博在动态动力学不对称酮的烯丙基化、炔丙基化和丁烯基化反应研究领域所取得的最新进展。
相关论文信息:
https://doi.org/10.1038/s44160-024-00567-9
编辑 |余 荷
排版|王大雪
欲知更多内容,敬请围观小柯机器人频道:http://paper.sciencenet.cn/AInews/

“小柯化学”是“小柯”系列学术公众号之一,主要介绍化学领域顶级学术期刊最新论文信息。“小柯”是一个科学新闻写作机器人,由中国科学报社联合北大团队研发而成。新闻由“小柯”独立完成,经领域专家和科学编辑双重人工审校。
https://blog.sciencenet.cn/blog-3607466-1440140.html
上一篇:Nat Synth:清华大学王训团队开发多酸团簇组装体超结构的相工程
下一篇:Nat Synth:刘臻课题组开发手性烯酮的高效生物合成方法学