博文
Hearts:铁过载心脏并发症的临床表现、评估与管理
||
背景介绍
心脏铁过载是遗传性血色病或输血依赖性疾病等全身性铁过载的罕见但严重的不良后果,其特征为铁在心肌中的异常积聚。心肌过量铁质会引发氧化应激、心肌细胞损伤及进行性纤维化,最终导致心肌病。及时的诊断与干预对改善临床结局至关重要。近期,一篇发表在Hearts 的文章综述了铁过载相关心血管并发症的最新进展。
流行病学
根据美国一项基于2012-2014年国家住院患者样本数据库 (NIS) 数据的全国性研究,27.8%的血色病患者存在一种或多种心血管表现,具体包括心律失常 (16%)、充血性心力衰竭 (9.3%)、肺动脉高压 (7.4%)、非缺血性心肌病 (4.2%) 及传导障碍 (2%)。经风险调整后,原发性与继发性血色病患者的室上性心律失常负担均显著升高。继发性血色病源于外源性铁过载,最常见于β型重型地中海贫血、镰状细胞病及骨髓增生异常综合征等患者的长期输血治疗。在输血依赖型重型地中海贫血中,心脏并发症是致死致残的首要原因,主要归因于铁介导的心肌病和心律失常。从地域分布看,血色病心脏并发症负担最严重的地区包括遗传性血色病高发区 (如北欧及北美北欧裔人群) 以及输血依赖性血红蛋白病高流行区 (如地中海部分地区、中东及南亚)。通过常规筛查 (血清铁蛋白、转铁蛋白饱和度及心脏影像学检查) 早期识别心脏受累,对于降低不可逆性器官损伤风险和改善预后至关重要。
病理生理学
铁过载性心肌病的病理生理机制涉及多种相互作用的机制,主要包括肌浆内铁沉积过量 (首要机制)、芬顿反应引发的氧化应激、线粒体功能障碍、炎症反应以及铁死亡。在遗传性血色病中,HFE基因突变会导致调控铁稳态的关键因子肝肽素调节失常,肝肽原水平降低导致膳食铁吸收增加,进而引发铁过载。输血相关性 (继发性) 血色病病理机制与此类似,但铁沉积途径主要通过反复外源性给药实现。随着心脏成为铁沉积的主要部位,尤其在心肌细胞内,铁沉积通过氧化应激和线粒体功能障碍导致细胞损伤。过量的游离铁通过芬顿反应催化活性氧 (ROS) 的形成,引发细胞膜脂质过氧化 (铁死亡)、蛋白质损伤及DNA链断裂。除直接损伤心肌外,铁过载还可能通过影响肝脏、内分泌腺体 (如糖尿病、甲状腺功能减退、甲状旁腺功能减退) 及免疫系统等器官间接损害心脏。图1与图2分别展示原发性与继发性血色病的病理生理机制。
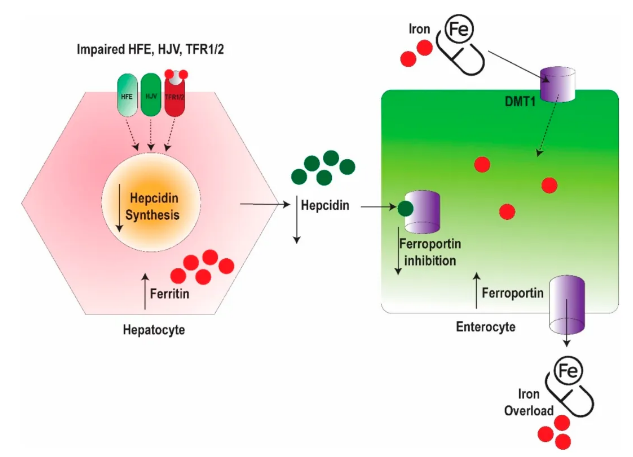
图1. 原发性血色病的病理生理机制图示。
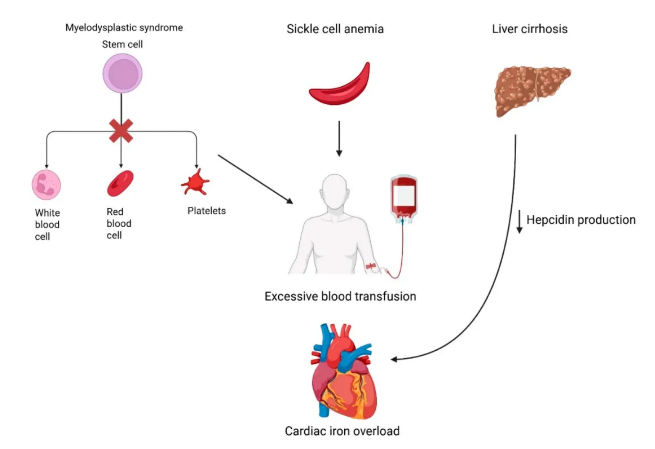
图2. 继发性血色病的病理生理机制图示。
临床表现
心脏铁过载通常表现为扩张型心肌病 (DCM) 或限制性心肌病 (RCM),其中DCM最常见。在DCM中,心肌内铁沉积过多会导致进行性心肌细胞损伤、纤维化和重塑,最终导致左心室扩张和收缩功能障碍。收缩功能的这种恶化导致心力衰竭,削弱了心脏有效泵血的能力。与收缩功能主要受影响的DCM不同,RCM的特征是充盈模式受限、舒张末期压力升高和舒张松弛不良。心室充盈受损导致心房压力升高,左心房和右心房扩大,使患者易患房颤和其他心律失常。传导障碍和心律失常是铁过载的突出心脏表现。患者可能会出现心悸、疲劳、胸部不适甚至晕厥等症状。氧化应激是铁超载的标志,在心肌梗死 (MI) 的发病机制中起着核心作用。铁超载会破坏内皮功能,损害血管舒张并促进炎症。这些变化加速了冠状动脉内动脉粥样硬化和斑块形成的发展,进一步提高了心肌梗死的风险。
结语
心脏铁过载是全身性铁过载的重要表现形式,主要见于遗传性血色病及继发性铁过载病症。采用临床评估、规范管理与先进影像技术相结合的综合策略,对优化心脏铁过载患者的预后至关重要。通过多模态影像技术实施早期干预和定期监测,可有效预防不可逆性心脏损伤,显著改善预后。
阅读英文原文:https://www.mdpi.com/3387908
Hearts 期刊介绍
主编:Prof. Dr. Matthias Thielmann, University of Duisburg Essen, Germany
期刊研究领域涵盖基础、转化和临床研究,心血管医学创新科学所有领域以及相关学科。
Time to First Decision:19.9 Days
Acceptance to Publication:2.8 Days
期刊主页:https://www.mdpi.com/journal/hearts

https://blog.sciencenet.cn/blog-3516770-1521000.html
上一篇:Brain Sciences 论文选题灵感:衰老与神经疾病
下一篇:Bioengineering华中科技大学的尉迟明教授等创建特刊:医用超声断层扫描技术及其应用进展