博文
复发性NOMO1基因缺失是早发结直肠癌的潜在临床标志并参与细胞迁移的调节 | MDPI Cancers
||
原因不明的早发性结直肠癌 (Early-Onset Colorectal Cancer, EOCRC) 发病率在全球范围内不断上升,因此有必要从机制层面研究其分子基础。与晚发性结直肠癌相比,EOCRC 中发生了大量 NOMO1 基因删除事件。西班牙萨拉曼卡大学生物医学研究所的 Rogelio González-Sarmiento 及其团队在 Cancers 发表研究成果,分析了早发性结直肠癌中 NOMO1基因的突变情况,并在不同的 CRISPR/cas9 编辑的细胞系及小鼠模型中探究了 NOMO1 缺失的影响。
病例研究过程与结果
1. 定量 PCR 揭示单个 NOMO 基因
人类 16 号染色体 p 臂的重复区域有三个高度相似的基因,分别是 NOMO1、NOMO2 和 NOMO3。研究人员通过设计寡核苷酸引物和定量 PCR,发现通过 RT-qPCR 扩增的 NOMO DNA 数量与单拷贝基因 LEMD3、RBFOX1 和 PKD1 的 30 号外显子相似,是 PKD1 13 号外显子的一半,是 STS 5 号外显子的 2 倍。而后他们比较了三个报道的 NOMO 基因编码区,发现它们有 20 个核苷酸的差异,对应 13 个沉默突变和 7 个错义突变。
2. 在 EOCRC 中,NOMO1 常因缺失或突变而失活
研究人员对 26 个 EOCRC 的 NOMO1 基因进行了测序,其中 4 个携带 NOMO1 基因的致病突变,6 个发生了可能致病的突变,且在 10 个NOMO1 基因杂合缺失的肿瘤中,有 3 个在剩余的等位基因中存在致病突变。这表明,NOMO1 在 EOCRC 中经常由于缺失或突变而失活。
3. CRISPR/Cas9 技术有效灭活 NOMO1
为研究 NOMO1 失活的后果,作者使用 CRISPR/Cas9 技术构建了 NOMO1-KO 细胞系,并使用 RT-qPCR (图1A)、PCR-Sanger 测序 (图1B) 和 Western Blotting (WB,图1C) 进行筛选。
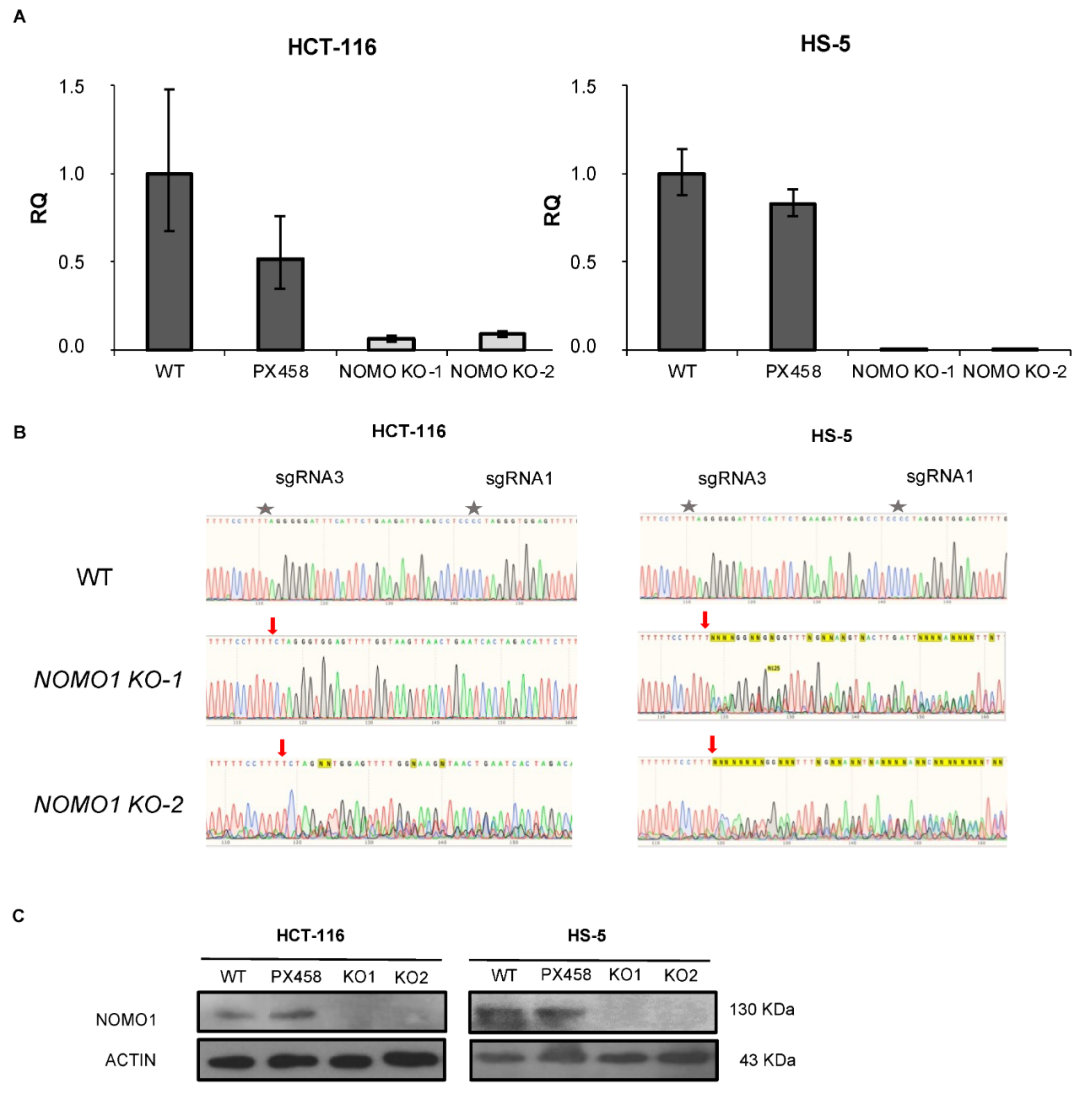
图1. 使用 CRISPR/Cas9 技术构建 NOMO1-KO 细胞系。
4. NOMO1 失活显著降低细胞系中 NCLN 的表达
研究发现 TMEM147 的表达不受 NOMO1 缺失的影响 (图2A)。相反,NOMO1-KO 细胞中 NCLN 的表达严重下降。NCLN 水平的降低并未伴随显著的 mRNA 表达水平的下降,这表明蛋白质是通过转录后的机制降低的 (图2B)。
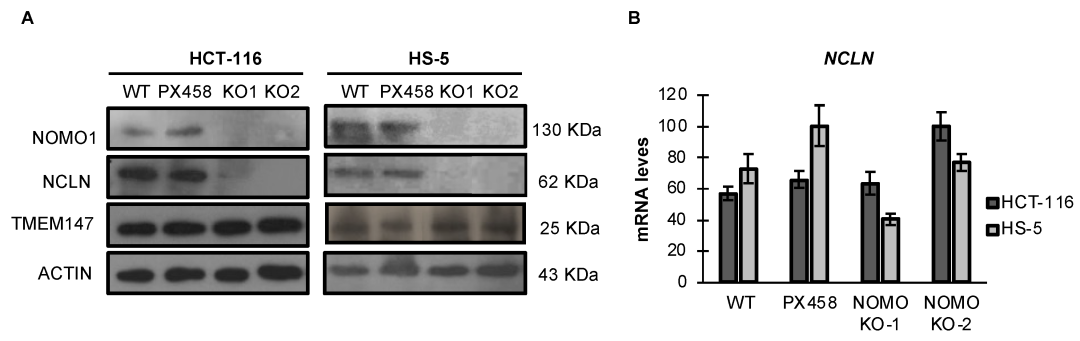
图2. 在 NOMO1 存在或不存在的情况下,各细胞系 Nicalin 和 TMEM147 的表达水平。
5. NOMO1 失活不影响 Nodal 信号通路活性或细胞增殖
研究通过 WB 分析了 NOMO1-KO 和对照组细胞中参与 Nodal 通路的蛋白质丰度,发现 NOMO1 失活后,这些蛋白的丰度没有任何改变,Smad4 的表达未受到 NOMO1 失活影响,表明 Nodal 通路的活性不受 NOMO1 失活的影响。
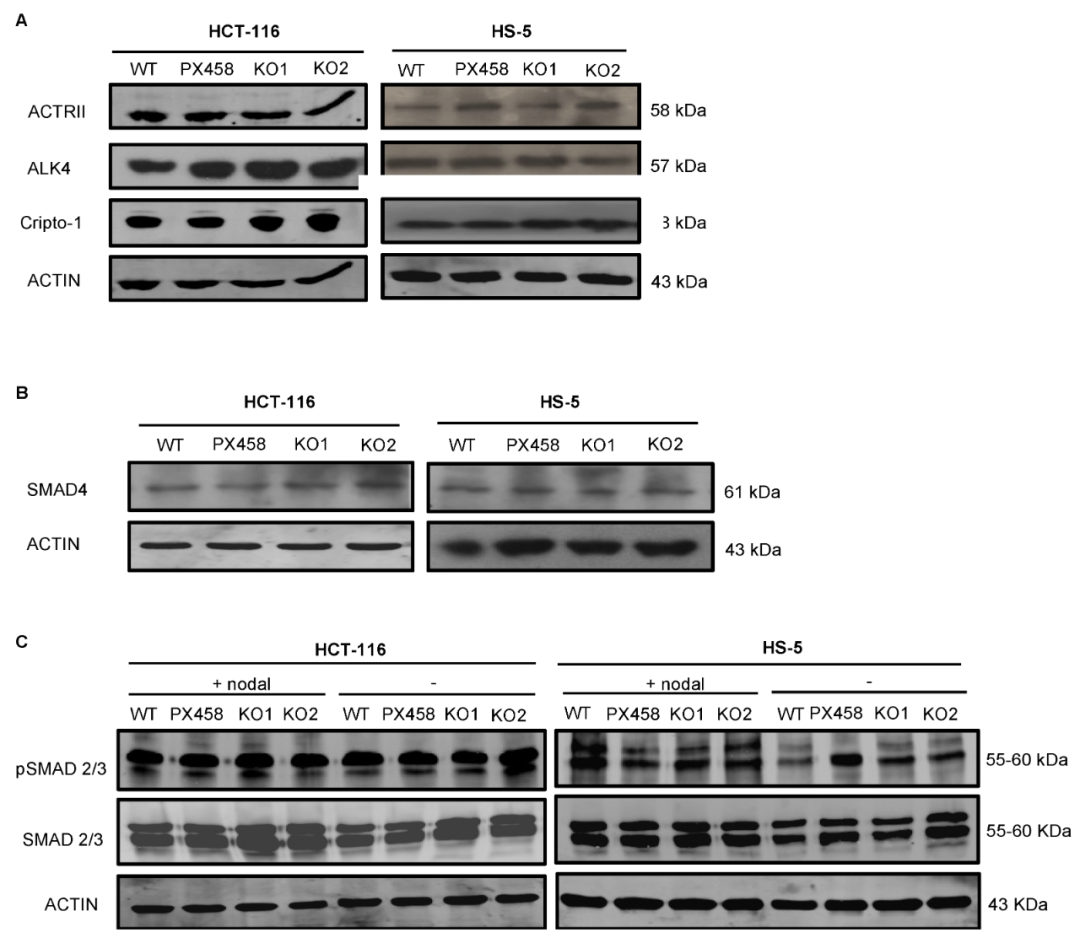
图3. Nodal 信号通路相关蛋白的表达水平
6. NOMO1-KO 细胞系的基因表达谱
根据测序芯片分析结果,研究人员发现与对照组相比,两个细胞系 (HCT-116 和 HS-5) 共有 126 个基因表达水平下调, NOMO1-KO 细胞系中共有 81 个基因被上调,45 个基因被下调。转录组分析结果表明,NOMO1 缺失的细胞系中与肿瘤坏死因子 α 通路及与炎症和血管形成过程等相关的基因表达水平降低。此外,NOMO1-KO 细胞中普遍下调的基因通过调节多种基因影响上皮间质转移和细胞迁移。
7. NOMO1-KO 细胞系的蛋白表达谱
为阐明 NOMO1 失活后两个细胞系 (HCT-116 和 HS-5) 蛋白质表达谱的变化,研究人员进行了 LC-IMS/MS 分析。结果显示,这两个细胞系中分别有 357 个和 486 个蛋白质的水平下降。此外,在 LC-IMS/MS 分析中,WB 确定了不同表达的细胞迁移相关蛋白 (CTND1、LMNB1 和 HMGA1)。这些结果证明了在转录组中观察到的过程的改变,并表明 NOMO1 缺失可能影响细胞的迁移能力。
8. NOMO1 失活促进细胞迁移
为探究 NOMO1 是否对细胞迁移具有重要作用,研究人员对结肠癌细胞在缺乏该基因情况下的迁移能力进行了研究。结果显示,与对照组相比,NOMO1-KO 细胞系的迁移百分比明显更高 (图4)。因此,NOMO1 缺失促进了细胞迁移。
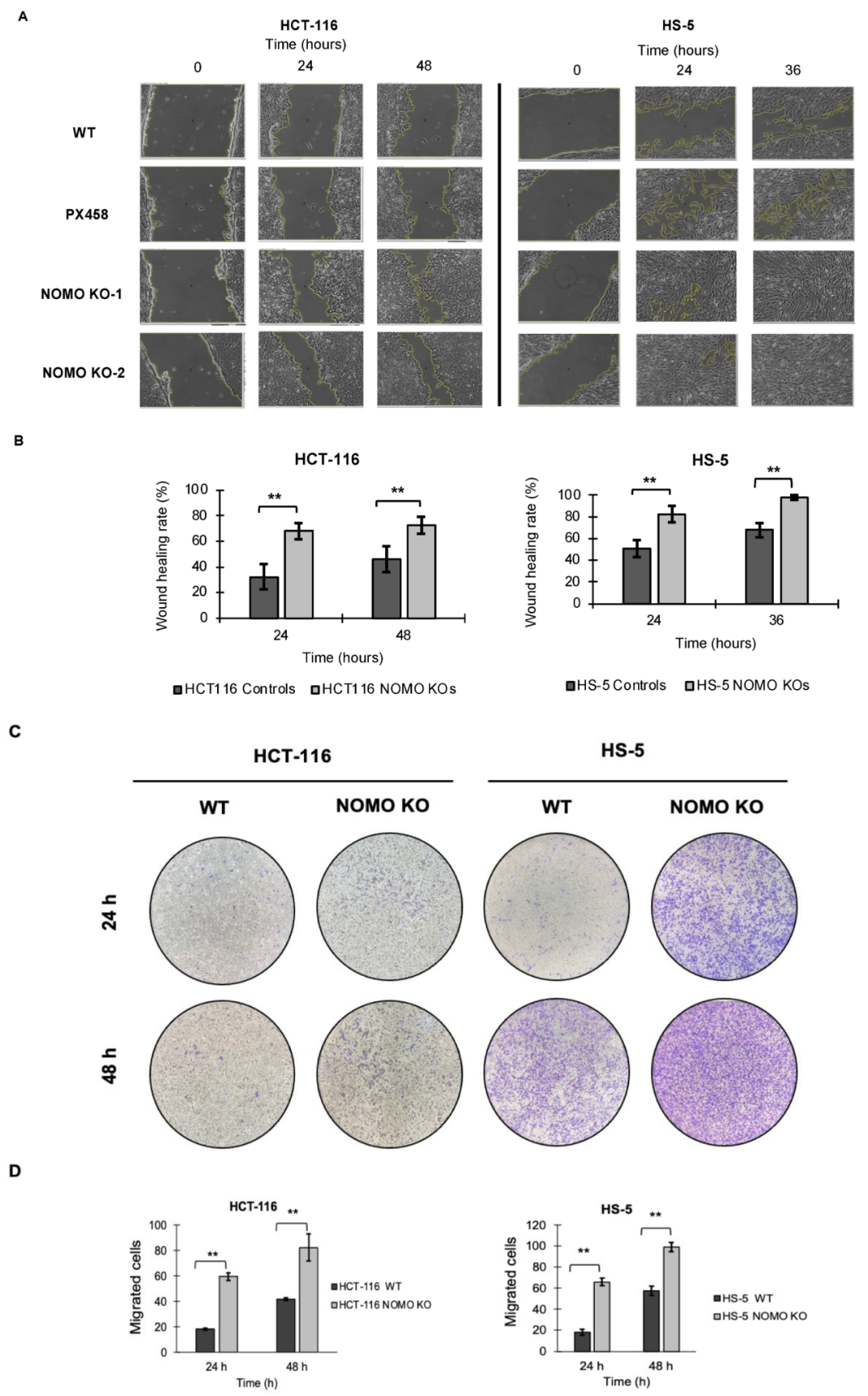
图4. NOMO1 缺失促进了 HCT-116 和 HS-5 细胞系的细胞迁移。
9. 小鼠结肠细胞的 NOMO1 缺失不会改变 EOCRC 的易感性
作者使用条件小鼠模型在小鼠结肠细胞中沉默 Nomo1 的表达。对实验组和对照组小鼠的病理研究结果显示,消化道中没有与结直肠癌或其他肿瘤发展相适应的病变。这表明 Nomo1 的缺失不是小鼠结直肠癌发展的驱动因素。
研究总结
虽然大部分 EOCRC 样本中发生 NOMO1 缺失,且导致结直肠癌迁移,但该基因在结直肠癌的发展过程中并不发挥决定性影响,而位于同一染色体区域的其他编码或非编码基因可能在早发结直肠癌的发生中充当驱动基因。因此,作者提出,需要进一步的机理研究来了解这一可能的肿瘤抑制因子在 EOCRC 中的作用机理基础。
原文出自 Cancers 期刊:https://www.mdpi.com/1787138
Pérez-García, J.; Martel-Martel, A.; García-Vallés, P.; Corchete, L.A.; García, J.L.; Gestoso-Uzal, N.; Vidal-Tocino, R.; Blanco, Ó.; Méndez, L.; Sánchez-Martín, M.; Fuentes, M.; Herrero, A.B.; Holowatyj, A.N.; Perea, J.; González-Sarmiento, R. Recurrent NOMO1 Gene Deletion Is a Potential Clinical Marker in Early-Onset Colorectal Cancer and Is Involved in the Regulation of Cell Migration. Cancers 2022, 14, 4029.
Cancers 期刊介绍
主编:Samuel C. Mok, The University of Texas MD Anderson Cancer Center, USA
期刊主题涵盖癌症治疗和免疫疗法、癌症生物标志物、流行病学和预防、肿瘤微环境、癌症病因和筛查、诊断和护理、癌症分子生物学等肿瘤学领域各个方面。目前,期刊已被 SCIE、Scopus 等重要数据库收录。
2021 Impact Factor:6.575
2021 CiteScore:5.8
Time to First Decision:17.4 Days
Time to Publication:40 Days


https://blog.sciencenet.cn/blog-3516770-1375524.html
上一篇:JCM:“听力损失”文章精选
下一篇:“晓果仁”专栏 | Horticulturae:利用油柿基因组助推柿属植物研究及育种