博文
我们为什么会衰老?统一衰老理论(TRCS)
|
摘要:把生活在不同雨季长度的寿命不同的鳉鱼放在同一个水池下饲养,它们寿命差别仍然存在,表明性成熟后衰老仍然是由程序控制的。个体衰老是由成体干细胞的复制性衰老导致的,我们的研究表明,细胞衰老是由端粒和rDNA通过P53途径调控的。此外,其他11个经典的衰老标志也是端粒和rDNA缩短后由P53途径调控的下级标志物。
关键词:复制性衰老;个体衰老;成体干细胞;端粒;rDNA;TRCS
预印本:Huang, Bilu, Why Do We Age?The Telomere DNA and Ribosomal DNA Co-regulation Model for Cell Senescence (TRCS) (October 01, 2025). Available at SSRN: https://ssrn.com/abstract=5558378 or http://dx.doi.org/10.2139/ssrn.5558378
如果你不能简单说清楚,就是你没完全明白。——爱因斯坦.
衰老太可怕了,那么,我们为什么会衰老?
1 衰老是由程序控制的,而非随机的损伤积累
把生活在不同雨季长度的寿命为3个月、9个月和16个月的三种鳉鱼品系放在同一水池中人工饲养,它们的寿命差别依然存在,这表明,性成熟后衰老仍然是由程序控制的,因为随机损伤积累无法解释这三种同一属的身体结构极为相似的鳉鱼寿命为什么差别如此之大,而且正好与雨季的长度相吻合[1]。
由于抗氧化剂能减少各种损伤,但抗氧化剂没能延长小鼠寿命,因此,仅凭这一证据足以推翻衰老是由各种随机损伤和积累导致的。
2 个体衰老是由成体干细胞的复制性衰老导致的
复制性衰老的特点是细胞每复制一次,子细胞就会比母细胞更老一些。具体来说,就是总蛋白质和ATP的合成速率下调,有些蛋白质上调,有些蛋白质下调,以此使细胞功能下降和改变,这表明,细胞衰老也是程序化的,直到细胞停止分裂,达到Hayflick极限。
组成个体各种组织和器官的体细胞分为“成体干细胞”和“功能性细胞”两大类,虽然心脏没有发现成体干细胞,但心肌细胞能通过自我复制来更新[2],因此,心肌细胞既是成体干细胞也是功能性细胞。
成体干细胞和功能性细胞都会因为细胞衰老、基因突变或病毒感染等因素而被免疫系统清除掉,然后由成体干细胞通过自我复制和细胞分化进行更新。但是,成体干细胞本身也会因为反复的自我复制而发生复制性衰老,而由衰老的成体干细胞分化的功能性细胞也是衰老的功能性细胞,从而导致了组织、器官、系统和个体的逐渐衰老(图1)。例如,下丘脑中的腺垂体中有6种体细胞,包括分泌生长激素细胞、促甲状腺激素细胞、促肾上腺皮质激素细胞、促性腺激素细胞、催乳素细胞和一种负责分化为这5种分泌激素细胞的腺垂体干细胞组成。随着年龄增长,腺垂体干细胞会逐渐发生复制性衰老,从而导致由腺垂体干细胞分化的这5种分泌激素的功能性细胞也越来越衰老,以至使内分泌系统发生增龄性变化。因此,导致个体衰老的根本原因,归根结底是由成体干细胞的复制性衰老导致的[3]。
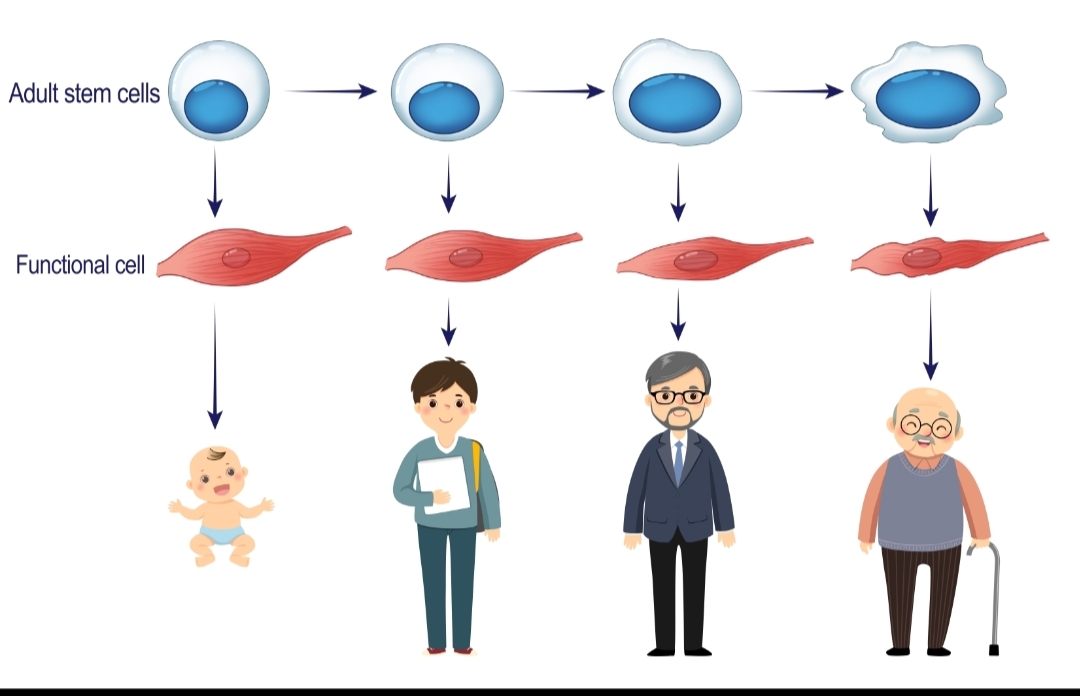
图1:成体干细胞衰老导致个体衰老
3 细胞的复制性衰老是由端粒和rDNA共同调控的
端粒是一种多拷贝的串联重复DNA阵列,端粒缩短已证明是细胞复制次数和衰老的倒计时器,然而,有些细胞端粒不会缩短,细胞复制次数和寿命仍然是有限的。而且还发现,用端粒酶维持端粒长度,虽然复制次数增加了,但细胞最终还是停止了复制并死亡掉。因此,除了端粒,细胞核中应该还有类似端粒的多拷贝的串联重复DNA阵列作为细胞的第二套复制次数和寿命的倒计时器。于是提出了“Telomere DNA and ribosomal DNA co-regulation model for cell senescence”(TRCS)[4],本理论认为,端粒和/或rDNA阵列缩短会导致肿瘤抑制蛋白P53水平升高,从而导致细胞衰老(图2)。并且TRCS已通过实验验证是正确的,rDNA对衰老的权重大于端粒。
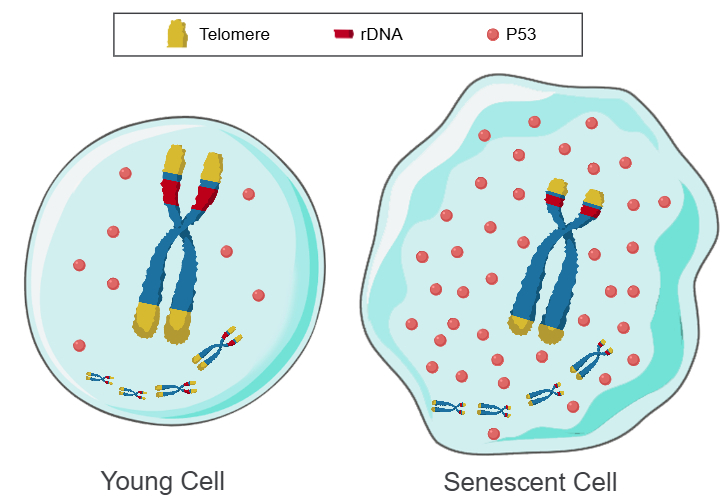
图2:Telomere DNA and ribosomal DNA co-regulation model for cell senescence
左: 长阵列的端粒和rDNA,P53迅速降解,细胞年轻。右:短阵列的端粒和rDNA,P53缓慢降解,细胞衰老。
另外,其他11个经典的衰老标志也是端粒和rDNA缩短后由P53途径调控的下级标志物(图3和表1)[1]。
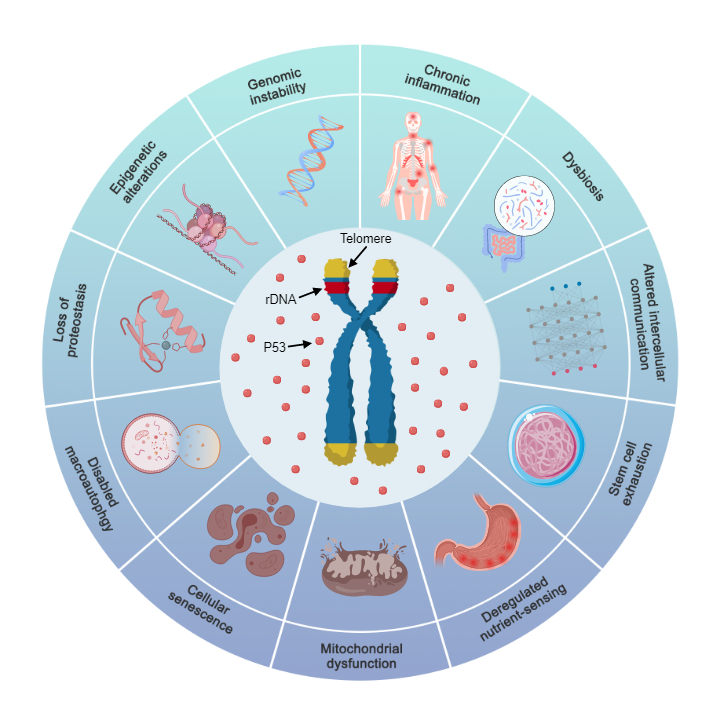
图3:端粒和rDNA阵列缩短后通过P53介导的11个衰老标志
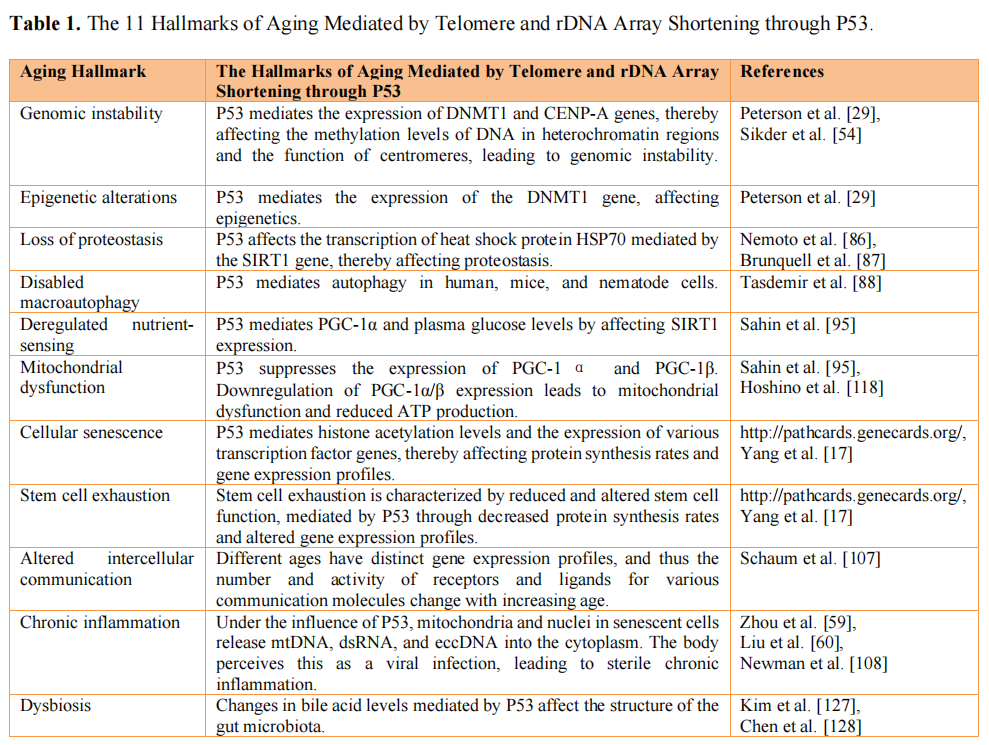
表1:端粒和rDNA阵列缩短后通过P53介导的11个衰老标志
综上所述,导致个体衰老的根本原因,归根结底是由组织中的成体干细胞的端粒和rDNA阵列缩短导致的。
参考文献
[1] Bilu Huang , Xiaowen Hu. Causality of Aging Hallmarks. Aging and disease. 2025 https://doi.org/10.14336/AD.2025.0541
[2] Wang WE, Li L, Zeng C. Dedifferentiation, Proliferation, and Redifferentiation of Adult Mammalian Cardiomyocytes After Ischemic Injury. Circulation. 2017 Aug 29;136(9):834-848. doi: 10.1161/CIRCULATIONAHA.116.024307.
[3] Huang, Bilu (1998). 衰老的机理意义及治疗 The mechanism significance and treatment of aging. figshare. Journal contribution. https://doi.org/10.6084/m9.figshare.29118716.v1
[4] Bilu Huang. Telomere DNA and ribosomal DNA co-regulation model for cell senescence. Negative, 2021. 12(3):9-15. doi:10.13276/j.issn.1674-8913.2021.03.003.
https://blog.sciencenet.cn/blog-3440171-1505509.html
上一篇:衰老研究的里程碑式进展
下一篇:为什么细胞衰老的端粒理论是正确的