博文
革命性的发现:包裹并消灭细菌的蛋白质  精选
精选
||
革命性的发现:包裹并消灭细菌的蛋白质
诸平
据荷兰代尔夫特理工大学(Delft University of Technology, Delft, The Netherlands)2024年10月19日提供的消息,革命性的发现:包裹并消灭细菌的蛋白质(Revolutionary Discovery: Proteins That Encase and Eradicate Bacteria)。
新的研究揭示了我们的免疫系统是如何利用鸟苷酸结合蛋白(Guanylate Binding Proteins简称GBP)在细菌周围形成一层破坏性的外壳来对抗细菌感染的,这为创新治疗提供了潜在的途径。
蛋白质鸟苷酸结合蛋白1(Guanylate Binding Proteins1简称GBP1)是人体抵抗病原体的天然防御系统的重要组成部分。它通过将细菌和寄生虫包裹在一层蛋白质外衣中来对抗它们。直到最近,这种保护作用背后的机制仍然是个谜。代尔夫特理工大学的研究人员现在已经破译了这种蛋白质的功能。他们的研究结果于2024年10月11日已经在《自然结构与分子生物学》(Nature Structural & Molecular Biology)杂志网站在线发表——Tanja Kuhm, Clémence Taisne, Cecilia de Agrela Pinto, Luca Gross, Evdokia A. Giannopoulou, Stefan T. Huber, Els Pardon, Jan Steyaert, Sander J. Tans, Arjen J. Jakobi. Structural basis of antimicrobial membrane coat assembly by human GBP1. Nature Structural & Molecular Biology, 11 October 2024. DOI: 10.1038/s41594-024-01400-9.
参与此项研究的除了来自荷兰代尔夫特理工大学的研究人员之外,还有来自荷兰 阿姆斯特丹的原子和分子物理学研究所{FOM Institute for Atomic and Molecular Physics (AMOLF) }(AMOLF, Amsterdam, The Netherlands)、比利时布鲁塞尔的VIB-VUB结构生物学中心(VIB-VUB Center for Structural Biology, Brussels, Belgium)以及比利时布鲁塞尔自由大学(Vrije Universiteit Brussel, Brussels, Belgium)的研究人员。
此研究成果可以为开发新的药物和疗法铺平道路,特别是对于免疫系统受损的个体。
鸟苷酸结合蛋白(GBPs)在先天免疫中的作用(Role of GBPs in Innate Immunity)
生物物理学家阿尔杰·贾科比(Arjen Jakobi)解释说,鸟苷酸结合蛋白(GBPs)对我们的先天免疫系统至关重要。“GBPs是抵御由细菌和寄生虫引起的各种传染病的第一道防线。这类疾病包括痢疾、沙门氏菌引起的伤寒和肺结核。这种蛋白质在性传播感染衣原体(chlamydia)和弓形虫病(toxoplasmosis)中也起着重要作用,弓形虫病在怀孕期间对未出生的孩子而言尤其危险。”
鸟苷酸结合蛋白1:细菌外壳(GBP1: The Bacterial Coat)
在他们的论文中,阿尔杰·贾科比和他的同事首次描述了先天免疫系统是如何利用GBP1蛋白对抗细菌的。阿尔杰·贾科比研究小组的博士候选人、上述研究论文的第一作者Tanja Kuhm解释说,“这种蛋白质通过在细菌周围形成一种外衣来包裹细菌。通过把这层外衣拉得更紧,它打破了包围入侵者的保护层即细菌的膜,之后免疫细胞可以清除此感染。”
破解GBP的防御策略(Decoding GBP’s Defensive Strategy)
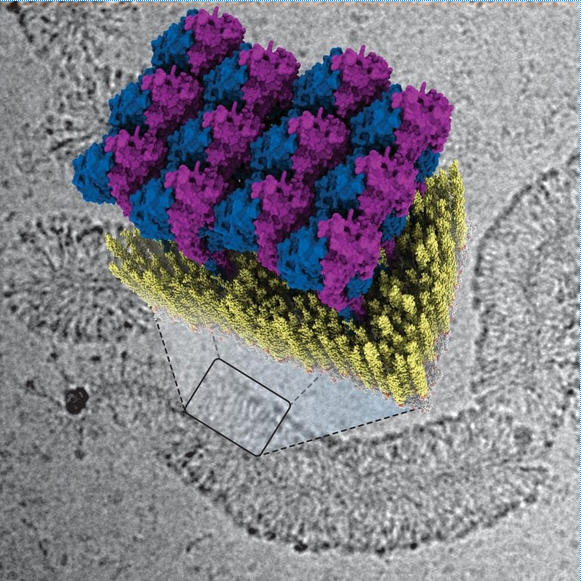
为了破解GBPs的防御策略,研究人员使用低温电子显微镜检查了GBP1蛋白如何与细菌膜结合。这使他们能够非常详细地观察到分子尺度的过程。
阿尔杰·贾科比说:“我们能够获得蛋白质外壳形成的详细三维图像。再加上AMOLF研究所Sander J. Tans研究组进行的生物物理实验,使我们能够精确地操纵系统,我们成功地破译了抗菌功能的机制。”
医药应用潜力(Potential for Medicinal Applications)
根据阿尔杰·贾科比的说法,这项研究帮助我们更好地了解我们的身体是如何对抗细菌感染的。“如果我们能很好地掌握这一点,并且我们可以通过药物特异性地激活或停用相关蛋白质,它可能会提供加速摆脱某些感染的机会。”
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
Guanylate-binding proteins (GBPs) are interferon-inducible guanosine triphosphate hydrolases (GTPases) mediating host defense against intracellular pathogens. Their antimicrobial activity hinges on their ability to self-associate and coat pathogen-associated compartments or cytosolic bacteria. Coat formation depends on GTPase activity but how nucleotide binding and hydrolysis prime coat formation remains unclear. Here, we report the cryo-electron microscopy structure of the full-length human GBP1 dimer in its guanine nucleotide-bound state and describe the molecular ultrastructure of the GBP1 coat on liposomes and bacterial lipopolysaccharide membranes. Conformational changes of the middle and GTPase effector domains expose the isoprenylated C terminus for membrane association. The α-helical middle domains form a parallel, crossover arrangement essential for coat formation and position the extended effector domain for intercalation into the lipopolysaccharide layer of gram-negative membranes. Nucleotide binding and hydrolysis create oligomeric scaffolds with contractile abilities that promote membrane extrusion and fragmentation. Our data offer a structural and mechanistic framework for understanding GBP1 effector functions in intracellular immunity.
https://blog.sciencenet.cn/blog-212210-1456284.html
上一篇:小小的调整会对你的日常步行产生巨大的影响
下一篇:核糖体诡计:癌症免疫逃避的秘密