博文
减少与常见化学物质的接触可以延缓衰老  精选
精选
||
减少与常见化学物质的接触可以延缓衰老
诸平
据日本名古屋大学(Nagoya University)网站2024年4月14日报道,该校的研究人员新的研究表明,减少与常见化学物质的接触可以延缓衰老(New Research Suggests That Cutting Exposure to Common Chemicals Could Slow Aging)。名古屋大学的一组研究人员发现,醛类(aldehydes)是与早衰有关的代谢副产物。他们的研究结果于2024年4月10日已经在《自然·细胞生物学》(Nature Cell Biology)杂志网站发表——Yasuyoshi Oka, Yuka Nakazawa, Mayuko Shimada, Tomoo Ogi. Endogenous aldehyde-induced DNA–protein crosslinks are resolved by transcription-coupled repair. Nature Cell Biology, 2024. DOI: 10.1038/s41556-024-01401-2. Published: 10 April 2024. https://www.nature.com/articles/s41556-024-01401-2
此研究结果揭示了对早衰疾病的见解,以及在健康个体中对抗衰老的潜在策略,如控制接触醛诱导物质,包括酒精、污染和烟雾。一个人的健康会受到醛类物质的伤害。然而,该小组的研究结果表明,这些有害影响还包括衰老。
发现这一发现的研究小组成员包括名古屋大学的岡 泰由(Yasuyoshi Oka)、中沢 由華(Yuka Nakazawa)、嶋田 繭子(Mayuko Shimada)和 荻 朋男(Tomoo Ogi)。
荻 朋男说:“ DNA损伤与衰老表型有关。然而,我们首次提出了醛源性DNA损伤(aldehyde-derived DNA damage)与早衰之间的关系。”
醛类与衰老之间的联系(Link Between Aldehydes and Aging)
研究人员假设,醛类物质与衰老之间可能存在联系,因为患有早衰症——如AMeD综合征(AMeD syndrome)——的人,会表现出分解醛类物质的酶(如ALDH2)活性不足。
对于健康的人来说,ALDH2在我们对酒精的反应中也很重要。当一个人喝葡萄酒或啤酒时,肝脏会将酒精代谢成醛类物质,从而将其排出体外。ALDH2的活性对于将醛类物质转化为无毒物质很重要。
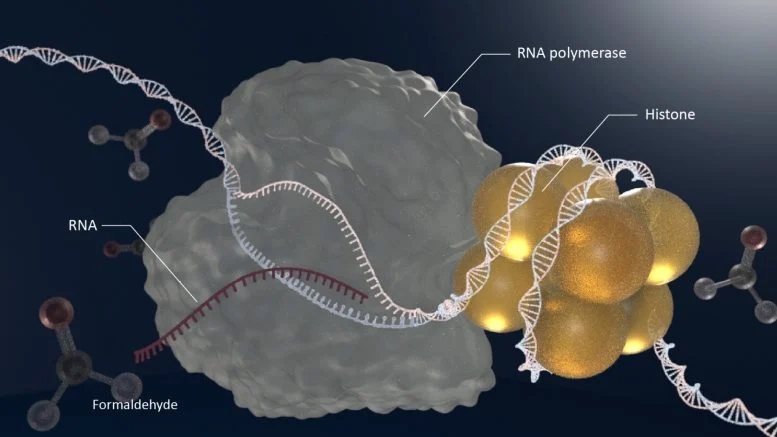
醛类物质是有害的,因为它们与DNA和蛋白质高度反应。在体内,它们形成DNA -蛋白质交联(DNA-protein crosslinks简称DPCs),阻断典型细胞增殖和维持过程中的重要酶,导致这些过程发生故障,导致患者衰老。
专注于由醛引起的DPCs,科学家们使用了一种称为DPC-seq的方法来研究醛积累与过早衰老疾病患者中的DNA损伤之间的联系。在一系列实验中,研究人员发现TCR复合体、VCP/p97和蛋白酶体(proteasome)参与去除活性转录区域中甲醛诱导的DPCs。缺乏醛清除过程和TCR途径的小鼠模型证实了这一点,显示出更严重的AMeD综合征症状。
这些过程很重要,因为它们与醛类物质的清除有关。提示早老性疾病与醛积累之间存在关联。
研究结果及未来发展方向(Research Findings and Future Directions)
荻 朋男教授(Professor Tomoo Ogi)对他们的发现充满希望,他说:“通过阐明DNA损伤快速愈合的机制,我们已经揭示了遗传早衰的部分原因。”
岡 泰由说:“我们的研究为理解早衰疾病的潜在机制开辟了新的途径,并为治疗干预提供了潜在的目标。通过阐明醛类物质在DNA损伤和衰老中的作用,我们正在为未来的研究铺平道路,旨在开发新的治疗和干预措施。”
他继续说:“治疗药物的开发没有进展,因为我们还没有完全了解AMeD综合征和Cockayne综合征(Cockayne syndrome)的原因。这项研究表明,患者的病理状况与细胞内产生的醛类物质衍生的DPC有关。这些结果有望帮助寻找去除醛类的化合物,从而帮助候选治疗药物的制定。”
这项研究的意义超出了遗传疾病,因为他们的发现表明,醛诱导的DNA损伤也可能在健康个体的衰老过程中发挥作用。通过确定醛类物质是导致衰老的物质,这项研究揭示了环境因素和细胞衰老之间的复杂联系。这可能对人类健康和寿命产生重大影响。
这项工作得到了日本医学研究与开发机构{Special Coordination Funds for Rare and Intractable Diseases from the Japan Agency for Medical Research and Development (AMED; JP21ek0109559, JP20ek0109488, JP23ek0109678 and JP21ek0109549}、日本学术振兴会KAKENHI科学研究资助基金{Grants in Aid for Scientific Research KAKENHI from the Japan Society for the Promotion of Science (JP18H03372, JP21H02399, JP20H00629 and JP23H00516}、日本科学技术振兴机构的JST FOREST计划(JST FOREST Program JPMJFR221E at the Japan Science and Technology Agency)、上原纪念基金会的科学研究基金(Science Research Grant from The Uehara Memorial Foundation)、铃木纪念基金会的研究基金(research grant from Suzuken Memorial Foundation)以及武田科学基金会的医学研究基金(medical research grants from Takeda Science Foundation)的资助。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
DNA–protein crosslinks (DPCs) induced by aldehydes interfere with replication and transcription. Hereditary deficiencies in DPC repair and aldehyde clearance processes cause progeria, including Ruijs–Aalfs syndrome (RJALS) and AMeD syndrome (AMeDS) in humans. Although the elimination of DPC during replication has been well established, how cells overcome DPC lesions in transcription remains elusive. Here we show that endogenous aldehyde-induced DPC roadblocks are efficiently resolved by transcription-coupled repair (TCR). We develop a high-throughput sequencing technique to measure the genome-wide distribution of DPCs (DPC-seq). Using proteomics and DPC-seq, we demonstrate that the conventional TCR complex as well as VCP/p97 and the proteasome are required for the removal of formaldehyde-induced DPCs. TFIIS-dependent cleavage of RNAPII transcripts protects against transcription obstacles. Finally, a mouse model lacking both aldehyde clearance and TCR confirms endogenous DPC accumulation in actively transcribed regions. Collectively, our data provide evidence that transcription-coupled DPC repair (TC-DPCR) as well as aldehyde clearance are crucial for protecting against metabolic genotoxin, thus explaining the molecular pathogenesis of AMeDS and other disorders associated with defects in TCR, such as Cockayne syndrome.
https://blog.sciencenet.cn/blog-212210-1429818.html
上一篇:困扰了科学家将近一个世纪的数学难题,两位数学家终于解决了
下一篇:永久化学品的危机:全球水资源超过安全的PFAS限制