博文
一种全新的抗癌方法——人工DNA
||
一种全新的抗癌方法——人工DNA
诸平


昨天介绍了“设计抗癌药物的操作指南”,今天再来介绍日本东京大学(University of Tokyo) 2023年1月30日的报道,一种全新的抗癌方法:人工DNA(A Completely New Way To Kill Cancer: Artificial DNA)。相关研究结果于2022年12月20日已经在《美国化学会志》(Journal of the American Chemical Society, 简称JACS)网站发表——Kunihiko Morihiro, Hiraki Osumi, Shunto Morita, Takara Hattori, Manami Baba, Naoki Harada, Riuko Ohashi, Akimitsu Okamoto. Oncolytic Hairpin DNA Pair: Selective Cytotoxic Inducer through MicroRNA-Triggered DNA Self-Assembly. Journal of the American Chemical Society, 2023, 145(1): 135–142. DOI: 10.1021/jacs.2c08974. Publication Date: December 20, 2022. https://doi.org/10.1021/jacs.2c08974
参与此项研究的有来自日本东京大学化学与生物技术系(Department of Chemistry and Biotechnology, The University of Tokyo, Bunkyo-ku, Tokyo, Japan)、日本新泻大学医学院(Faculty of Medicine, Niigata University, Niigata, Japan)以及新泻大学医学和牙科科学研究生院(Graduate School of Medical and Dental Sciences, Niigata University, Niigata, Japan)的研究人员。
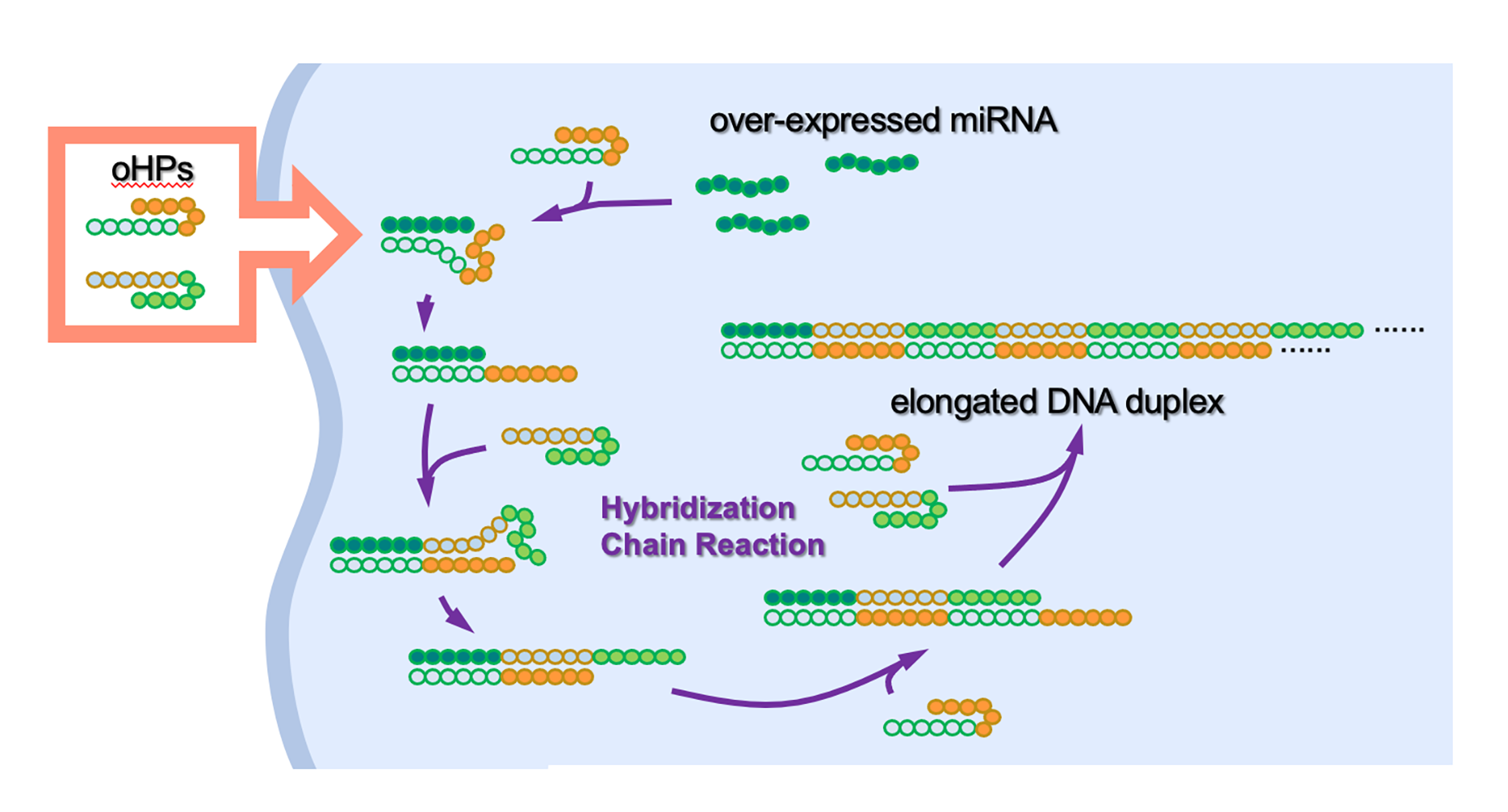
发夹状DNA(Hairpin-shaped DNA, Fig. 4)与癌细胞中的microRNA相互作用,激活免疫反应。东京大学的研究人员在使用人工DNA抗癌方面取得了突破(Fig. 1)。在实验室测试中,该方法有效地靶向并破坏了人类宫颈癌细胞(cervical cancer cells)和乳腺癌细胞(breast cancer cells),以及来自小鼠的恶性黑色素瘤细胞(malignant melanoma cells)。该团队设计了一对化学合成的DNA,形状像发夹(Fig. 4),专门用于杀死癌细胞。当注入癌细胞时,DNA对会附着在某些癌症中过量产生的microRNA (miRNA) 分子上。
此DNA对在附着到miRNA上后解开并结合,形成更长的DNA链,从而激活免疫反应。这种反应不仅消除了癌细胞,还阻止了癌细胞继续生长。这种创新方法有别于传统的癌症药物治疗,有望开创药物开发的新纪元。
癌症是一个令人遗憾的全球健康问题,目前的治疗方法有其局限性。然而,基于核酸(即 DNA和RNA,携带重要信息的分子)的药物可以控制细胞的生物学功能,有望改变医学的未来,并为战胜癌症和其他难以治愈的由病毒和遗传因素引起的疾病提供重大推动力。
由东京大学助理教授森廣邦彦(Kunihiko Morihiro)和工学研究生院的岡本晃充(Akimitsu Okamoto)教授领导的一个研究小组,受到启发,利用人工DNA创造了一种新的抗癌药物。岡本晃充说:“我们认为,如果我们能够创造出与传统药物作用机制不同的新药,它们可能对迄今为止无法治愈的癌症有效。”
用于癌症治疗的核酸药物一直具有挑战性,因为很难使核酸区分癌细胞和其他健康细胞。这意味着如果健康细胞受到无意中的攻击,就有可能对患者的免疫系统产生不利影响。然而,该团队首次能够开发出一种发夹状DNA链,可以激活自然免疫反应,靶向并杀死特定的癌细胞。
溶瘤DNA发夹对 (Oncolytic DNA hairpin pairs简称oHPs) 被引入癌细胞。当oHPs遇到引起肿瘤的过度表达的microRNA(miRNA)时,它们解开以与miRNA连接并相互连接以形成更长的DNA链。这些细长的链随后会触发免疫反应,这是人体的内在防御机制,可抑制肿瘤的进一步生长(Fig. 3)。
癌细胞会过度表达或复制过多某些DNA或RNA分子,导致它们无法正常发挥作用。该团队创建了称为oHPs的人工溶瘤(抗癌)发夹DNA对。当这些oHPs遇到在某些癌症中过度表达的被称为miR-21的短(微)RNA时,它们会被触发形成更长的DNA链。
通常,oHPs由于其弯曲的发夹形状而不会形成更长的线状链。然而,当人造oHPs进入细胞并遇到目标microRNA时,它们会打开并与之结合并形成更长的链。然后,这会导致免疫系统将过表达的miR-21的存在识别为危险,并激活先天免疫反应,最终导致癌细胞死亡。
这些测试对在人类宫颈癌衍生细胞(human cervical cancer-derived cells)、人类三阴性乳腺癌衍生细胞(human triple-negative breast cancer-derived cells)和小鼠恶性黑色素瘤衍生细胞(malignant melanoma-derived cells)中发现的过度表达的miR-21有效。“由于短 DNA oHPs和过表达的miR-21之间的相互作用,该研究小组发现了长DNA链的形成,这是其用作选择性免疫放大反应的第一个例子,可以靶向肿瘤消退,提供了一种与已知的核酸药物完全不同的新型核酸类候选药物的机制,”岡本晃充教授说。
“这项研究的结果对医生、药物发现研究人员和癌症患者来说是个好消息,因为我们相信它将为他们提供新的药物开发和药物策略选择。接下来,我们将以这项研究的结果为基础进行药物发现,并详细研究药物的功效、毒性和潜在的给药方法。” 在提供治疗方法之前,这项研究还有很多步骤要做,但该团队对核酸在新药发现的好处充满信心。
该研究由科学技术振兴机构(Japan Science And Technology Agency简称JST, JST ACT-X)、日本学术振兴会(Japan Society For Promotion Science简称JSPS, JSPS KAKENHI)、 日本医疗研究开発机构(AMED Grant)以及日立全球基金会(Hitachi Global Foundation)资助。
上述介绍,仅供参考。欲了解更多信息,敬请注意浏览原文或者相关报道。
Artificial nucleic acids have attracted much attention as potential cancer immunotherapeutic materials because they are recognized by a variety of extracellular and intracellular nucleic acid sensors and can stimulate innate immune responses. However, their low selectivity for cancer cells causes severe systemic immunotoxicity, making it difficult to use artificial nucleic acid molecules for immune cancer therapy. To address this challenge, we herein introduce a hairpin DNA assembly technology that enables cancer-selective immune activation to induce cytotoxicity. The designed artificial DNA hairpins assemble into long nicked double-stranded DNA triggered by intracellular microRNA-21 (miR-21), which is overexpressed in various types of cancer cells. We found that the products from the hairpin DNA assembly selectively kill miR-21-abundant cancer cells in vitro and in vivo based on innate immune activation. Our approach is the first to allow selective oncolysis derived from intracellular DNA self-assembly, providing a powerful therapeutic modality to treat cancer.
https://blog.sciencenet.cn/blog-212210-1374700.html
上一篇:设计抗癌药物的操作指南
下一篇:《自然》:物理学家首次在分子中观察到罕见的共振