博文
[转载]细胞因子风暴的临床特点和治疗方法
||| |
撰文 | 邓海静、谢琦(西湖大学生命科学学院)
前言:越来越多的临床证据显示细胞因子风暴造成的多器官衰竭是导致新型冠状肺炎重症病人死亡的重要因素。笔者此前从事CAR-T细胞治疗脑肿瘤的相关工作,对其引起的细胞因子风暴的一直保持密切的关注。在此,我们总结了目前细胞因子风暴的临床特点和治疗方法,希望能够为新型冠状肺炎重症病人的治疗提供一些提示和参考。 细胞因子风暴(Cytokine release syndrome,CRS),是一种全身性炎症反应,可由感染和某些药物等多种因素引发,表现为大量促炎症的细胞因子水平急剧升高【1】。“细胞因子风暴”多见于免疫系统相关疾病或者免疫相关疗法,比如CAR-T细胞疗法、器官移植以及病毒感染等。本文将对于CRS的临床症状、机制与治疗等进行简述。
1.CRS的临床症状与分子检测
CRS的临床症状和严重程度差异很大。轻度症状包括发热、疲劳、头痛、皮疹、关节痛和肌肉痛;严重症状包括高热和低血压,可进展为系统性炎症反应,伴有循环休克,血管渗漏,弥漫性血管内凝血和多器官功能衰竭等。相关的异常指标包括淋巴细胞减少、肌酐和肝酶升高、凝血参数紊乱、铁蛋白和C反应蛋白升高等【1,2】。
CRS是一种免疫系统的超敏性激活,由多种细胞参与并以释放大量细胞因子为标志【3】。CRS释放的细胞因子在不同疾病中有所差别,CAR-T治疗引发的CRS所涉及的细胞因子包括IFN-γ、IL-2、IL-2Ra、IL-6、sIL-6R、GM-CSF、IL-1、IL-10、IL-12、TNF-a、IFN-a、MCP-1、MIP-1A等【3,4】。外周血中的IL-6常被用在CART治疗以及脓毒症的细胞因子风暴检测与靶向中,由于IL-6可由TNF和IL-1β刺激产生,因此其浓度间接反映了这两种重要的早期因子的表达水平,同时也提供了综合性的下游治疗靶点【5】。在流感病毒相关的CRS中,不同的病毒引发的CRS涉及的主要因子并不完全相同。Farrar等的研究比较了18位感染H5N1病毒的患者于8位感染了季节性H1N1普通流感的患者,他们发现H5N1感染患者具有更高水平的MCP-1、CXCL10、CXCL9以及IL-8的分泌【6】。在HIN1相关的研究报道中,Kelvin DJ等发现较严重的感染者具有更高的Th1和Th17细胞因子的分泌。IL-15、IL-12p70、IL-6是危重症的标志【7】。SARS引起的细胞因子风暴主要涉及IL-1β、IL-6、IL-12、IFN-γ、IP10 以及MCP-1等,而MERS冠状病毒引起的细胞因子风暴主要与IFN-γ、TNF-α、IL-15 和IL-17相关【8-10】。Cao等对2019年新型冠状病毒COVID-19的检测发现,相对于非重症监护患者,重症监护(ICU)患者的血浆中存在更高水平的IL-2、IL-7、IL-10、G-SCF、IP10、MCP-1、MIP-1A以及TNF-α【11】(Table 1)。除了病毒各自的特异性外,宿主对病毒的易感性以及免疫系统的反应性等差异都可能改善或加重感染状况并影响临床结果。
Table 1. 不同原因诱发的CRS中涉及的主要细胞因子
诱发原因 | 细胞因子 |
CAR-T | IFN-γ,IL-2,IL-2Ra,IL-6,sIL-6R,GM-CSF,IL-1,IL-10,IL-12,TNF-a,IFN-a,MCP-1,MIP-1A |
H5N1 | MCP-1,CXCL10,CXCL9,IL-8 |
HIN1 | IL-8,IL-9,IL-17,IL-6,TNF-α,IL-15,IL-12p70,IL-6 |
SARS | IL-1β,IL-6,IL-12,IFN-γ,IP10,MCP-1 |
MERS | IFN-γ,TNF-α,IL-15,IL-17 |
COVID-19 | IL-2,IL-7,IL-10,G-SCF,IP10,MCP-1,MIP-1A,TNF-α |
因此,不同治疗方式与疾病引发的CRS由于病理生理机制的差异临床表现与实验室检查可能存在一定的差异。但是尽早的寻找相关标志物并进行干涉治疗将有效的降低疾病中的病死率,提高治疗效果。
2.CRS的病理生理学机制
虽然CRS的病理生理机制尚不完全清楚,但既往研究表明,其发生过程涉及促炎与抗炎机制的平衡失调,由多种细胞间与细胞因子间的相互作用与调节紊乱导致。
病毒一旦进入宿主,可以激活细胞内的模式识别受体分子,这些模式识别受体分子可以感知病毒的遗传物质,并分别通过先天免疫细胞和适应性免疫细胞(主要为NK细胞和CD8 T细胞)激发细胞溶解性免疫反应。因此,CRS的发生与参与该过程的免疫细胞及其他细胞显著相关,可能涉及到淋巴细胞(B/T淋巴细胞和NK细胞),髓样细胞(巨噬细胞、树突状细胞和单核细胞)以及内皮细胞间的复杂网络调控,并以多种细胞因子分泌(IFN-γ,TNF-α,IL-6等)为主要标志【12】(Table 2)。
Table 2. CRS中主要细胞因子及来源细胞
细胞因子 | 主要作用 | 来源细胞 |
IFN-γ | 激活巨噬细胞,增强抗原处理,诱导上皮细胞死亡 | T 细胞and ILCs |
TNF-α | 激活成纤维细胞,刺激促炎细胞因子产生和血管生成,诱导上皮细胞死亡,介导T细胞抵抗凋亡,诱导恶病质 | 巨噬细胞,树突状细胞和T细胞 |
IL-6 | 激活T细胞,防止细胞凋亡,诱导巨噬细胞活化,招募免疫细胞,激活急性期蛋白,诱导上皮细胞增殖,促进肿瘤生长 | 巨噬细胞、成纤维细胞和T细胞 |
G-SCF | 刺激中性粒细胞的发育和分化 | 成纤维细胞和单核细胞 |
IP10 | 招募中性粒细胞,促进多种细胞因子分泌 | 单核/巨噬细胞和T淋巴细胞 |
MCP-1 | 特异性趋化激活单核/巨噬细胞 | 单核细胞、巨噬细胞、成纤维细胞、血管内皮细胞等 |
IL-1β | 激活血管内皮细胞,激活淋巴细胞,局部组织破坏,增加效应细胞浸润 | 巨噬细胞,上皮细胞 |
IL-8 | 趋化因子可招募嗜中性粒细胞、嗜碱性粒细胞、T细胞等到感染部位 | 巨噬细胞,上皮细胞 |
在适应性反应成熟前的早期抗病毒宿主防御中,浆细胞样树突状细胞专门产生高水平的I型干扰素,并与NK细胞一起发挥核心作用,但高水平的I型干扰素或与感染早期的CRS发生相关。在病毒感染的最初反应阶段,单核/巨噬细胞是进入肺泡的主要细胞,可以产生IFN-γ、TNFα、IL-6等细胞因子,也可与A型流感病毒RNA形成炎症小体,促进IL-1β和IL-18的分泌,进而招募中性粒细胞等引发炎症反应。但是,也研究表明消耗单核/巨噬细胞并不能阻止病毒感染的免疫病理现象出现,这表明它们在病毒清除中起重要作用。虽然多种免疫细胞都在病毒感染引起的炎症反应与细胞因子产生中发挥重要作用,有趣的是,Teijaro等的研究显示,内皮细胞才是细胞因子风暴的核心调控者,通过S1P1激动剂调控内皮细胞上的S1P1表达可以抑制细胞因子和先天免疫细胞募集,抑制CRS发生与发展【13】。此外,抗体可与感染细胞表面结合,诱导抗体依赖性细胞介导的细胞毒性或补体激活,因此,有报道表明补体系统也在抗病毒感染与CRS发生中发挥重要作用,或成为潜在的治疗选择【14,15】。
CRS中多种细胞因子的分泌与其临床症状密切相关。既往研究表明,IFN-γ可引起发烧、发冷、头痛、头晕和疲劳。TNF-α可引起类似IFN-γ的流感样症状,伴有发热、全身不适和疲劳,但还可引起水样腹泻、血管渗漏、心肌病、肺损伤和急性期蛋白的合成[1]。在过继性细胞治疗引发的CRS中作为重要靶点的IL-6可导致血管渗漏,激活补体和凝血级联导致弥散性血管内凝血(DIC)等严重CRS的特征性症状【16,17】。值得关注的是,IL-6很可能通过促进心肌功能障碍而导致心肌病,这种疾病在CRS患者中经常被观察到【18】。此外,内皮细胞的激活也可能是严重CRS的标志之一。内皮功能障碍可导致毛细血管渗漏,低血压,凝血障碍等症状出现【4】。
总之,CRS的病理生理学机制仍有待进一步探究,该过程中的主要调节细胞与因子,以及参与调节的细胞在病毒清除与CRS发生中的多重身份需要更深入的研究明确。
3.CRS的综合治疗
目前,由于对CRS病理生理机制的认识有限,CRS的临床管理仍然具有挑战性,主要依靠专家的经验性疗法。美国国家癌症研究所提出的CTCAE v4.0制定了与抗体治疗相关的CRS的分级系统,为了最大限度地提高免疫治疗的疗效,同时最小化CRS危及生命的并发症出现的风险,Daniel W等提出了一种新的CRS严重程度分级系统,定义了5个级别的CRS,并根据该系统来指导治疗用药【19】(Table 3)。
Table 3. CRS分级系统与治疗指南
分级 | 症状 | 治疗 |
1级 | 症状不危及生命,只需要对症治疗,如发烧、恶心、疲劳、头痛、肌痛、不适; | 对症治疗; 维护静脉输液 |
2级 | 症状需要适度的干预并产生反应。需氧量<40%或低血压对液体或低剂量的抗利尿激素有反应或二级器官毒性; | 密切监测(心脏功能);低血压应及时用0.9%生理盐水静脉输液;其他症状对症处理。此外,推荐使用托珠单抗或西妥昔单抗 |
3级 | 症状需要积极的干预并有反应。需氧量≥40%或低血压需要高剂量或多种血管升压药或3级器官毒性或4级转氨酶升高; | 密切监测(心脏功能);重症监护病房进行1:1护理;同时使用抗IL -6治疗和糖皮质激素 |
4级 | 危及生命的症状。呼吸机支持或四级器官毒性(不包括转氨酶升高); | 机械通气;免疫抑制剂,同时使用抗IL -6治疗和糖皮质激素;按标准指南对症处理器官毒性 |
5级 | 死亡 |
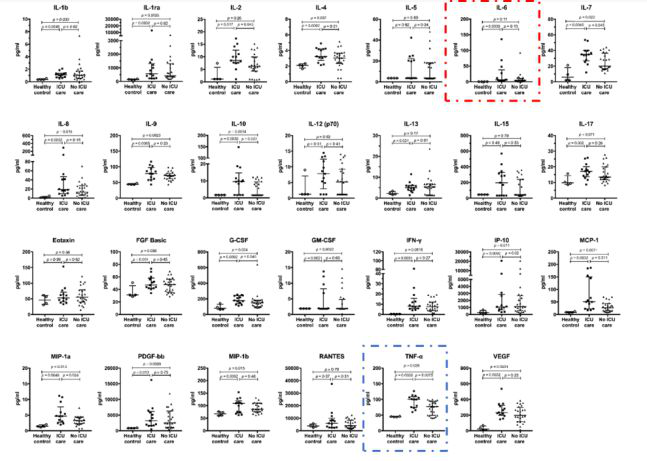
目前,大部分CRS临床管理经验都来自于免疫治疗尤其是过继性细胞治疗所引发的CRS症状,在流感病毒感染当中,该类症状没有明确的治疗指南,但是也相应的借鉴免疫治疗的管理办法。刘强等概述了目前在大流感中应用的免疫调节剂,包括:糖皮质激素、过氧化物酶体增殖物激活受体激动剂、鞘氨醇-1-磷酸酯受体激动剂、环氧化酶抑制剂、抗氧化剂、抗肿瘤坏死因子治疗、静脉注射免疫球蛋白以及其他疗法(包括血管紧张素转换酶抑制剂;CCR抑制剂;腺苷酸活化蛋白激酶激动剂;OX40单抗;细胞因子信号转导抑制因子;大环内酯类抗生素以及中草药等)【20】。此外,当下有大量新兴注册临床试验针对流感感染中的CRS治疗。针对IL6的托珠单抗已经登记了一项在新型冠状病毒肺炎(COVID-19)中的有效性及安全性的多中心、随机对照临床研究(注册号:ChiCTR2000029765 ),但是Cao等对2019年新型冠状病毒肺炎病人的细胞因子检测的结果却显示重症病人和轻症病人相比,IL6水平变化并不显著(ICU vs Non-ICU,p=0.13)【11】(图1)。因为前期检测的样本数较少(ICU:n=13, Non-ICU:n=28),此有必要继续检测的样本量,筛选合适的病人进行临床试验。由于CD24Fc可以有效的降低重度急性移植物抗宿主病以及能够有效控制SIV病毒引发的炎症细胞因子释放和炎症细胞浸润,也拟申请进行新型冠状病毒肺炎的治疗【21,22】。值得关注的是,目前COVID-19治疗中采用的治愈者血浆治疗制备中和抗体的方法,在SARS、H5N1与H1N1等流感治疗中广泛使用【23,24】。研究报道,恢复期血浆治疗也可以减少血清中细胞因子反应,降低病死率【25】。但同时,由中和抗体激发的免疫反应也有可能诱导CRS的发生。此外,李兰娟院士主导的“人工肝”技术对于COVID-19引起的细胞因子风暴的治疗也已经显示出一定的疗效。
图1. 健康对照组、ICU患者和非ICU患者血浆细胞因子和趋化因子水平。红色:血浆IL-6水平;蓝色:血浆TNF-α水平。【11】
虽然不断深入的探究提供了更多的药物选择,但是针对CRS发展的不同阶段以及出现的不同症状选择合适的药物仍存在问题,而且药物限制CRS发生发展的效果并不稳定。Russell等的研究表明,在COVID-19感染过程中,糖皮质激素的使用并不能缓解肺损伤进展【26】。而且值得注意的是,许多参与CRS过程的细胞因子也可能有助于病毒清除,Katze等的研究发现,IL-1受体缺失的小鼠在H5N1感染后预后更差,这说明IL-1受体通路参与急性炎症反应并发挥积极的防御作用【27】。因此,如何平衡抗病毒与抑制CRS症状的治疗仍需要有更详尽的研究去细节化临床用药。此外,结合Cao等对本次新型冠状病毒COVID-19感染患者的临床检测可知,TNF-α分泌在重症监护患者与非重症监护患者间水平差异显著,或可成为有效的抑制感染患者病情进展的靶点,英夫利昔单抗或者乌司他丁的使用有望缓解COVID-19引起的CRS症状【28,29】(图1)。但是,既往在H5N1病毒感染中有研究报道,TNF受体缺失的小鼠或者使用TNF抗体治疗的小鼠,相较于对照组并没有展现出生存优势【30】。虽然不同病毒感染诱导的CRS可能存在区别,但是这也提示我们不同诱发因素导致的CRS治疗手段可能存在差异,并且不同患者针对同一治疗也可能存在较大的个体异质性。因此,除却新型药物的筛选与研发外,如何寻找到有效的疗效预测因子、建立风险评估模型等,在临床用药指导中至关重要。
4.结语与展望
无论是SARS、MERS还是这次的新型冠状肺炎COVID-19,CRS的出现都是导致患者死亡的重要原因,因此,对其病理生理学机制、临床标志物以及治疗方式的探究对降低感染者死亡率尤其重要。除此之外,值得注意的是病毒的清除依赖于宿主免疫系统及细胞因子调节,而该过程过度激活则会引发CRS,因此,如何平衡病毒感染中的生理性免疫反应与病理性CRS发生是治疗过程中亟待解决的问题。是否使用免疫激活药物,如何监测与评估免疫激活药物的疗效?CRS发生过程中如何使用免疫调节药物,如何平衡感染者的CRS症状与病毒负荷?免疫调节是否会影响病毒的抗原漂移与抗原转变等,这些不仅是当下面对新型冠状病毒肺炎COVID-19需要解决的问题,同时也是在多种可引发CRS的治疗中需要考虑的问题,未来仍需通过临床样本的密切跟踪与检测,结合更深入的基础实验探究来认识与治疗CRS,以提高患者的生存获益。
参考文献
1.Shimabukuro-Vornhagen, A., et al., Cytokine release syndrome. J Immunother Cancer, 2018. 6(1): p. 56.
2.Chousterman, B.G., F.K. Swirski, and G.F. Weber, Cytokine storm and sepsis disease pathogenesis. Semin Immunopathol, 2017. 39(5): p. 517-528.
3.Hay, K.A., Cytokine release syndrome and neurotoxicity after CD19 chimeric antigen receptor-modified (CAR-) T cell therapy. Br J Haematol, 2018. 183(3): p. 364-374.
4.Hay, K.A., et al., Kinetics and biomarkers of severe cytokine release syndrome after CD19 chimeric antigen receptor-modified T-cell therapy. Blood, 2017. 130(21): p. 2295-2306.
5.Abraham, E., et al., p55 Tumor necrosis factor receptor fusion protein in the treatment of patients with severe sepsis and septic shock. A randomized controlled multicenter trial. Ro 45-2081 Study Group. JAMA, 1997. 277(19): p.1531-8.
6.de Jong, M.D., et al., Fatal outcome of human influenza A (H5N1) is associated with high viral load and hypercytokinemia. Nat Med, 2006. 12(10): p.1203-7.
7.Bermejo-Martin, J.F., et al., Th1 and Th17 hypercytokinemia as early host response signature in severe pandemic influenza. Crit Care, 2009. 13(6): p.R201.
8.Kindler, E., V. Thiel, and F. Weber, Interaction of SARS and MERS Coronaviruses with the Antiviral Interferon Response. Adv Virus Res, 2016. 96: p.219-243.
9.Channappanavar, R., et al., Dysregulated Type I Interferon and Inflammatory Monocyte-Macrophage Responses Cause Lethal Pneumonia in SARS-CoV-Infected Mice. Cell Host Microbe, 2016. 19(2): p.181-93.
10.Channappanavar,R.and S. Perlman,Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology. Semin Immunopathol, 2017.39(5): p.529-539.
11.Huang, C., et al., Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 2020.
12.Neurath, M.F., Cytokines in inflammatory bowel disease. Nat Rev Immunol, 2014. 14(5): p. 329-42.
13.Teijaro, J.R., et al., Endothelial cells are central orchestrators of cytokine amplification during influenza virus infection. Cell, 2011. 146(6): p. 980-91.
14.Sicca, F., S. Neppelenbroek, and A. Huckriede, Effector mechanisms of influenza-specific antibodies: neutralization and beyond. Expert Rev Vaccines, 2018. 17(9): p. 785-795.
15.Koupenova, M., et al., The role of platelets in mediating a response to human influenza infection. Nat Commun, 2019. 10(1): p. 1780.
16.Tanaka, T., M. Narazaki, and T. Kishimoto, Immunotherapeutic implications of IL-6 blockade for cytokine storm. Immunotherapy, 2016. 8(8): p. 959-70.
17.Hunter, C.A. and S.A. Jones, IL-6 as a keystone cytokine in health and disease. Nat Immunol, 2015. 16(5): p. 448-57.
18.Pathan, N., et al., Role of interleukin 6 in myocardial dysfunction of meningococcal septic shock. Lancet, 2004. 363(9404): p. 203-9.
19.Lee, D.W., et al., Current concepts in the diagnosis and management of cytokine release syndrome. Blood, 2014. 124(2): p. 188-95.
20.Liu, Q., Y.H. Zhou, and Z.Q. Yang, The cytokine storm of severe influenza and development of immunomodulatory therapy. Cell Mol Immunol, 2016. 13(1): p. 3-10.
21.Wilhelm, K., et al., Graft-versus-host disease is enhanced by extracellular ATP activating P2X7R. Nat Med, 2010. 16(12): p. 1434-8.
22.Tian, R.R., et al., CD24 and Fc fusion protein protects SIVmac239-infected Chinese rhesus macaque against progression to AIDS. Antiviral Res, 2018. 157: p. 9-17.
23.Zhou, B., N. Zhong, and Y. Guan, Treatment with convalescent plasma for influenza A (H5N1) infection. N Engl J Med, 2007. 357(14): p. 1450-1.
24.Cheng, Y., et al., Use of convalescent plasma therapy in SARS patients in Hong Kong. Eur J Clin Microbiol Infect Dis, 2005. 24(1): p. 44-6.
25.Hung, I.F., et al., Convalescent plasma treatment reduced mortality in patients with severe pandemic influenza A (H1N1) 2009 virus infection. Clin Infect Dis, 2011. 52(4): p. 447-56.
26.Chen, N., et al., Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet, 2020.
27.Tisoncik, J.R., et al., Into the eye of the cytokine storm. Microbiol Mol Biol Rev, 2012. 76(1): p. 16-32.
28.Goujon, C., H. Bachelez, and d. Groupe de recherche sur le psoriasis de la Societe francaise de, [Infliximab]. Ann Dermatol Venereol, 2019. 146(6-7): p. 483-486.
29.Kanai, T., et al., Ulinastatin, a urinary trypsin inhibitor, for the initial treatment of patients with Kawasaki disease: a retrospective study. Circulation, 2011. 124(25): p. 2822-8.
30.Peiris, J.S., et al., Innate immune responses to influenza A H5N1: friend or foe? Trends Immunol, 2009. 30(12): p. 574-84.
https://blog.sciencenet.cn/blog-279293-1219100.html
上一篇:这疗效,没办法统计
下一篇:[转载]中国科大新冠肺炎“炎症风暴”研究重大进展:发现有效阻断药物