博文
[转载]Ab-PROTAC偶联物可选择性降解HER2+细胞系中受体相互作用的RIPK2
||
蛋白酶降解靶向嵌合物(PROTACs)是一类异双功能分子,目前正在实现其作为靶向蛋白质降解的治疗策略的潜力。然而,现有设计的缺陷是缺乏对蛋白质降解有效载荷的细胞选择性靶向。本文报道了Burley团队发表的一篇关于HER2+细胞系中受体相互作用丝氨酸/苏氨酸蛋白激酶2(RIPK2)的细胞靶向降解方法,实现PROTAC骨架的细胞选择性传递的潜力。
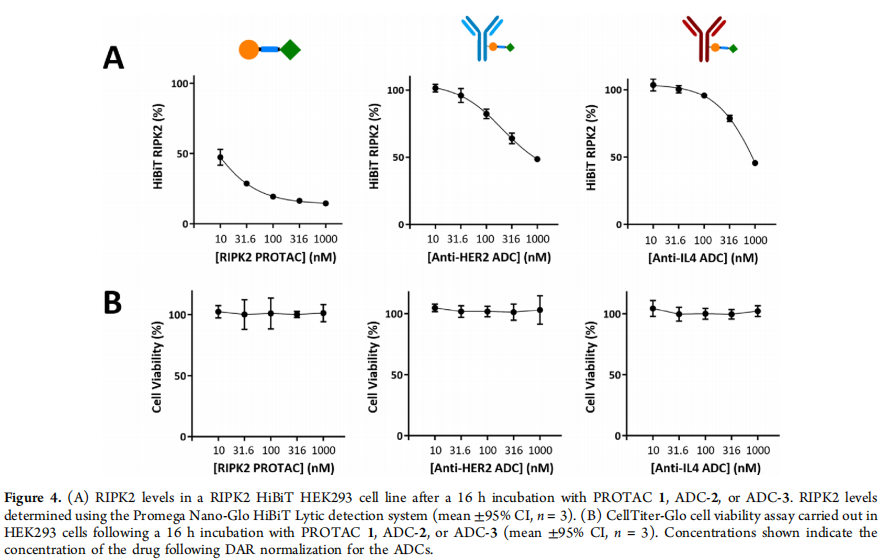
蛋白水解靶向嵌合体(PROTACs)是一种异双功能分子,可以选择性地降解目标蛋白(POI)。[1,2]PROTACs的作用机制(MoA)是POI和E3连接酶形成三元复合物,然后给靶蛋白打上泛素化的标签,随后通过泛素−蛋白酶体途径降解。[3,4]这些蛋白质降解剂的一个特点是其降解过程具有催化性质,使得PROTAC从三元复合物解离后能够再循环利用。这种独特的作用机制相较于传统的非共价抑制具有更持久的药理效应,在体内使用剂量较低。[5−9]与传统的抑制剂策略相比,PROTACs的另一个优势是最终需要与POI结合并进行降解,而不是通过与小分子的化学计量相互作用来调节蛋白质功能。[10] 目前,PROTACs应用的一个主要缺陷是缺乏细胞选择性和可变的细胞渗透性,[11]这反映在其次优的药代动力学特性上。[12,13]细胞靶向模块融入PROTAC设计中,可以将PROTAC载荷输送到所需的细胞类型,并降低脱靶毒性(Figure1A)。 一种新兴的细胞选择性递送PROTACs平台是将其与抗体(Ab)结合。[14]抗体药物偶联物(ADCs)选择性地将分子载荷(如PROTAC)传递到特定的细胞类型,从而避免了对PROTAC骨架的细胞摄取进行大量优化的需求(Figure1B)。虽然已经开发出了Ab-PROTAC用于细胞选择性降解BRD4和ERα的研究,[15−17]但连接化学(可裂解vs不可裂解)、药物在目标细胞中的积累以及通过Ab结合可靶向多样的POI的影响仍处于起步阶段。在这里,作者扩展了Ab-PROTAC结合物的范围,并展示了在HER2+细胞系中对丝氨酸和苏氨酸蛋白激酶2(RIPK2)的细胞选择性和靶向性降解(Figure1C)。 作者通过二硫化物重连试剂(二溴吡嘧啶二酮,diBrPD),将RIPK2 PROTAC分别与抗HER2单克隆抗体(mAb),曲妥珠单抗,和抗IL-4帕索利珠单抗(阴性对照)偶联起来,分别得到了ADC-2和ADC-3。在SKOV3 HER2+卵巢癌细胞系中评估了使用ADC-2和ADC-3对RIPK2的降解作用。与原始PROTAC相比,抗HER2的ADC-2显示出类似的RIPK2降解水平,而抗IL-4的ADC-3在10nM浓度下没有发生降解。意外发现是,在100nM以上的浓度下使用ADC-3进行RIPK2降解(Figure3A)。由于SKOV3细胞没有膜结合的IL-4,观察到的降解可能是由于非特异性摄取机制,可能是巨噬细胞吞噬作用所致。[18] 为了证实RIPK2降解是通过泛素−蛋白酶体途径发生的,作者在SKOV3细胞中加入已知的蛋白酶体抑制剂MG132(浓度为10μM),然后用PROTAC 1、ADC-2或ADC-3处理细胞,没有观察到任何化合物的降解,这证实了降解是通过蛋白酶体依赖的途径发生的(Figure3C)。在ADC-1和ADC-2在1μM范围内均未观察到细胞毒性(Figure3D),也排除连接子的不稳定性导致PROTAC的过早释放。 然后在HEK293 HER2-细胞系中使用HiBiT实验检测ADC-2和ADC-3的细胞选择性靶向性。这两个ADC-2和ADC-3在较高浓度下表现出RIPK2的降解,当浓度超过100nM时,降解效果更为显著。 这与在SKOV3细胞中观察到的类似降解可能是由于非特异性细胞摄取的事实相一致。重要的是,与使用PROTAC 1时降解50%相比,两种偶联物在10nM时均未观察到降解(Figure 4A)。同样,所有化合物均未观察到细胞毒性(Figure 4B)。 总之,作者通过使用Ab-PROTAC偶联物,在HER2+SKOV3细胞中展示了对RIPK2的细胞选择性降解。这种方法补充了ADC的发展,并且为使用具有次优物理化学性质的PROTAC或需要在特定细胞中选择性传递PROTAC载荷的情况下提供了设计策略,为药物开发和治疗提供了新的可能性。 (1) Békés, M.; Langley, D. R.; Crews, C. M. PROTAC targeted protein degraders: the past is prologue. Nat. Rev. Drug Discovery 2022,21 (3), 181−200. (2) Diehl, C. J.; Ciulli, A. Discovery of small molecule ligands for the von Hippel-Lindau (VHL) E3 ligase and their use as inhibitors and PROTAC degraders. Chem. Soc. Rev. 2022, 51 (19), 8216−8257. (3) Sakamoto, K. M.; Kim, K. B.; Kumagai, A.; Mercurio, F.; Crews, C. M.; Deshaies, R. J. PROTACs: chimeric molecules that target proteins to the Skp1-Cullin-F box complex for ubiquitination and degradation. Proc. Natl. Acad. Sci. U. S. A. 2001, 98 (15), 8554−8559. (4) Bondeson, D. P.; Mares, A.; Smith, I. E. D.; Ko, E.; Campos, S.; Miah, A. H.; Mulholland, K. E.; Routly, N.; Buckley, D. L.; Gustafson, J. L.; Zinn, N.; Grandi, P.; Shimamura, S.; Bergamini, G.; FaelthSavitski, M.; Bantscheff, M.; Cox, C.; Gordon, D. A.; Willard, R. R.; Flanagan, J. J.; Casillas, L. N.; Votta, B. J.; den Besten, W.; Famm, K.; Kruidenier, L.; Carter, P. S.; Harling, J. D.; Churcher, I.; Crews, C. M. Catalytic in vivo protein knockdown by small-molecule PROTACs. Nat. Chem. Biol. 2015, 11 (8), 611−617. (5) Yan, J.; Li, T.; Miao, Z.; Wang, P.; Sheng, C.; Zhuang, C. Homobivalent, Trivalent, and Covalent PROTACs: Emerging Strategies for Protein Degradation. J. Med. Chem. 2022, 65 (13), 8798−8827. (6) Nemec, V.; Schwalm, M. P.; Muller, S.; Knapp, S. PROTAC degraders as chemical probes for studying target biology and target validation. Chem. Soc. Rev. 2022, 51 (18), 7971−7993. (7) Burslem, G. M.; Smith, B. E.; Lai, A. C.; Jaime-Figueroa, S.; McQuaid, D. C.; Bondeson, D. P.; Toure, M.; Dong, H. Q.; Qian, Y. M.; Wang, J.; Crew, A. P.; Hines, J.; Crews, C. M. The Advantages of Targeted Protein Degradation Over Inhibition: An RTK Case Study. Cell Chem. Biol. 2018, 25 (1), 67−77. (8) Tinworth, C. P.; Lithgow, H.; Dittus, L.; Bassi, Z. I.; Hughes, S. E.; Muelbaier, M.; Dai, H.; Smith, I. E. D.; Kerr, W. J.; Burley, G. A.; Bantscheff, M.; Harling, J. D. PROTAC-Mediated Degradation of Bruton’s Tyrosine Kinase Is Inhibited by Covalent Binding. ACS Chem. Biol. 2019, 14 (3), 342−347. (9) Schneider, M.; Radoux, C. J.; Hercules, A.; Ochoa, D.; Dunham, I.; Zalmas, L.-P.; Hessler, G.; Ruf, S.; Shanmugasundaram, V.; Hann, M. M.; Thomas, P. J.; Queisser, M. A.; Benowitz, A. B.; Brown, K.; Leach, A. R. The PROTACtable genome. Nat. Rev. Drug Discovery 2021, 20, 789−797. (10) Shimokawa, K.; Shibata, N.; Sameshima, T.; Miyamoto, N.; Ujikawa, O.; Nara, H.; Ohoka, N.; Hattori, T.; Cho, N.; Naito, M. Targeting the Allosteric Site of Oncoprotein BCR-ABL as anAlternative Strategy for Effective Target Protein Degradation. ACS Med. Chem. Lett. 2017, 8 (10), 1042−1047. (11) Yokoo, H.; Naito, M.; Demizu, Y. Investigating the cell permeability of proteolysis-targeting chimeras (PROTACs). Expert. Opin. Drug Discovery 2023, 18 (4), 357−361. (12) Benowitz, A. B.; Scott-Stevens, P. T.; Harling, J. D. Challenges and opportunities for in vivo PROTAC delivery. Future Med. Chem. 2022, 14 (3), 119−121. (13) Guenette, R. G.; Yang, S. W.; Min, J.; Pei, B.; Potts, P. R. Target and tissue selectivity of PROTAC degraders. Chem. Soc. Rev. 2022, 51 (14), 5740−5756. (14) Dragovich, P. S. Degrader-antibody conjugates. Chem. Soc. Rev. 2022, 51 (10), 3886−3897. (15) Dragovich, P. S.; Pillow, T. H.; Blake, R. A.; Sadowsky, J. D.; Adaligil, E.; Adhikari, P.; Chen, J. H.; Corr, N.; Dela Cruz-Chuh, J.; Del Rosario, G.; Fullerton, A.; Hartman, S. J.; Jiang, F.; Kaufman, S.; Kleinheinz, T.; Kozak, K. R.; Liu, L. L.; Lu, Y.; Mulvihill, M. M.; Murray, J. M.; O’Donohue, A.; Rowntree, R. K.; Sawyer, W. S.; Staben, L. R.; Wai, J.; Wang, J.; Wei, B. Q.; Wei, W. T.; Xu, Z. J.; Yao, H.; Yu, S. F.; Zhang, D. L.; Zhang, H. Y.; Zhang, S. H.; Zhao, Y. X.; Zhou, H.; Zhu, X. Y. Antibody-Mediated Delivery of Chimeric BRD4 degraders. Part 2: Improvement of In Vitro Antiproliferation Activity and In Vivo Antitumor Efficacy. J. Med. Chem. 2021, 64 (5), 2576−2607. (16) Dragovich, P. S.; Adhikari, P.; Blake, R. A.; Blaquiere, N.; Chen, J.; Cheng, Y. X.; den Besten, W.; Han, J.; Hartman, S. J.; He, J.; He, M.; Rei Ingalla, E.; Kamath, A. V.; Kleinheinz, T.; Lai, T.; Leipold, D.; Li, C. S.; Liu, Q.; Lu, J.; Lu, Y.; Meng, F.; Meng, L.; Ng, C.; Peng, K.; Lewis Phillips, G.; Pillow, T. H.; Rowntree, R. K.; Sadowsky, J. D.; Sampath, D.; Staben, L.; Staben, S. T.; Wai, J.; Wan, K.; Wang, X.; Wei, B.; Wertz, I. E.; Xin, J.; Xu, K.; Yao, H.; Zang, R.; Zhang, D.; Zhou, H.; Zhao, Y. Antibody-mediated delivery of chimeric protein degraders which target estrogen receptor alpha (ERα). Bioorg. Med.Chem. Lett. 2020, 30 (4), No. 126907. (17) Maneiro, M. a.; Forte, N.; Shchepinova, M. M.; Kounde, C. S.;Chudasama, V.; Baker, J. R.; Tate, E. W. Antibody−PROTAC Conjugates Enable HER2-Dependent Targeted Protein Degradation of BRD4. ACS Chem. Biol. 2020, 15 (6), 1306−1312. (18) Commisso, C. The pervasiveness of macropinocytosis in oncological malignancies. Philos. Trans. R. Soc. London B 2019, 374 (1765), 20180153.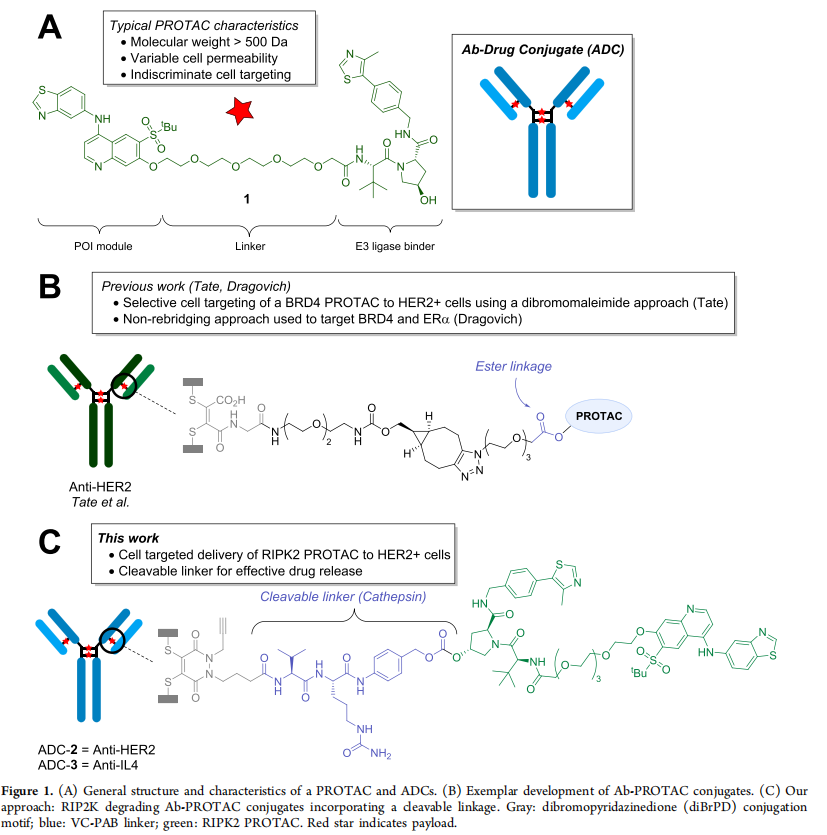

参考文献
https://blog.sciencenet.cn/blog-3543934-1411879.html
上一篇:[转载]AIE核心分子四苯基乙烯(TPE)衍生物的应用进展
下一篇:[转载]不对称CuAAC反应的“秘密武器”---新型大位阻PYBOX配体