博文
Science子刊: 花非花,雾非雾 抑郁去,肥胖来
||
代谢学人
Science子刊:花非花,雾非雾 抑郁去,肥胖来撰文 | 游俊丰 程诗淼 高铭远 生茂正 郭盈盈 于剑
编辑 | 孟美瑶
校对 | 于剑

背景介绍
精神障碍,包括精神分裂症、分裂情感障碍、短暂性精神障碍和妄想障碍,是严重影响精神疾病患者精神健康的主要健康问题。目前临床上主要使用的是第二代非典型抗精神病药物进行治疗,包括氯氮平、齐拉西酮、帕利哌酮、奥氮平和利培酮,尽管这些药物在治疗精神健康障碍方面非常有效,但同时也带来了一些代谢副作用,例如肥胖和高脂血症。
目前研究发现抗精神病药物作用于机体后影响关键的下丘脑食欲调节神经元,进而导致暴饮暴食。除了神经回路受到影响外,炎症也被报道参与抗精神病药物引起的代谢紊乱,抗精神病药物的长期治疗会促进巨噬细胞浸润,诱导外周组织和中枢神经系统产生炎症反应,因此减轻抗精神病药物副作用的研究主要集中在神经元接触过程和炎症相关过程。已有研究发现使用5-羟色胺受体 2C-特异性激动剂治疗可以逆转奥氮平导致的体重增加和高脂血症,此外使用四环素类抗生素二甲胺四环素抑制机体炎症也可以在奥氮平治疗中减轻体重增加和高血糖。
瘦素是一种主要由脂肪组织分泌的激素,其循环水平与体脂量比例或热量摄入量成正比,对能量摄入的急剧变化十分敏感,在禁食仅3天后降至10%至20%,瘦素主要结合大脑中的瘦素受体,进而降低食欲、增加能量消耗、减轻体重,因此瘦素被认为是调节机体新陈代谢和能量稳态的重要因子。此外,也有研究发现瘦素作用于外周会促进免疫系统T、B细胞发育及炎症因子产生。近期的一些临床研究中发现在接受抗精神病药物治疗的患者中,其机体循环瘦素在体重大量增加之前迅速增加,因此瘦素可能与药物诱导的体重增加和代谢恶化有因果关系,但是瘦素在抗精神病药物诱导代谢恶化的过程中所发挥的作用尚未研究清楚,为了解决这一问题,美国德克萨斯大学西南医学中心的Philipp E. Scherer团队进行相关研究,其成果“Hyperleptinemia contributes to antipsychotic drug-associated obesity and metabolic disorders”近期发表在Science Translational Medicine上,该研究发现抗精神病药物诱发的高瘦素血症是治疗相关体重增加和代谢功能障碍的关键因素,并且高瘦素血症发生在小鼠体重增加之前,而通过单克隆瘦素中和抗体(LepAb)降低瘦素水平至少可以部分减轻药物诱导的肥胖并防止代谢功能障碍。

敲黑板啦!
1、抗精神病药物处理后机体循环瘦素水平增加
2、利培酮处理导致体重增加和葡萄糖不耐受
3、中和瘦素可以抵抗利培酮引起的体重增加并改善葡萄糖耐受性
4、中和瘦素可以减轻利培酮引起的器官功能障碍和机体炎症
5、中和瘦素可以抑制利培酮引起的乳腺导管发育
研究结果
1、 奥氮平诱导的体重增加表现为瘦素水平上调
目前已有研究表明,奥氮平会导致雌鼠体重大幅增加。然而研究人员在使用奥氮平处理小鼠的过程中发现,部分雌鼠容易肥胖,但也有部分雌鼠能够抵抗肥胖(图S1A)(小编注:本研究使用的小鼠为C57雌鼠,研究人员使用奥氮平随机喂养共40只小鼠,对体重进行监测后,选取体重最大的8只小鼠和体重最小的8只小鼠,整理体重数据后绘制图S1A)。为了探究是哪种因素影响小鼠体重增加程度,研究人员对奥氮平处理后容易肥胖(后文简称为“易胖”)小鼠和抵抗肥胖(后文简称为“抵抗”)小鼠的性腺脂肪进行基因表达分析,发现与抵抗小鼠相比,易胖小鼠编码瘦素基因表达水平显著增加,编码脂联素基因表达水平显著降低(图S1E、F),而其他基因例如乙酰辅酶A羧化酶-1(Acetyl CoA carboxylase, Acc1)、脂肪酸合成酶(Fatty acid synthase, Fasn)、肉碱棕榈酰转移酶1A(Carnitine palmitoyltransferase 1A, Cpt1a)在易胖小鼠和抵抗小鼠之间也具有差异性(图S1B-D)。这些结果揭示了在奥氮平诱导体重增加的过程中瘦素可能发挥重要作用。
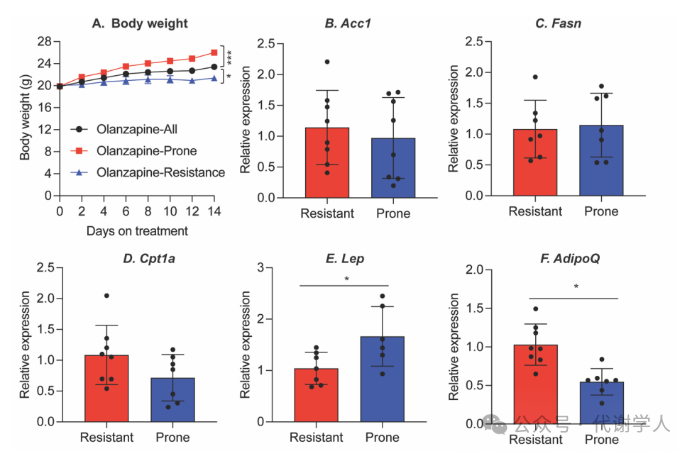
图S1.瘦素和脂联素可区分奥氮平治疗的易胖小鼠和肥胖抵抗小鼠
2、 在利培酮和奥氮平处理的小鼠中高瘦素血症发生在体重增加之前
为了阐明抗精神病药物利培酮和奥氮平导致体重增加的潜在机制,研究人员使用HFD饮食喂养年轻的雌性小鼠,同时补充奥氮平或利培酮,这种小鼠模型复刻了抗精神病药物诱导的体重增加和高血糖的表型。已有临床研究发现服用抗精神病药物的患者瘦素水平迅速上调,因此研究人员检测了急性奥氮平和利培酮处理后小鼠的瘦素浓度,发现服用奥氮平或利培酮的小鼠循环瘦素水平在药物处理后3天内迅速增加,但体重和累积摄食量没有显著变化(图1A-C)。同时研究人员也证实了服用奥氮平或利培酮的小鼠SAT和GAT中瘦素的基因表达水平显著上调(图1D、E)。研究人员进一步观察发现药物处理小鼠的SAT中编码脂联素基因表达减少,但GAT中并未发生显著变化,这说明不同脂肪组织中瘦素和脂联素水平存在差异(图1F、G)。此外,研究人员发现药物处理小鼠的SAT和GAT中巨噬细胞标记物F4/80基因表达水平显著上调,说明两种脂肪库中巨噬细胞均显著增加(图1H、I),并且利培酮的促炎作用强于奥氮平。基于这些数据,研究人员选择利培酮来进一步探究抗精神病药物对体重和全身代谢产生的不良副作用中瘦素所发挥的作用。
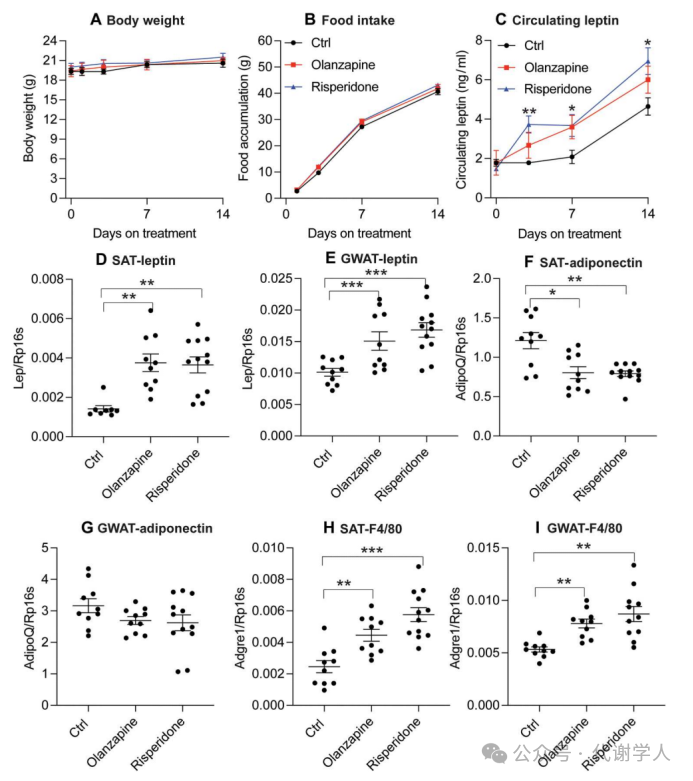 图1.急性奥氮平和利培酮处理对小鼠体重、食物摄入量和循环瘦素的影响
图1.急性奥氮平和利培酮处理对小鼠体重、食物摄入量和循环瘦素的影响
3、 中和瘦素可以抵抗利培酮引起的体重增加并改善机体葡萄糖耐受性
缓解高瘦素血症有助于抵抗利培酮等抗精神病药物引起的体重增加并改善葡萄糖耐受性,因此研究人员认为中和过量的瘦素可以减少药物副作用。研究人员首先检测了LepAb中和瘦素的效果,他们使用长型瘦素受体(小编注:瘦素受体存在选择性剪接,因此可以产生至少五种不同的变体,每种变体具有不同长度的胞内段。长型瘦素受体(ObRb)具有完整胞内段,主要分布于下丘脑和海马组织,负责调控下丘脑细胞的代谢活性和机体内分泌功能。该受体包含与其它蛋白相互作用所需要的各个亚基,被认为是重要的瘦素功能受体。此种亚型能传导瘦素信号通路并调节热量摄入和能量消耗。而其他四种短型受体(ObRa、ObRc、ObRd和ObRf)则与瘦素由脉络丛通过血脑屏障的过程有关。当与Leptin二聚体结合后,ObRb二聚体会与短型受体形成四聚体复合物,从而传递信号。此外,机体内还存在游离的ObRe受体,其不包含细胞内和细胞质结构域,并作为可溶性受体分泌到血液中发挥功能。)转染HEK293细胞,再使用不同浓度的瘦素以及LepAb处理细胞,最后使用p-STAT3蛋白表达水平确定瘦素作用效果,结果发现LepAb能够以剂量依赖的方式有效阻断瘦素信号通路(图S2A)。在体外研究的基础上,研究人员选择了一个最佳浓度的LepAb(1mg/kg)(小编注:从S2A的图中可以发现,体外实验发现当LepAb的浓度为100ng/ml时,瘦素的作用几乎被完全消除,但本文并未对体内实验剂量的选择进行解释。在作者所发表的其他文献中也未发现与本文选择浓度相同的注射剂量)进行体内研究,研究人员以HFD喂养小鼠,然后在急性LepAb治疗前后对小鼠进行了高胰岛素-正葡萄糖钳夹实验测定小鼠的胰岛素敏感性(小编注:该方法是一种用于评估胰岛素敏感性的实验方法,在实验过程中以恒定速率输注胰岛素,同时补充葡萄糖维持血糖水平,通过测定外源性葡萄糖输注率来确定在机体胰岛素—葡萄糖代谢平衡状态下的胰岛素敏感性)。在LepAb治疗前,所有小鼠的葡萄糖输入速率无显著差异(图S2B),在急性LepAb治疗16小时后,小鼠的葡萄糖输入率显著增加(图S2B),表明小鼠胰岛素敏感性增加。这些结果表明,LepAb可以有效地结合循环瘦素,并在短时间内迅速抑制瘦素信号通路。
拓展阅读
瘦素的两面性
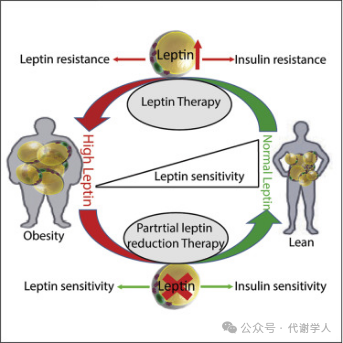
体内瘦素的表达在不同的情况下造成了不同的结果。在瘦素敏感性较高的状态下,循环瘦素水平较低。这种情况下瘦素的作用和经典模型相一致,即低瘦素传递能量不足信号至中枢,促使机体增加食物摄入量并降低能量消耗(如ob/ob鼠)。此外,瘦素信号可通过刺激肌肉等组织的AMPK活化,从而提高胰岛素敏感性。因此,通常在瘦素含量较低时,使用重组瘦素治疗可以改善葡萄糖代谢和胰岛素敏感性,降低体重。
然而,瘦素在抑制食物摄入和促进能量消耗方面的剂量范围非常狭窄,即在瘦素水平低的能量不足状态和瘦素水平略高引起的“能量充足”之间过渡。且当瘦素表达较高时,其含量往往趋于稳定,这种情况会造成中枢的瘦素敏感性降低,从而引发瘦素耐药。
瘦素耐药的情况则和瘦素不足截然相反。当瘦素长期大量表达后,可引发高瘦素血症,造成瘦素敏感性降低,此时减少瘦素可促进抗糖尿病和抗肥胖作用。在这种情况下,通过使用β3-肾上腺素能受体激动剂或二甲双胍、白藜芦醇等药物可抑制脂肪细胞分泌瘦素,恢复瘦素敏感性和胰岛素敏感性,抑制肥胖。关于这种现象目前尚未阐明其详细机制,在本文作者先前发表的文献中,猜测其机制是由于瘦素减少导致负反馈机制被去除,从而增强瘦素运输和转导,并恢复关键“代谢”神经元(如POMC和AgRP细胞)中的瘦素感应。
参考文献:
[1] Zhao S et al. Diabetes. 2020 May;69(5):823-829.
[2] Zhao S et al.Mol Metab. 2020 Jul:37:100995.
[3] Zhao S et al.Cell Metab. 2019 Oct 1;30(4):706-719.
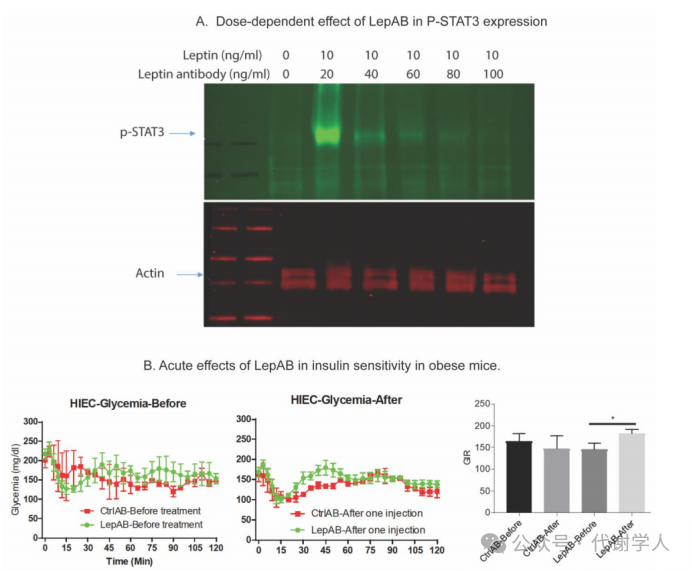
图S2.瘦素中和抗体剂量依赖性地抑制肥胖小鼠的瘦素信号通路并提高机体胰岛素敏感性
然后研究人员使用HFD喂养雌鼠同时补充利培酮。与预期相同,服用利培酮的雌鼠比只服用高脂饮食的雌鼠体重增加得更多(图2A),并且利培酮诱导的体重快速增加可能是由摄食量大幅增加引起的(图2B、C),但给利培酮饮食的小鼠服用LepAb可以减少体重增加程度,部分原因是服用LepAb后小鼠的食物摄入量减少(图2A-C)。已有研究证明利培酮处理会损伤小鼠的糖耐量,研究人员也进一步证实了利培酮处理小鼠表现出葡萄糖不耐受,而LepAb治疗完全逆转这一现象(图2D)。上述结果表明,利培酮诱导的高瘦素血症直接促进体重增加和葡萄糖耐受不良。
前文发现LepAb治疗可以部分抑制利培酮引起的体重增加,基于此,研究人员探究在利培酮治疗后已经引起肥胖和瘦素增加的小鼠中使用LepAb是否能够抑制瘦素的作用。研究人员使用HFD和利培酮喂养小鼠4周,使其获得肥胖表型,然后使用LepAb或IgG对照来治疗这些肥胖小鼠。结果发现中和瘦素后能够抑制小鼠体重增加,并减少每日摄食量(图2E-G)。此外,与IgG治疗的小鼠相比,LepAb处理的肥胖小鼠葡萄糖耐量显著改善(图2H)。这些结果表明,在利培酮治疗的不同阶段,降低瘦素水平均可以抵消抗精神病药物的副作用。
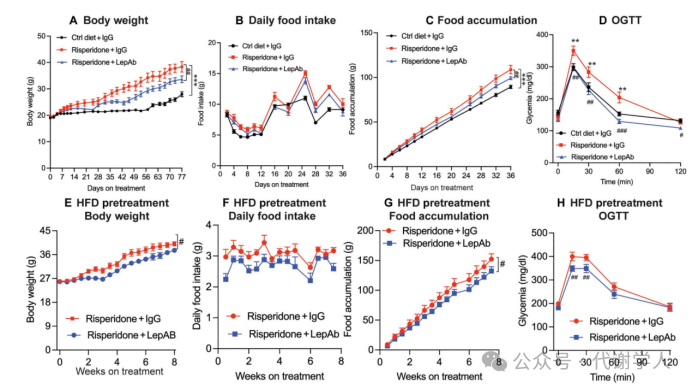
图2.利培酮和利培酮+LepAb对体重、食物摄入量和糖耐量的影响
利培酮急性处理会导致小鼠全身瘦素浓度显著增加,因此研究人员测量了长期利培酮处理后机体瘦素、脂联素和胰岛素动态变化情况。研究人员发现长期给药后小鼠SAT和性腺脂肪GWAT中瘦素基因Lep表达水平和循环系统中的瘦素水平均显著增加,LepAb处理后,瘦素基因表达和循环系统中瘦素浓度显著下调(图3A-C)。此外,利培酮处理导致SAT中脂联素基因Adipoq表达水平显著降低,而LepAb处理能够逆转这一情况(图3D)。相比之下,GAT中脂联素基因表达水平和循环系统中的脂联素浓度没有显著变化(图3E、F)。对于胰岛素,利培酮处理后胰岛素循环浓度显著升高,说明机体发生强烈的胰岛素抵抗(图3G)。而LepAb治疗虽然也有效地减弱了这种高胰岛素血症,但体重却仅被轻微降低。综上,这些结果表明,瘦素中和作用对葡萄糖耐量和胰岛素敏感性的影响与体重无关。
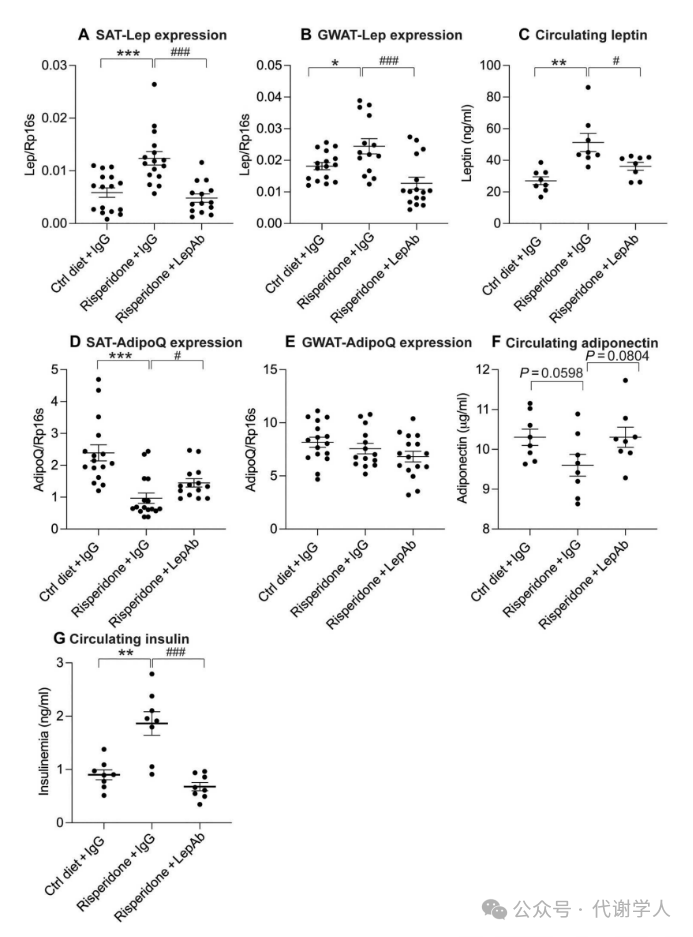
图3.利培酮和利培酮+LepAb治疗后循环瘦素、脂联素和胰岛素浓度变化
4、 利培酮诱导的高瘦素血症促进肝脏纤维化和棕色脂肪组织白色化
多项研究表明,瘦素在慢性肝损伤后肝纤维化的发展中起着关键作用。因此,研究人员探究利培酮治疗引起的高瘦素血症是否也促进了肝纤维化,并进一步评估了它与其他常见的肥胖相关组织功能障碍(例如棕色脂肪白色化)的关系。研究人员发现慢性利培酮治疗后小鼠发生严重的肝纤维化,纤维化基因如Ⅰ型胶原蛋白α1链(Collagen type I alpha 1 chain, Col1a1),Ⅳ型胶原蛋白α4链(Collagen type IV alpha 4 chain, Col4a4)和α平滑肌肌动蛋白(α-Smooth muscle actin, SMA)表达水平显著上调(图4A、C),Masson染色(小编注: Masson三色染色,亦称马松染色,旨在有效显示组织中的纤维结构。染色结果中,肌纤维在染色后呈现红色,而胶原纤维则呈现绿色或蓝色。)发现在利培酮治疗的小鼠肝脏中呈清晰的深蓝色染色,进一步证实了肝脏纤维化的加剧。通过对脂滴积累情况进行分析,研究人员发现利培酮治疗会引起肝脂肪变性显著增加(图4D)。而LepAb的治疗能够完全抑制利培酮引起的肝纤维化,部分逆转肝脂肪变性(图4A、D)。
肥胖通常伴随着小鼠棕色脂肪的白色化。然而,肥胖相关的高瘦素血症在这一过程中的作用尚不清楚,因此研究人员对利培酮处理小鼠的BAT进行分析,发现Prdm16、Pgc1α、Ucp1表达水平显著下调(图4E-G),并且BAT出现明显的棕色脂肪白色化,并伴有较大脂滴的积累(图4H),这与肝脏中发生的变化类似,而使用LepAb进行处理可以逆转利培酮对棕色脂肪白色化的影响。
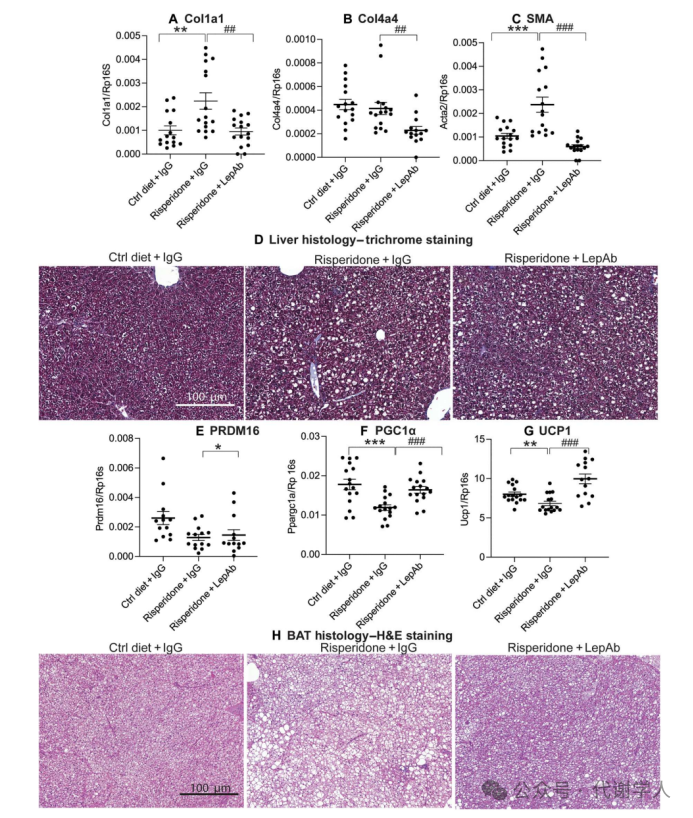
图4.利培酮及利培酮+LepAb对肝脏和棕色脂肪组织功能的影响
5、 利培酮诱导的高瘦素血症会促进局部组织和全身炎症的发生
炎症被认为是抗精神病药物引起代谢紊乱发展的驱动力。由于瘦素是免疫功能的关键调节因子,因此抗精神病药物治疗引发的高瘦素血症可能是引起全身炎症和代谢失调的一个重要因素。在肥胖情况下,GWAT会发生大规模的扩张并发生严重的炎症,该现象通常被认为会促进全身炎症的发生。在利培酮处理后,小鼠体重增加,同时GWAT中炎症标志物如F4/80、单核细胞趋化蛋白-1(Monocyte chemotactic protein-1,MCP1)和巨噬细胞炎症蛋白(C-C Motif Chemokine Ligand 4,Ccl4)的表达水平显著上调(图5A-C)。利培酮处理小鼠GWAT组织半乳糖凝集素Mac2染色增强也进一步证明巨噬细胞在GWAT中的浸润增加(图5D)。而LepAb的治疗有效降低了GWAT组织炎症标志物基因的表达水平和巨噬细胞在GWAT中的浸润。综上,研究人员证实了高瘦素血症在GWAT炎症的发展和维持中发挥的重要作用。
除了GWAT外,肝脏也受到肥胖相关炎症的影响。研究人员发现利培酮处理小鼠的肝脏中炎症标志基因以及F4/80染色均有所增加,而经过LepAb治疗后,肝脏炎症水平下降(图S3A-D),最后,LepAb处理的小鼠肝脏SMA染色程度下降进一步证实了LepAb在肝脏纤维化过程中能够发挥保护作用。
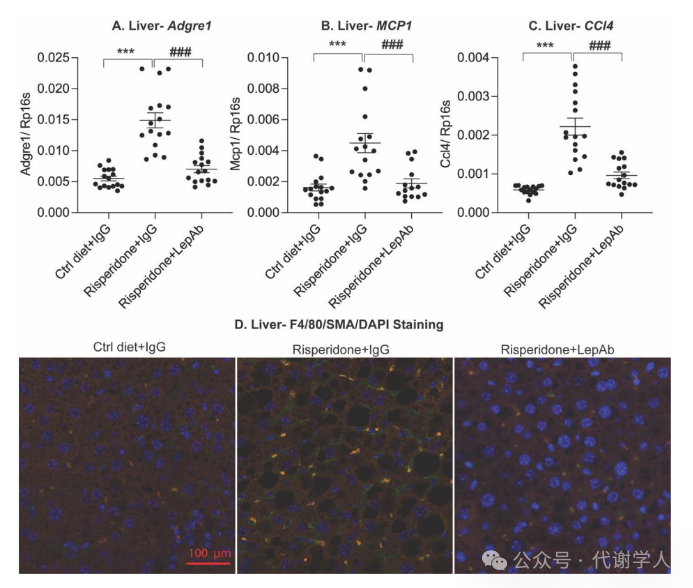
图S3.利培酮及利培酮+LepAb对肝脏炎症的影响
在局部组织炎症增加的过程中,机体炎症细胞因子如MCP1、IL-1β和TNFα的循环浓度同样升高。而在中和瘦素后,利培酮诱导的炎症标志物的升高也被显著抑制(图5E-G)。上述结果证实了利培酮诱导的高瘦素血症直接导致局部组织和全身炎症,最终诱发异常的代谢表型。
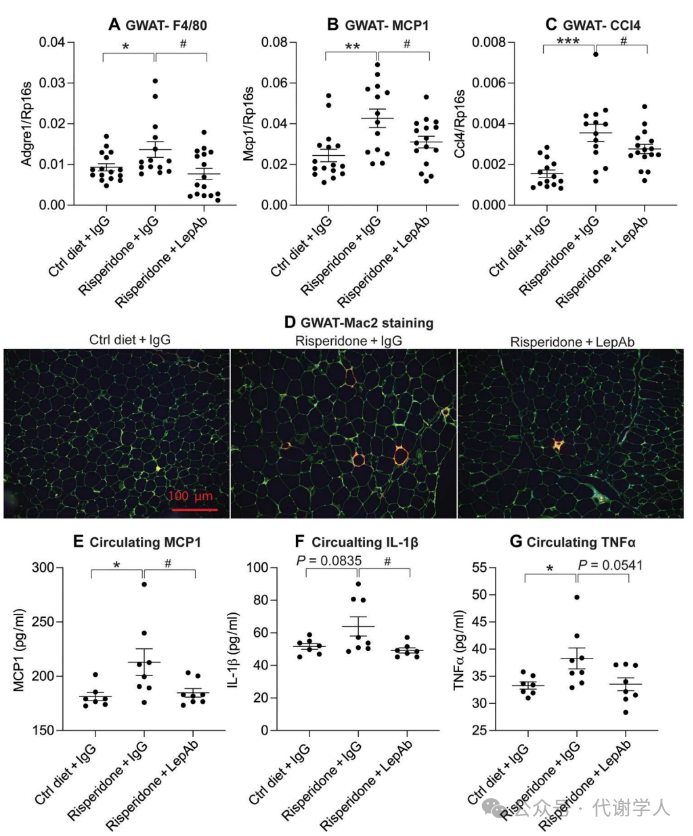
图5.利培酮和利培酮+LepAb对脂肪组织和全身炎症的反应
6、 中和瘦素抑制下丘脑炎症
先前的研究表明,利培酮处理导致神经元群体中阿黑皮质素原(Pro-opiomelanocortin, POMC)减少,进而影响机体对能量平衡的调节。在作者的其他研究中,已经发现降低瘦素水平能够恢复下丘脑的瘦素敏感性。基于此,研究人员探究LepAb治疗是否可以抑制利培酮处理对小鼠下丘脑Pomc表达水平的影响。研究人员发现利培酮处理会导致下丘脑刺鼠关联蛋白(Agouti-related protein, Agrp)和Pomc基因表达水平显著降低,炎症基因表达水平显著升高,而LepAb处理后可以恢复Agrp和Pomc的表达水平,同时抑制炎症基因表达(图6A-F)。上述结果进一步证实了利培酮诱导的高瘦素血症是导致中枢和外周系统性炎症以及中枢能量平衡失调的因素。
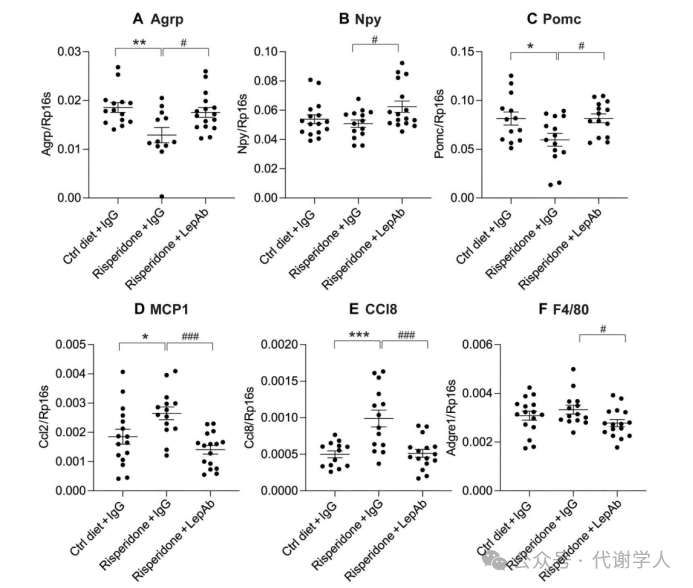
图6.利培酮及利培酮+LepAb对下丘脑基因表达的影响
7、 利培酮处理与哺乳动物乳腺导管发育相关
利培酮一个显著的副作用是增加患者的血浆催乳素浓度,催乳素是怀孕期间乳腺导管网络形成的关键因素。在长期利培酮处理后,研究人员发现未怀孕小鼠SAT形成了与妊娠诱导乳腺发育类似的结构,而在仅HFD喂养的小鼠并未出现这一变化(图7A)(小编注:乳腺导管集中在SAT腹股沟部分并靠近淋巴结,HE染色呈现红色的细胞是导管样细胞,利培酮诱导部分细胞成为导管样细胞,并没有真正形成导管)。CD31/Mac2的组织学染色也证实慢性利培酮处理诱导乳腺导管发育,这与抗精神病药物会引起乳腺发育的普遍特征一致(图7B)(小编注:Mac2染色为红色,用于指示巨噬细胞,CD31染色为绿色,用于指示内皮细胞。Control组中主要是对巨噬细胞进行染色,在利培酮处理后,CD31染色增强,说明上皮细胞增多,即导管增多),而使用LepAb治疗可部分抑制SAT中这些乳腺样结构的形成(图7A、B)。先前报道表明,催乳素在妊娠期间诱导乳腺扩张,因此研究人员探究观察到的这些乳腺结构的膨胀是否与泌乳素循环增加有关。研究人员对利培酮处理小鼠体内循环催乳素浓度进行分析,发现利培酮显著增加了循环催乳素的水平,并且在中和瘦素后催乳素水平下调(图7C)。这些结果表明,在利培酮治疗下,中和瘦素可能有助于减少高催乳素血症引起的乳腺发育。

图7.利培酮诱导乳腺发育
8、 在奥氮平处理的雌鼠中减少循环瘦素水平同样发挥作用
利培酮和奥氮平均能够诱导循环瘦素水平升高,于是研究人员探究循环系统瘦素的增加是否是抗精神病药物诱导体重增加和葡萄糖不耐受的普遍机制。研究人员用奥氮平代替利培酮处理雌性小鼠,在给药奥氮平时开始注射IgG和LepAb,结果发现LepAb通过减少奥氮平处理期间小鼠的摄食量有效地抑制了奥氮平诱导的体重增加(图S4A),同时逆转奥氮平诱导的葡萄糖不耐受(图S4D),降低了肝纤维化相关基因和脂肪组织中炎症相关基因的表达(图S4E、F)。这些结果与利培酮处理的小鼠中观察到的效果相似,进一步证实了抗精神病药物引起的高瘦素血症导致体重增加和葡萄糖不耐受的观点。因此,使用LepAb 中和瘦素可作为减少抗精神病药物相关副作用的潜在手段。
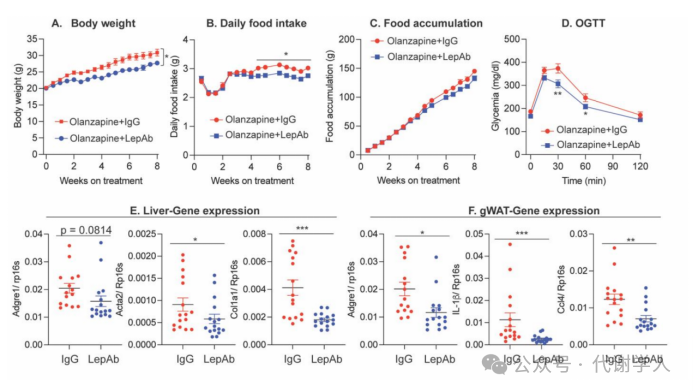
图S4.瘦素中和抗体在奥氮平诱导的体重增加和葡萄糖不耐受中的作用
总结
在本文中,研究人员发现使用抗精神病药物治疗时,机体发生高瘦素血症等副作用并导致肥胖和相关代谢紊乱疾病的发生,而使用瘦素中和抗体能够有效地抑制抗精神病药物的副作用,例如抑制体重增加和胰岛素抵抗,改善葡萄糖耐量,减轻肝脏、脂肪组织、下丘脑以及全身炎症,恢复机体器官的功能,从而减轻代谢紊乱。
文章链接:https://www.science.org/doi/10.1126/scitranslmed.ade8460
https://blog.sciencenet.cn/blog-3483272-1418433.html
上一篇:Neuron: Irisin让你不再困在时间里
下一篇:代谢学人——Cell Metabolism:谁动了我的甘氨酸?