博文
代谢学人--Cell Metabolism:看线粒体如何“嵴”速享“瘦”
||
代谢学人
Cell Metabolism:看线粒体如何“嵴”速享“瘦”
撰文 | 郑宇含 张婷 仲银召 李雨
编辑 | 孟美瑶
校对 | 张彦康

背景介绍
不均衡饮食造成的营养过剩,加上较少的运动量会导致代谢疾病的发生,包括肥胖/2型糖尿病(T2D),进而引起严重的临床并发症,如心血管疾病、脂肪肝等。目前,治疗肥胖/T2D临床并发症的策略主要为个性化饮食方案与体育运动相结合,例如有研究表明快走可维持减肥效果。此外少量剧烈的运动也能降低患癌症和心血管疾病等的风险。然而,大多数情况下,患者不能长久地坚持下去,这会促使代谢性疾病的发展。
引起肥胖的主要原因是机体能量摄入和能量消耗的不均衡。然而,目前大多数对机体能量消耗的研究主要集中在产热脂肪组织上,对非脂肪组织的能量消耗研究较少。肝脏作为机体重要的代谢器官,在不同代谢状态下(如禁食和摄食状态)调整不同组织对代谢物的利用,调节机体的能量代谢稳态。例如,有研究表明在禁食期间,肝脏中线粒体活性升高,并促进葡萄糖生成和酮体的产生,这一过程可维持小鼠在禁食期间的血糖稳态,并向其他组织提供酮体进行氧化分解供能。然而,禁食状态下如何调控线粒体功能,目前仍不清楚。
线粒体内膜向基质侧凹陷形成嵴,嵴上富含线粒体呼吸复合物,可通过氧化磷酸化(OxPHOS)途径产生ATP,并加速代谢物的氧化分解。MICOS(线粒体连接位点和嵴形成系统)复合体是调控线粒体嵴结构和功能的主要蛋白,其定位于嵴连接处,由2个亚复合体组成:MIC10-MIC26-MIC27亚复合体和MIC60-MIC19-MIC25亚复合体。前者主要负责嵴的形成并稳定嵴连接结构;后者主要负责在线粒体内外膜之间形成连接位点,并维持嵴连接结构,以保证线粒体结构的完整性。MIC19是位于膜间隙的可溶性膜蛋白,其结构中含有二硫键,以还原形式或氧化形式存在,已有研究表明,MIC19能促进 2个 MICOS亚复合物相互作用,处于氧化态时促进作用更明显。MIC10-MIC26-MIC27亚复合体和MIC60-MIC19-MIC25亚复合体通过MIC19亚基相互结合形成MICOS复合体。研究表明,寒冷刺激促进棕色脂肪组织中MICOS复合体亚基MIC19蛋白向线粒体运输,促进线粒体嵴的形成,进而提高线粒体功能。然而,在禁食状态下,肝脏线粒体中MICOS复合体以及嵴形成过程如何被调控,目前还不清楚。
在本篇文章中,研究人员通过肝脏蛋白组学分析发现,禁食条件下肝脏中MICOS复合体亚基MIC19蛋白水平显著上调,并促进线粒体嵴的形成,以及肝脏对脂肪酸的利用。并且,在肝脏中特异性过表达MIC19可保护小鼠免受饮食诱导的肥胖和代谢紊乱,这一保护作用是由肝脏MIC19促进机体能量消耗所介导的。总之,本篇研究主要阐明了肥胖条件下线粒体嵴形成的营养依赖调控分子机制,以及线粒体嵴形成如何调控肝脏和全身的能量代谢。

敲黑板啦!
1.禁食特异性促进CD-1品系小鼠肝脏MIC19表达和线粒体嵴的形成
2.BL6小鼠肝脏MIC19促进线粒体嵴的形成,并缓解饮食诱导的肥胖
3.肝脏MIC19可促进线粒体呼吸作用,并提高机体能量消耗
4.肝脏MIC19通过提高尿嘧啶水平,促进小鼠运动能力
研究结果
1禁食诱导CD-1小鼠肝脏线粒体嵴相关蛋白质组重塑
据报道,与C57BL/6(BL6)小鼠模型不同,CD-1小鼠可抵抗HFD诱导的肝脏脂肪变性。鉴于线粒体功能失调与肝脏代谢疾病密切相关,研究人员推测BL6小鼠和CD-1小鼠肝脏线粒体对禁食的反应不同。为了验证这一假设,研究人员利用无偏倚的蛋白质组学分析自由摄食和禁食24小鼠的BL6小鼠和CD-1小鼠肝脏线粒体蛋白水平变化,结果显示,CD-1小鼠肝脏样本中共鉴定出839种线粒体蛋白,其中有145种(17.3%)线粒体蛋白在禁食后显著上调,有22种(2.6%)线粒体蛋白在禁食后显著下调;而在BL6小鼠肝脏中,共鉴定出811种线粒体蛋白,其中有16种(2.0%)线粒体蛋白在禁食后上调,有8种(1.0%)线粒体蛋白在禁食后下调(图1A-B)。这些结果表明,与BL6小鼠相比,CD-1小鼠肝脏线粒体蛋白对禁食的反应更为强烈。此外,与自由摄食的CD-1小鼠相比,禁食处理的CD-1小鼠血清中AST和ALT水平无明显变化,表明禁食并没有引起CD-1小鼠肝脏损伤(图S1A)。GO分析显示,禁食后CD-1小鼠肝脏中上调的线粒体蛋白主要与线粒体内膜结构和功能相关,包括呼吸链复合物和嵴相关蛋白,而在禁食后BL6小鼠肝脏中并没有发生这一现象(图1C-D)。线粒体内膜内陷形成嵴,而嵴中富含氧化磷酸化(OxPHOS)复合物。随后研究人员检测了CD-1小鼠肝脏中OxPHOS复合物Ⅰ-Ⅴ的水平,结果显示禁食后CD-1小鼠肝脏中OxPHOS复合物Ⅰ-Ⅴ水平显著升高,而BL6小鼠肝脏中OxPHOS复合物水平均无明显变化(图1E)。接着研究人员检测了BL6小鼠和CD-1小鼠肝脏线粒体嵴相关蛋白表达水平,发现禁食后CD-1小鼠肝脏线粒体中MICOS复合物亚基MIC19水平显著上调,其他MICOS复合物亚基如MIC60、MIC26和MIC27和线粒体动力蛋白OPA1水平有上调趋势但无显著差异(图1F)。有趣的是,研究人员还发现禁食后CD-1小鼠肝脏中MIA40蛋白水平显著上调(图1G)。MIA40可作为线粒体外膜转位酶(TOM)复合物的受体,负责将富含半胱氨酸的蛋白质转运至膜间隙(IMS)并进行氧化折叠,且MIC19也是MIA40的下游靶蛋白。总之,这些结果表明禁食后CD-1小鼠肝脏线粒体嵴被重塑。因此,研究人员重点关注了MICOS复合物亚基MIC19蛋白。WB结果显示禁食后CD-1小鼠肝脏中MIC19蛋白上调,同时负责MIC19进入线粒体的TOM复合体亚基TOM70也显著上调,而BL6小鼠肝脏中MIC19和TOM70表达无明显差异(图1H-I),此外研究人员还发现禁食后CD-1小鼠肝脏中含有MIC19的MICOS复合物水平升高(图1J),这表明禁食诱导CD-1小鼠肝脏MIC19蛋白水平升高,参与MICOS复合物的形成,且禁食并不影响线粒体中形成MICOS复合物的MIC19蛋白水平与MIC19单体水平之间的比例(图1K)。接下来为了探究禁食是否调控了MIC19蛋白向线粒体的输入,研究人员分离自由摄食和禁食的CD-1小鼠肝脏线粒体,体外检测35S放射性标记MIC19蛋白向线粒体的输入量,结果显示禁食显著促进了MIC19向线粒体的运输(图1L)(小编注:PK是指蛋白酶K,本实验是MIC19蛋白线粒体导入分析,即分析35S放射性标记MIC19蛋白向线粒体的导入量。PK在这里的作用是消化掉未被成功导入线粒体的蛋白,而已成功导入线粒体的蛋白不受影响。本图表示MIC19蛋白的线粒体导入速率,差异主要体现在第1和第2min的MIC19蛋白导入水平。-PK组用于表示MIC19的蛋白总量无差异,+PK组消化掉未被成功导入线粒体的蛋白后,用于表示导入线粒体的MIC19蛋白含量,Fasted组在第1min和第2min的MIC19相比于Fed组略高,表明禁食状态下MIC19向线粒体的导入较快)。随后,研究人员探究了禁食是否会影响CD-1小鼠肝脏MIC19的转录水平,发现禁食均诱导CD-1小鼠和BL6小鼠肝脏中Ppargc-1a表达上调,而Chchd3表达无明显差异(图S1B-S1C),表明禁食并不会影响CD-1小鼠肝脏线粒体MIC19的转录水平,CD-1小鼠肝脏线粒体MIC19水平的调控可能依赖于蛋白翻译或蛋白质运输途径。总之,这些结果表明禁食可诱导CD-1小鼠肝脏线粒体嵴相关蛋白质组重塑。
为了进一步验证禁食诱导CD-1小鼠肝脏线粒体嵴重塑,研究人员利用透射电镜(TEM)观察了CD-1小鼠和BL6小鼠肝脏线粒体的超微结构,发现禁食后CD-1小鼠肝脏线粒体嵴数量显著升高,而BL6小鼠肝脏线粒体嵴数量无明显差异(图2A-2D)。随后研究人员检测了CD-1小鼠和BL6小鼠肝脏线粒体呼吸水平(小编注:对于复合物I依赖性OCR,在5 mM丙酮酸盐+3 mM苹果酸盐,1 mM ADP和5 mM寡霉素+ 5 mM FCCP处理后测量OCR;对于复合物II依赖性OCR,用5 mM琥珀酸盐+8 mM鱼藤酮、1 mM ADP和5 mM寡霉素+ 5 mM FCCP处理后测量OCR,两者的区别主要在于提供的能量底物不同。丙酮酸盐和苹果酸盐的代谢反应会产生NADH,而琥珀酸盐的代谢反应会产生FADH2。NADH依次经过复合物Ⅰ、辅酶Q、复合体Ⅲ、细胞色素C、复合体Ⅳ最终把电子传递给氧气,并将质子排到线粒体膜间隙最终经线粒体ATP合酶生成2.5个ATP;FADH2经复合体Ⅱ、辅酶Q、复合体Ⅲ、细胞色素C、复合体Ⅳ最终把电子传递给氧气,并将质子排到线粒体膜间隙最终经线粒体ATP合酶生成1.5个ATP,由于前者的生成ATP量大于后者,所以前者称为主电子传递链,后者称为次电子传递链。因此本文利用丙酮酸盐和苹果酸盐作为能量底物检测复合体1衍生的OCR,利用琥珀酸盐作为底物检测和复合体II衍生的OCR,表明无论是通过主电子传递链还是次电子传递链,CD-1小鼠肝脏线粒体OCR水平都是显著升高的),结果显示禁食显著促进了CD-1小鼠肝脏线粒体OCR水平,但不影响BL6小鼠肝脏线粒体OCR水平(图2E-F)。有趣的是,禁食均提高了CD-1小鼠和BL6小鼠肝脏中椭圆和细长形状的线粒体数量,减少了圆形线粒体数量(图2G-H)。有研究表明饥饿时线粒体形状的拉长可保护线粒体免受自噬体的降解,并通过促进嵴的形成和ATP的产生,维持细胞活力。然而研究人员发现禁食可提高BL6小鼠肝脏中椭圆和细长线粒体数量,但并没有影响线粒体嵴的数量(图2B,2D,2H),这表明线粒体形状的拉长与线粒体嵴的形成之间并没有因果联系。
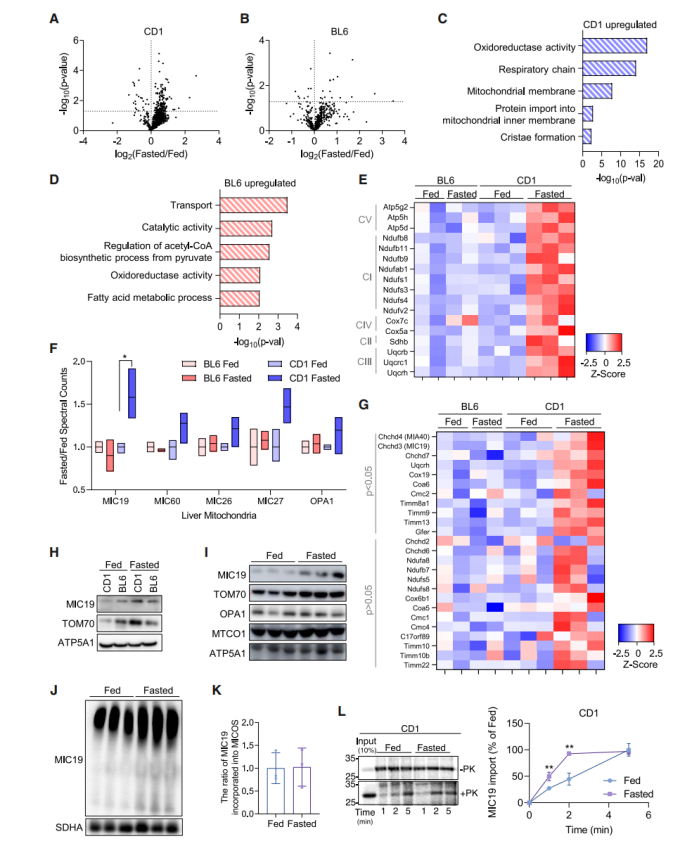
图1.禁食诱导CD-1小鼠肝脏线粒体嵴相关蛋白质组重塑
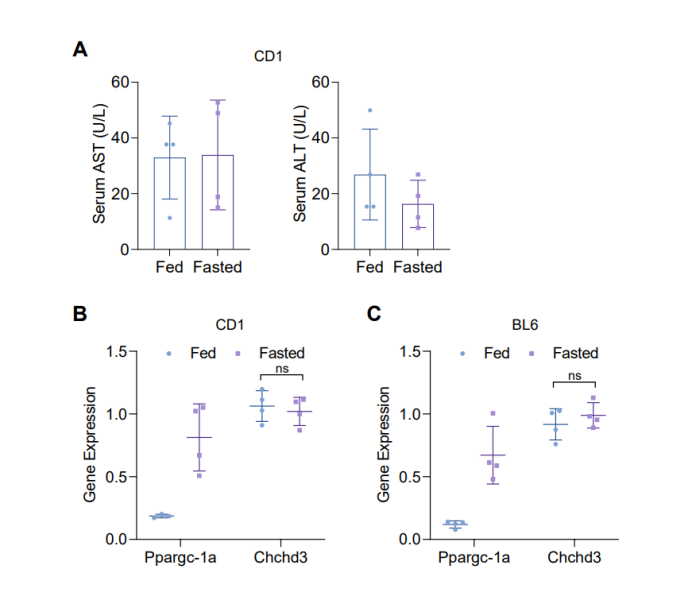
图S1. 禁食不影响肝脏损伤和肝脏Chchd3表达
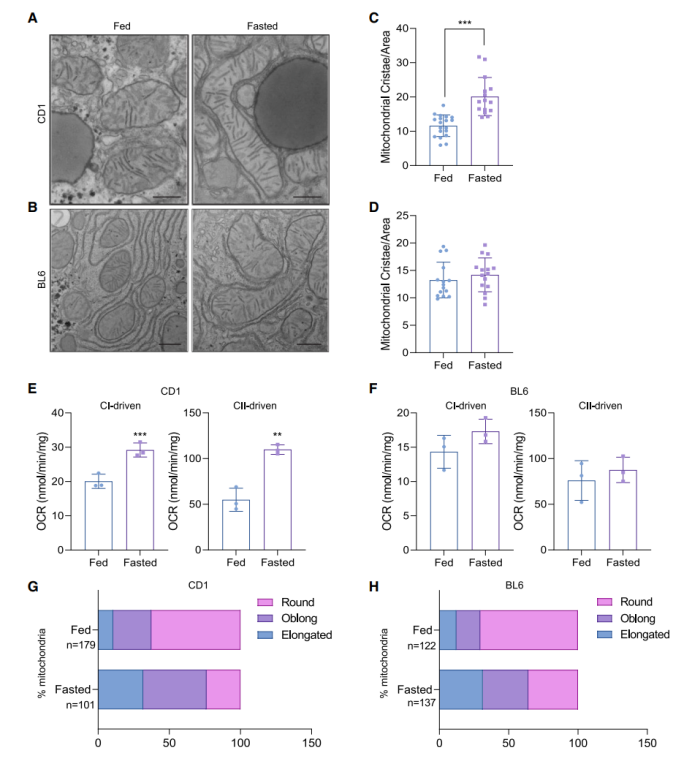
图2.禁食促进CD-1小鼠肝脏线粒体嵴的形成和线粒体呼吸
2 BL6小鼠肝原代细胞中MIC19可促进脂肪酸氧化,抑制葡萄糖生成
禁食提高MICOS复合体亚基MIC19水平可能是促进线粒体嵴形成的潜在机制。已有研究表明寒冷刺激可促进棕色脂肪中MIC19向线粒体的运输,进而促进棕色脂肪线粒体嵴的形成。为了探究肝脏中MIC19向线粒体的运输是否可促进线粒体嵴的形成,研究人员探究了BL6小鼠肝脏中MIC19对线粒体嵴的调控作用。由于禁食可促进肝脏葡萄糖的生成和脂肪酸氧化途径,因此为了确定禁食条件下MIC19是否参与调控肝脏葡萄糖生成和脂肪酸氧化,研究人员在BL6小鼠肝原代细胞中过表达或敲减MIC19(图S2A-C),并利用胰高血糖素刺激以模拟禁食,结果显示在胰高血糖素刺激下,MIC19显著抑制了肝原代细胞葡萄糖的生成,并促进葡萄糖氧化和脂肪酸氧化途径(图S2D-J)。这些结果表明肝脏MIC19可重塑肝脏代谢程序,即抑制肝脏葡萄糖生成并促进脂肪酸氧化。此外,在胰高血糖素刺激下,敲减MIC19显著降低了肝原代细胞线粒体嵴的数量,但线粒体总面积并没有变化(图S2K-L),这表明MIC19可细胞自主性调控肝脏线粒体嵴的形成。
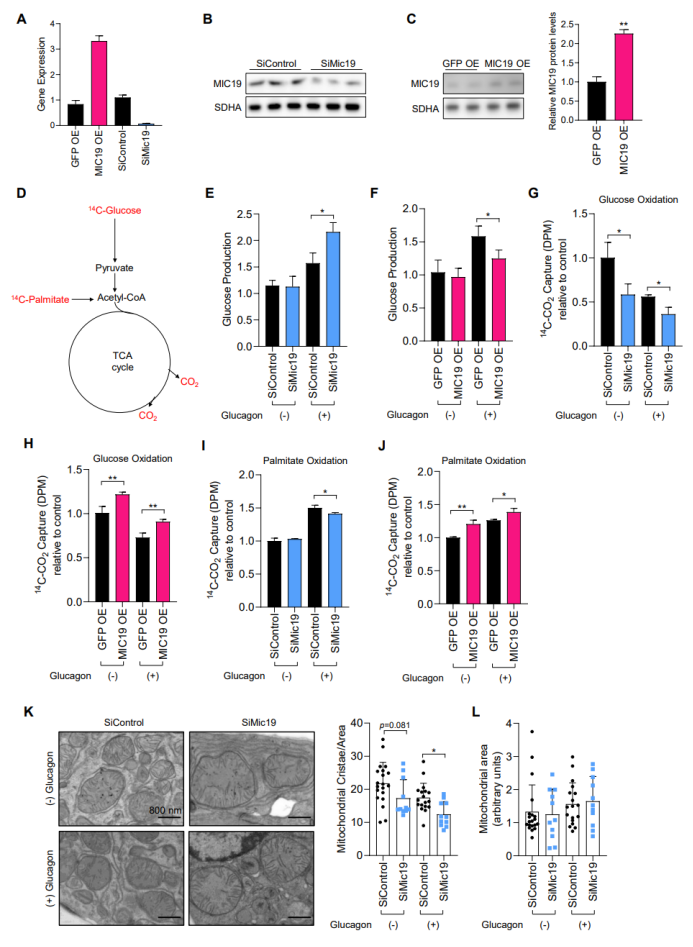
图S2. BL6小鼠肝原代细胞中MIC19调控葡萄糖生成和脂肪酸氧化途径
3 BL6小鼠肝脏MIC19可促进线粒体嵴的形成,并促进线粒体呼吸
鉴于肝原代细胞中MIC19可促进脂肪酸氧化并抑制葡萄糖生成,研究人员推测过表达肝脏MIC19可能改善小鼠肥胖、T2D或脂肪肝相关代谢性疾病。研究人员利用AAV2/8对BL6小鼠尾静脉注射,以肝脏特异性过表达MIC19(MIC19 AAV小鼠)(图3A,S3A-D),且过表达MIC19后小鼠血清AST、ALT水平无明显变化,表明肝脏特异性过表达MIC19不会引起肝脏损伤(图S3E)。随后,研究人员检测了肝脏特异性过表达MIC19是否可以诱导线粒体嵴的形成,结果显示MIC19 AAV小鼠肝脏线粒体嵴的数量显著增多,但线粒体总面积没有变化(图3B-D)。此外,研究人员还发现肝脏特异性过表达MIC19后,肝脏线粒体中含MIC19的MICOS复合体水平升高,且呼吸链复合物Ⅴ(ATP合酶)二聚体水平升高,这是线粒体嵴数量增加的标志(小编注:有研究报道过ATP合酶形成二聚体与嵴形成相关,所以此处强调了复合物V的二聚体)(图3E)。有研究表明ATP合酶二聚体是线粒体内膜的保守性特征,是线粒体嵴形成的必要因素。虽然肝脏特异性过表达MIC19不影响线粒体OxPHOS蛋白水平,但MIC19显著上调了呼吸链超复合体的组装,进而增强线粒体呼吸水平(小编注:线粒体的五种呼吸链复合物均由多个亚基和装配因子有序组装而成,而单个的呼吸链复合物可进一步形成超复合体,如CICIII2CIV、CICIII2等复合体。线粒体复合物和线粒体超复合物的装配应该也是一个动态的过程,普通情况下单体形式的蛋白和复合体形式的蛋白应该都存在,但其装配过程会受到调控。本文的WB表明单一的呼吸链复合物水平无差异,但超复合体水平发生了变化,所以可能调控了超复合体的组装)(图3F-G)。接下来,为了确定线粒体嵴数量增多是否可促进线粒体功能,研究人员检测了肝脏线粒体OCR水平和肝原代细胞线粒体OCR水平,结果显示过表达MIC19显著促进了肝脏线粒体OCR水平和肝原代细胞线粒体OCR水平(图3H-I,S3F),但肝脏线粒体中柠檬酸合成酶(小编注:柠檬酸合成酶位于线粒体基质,是TCA循环的关键酶,催化乙酰辅酶A生成柠檬酸。其活性在一些组织如骨骼肌中与线粒体数量相关,因此可用来粗略反应线粒体数量)活性无显著差异,线粒体DNA拷贝数也无明显变化(图3J-K),这些结果表明肝脏MIC19可促进线粒体呼吸,但不影响线粒体的生物发生。
鉴于肝原代细胞中MIC19可重塑肝原代细胞的代谢程序,因此接下来研究人员想要探究肝脏中MIC19如何影响肝脏脂肪酸代谢和葡萄糖代谢。与肝原代细胞结果一致,肝脏特异性过表达MIC19显著促进肝脏脂肪酸氧化,并抑制肝脏丙二酰辅酶A水平(图3L-M),丙二酰辅酶A是CPT1(是一种负责将长链脂酰辅酶A转运至线粒体氧化的酶)的变构抑制剂。随后,研究人员对BL6小鼠肝脏进行脂质组学分析,发现过表达MIC19显著降低了肝脏中酰基肉碱(6:0)水平(图S3G)。酰基肉碱与脂肪酸氧化途径密切相关,被认为是T2D和肥胖的标志。随后研究人员检测了肝脏MIC19对葡萄糖代谢的影响,发现在正常饮食喂养下,肝脏特异性过表达MIC19对小鼠体重、体脂和肝脏重量无明显影响(图3N,S3H-I),但机体葡萄糖耐量和胰岛素敏感性显著改善(图3O-P),而空腹血胰岛素水平无明显变化(图S3J)。总之,这些结果表明肝脏MIC19可促进肝脏脂肪酸氧化,并改善葡萄糖稳态。
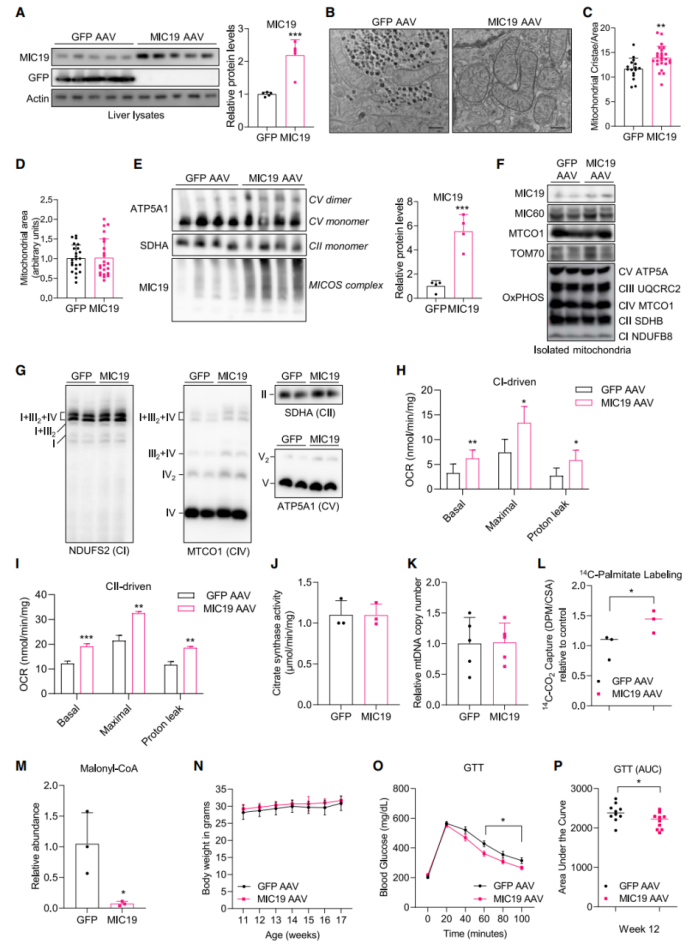
图3.BL6小鼠肝脏特异性过表达MIC19可促进线粒体嵴的形成和线粒体呼吸作用
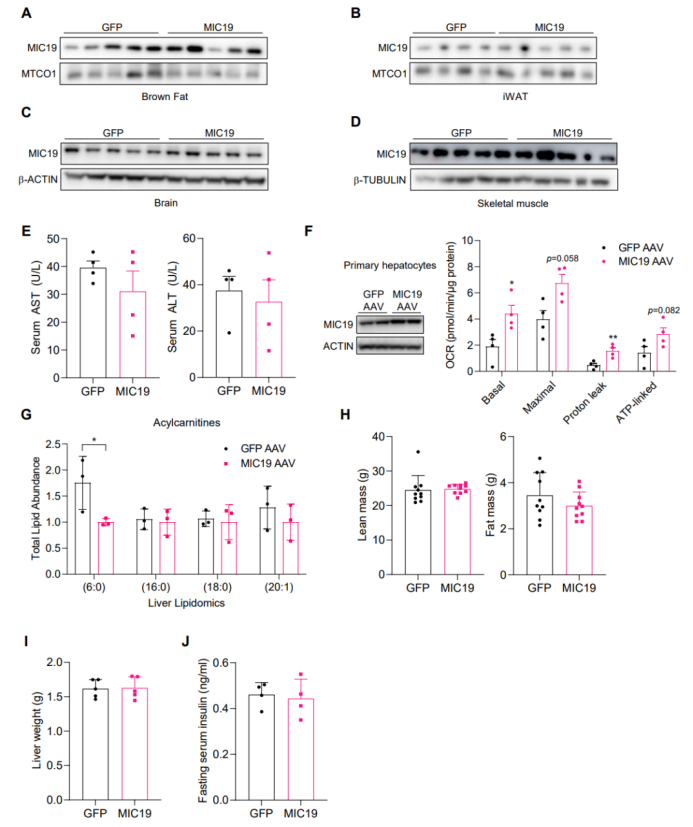
图S3.MIC19 AAV小鼠表型
4 肝脏特异性过表达MIC19可缓解饮食诱导的肥胖
接下来,为了探究肝脏特异性过表达MIC19是否可以改善小鼠机体代谢稳态,研究人员对BL6小鼠进行HFD饮食喂养,结果发现在HFD喂养1周后,MIC19 AAV小鼠体重显著低于对照组,并且随着时间推移,体重差异更加显著(图4A)。在HFD喂养8周后,MIC19 AAV小鼠体脂显著下降,但摄食量无明显差异(图4B-C)。此外,肝脏特异性过表达MIC19显著降低了HFD小鼠肝脏TG水平和空腹血糖水平,并提高肝脏线粒体OCR水平,但不影响肝脏线粒体柠檬酸合酶活性(图4D-H)。总之,这些结果表明肝脏MIC19可改善HFD小鼠肝脏脂肪变性和机体代谢紊乱现象。
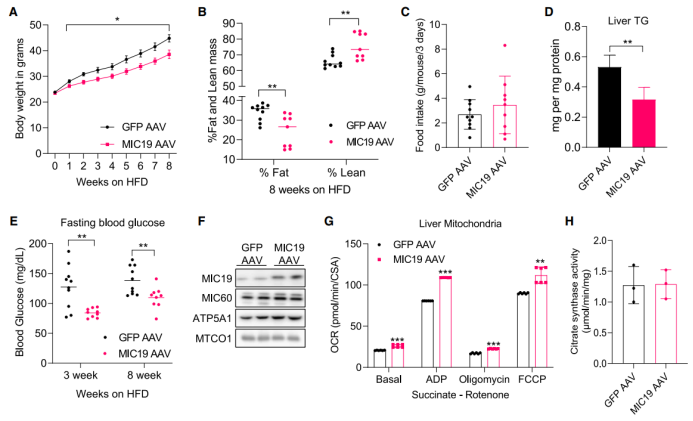
图4.肝脏特异性过表达MIC19可缓解饮食诱导的肥胖
5肝脏特异性过表达MIC19可促进小鼠运动能力
为了探究肝脏MIC19对机体能量代谢的影响,研究人员利用代谢笼监测正常饮食喂养小鼠的代谢参数,为了确定肝脏对机体能量代谢的作用,研究人员选择在热中性(30℃)下进行实验,因为热中性环境可以降低棕色脂肪产热作用的影响。首先研究人员评估了肝脏脂肪酸氧化的增加是否会影响小鼠的RER水平,结果显示肝脏特异性过表达MIC19不影响小鼠RER水平(图5A-B),这表明肝脏脂肪酸氧化的增加可能不足以改变整体能量代谢。随后研究人员发现MIC19 AAV小鼠活动量显著升高(小编注:本文的pedestrian locomotion统计的是小鼠移动速度>1 cm/s时的移动总距离) ,且能量消耗(EE)也显著增加(图5C-F)。进一步分析显示,MIC19 AAV小鼠的运动耐力和运动速度均显著升高(图5G)。
接下来,为了探究MIC19 AAV小鼠EE增加是否是由于棕色脂肪产热引起的,研究人员检测了小鼠棕色脂肪和米色脂肪中产热相关基因表达水平(图S4A-B),结果显示肝脏MIC19并不影响脂肪组织产热基因表达水平。鉴于实验是在热中性环境中进行的,因此棕色脂肪产热对小鼠EE的影响比较小。随后,研究人员探究MIC19 AAV小鼠EE增加是由运动能力增加还是肝脏能量代谢的内在变化引起的,研究人员检测了小鼠在静止状态下或运动状态下的平均EE水平和总EE水平,结果发现小鼠在静止状态下,MIC19 AAV小鼠的平均EE水平显著增加,这表明肝脏能量代谢的内在变化在一定程度上可调控小鼠EE水平。而小鼠在运动状态下,MIC19 AAV小鼠的平均EE水平无明显变化,但总EE水平显著升高,可能是由于MIC19 AAV小鼠运动的时间更长;而在静止状态下,MIC19 AAV小鼠的总EE水平无明显变化(图5H和5I)。并且,在HFD喂养下,MIC19 AAV小鼠的运动耐力也显著升高(图5J)。此外,MIC19 AAV小鼠的摄食量与对照组小鼠无明显差异(图5K)。这些结果表明MIC19 AAV小鼠EE的增加是由小鼠运动能力的增加和肝脏能量代谢的内在变化共同引起的。
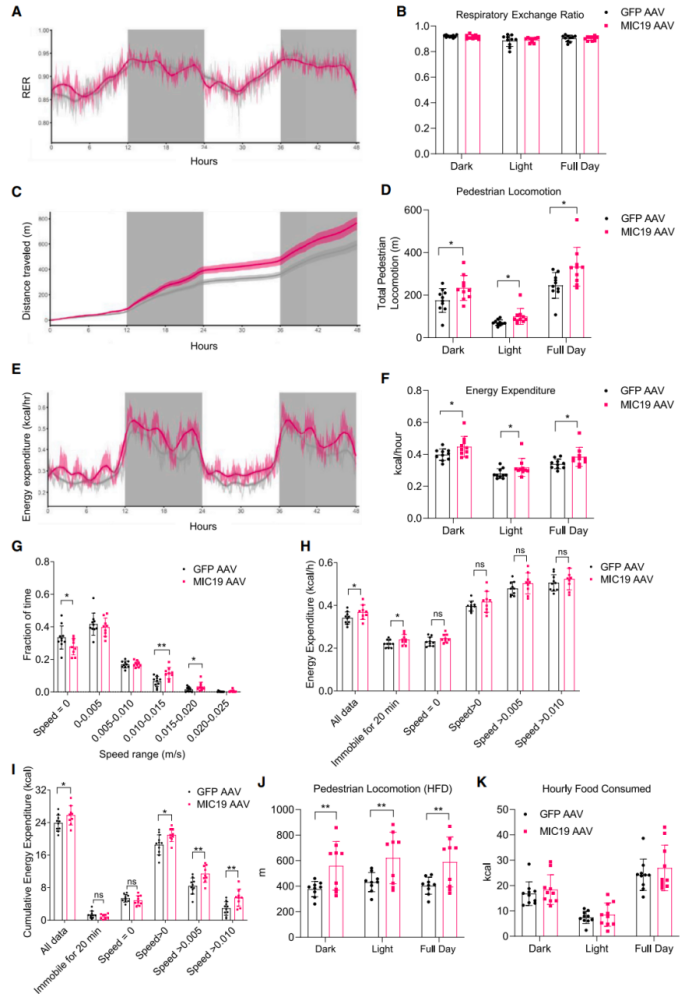
图5.MIC19 AAV小鼠运动能力提高
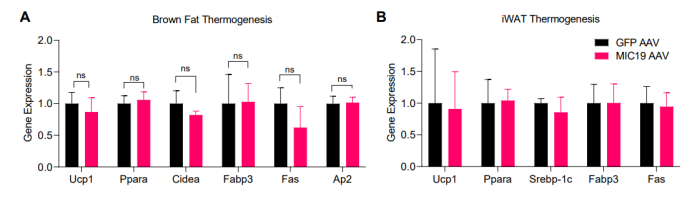
图S4.肝脏MIC19 不影响脂肪组织产热相关基因表达
6 肝脏MIC19通过提高尿嘧啶水平,促进小鼠运动能力
鉴于肝脏MIC19可促进小鼠的运动能力,研究人员推测肝脏MIC19可能介导肝脏分泌某种代谢物,影响了小鼠调节运动的神经元。有研究表明,肝脏脂肪酸氧化水平的增加可提高肝脏酮体的水平,酮体可在肝外组织线粒体内进行氧化分解,或者作为信号分子发挥功能。并且也有研究表明禁食可提高血清β-羟基丁酸(β-OHB)水平,从而促进小鼠摄食量和运动能力。因此,研究人员检测了小鼠血清中酮体(包括β-OHB和乙酰乙酸)水平,结果显示肝脏MIC19不影响小鼠血清酮体水平(图S5A-B)。于是,研究人员利用无偏倚的代谢组学分析MIC19 AAV小鼠肝脏中代谢物水平的变化(图6A),结果显示肝脏MIC19显著改变了嘧啶代谢相关代谢物水平(图S5C)。进一步研究发现肝脏MIC19促进了肝脏尿嘧啶的积累,而尿苷和胞苷水平显著下降,表明肝脏中尿苷和胞苷可能转化为了尿嘧啶(图6B)。随后,研究人员给WT小鼠补充外源性尿嘧啶,发现尿嘧啶处理显著提高了小鼠的活动量(图6C-D),且不影响小鼠摄食量(图S5D)。此外,尿嘧啶处理不影响小鼠平均EE水平,但显著提高了小鼠在运动状态下的总EE水平(图S5E-F),这与MIC19 AAV小鼠的结果一致。有趣的是,研究人员发现MIC19 AAV小鼠的脑中尿嘧啶水平显著升高,且血清尿嘧啶水平也有升高趋势但无显著差异。然而,目前尚不清楚MIC19 AAV小鼠或补充外源性尿嘧啶小鼠运动能力的提高是由尿嘧啶还是尿嘧啶衍生的代谢物所直接介导的。
接下来,研究人员探究了尿嘧啶如何影响小鼠葡萄糖稳态。在正常饮食喂养下,给小鼠补充外源性尿嘧啶,小鼠血清中尿嘧啶水平显著升高,且空腹血糖水平显著下降,而小鼠体重和空腹血胰岛素水平无明显变化(图6E-F,S5I-J)。此外,给小鼠补充外源性尿嘧啶并未改变小鼠肝脏线粒体嵴的数量和MIC19蛋白的水平,这表明尿嘧啶可能直接调控小鼠的运动能力,并不改变肝脏线粒体结构和MIC19水平(图S5K-L)。随后研究人员探究补充尿嘧啶是否可以预防HFD小鼠的肥胖,研究人员给小鼠补充尿嘧啶的同时给小鼠HFD饮食喂养,发现在HFD喂养0.5周时,与对照组小鼠相比,尿嘧啶处理小鼠体重显著下降,而小鼠摄食量无明显变化(图6H,S5M)。总之这些结果表明,与MIC19 AAV小鼠的结果一致,补充尿嘧啶可提高小鼠运动能力。
拓展阅读 :尿苷代谢与肝脏和代谢的关系
尿苷(尿嘧啶核苷)可在尿苷磷酸酶的催化下分解产生尿嘧啶和核苷,而胞苷(胞嘧啶核苷)可作为尿苷合成的前体,在胞苷脱氨酶的催化下脱氨基转化为尿苷,进而分解产生尿嘧啶。肝脏被认为是调控血液尿苷水平的主要组织,其中肝细胞可介导尿苷的生物合成途径,而Kupffer细胞可介导尿苷的分解途径。研究表明,尿苷代谢参与调控全身代谢反应,如糖脂代谢。有研究发现给小鼠补充尿苷,可抑制肝脏线粒体中ECHD(过氧化物酶体双功能酶)、ACOX1(乙酰辅酶A氧化酶1)的乙酰化修饰,减少长链脂肪酸和超长链脂肪酸的积累,从而改善小鼠肝脏脂质积累现象。也有研究发现给HFD小鼠和ob/ob小鼠腹腔注射尿苷,HFD小鼠的葡萄糖稳态得到显著改善,而ob/ob小鼠的葡萄糖稳态则没有,这也提示尿苷可调控机体糖稳态,而这一过程需要瘦素的参与。有趣的是,最近一项研究发现,在禁食期间,小鼠肝脏中编码尿苷生物合成相关酶的基因表达显著下调,而在脂肪组织中显著上调,这提示在禁食状态下,脂肪组织可能是尿苷的主要来源。
参考文献:
Yingfeng Deng, et al. Science . 2017 Mar 17;355(6330):eaaf5375.
2. Claire Greenhill, et al. Nat Rev Endocrinol . 2017 May;13(5):249.
3. Thuc T Le, et al. PLoS One. 2014 Jan 24;9(1):e87179.
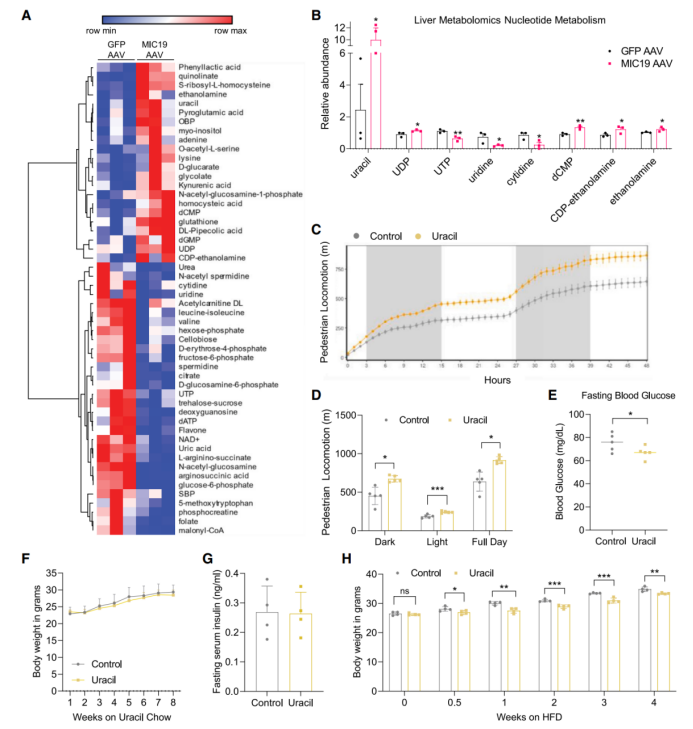
图6.肝脏特异性过表达MIC19可促进肝脏尿嘧啶水平,并提高小鼠运动能力
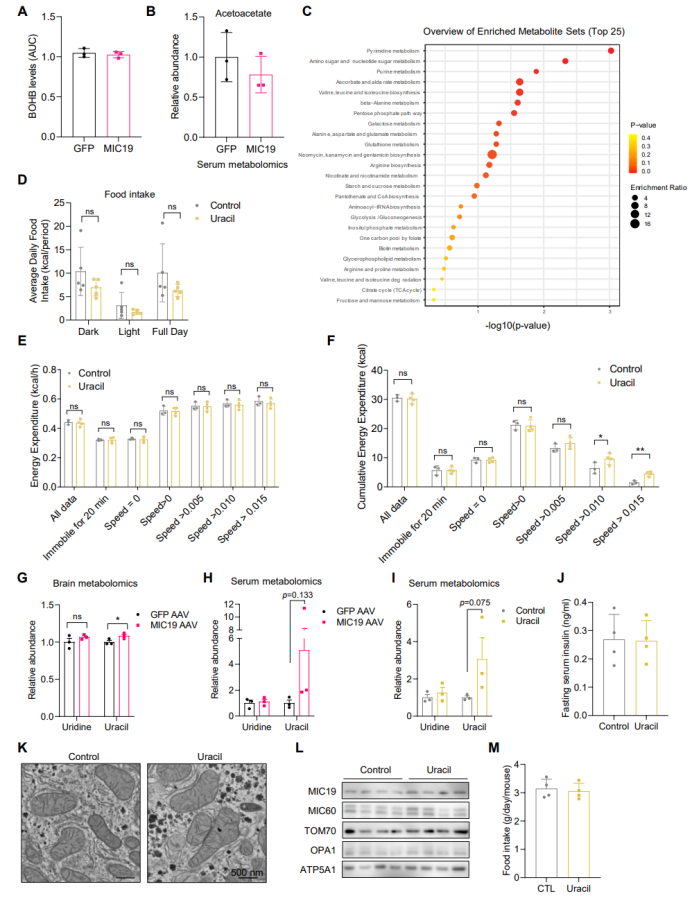
图S5.肝脏代谢组学鉴定尿嘧啶为促运动信号分子
7 肝脏MIC19通过促进UPP2酶活性,促进肝脏尿嘧啶积累
接下来,为了探究肝脏MIC19如何调控肝脏尿嘧啶水平,研究人员给WT小鼠的水中添加了3%尿苷(可转化为尿嘧啶),发现尿苷处理显著促进了小鼠的活动量,但小鼠摄食量和饮水量无明显差异(图7A-B,S6A-B)。此外,尿苷处理还可缓解HFD饮食诱导的体重增长(图S6C)。有研究表明,在小鼠禁食期间,脂肪组织是肝脏尿苷的主要来源。于是研究人员检测了MIC19 AAV小鼠iWAT组织中尿苷水平,结果显示MIC19 AAV小鼠iWAT组织中尿苷水平无明显变化(图7C),这提示可能是肝脏可能利用肝脏尿苷或来源于其他组织的尿苷转化为尿嘧啶。有研究表明尿苷可通过UPP2(尿苷磷酸酶2)转化为尿嘧啶。于是研究人员检测了MIC19 AAV小鼠肝脏中UPP2的表达和活性,结果显示肝脏特异性过表达MIC19不影响肝脏UPP2的基因表达和蛋白表达水平,但显著促进了肝脏UPP2的活性(图7D-F),表明肝脏MIC19通过促进UPP2活性,进而促进尿苷转化为尿嘧啶。接下来,研究人员想要探究肝脏MIC19如何调控UPP2活性。有研究表明线粒体OxPHOS受损与线粒体一碳代谢途径受损以及线粒体NADPH和谷胱甘肽(GSH)水平降低有关。因此研究人员评估了肝脏MIC19对肝脏线粒体一碳代谢途经的影响,结果显示肝脏特异性过表达MIC19显著促进了肝脏线粒体丝氨酸氧化代谢(图7G),这表明肝脏MIC19可促进线粒体一碳代谢途经,这可能会增加肝脏线粒体GSH水平,并调控氧化还原敏感的酶活性(如UPP2)。有研究表明,在UPP2的Cys95与Cys102之间形成分子内二硫键,可导致UPP2酶失活,而减少线粒体GSH水平或DTT处理可增加UPP2酶活性。研究人员发现,肝脏特异性过表达MIC19显著促进了肝脏GSH水平以及GSH/GSSG水平(图7H),表明肝脏线粒体氧化还原水平可能调控UPP2活性。随后研究人员用DTT处理肝脏3h,发现DTT处理后MIC19 AAV小鼠肝脏UPP2活性与对照组无明显差异(图7I),表明肝脏MIC19可能通过调控线粒体氧化还原水平,进而调控肝脏UPP2活性,促进肝脏尿嘧啶水平。
拓展阅读:丝氨酸、一碳代谢与GSH水平
一碳代谢指某些氨基酸在代谢过程中可以生成含有一个碳原子的基团,经过转移参与生物合成的过程。这些含有一个碳原子的基团称为一碳基团,包括甲基(-CH3)、甲烯基(-CH2)等,是核酸生物合成的重要前体。一碳单位可来自于甘氨酸、丝氨酸、组氨酸、色氨酸等,其中丝氨酸是一碳单位的主要来源。在线粒体中,来自丝氨酸的一碳单位与THF(四氢叶酸,是一碳单位代谢的辅酶)形成10-THF(10-甲酰四氢叶酸),10-THF可在ALDH1L2(醛脱氢酶)的催化下转化为THF和CO2,并产生NADPH,而NADPH可催化GSH的生成。
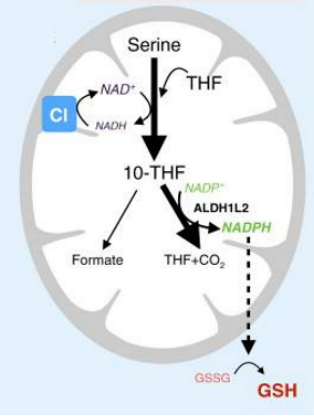
参考文献:1.Eduardo Balsa, et al. Nat Commun. 2020 Jun 1;11(1):2714.
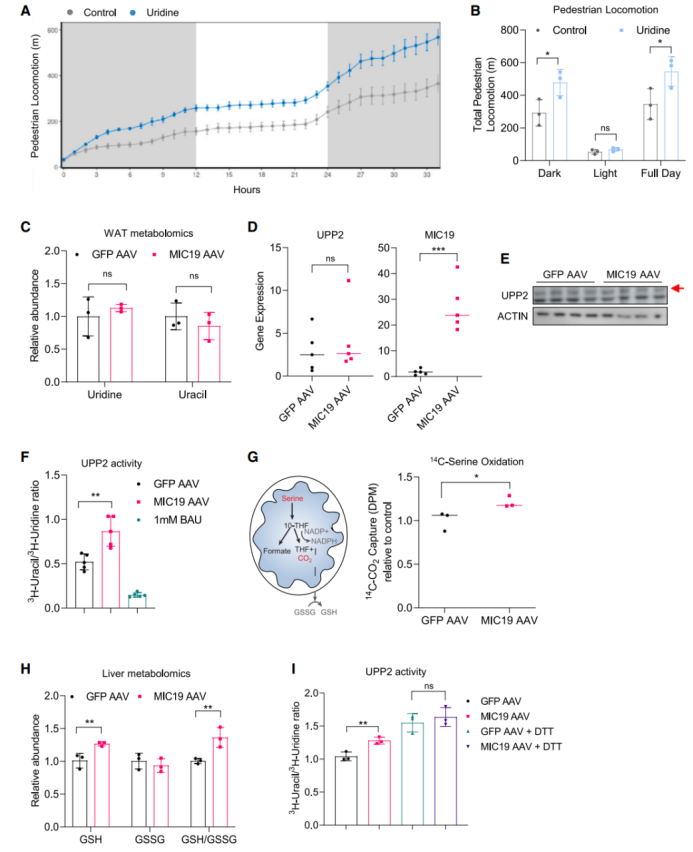
图7.肝脏MIC19通过调控线粒体氧化还原水平,促进尿苷转化为尿嘧啶
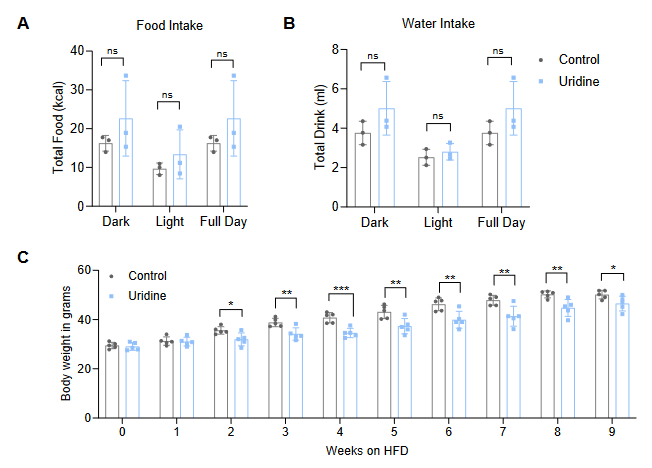
图S6.尿嘧啶的前体尿苷可以防止饮食引起的肥胖
总结
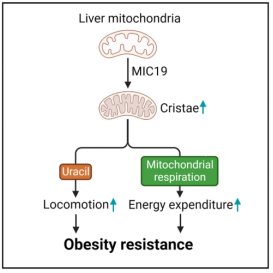
本篇文章中,研究人员通过肝脏蛋白质组学分析,发现禁食通过上调肝脏线粒体MICOS复合物亚基MIC19的表达,特异性诱导CD-1品系小鼠肝脏线粒体嵴的形成。肝脏特异性过表达MIC19也可显著促进线粒体嵴的形成,增强线粒体呼吸作用和脂肪酸氧化途径,还可缓解由饮食诱导的肥胖和胰岛素抵抗现象。进一步分析发现肝脏MIC19通过促进小鼠的活动量和能量消耗,进而改善小鼠整体代谢稳态。机制上,一方面,肝脏MIC19通过促进线粒体嵴形成,促进线粒体呼吸作用,提高小鼠能量消耗;另一方面,肝脏MIC19通过促进线粒体一碳代谢途经,改变线粒体氧化还原水平,促进UPP2酶活性,提高肝脏尿嘧啶水平,增强小鼠运动能力。此外补充外源性尿嘧啶也可提高小鼠的运动能力。总之,本篇文章发现肝脏MIC19可诱导肝脏线粒体嵴的形成,提高肝脏尿嘧啶水平,尿嘧啶作为促运动的信号分子,提高小鼠机体能量消耗,从而改善饮食诱导的肥胖。
原文链接:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(23)00225-5
关注微信公众号代谢学人
了解更多代谢前沿资讯

转载本文请联系原作者获取授权,同时请注明本文来自徐凌燕科学网博客。
https://blog.sciencenet.cn/blog-3483272-1400176.html
上一篇:代谢学人Nature :八角笼中——相分离抑制铁死亡新机制!
下一篇:代谢学人--Cell Metabolism:肠菌分泌BefA来和β-cell说说话