博文
《自然—癌症》:于吉洋团队基于乳腺癌基因调控网络开发出新的药物敏感度预测模型
||
2022年12月30日,美国西奈山伊坎医学院JoseSilva研究团队、圣裘德儿童研究医院于吉洋研究团队以及哥伦比亚大学欧文医学中心KevinKalinsky研究团队,在Nature Cancer发表了题为“Network-based assessment of HDAC6 activity is highly predictive of pre-clinical and clinical response to the HDAC6 inhibitor ricolinostat”的研究论文。
该研究基于乳腺癌基因调控网络开发了新的药物敏感度预测模型,可准确预测临床前及临床样本对Ricolinostat的治疗反应。同时该研究通过开展Ib期临床试验证明了Ricolinostat与紫杉醇(Paclitaxel)联合用药方案治疗乳腺癌的安全性与有效性,并通过多组学数据分析揭示了Ricolinostat抑制乳腺癌肿瘤发生发展的新机制。

组蛋白去乙酰化酶6(Histone Deacetylase 6,HDAC6)是组蛋白去乙酰化酶家族中最具特色的成员。该酶不仅是唯一一个主要定位于细胞质的组蛋白去乙酰化酶,而且在C末端存在2个催化结构域和1个泛素结合锌指结构域,这种特殊结构使其得以参与调控与细胞增殖、分化、凋亡以及转移相关的多种细胞途径。近年来,HDAC6作为新型药物治疗靶点已引起广泛关注,其选择性抑制剂在多种疾病的治疗方面具有广阔的前景。目前已知的HDAC6选择性抑制剂还十分有限,主要包括Ricolinostat、Tubacin、Tubastatin A等,其中Ricolinostat因特异性高、耐受性好、可口服、宜联合用药等特性成为目前最炙手可热的HDAC6抑制剂,已应用于多发性骨髓瘤、非霍奇金淋巴瘤等疾病的临床研究。然而同其他药物一样,肿瘤异质性,尤其是肿瘤间异质性(Intertumoral Heterogeneity),导致不同个体对Ricolinostat治疗的反应有很大的差异。如何准确预测患者对Ricolinostat治疗方案的敏感度,是进一步提高临床治疗效果、实现精准医疗的主要挑战。
早在2015年,该工作的研究人员便发现HDAC6依赖(HDAC6 dependency)在炎性乳腺癌(Inflammatory Breast Cancer,IBC)样本与非炎性乳腺癌(non-IBC)中存在显著差异,前者对于Ricolinostat的治疗更为敏感。更有意思的是,这种依赖跟HDAC6的基因表达(HDAC6 Expression)并不相关,而基于下游调控基因计算出的HDAC6活性分数(HDAC6 Score)则可以准确预测个体的HDAC6依赖【1】。这一发现为研究人员构建Ricolinostat的药物敏感性预测模型奠定了基础。为了建立适用于所有乳腺癌样本的Ricolinostat药物敏感性预测模型,研究人员开发了新一代的HDAC6活性计算框架。具体而言,他们首先从TCGA与METABRIC两个数据库收集了超过3000例、包含所有亚型的原发乳腺癌样本的基因表达谱数据,然后利用基于互信息(Mutual Information)的基因调控网络构建算法SJARACNe【2 】构建出乳腺癌亚型特异性的基因调控网络并鉴定出适用于所有乳腺癌亚型的HDAC6通用调控子(HDAC6 Universal Regulon)。该通用调控子由294个基因,包括275个正向调控基因和19个反向调控基因(图1A)。以此为基础,研究人员利用自主开发的系统生物学计算工具NetBID【3 】,对各乳腺癌样本进行基于转录谱的HDAC6活性计算,并以HDAC6活性预测其对Ricolinostat的敏感度。
紧接着,研究人员从准确性和稳健性两个方面对模型的预测能力进行了系统评估。为了评估模型的稳健性,研究人员首先从公共数据库收集了约4000例、包括细胞系、小鼠模型和临床样本三个类型的乳腺癌样本,然后利用该模型计算出每个样本的HDAC6活性并按照亚型统计HDAC6活性的分布。研究发现,该模型预测的HDAC6活性在三个类型的乳腺癌样本中呈现一致的分布(图1B),说明该模型稳健性良好。同时,研究人员从体外及体内对模型预测的准确性进行了验证(图1C)。在体外验证试验中,研究人员发现HDAC6活性与Ricolinostat的IC50值在乳腺癌细胞系中存在显著相关性,而且高HDAC6活性的细胞系(MDA-MB-453)比低HDAC6活性的细胞系(MDA-MB-436)对Ricolinostat的处理具有更好的应答。在体内验证试验中,研究人员利用以上两个细胞系构建了乳腺癌异种移植小鼠模型(Xenograft mouse model)并发现:高HDAC6活性的细胞系构建的小鼠模型中Ricolinostat处理可以显著减缓肿瘤生长,而在低HDAC6活性的细胞系构建的小鼠模型中Ricolinostat处理对于肿瘤生长无显著影响。与此同时,研究人员还对一种高HDAC6活性的基因工程小鼠模型(Genetically engineered mouse model),TgMMTV-Neu,进行了研究,证明Ricolinostat处理可以显著减缓该模型中肿瘤的生长、提高小鼠存活率。
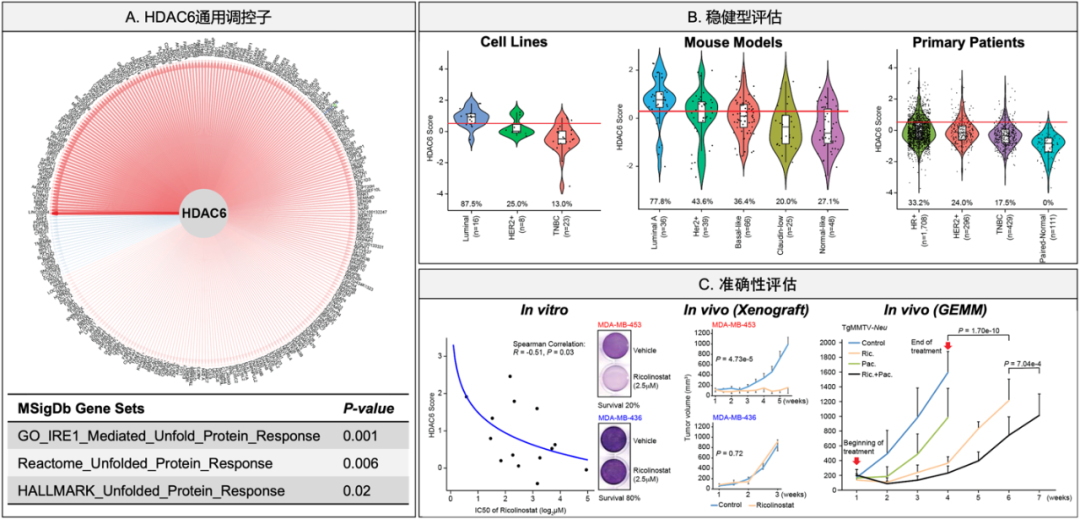
图1 Ricolinostat药物敏感度预测模型的开发与评估
为了促进该发现的临床转化,研究人员利用Ricolinostat与白蛋白结合型紫杉醇的药物组合对乳腺癌患者开展了Ib期临床试验(NCT02632071)。一方面,研究人员通过该临床试验进一步在临床样本中验证了敏感度预测模型的有效性。如图2所示,该模型预测的HDAC6活性不仅可以清晰地将Ricolinostat治疗的响应者和非响应者分开,而且在对Ricolinostat治疗敏感患者的筛选中表现完美(AUC=100%)。同时,HDAC6活性与患者的无进展生存期(Progress Free Survival,PFS)呈现显著的相关性。另一方面,该临床试验还首次证明了Ricolinostat与白蛋白结合型紫杉醇联合用药的安全性与有效性,收集了包括最大耐受剂量(Maximum Tolerated Dose, MTD)在内的重要临床应用指标,为Ricolinostat治疗乳腺癌的临床应用打下了坚实基础。
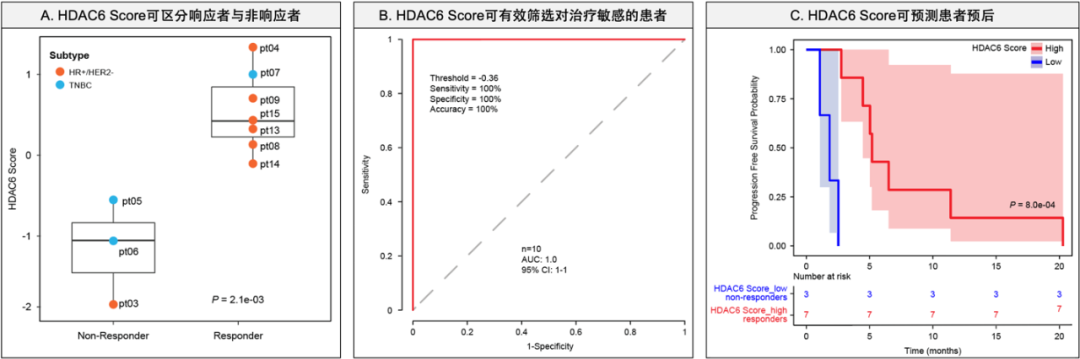
图2 药物敏感度预测模型在临床试验样本中的有效性评估
除此之外,研究人员还揭示了Ricolinostat抑制乳腺癌肿瘤的生物学机制。研究人员首先对Ricolinostat的两个敏感(sensitive)细胞株及两个耐药(resistant)细胞株进行了转录组定量分析,基因富集分析(GSEA)显示:Ricolinostat 处理后,MYC相关信号通路活性在敏感细胞株中显著下降,而在耐药细胞株中则无明显变化。随后,研究人员通过免疫印迹以及实时荧光定量PCR技术验证了Ricolinostat处理会导致MYC表达下降,并且证明了MYC表达下降会直接导致细胞存活率下降。接着,研究人员利用免疫共沉淀实验确定MYC为HDAC6的底物。为了更深入地阐明基于MYC的调控机制,研究人员对野生型、HDAC6敲除、HDAC6催化结构域2突变(H651A)三种基因型的HAP1细胞系进行了定量乙酰化蛋白质组学研究,数据分析表明,HDAC6敲除后,MYC的K-148位乙酰化修饰水平显著增加。随着这些发现被后续免疫印迹试验所验证,作者揭示了蛋白酶体介导的、Ricolinostat抑制肿瘤发生发展的新机制(图3)。
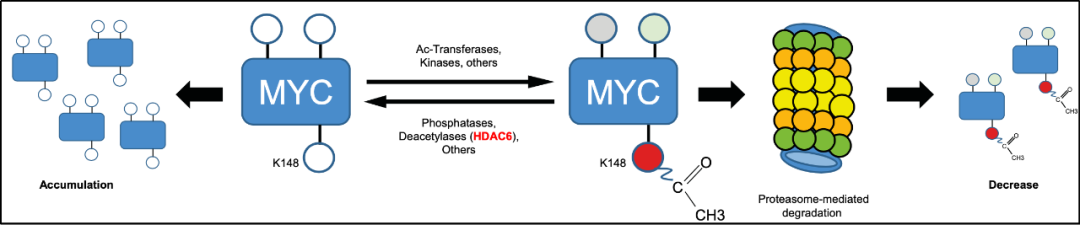
图3 HDAC6抑制剂Ricolinostat抑制乳腺癌肿瘤的机制模式图
综上所述,该研究揭示了Ricolinostat抑制乳腺癌肿瘤的新途径,证明了Ricolinostat用于乳腺癌临床治疗的安全性与有效性。该研究开发的药物敏感度预测模型可以从基因表达谱数据准确地预测乳腺癌临床前与临床样本对Ricolinostat的治疗反应,为实现基于HDAC6抑制剂的乳腺癌的精准医疗提供了有力支持。
美国西奈山伊坎医学院的Jose Silva教授、圣裘德儿童研究医院的于吉洋教授以及哥伦比亚大学欧文医学中心的Kevin Kalinsky教授为该文的共同通讯作者。西奈山伊坎医学院的Tizita Zeleke博士与圣裘德儿童研究医院的潘庆飞博士为共同第一作者。
于吉洋组去年和圣裘德儿童研究医院的杨俊组在Nature Cancer上发表基于基因网络的系统药理学方法在白血病治疗上的应用【4 】,目前该成果已被转化到多项临床试验中(点击阅读:杨俊/于吉洋组发现达沙替尼隐形靶点和治疗T细胞急性淋巴性白血病新思路)。
相关论文信息:
https://doi.org/10.1038/s43018-022-00489-5
参考文献
1.Putcha, P. et al. HDAC6 activity is a non-oncogene addiction hub for inflammatory breast cancers. Breast Cancer Research 17, 1–14 (2015). 2.Khatamian, A., Paull, E. O., Califano, A. & Yu, J. SJARACNe: a scalable software tool for gene network reverse engineering from big data. Bioinformatics 35, 2165–2166 (2019). 3.Du, X. et al. Hippo/Mst signalling couples metabolic state and immune function of CD8α + dendritic cells. Nature 558, 141–145 (2018). 4.Gocho, Y. et al. Network-based systems pharmacology reveals heterogeneity in LCK and BCL2 signaling and therapeutic sensitivity of T-cell acute lymphoblastic leukemia. Nat Cancer 2, 284-299, (2021).
https://blog.sciencenet.cn/blog-3423233-1370478.html
上一篇:《自然—生物技术》:北京大学李毓龙实验室开发新型催产素荧光探针揭秘神经肽的时空动态调控
下一篇:《自然—代谢》:邓宏魁/彭小忠合作建立全新胰岛移植策略,解决干细胞治疗糖尿病的关键难题