博文
[转载]微量营养素缺乏引发肠道微生物组改变及抗生素耐药的新启示
||

我们知道,微量营养素在人体健康中发挥着重要作用。然而,在全球范围内,约有3.4亿儿童患有多种微量营养素缺乏症,并伴有高致病性负担和耐多药细菌导致的死亡风险。
这些儿童经常用抗生素治疗营养不良相关疾病。可矛盾的是,由于潜在的微量营养素缺乏,他们的肠道微生物组可能已经为抗生素耐药性做好了准备...
通常,这些缺陷发生在生命早期前1000天,并可能带来即时和终身的健康缺陷。生命早期前1000 天是肠道微生物组成熟的关键时期,扰动会产生直接和长期的后果。
越来越多的研究让人认识到微生物与营养不良之间的密切关联。一些对单一微量营养素缺乏症的动物研究表明,诱导缺乏症后微生物特征发生了改变。例如,锌缺乏的雏鸡变形杆菌和厚壁菌门的丰度增加;妊娠、哺乳和断奶期间的维生素A缺乏症大鼠显示,其幼崽的微生物组成发生了显著变化,特别是厚壁菌门机会性病原体较高。
肠道环境中另一个容易被遗忘的元素是肠道抗性基因组(resistome),它是广泛表达于肠道微生物群栖息地内的共生菌和致病菌中的抗生素耐药基因(ARGs)和机制的完整集合。随着共生菌群的形成,抵抗基因组在婴儿期更加丰富,并在头几个月内高度动态变化。
抗生素耐药性可以是内在的,也可以是后天的。2019年的一份最新报告估计,5岁以下儿童中每5个死亡案例中就有1个是由于耐药细菌引起的。对营养不良微生物群组的理解仍然不完整,干预和治疗策略也可能被误导。
来自不列颠哥伦比亚大学的研究人员使用最近开发的小鼠模型,研究了多种微量营养素缺乏症,即维生素A、B12、叶酸、铁和锌,这是最常见的缺乏症,对成熟的肠道微生物组、结构和耐药性的影响。研究人员发现微量营养素缺乏会显著改变肠道菌群、真菌群、病毒组的组成,并且提供了以前未知的关于微量营养素如何塑造发育中的肠道抗性基因组的数据。

近日其研究成果发表在《Nature Microbiology》上,这为早期微量营养素缺乏症的长远后果提供了重要的见解。解决微量营养素缺乏问题,不仅仅是克服营养不良,也可能是抗击全球抗生素耐药性祸害的关键一步。我们一起来详细了解一下。
微量营养素缺乏重塑肠道细菌群
断奶C57BL/6N雄性小鼠接受等热量实验对照或多种微量营养素缺乏(即低锌、叶酸、铁、维生素A和B12)饮食28天。正如预期的那样,实验结束时,低微量营养素(LM)饮食的小鼠体重增加较少,发育迟缓和贫血。这里用鸟枪法宏基因组测序来表征饮食治疗前后的肠道微生物组。
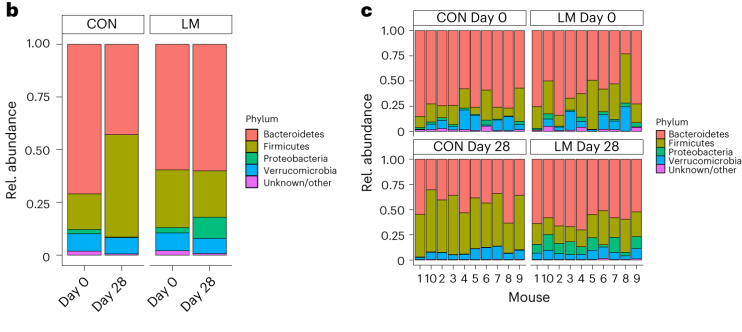
第28天,在LM小鼠中观察到变形菌门、肠杆菌门和Tannerellaceae科的扩增,而CON组的厚壁菌门和丹毒科扩增。LM小鼠中,下列菌群的相对丰度较高:
克雷伯菌
粪杆菌属 Faecalibaculum
Erysipelatoclostridium
副拟杆菌属 Parabacteroides
Enterocloster
经黏液真杆菌属 Blautia
而下列菌群丧失:
Lachnoclostridium
Muribaculum
Ligilactobacillus
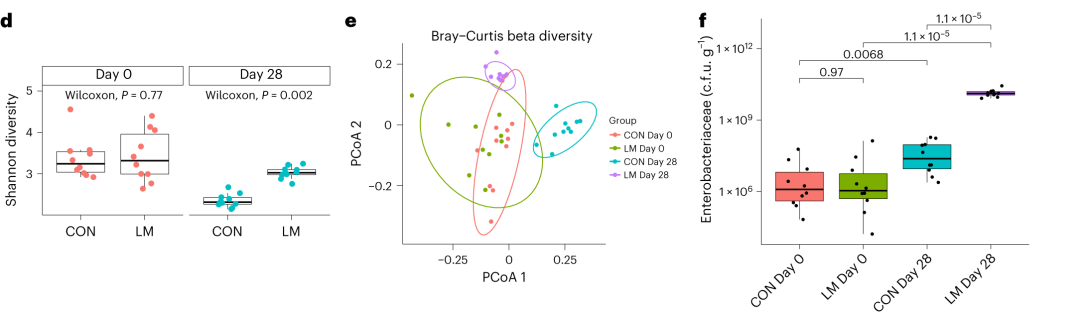
实验结束时,LM小鼠的α多样性较高(Shannon指数,P = 0.002);
PCA图显示,饮食处理后,两组之间存在明显的差异(p=0.001)
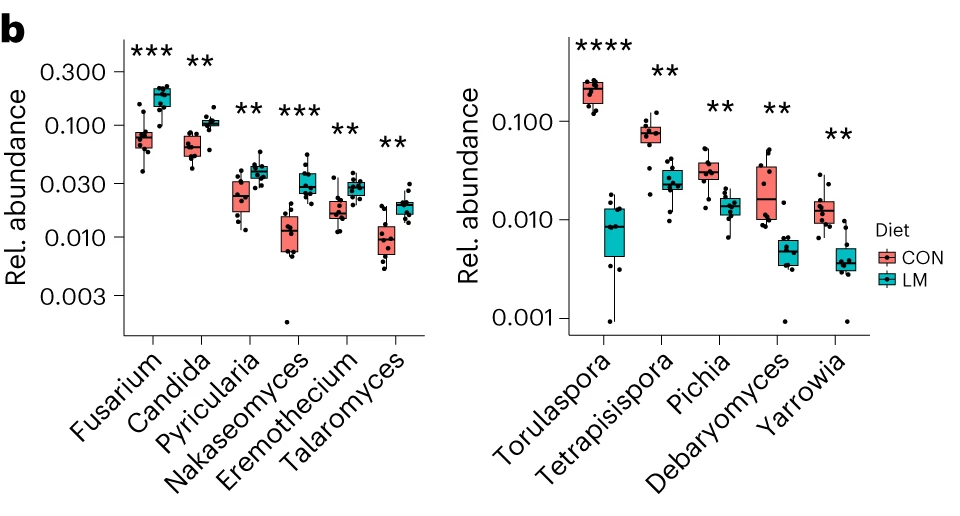
微量营养素缺乏改变真菌群
第28天,LM组中下列菌群增加:
Nectriaceae
Pyriculariaceae
Trichomoaceae
Fusarium
Candida
Pyricularia
Nakaseomyces
Eremothecium
Talaromyces
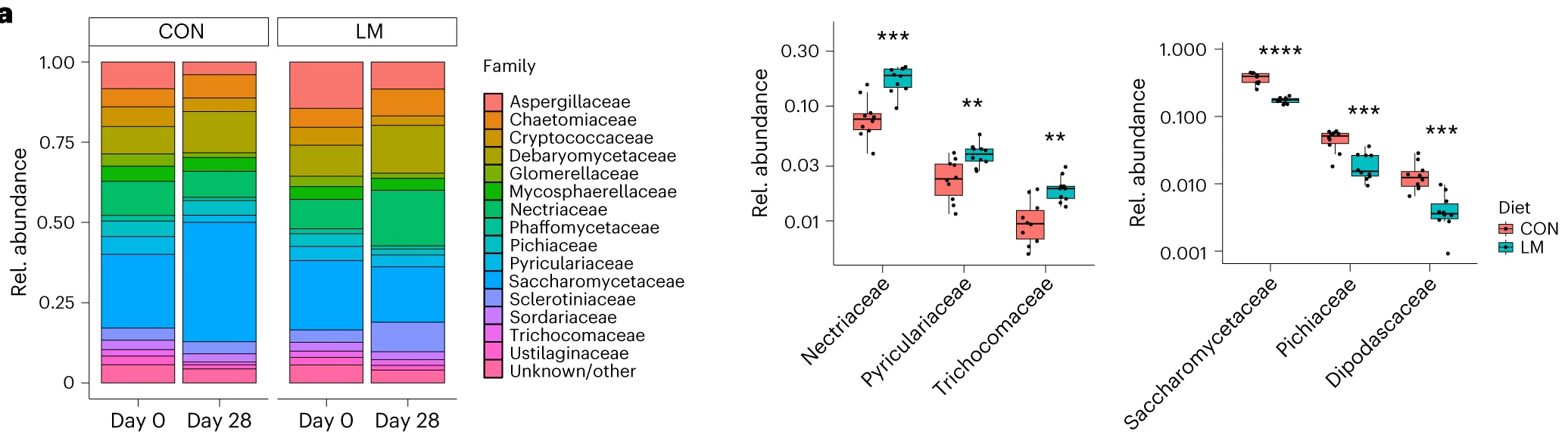
下列菌群丰度降低:
Saccharomycetaceae
Pichiaceae
Dipodascaceae
微量营养素缺乏改变病毒组
LM小鼠中,下列噬菌体丰度更高:
Marseilleviridae
Herelleviridae
Microvirdae
对照小鼠中,下列菌群的丰度更高:
Mypviridae
Podoviridae
Caliciviridae
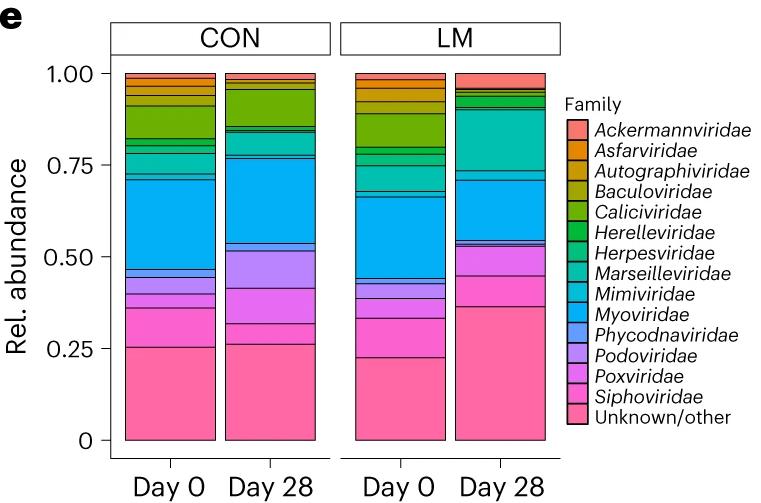
LM组的β多样性与对照在第28天有显著差异(Bray-Curtis,PERMANOVA,P < 0.01)
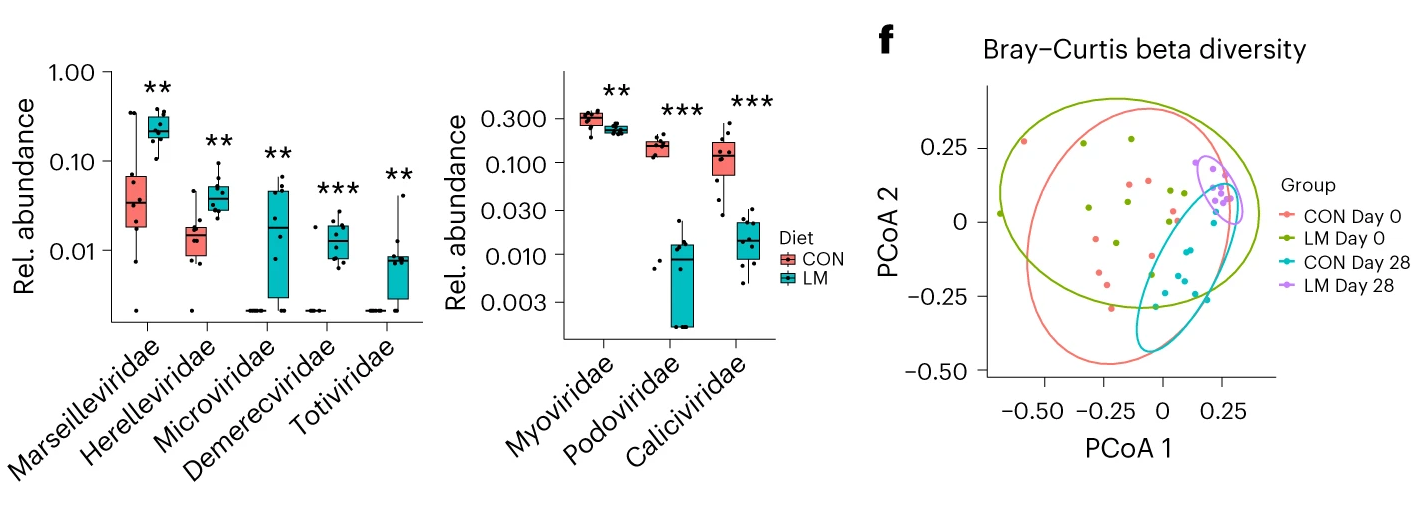
指标分析确定了推动变化的关键微生物
发现了14种指示细菌:
Pseudoalteromonas spongiae
Klebsiella sp. P1CD1
Klebsiella sp. BDA-134-6
Klebsiella quasivariicola
Klebsiella grimontii
Kaistella jeonii
Enterobacter cloacae complex sp. FDA-CDC_AR_0164
Corynebacterium stationiis
Comamonas aquatica
Candidatus Synthrocurvum alkaliphilum
Candidatus Arthromitus sp. SFB-mouse-NL
Candidatus Arthromitus sp. SFB-mouse
Bacillus sp. 1 NLA3E
Acinetobacter equine
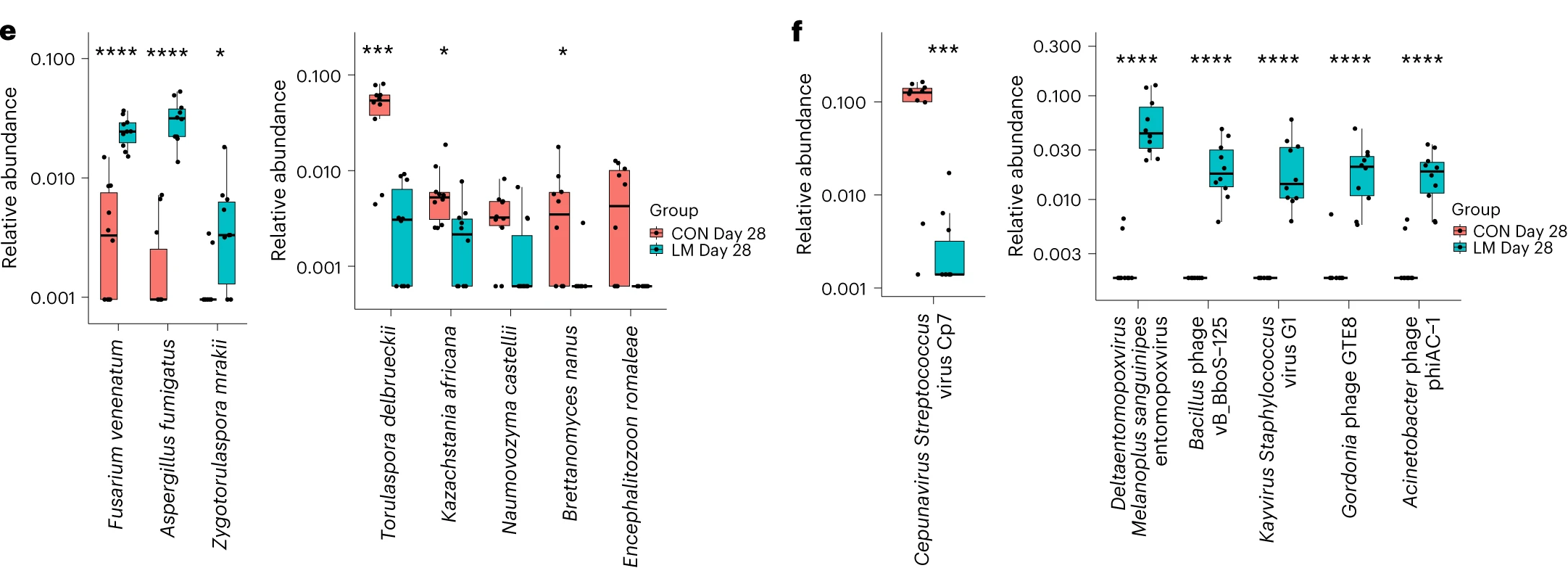
在真菌组和噬菌体组中,LM小鼠中下列相对丰度显著增加:
Aspergillus fumigatus
Fusarium venenatum
Zygotorulaspora mrakii
Acinetobacter phage phiAC-1
Bacillus phage vB_BboD-125
Gordonia phage GTE8
Kayvirus Staphylococcus virus G1
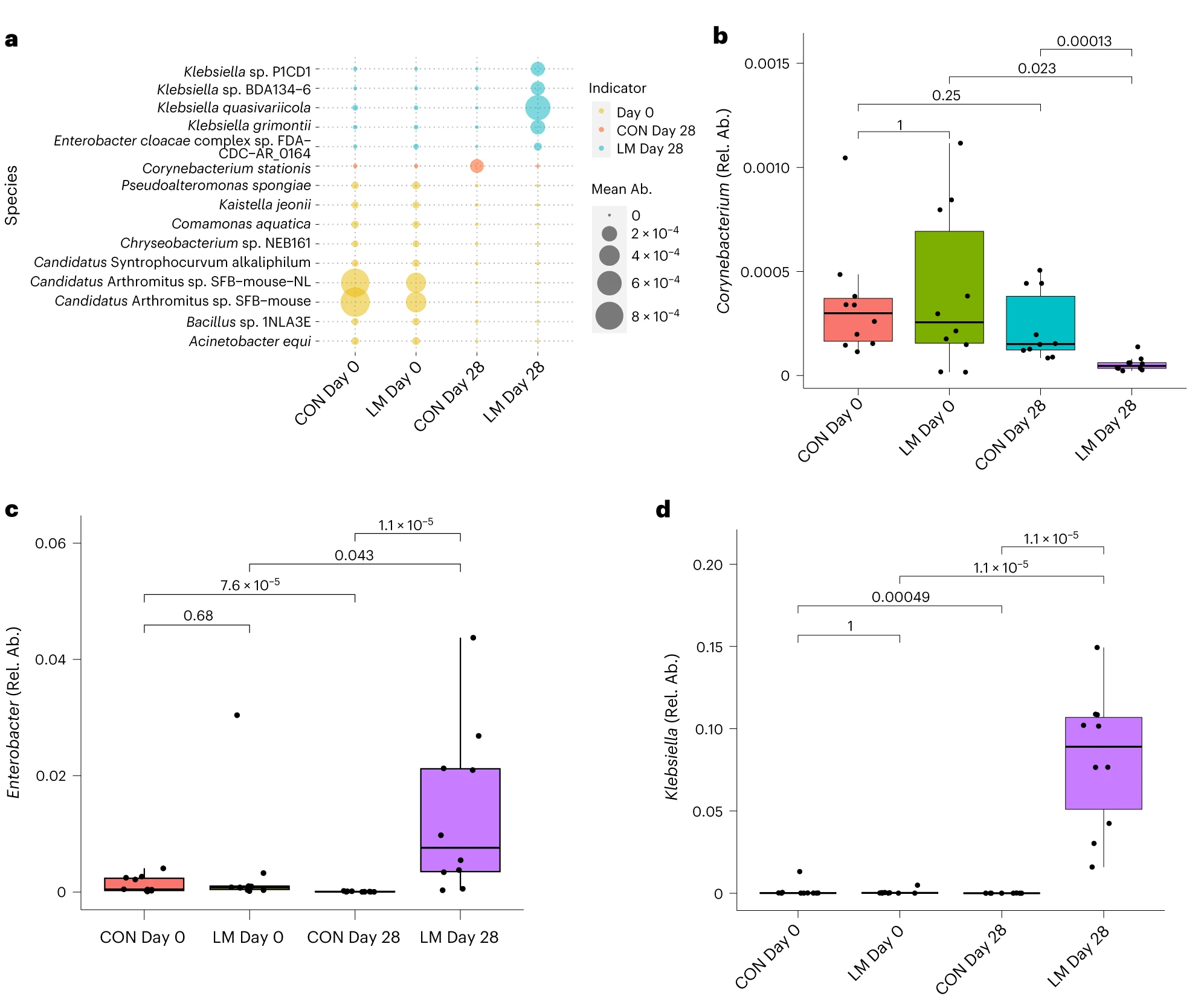
微量营养素含量低扩大机会性细菌和真菌
在营养不良的儿童中,机会性细菌的扩张(在不利情况下可能引发危害的微生物)是肠道的常见表型。因此,研究人员将模型中的机会性细菌与常见于营养不良儿童中的细菌进行表型比较。
第28天,LM小鼠中总机会性细菌的相对丰度总体增加(P < 0.0001)。11个分类单元中,有7个在第28天LM组的相对丰度显著增加:
Klebsiella
Enterococcus
Phocaeicola vulgatus
Escherichia
Campylobacter
Haemophilus
Shigella
有3个在LM组中丰度减少:
Streptococcus
Staphylococcus
Prevotella copri
在LM的小鼠真菌群落中,观察到Candida dubliniensis 的相对丰度较高(P < 0.019)。
机会性细菌与耐药性扩展相关
抗生素耐药性,无论是内在的还是后天的,都是由几个关键机制驱动的。
使用综合抗生素耐药性数据库(CARD)对肠道耐药性组进行分析显示,总ARGs的相对丰度增加(P = 1. × 10−5)。
随后的分析表明,抗生素外排和抗生素失活是改变的最常见的内在耐药性机制。
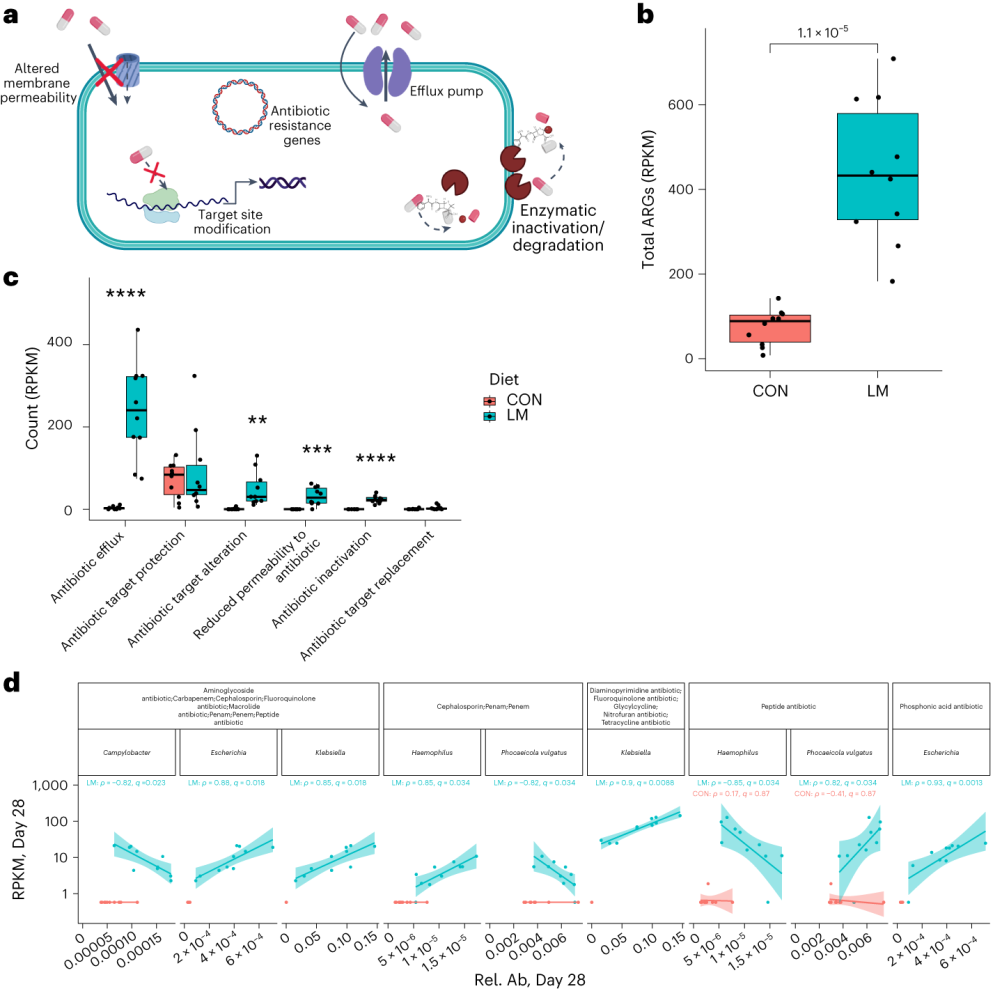
第28天LM组的ARG α多样性显著高于对照组(P = 0.0092)。
基于Bray–Curtis的相异性指标显示,低微量营养素饮食强烈影响了早期肠道抵抗。ARGs的计数显示,绝大多数(73%)ARGs仅在LM第28天组中流行≥30%。
将CARD数据库映射和药物分类分析显示,氟喹诺酮类/大环内酯类/青霉素类抗生素(Q < 0.0001)是LM处理小鼠中最常见的药物耐药机制改变,其次是磷酸酯类(即福氏霉素)(Q < 0.001),以及二氨基嘧啶类/氟喹诺酮类/甘氨环素类/硝呋环酮类/四环素类(Q < 0.001)。
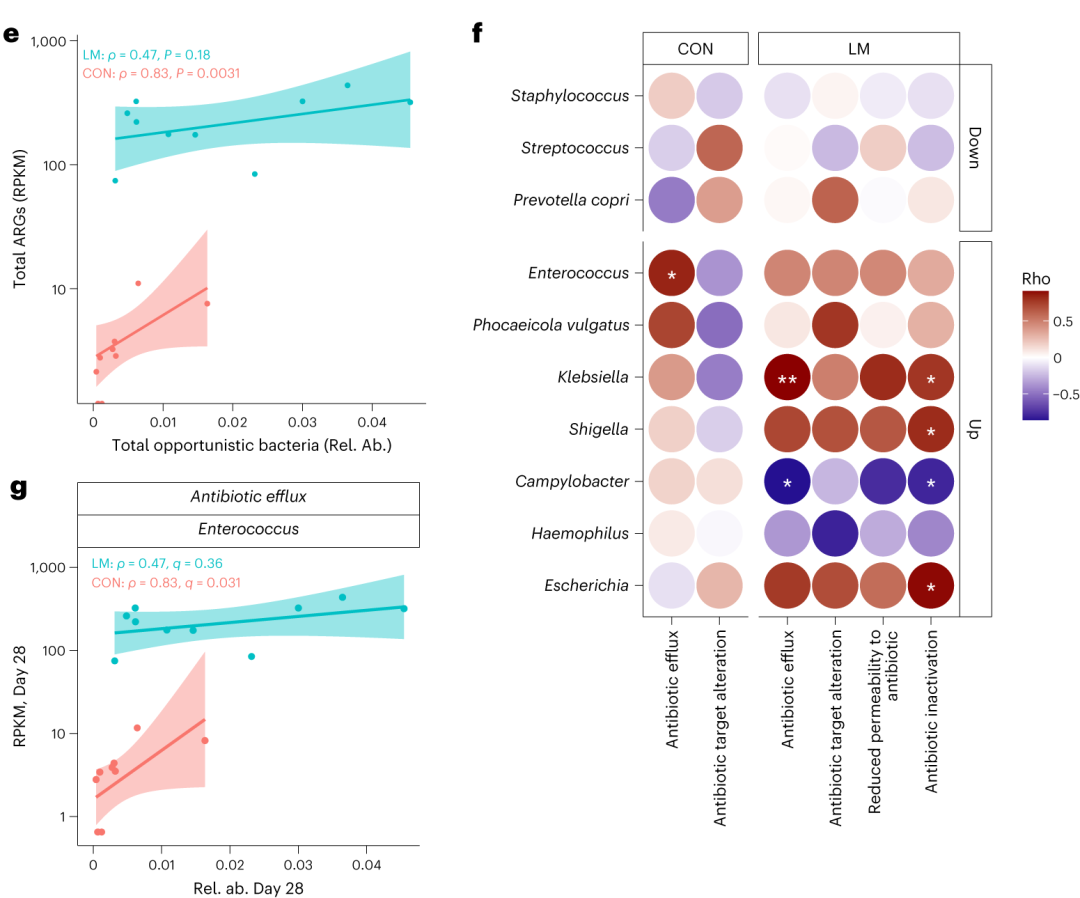
▸ 接下来,研究人员提出是否有药物类别或耐药性机制与任何细菌门或机会性细菌相关?
事实上在LM小鼠中,克雷伯氏菌、嗜血杆菌、埃希氏菌、弯曲杆菌、Phocaeicola vulgatus和几种药物类别之间存在正相关(Q < 0.05)。不出所料,克雷伯菌和大肠杆菌与ARGs药物类别的相关性比其他机会细菌更强。
在个体机会性细菌中,克雷伯菌和弯曲杆菌与外排机制相关,克雷伯菌,志贺菌,弯曲杆菌和埃希氏菌与抗生素失活相关。
肠球菌与外排机制相关,但仅在对照组中。
细菌氧化应激与内在耐药性相关
环境压力源,如营养缺乏,已被证明会触发细菌的压力反应,从而诱导抗生素耐药性机制作为生存策略。矛盾的是,细菌也可以产生活性氧(ROS),在致命压力的存在下自毁。
研究人员研究了LM喂养的小鼠的应激反应机制是否发生了改变,以及它们是否与个体ARGs相关。
事实上,在LM小鼠中发现编码氧化应激和氧化应激反应的基因更丰富,总ARGs与氧化应激之间具有很强的相关性(P = 0.0098)。
具体来说,氧化应激反应与下列之间存在强烈的相关性:
抗生素外排泵ARO 3003551,emeA、ARO 3003948,erfA
抗生素靶点保护:ARO 3000300,IsaA
抗生素靶点替代:ARO 3002875,dfrE
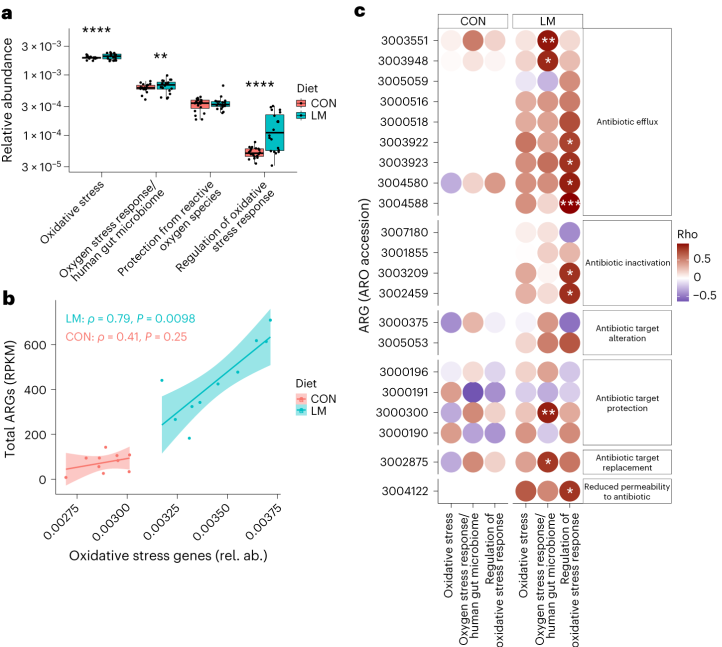
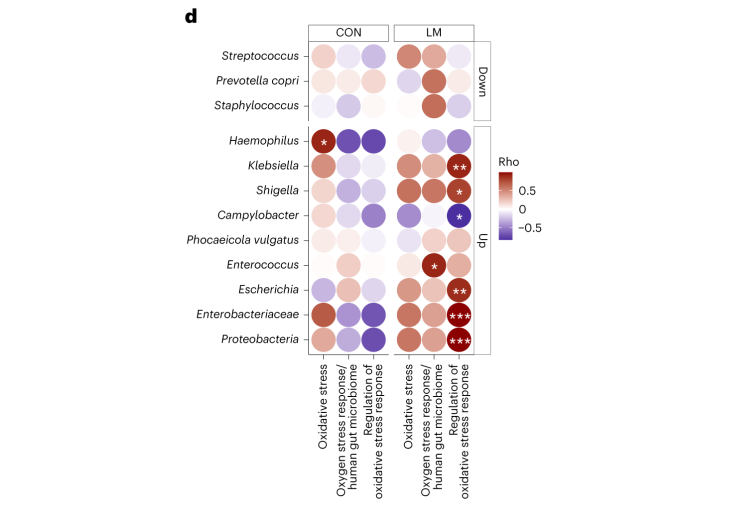
在对照小鼠中,总体氧化应激与嗜血杆菌之间存在强烈的相关性(p<0.05)。
在LM小鼠中,氧化应激反应的调节与克雷伯杆菌、志贺氏菌、弯曲杆菌、大肠杆菌、肠杆菌科菌和变形菌门菌的增加相关。
讨论与总结
微量营养素缺乏是一项重要的公共卫生危机,同时也是一个容易忽视的研究领域。该研究基于先前的动物研究,强调了这些微量营养素缺乏如何影响发育中的肠道微生物组。此外还探索了耐药基因组。
低微量营养素 & 肠道微生物组
在低微量营养素饮食28天的小鼠体内,细菌、真菌和病毒/噬菌体粪便种群发生了变化 。由于微量营养素不足的影响,变形菌门细菌和机会性细菌,如克雷伯菌、大肠杆菌、志贺菌、衣原体、肠球菌、弯曲杆菌、肠杆菌、Phocaeicola vulgatus富集。
研究表明,饮食扰动确实会破坏肠道中正在发育的真菌生物群落和病毒组/噬菌体。还观察到LM小鼠体内病毒/噬菌体的富集,这表明了一个不成熟(即婴儿)表型和发育延迟。这一特征可能对细菌适应能力和宿主免疫反应产生影响。
真菌组在早期生命发育阶段受到饮食和其他环境因素的影响,可能对短期和终身健康产生影响。两个实验组的真菌携带量随着群落成熟而增加。然而,在第28天,低微量营养素饮食组的小鼠体内明显增加了致病真菌念珠菌,这是一种常见的侵袭性物种。
这些发现与一个在马拉维队列中的研究结果一致。该研究报道了在无锌情况下给予多微量营养素粉剂(MNP)后,马拉维队列的肠道微生物组中原生动物和真菌群落的增加。埃希氏菌-志贺菌也在12个月大的婴儿中富集,这些婴儿接受了补充或不补充锌的MNP,强调了微量营养素在形成营养不良儿童肠道群落组成中的作用。
低微量营养素 & 抗生素耐药性
抗生素耐药性是一项迫切的全球公共卫生威胁,肠道微生物组是耐药基因(抗性基因组)的重要来源。
一项先前的研究发现,健康婴儿的耐药基因组中存在预测超过30类抗生素耐药性的400多个基因。其中,167个基因对多个抗生素表现出表型耐药性。有趣的是,婴儿的耐药基因组中还包括对婴儿之前未接触过的多种抗生素的耐药性。这进一步强调了内在耐药基因组作为当前和新兴抗生素耐药性的病原库的重要性。
在本次研究中,发现低微量营养素饮食的小鼠中富集了参与内在抗生素耐药性机制的基因,这些基因与机会性细菌的存在具有关联性。例如,与氟喹诺酮和膦酸(如磷霉素)耐药相关的基因得到了富集。这对于常见患有多药耐药细菌引起的菌血症的营养不良儿童来说,具有重要的临床意义。
本次研究提供了重要发现,并强调了微量营养素缺乏与肠道抗药基因组之间的重要联系。这些结果表明,我们对营养不良微生物组的认识还不完整,需要进一步研究成熟的抗药基因组。
低微量营养素 & 肠道微生物组 & 耐药性
此外,还展示了微量营养素缺乏引起了肠道微生物组成的显著变化。这导致了变形菌门的扩增、机会性细菌和真菌病原体的增加,进一步促进了多种内在耐药基因的表达。
尤其是发现了细菌氧化应激与抗药基因组之间的显著相关性。确定了微量营养素缺乏引起的细菌应激在营养不良宿主中显著促进内在抗生素耐药性的作用。因此,未来解决营养不良和抗生素耐药性问题的策略应将内在耐药基因组纳入考虑,并与可持续发展目标(良好健康和福祉)相一致,最大程度造福于相关儿童。
局限性和未来的方向
本研究的一个局限性是初步的微生物组特征分析中使用了雄性小鼠(基于先前的研究表明雄性对营养不良比雌性更加敏感),研究人员计划在未来探索雌性小鼠。
另一个潜在的局限性是使用了多种微量营养素;然而,这种设计增强了模型,反映了实际应用中与儿童相符的多种微量营养素的复杂协同作用。一个主要的优势是将测序和生物学评估相结合,用于微生物组和抗生素耐药性的特征化。进一步探索数据集可能揭示共存微量营养素缺乏的功能和微生物动态。
未来可以调查肠道生理学以及抗药基因组在致病感染易感性中的作用。进一步探索真菌耐药基因组和该模型中内在抗真菌性能。然而,抗真菌耐药性数据库(MARDy)是目前唯一经过策划的抗真菌耐药性数据库,但更新不够频繁,限制了它的应用。
目前可用的抗生素耐药性分析数据库往往存在高估基因关联性的倾向。数据库的选择取决于研究人员想要回答的问题类型。
CARD数据库的一个局限性是它基于已发表的基因组数据进行策划,可能对经过深入研究的生物体比对少研究的生物体有偏见。不过它的全面列表、专家的定期更新和机器学习算法支持使其成为该领域中的宝贵工具。

抗生素耐药性通常归因于抗生素的过度使用和误用,但本研究表明,微量营养素缺乏的“隐性饥饿”是一个重要因素。需要进一步加强对营养不良与抗生素耐药性之间关系的研究,增进我们对这一领域的理解。还需要制定和实施综合性的干预策略,以解决儿童营养不良及其对健康的连锁反应,以及抗生素耐药性的双重挑战。总的来说,该研究为减少抗生素耐药性提供新的视角,为这方面的研究带来新的思路,并在全球范围内推动健康和可持续发展目标的实现。
参考文献
Littlejohn PT, Metcalfe-Roach A, Cardenas Poire E, Holani R, Bar-Yoseph H, Fan YM, Woodward SE, Finlay BB. Multiple micronutrient deficiencies in early life cause multi-kingdom alterations in the gut microbiome and intrinsic antibiotic resistance genes in mice. Nat Microbiol. 2023 Nov 16.
本文转自:谷禾健康
https://blog.sciencenet.cn/blog-2040048-1410367.html
上一篇:[转载]宠物猫可能塑造人类肠道中的抗生素耐药性和益生菌
下一篇:[转载]消化性溃疡与胃肠道微生物群