博文
[转载]宠物猫可能塑造人类肠道中的抗生素耐药性和益生菌
||

宠物猫——伴侣——耐药性
宠物可以为人类的身心健康做出贡献,它们通常与主人生活得很亲密,有时甚至睡一张床。然而,宠物与其主人之间的密切接触所带来的潜在生物安全风险常常被忽视。狗和猫是很受欢迎的宠物,也是人畜共患感染的重要来源。
研究表明,宠物狗和猫可携带多种人类相关病原体和多种多重耐药细菌,包括耐甲氧西林金黄色葡萄球菌和耐β-内酰胺类抗生素的肠杆菌科细菌。
这些耐抗生素微生物可能通过直接接触、体外寄生虫和气溶胶从宠物传给人类。特别是弱势群体,包括免疫功能低下的老年人和婴儿,可能面临更大的风险。
而且,随着宠物数量的不断增加,抗生素使用在宠物临床会诊中的使用也变得更加普遍。抗生素使用不当可能会促进抗生素耐药性。
例如:头孢维星是一种半合成三代长效头孢菌素,用于犬猫的皮下注射,已在动物临床中广泛使用。在体外,头孢维星对犬猫皮肤病、尿路和牙周感染相关的革兰氏阳性菌和革兰氏阴性菌(需氧菌和厌氧菌)均有作用。头孢维星对犬猫的临床疗效和安全性在尿路感染、脓肿和伤口感染以及犬莱姆病中得到证实。
但是这种长效抗生素的主要风险之一是发生抗生素的耐药性和造成共生菌群的紊乱。据报道,健康犬在使用头孢维星治疗后,粪大肠埃希菌更容易发生β-内酰胺类的耐药性。其他抗生素对患者肠道菌群和耐药性的潜在不利影响,需要进一步的研究确定。
这些强调了宠物中抗生素耐药性风险不容忽视的事实。
近日,华南农业大学动物科学学院团队发表在《Microbiome》上的一篇研究成果揭示了这方面的影响和给出初步结论。
研究发现:
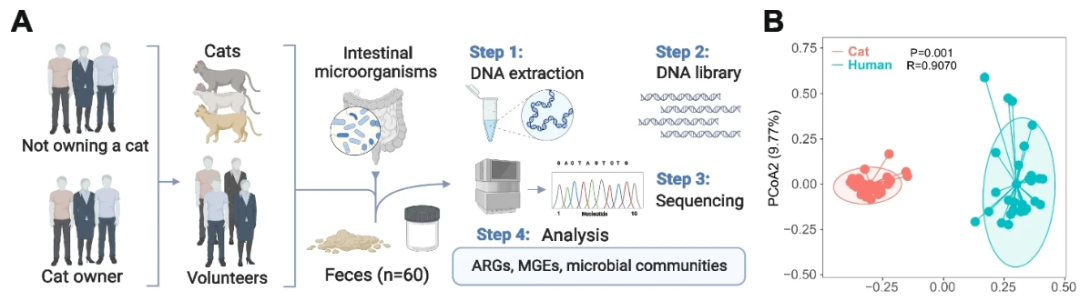
猫肠道中细菌群落的组成和多样性与人类肠道中的细菌群落存在显著差异。
猫肠道中抗生素抗性基因(ARG)的α和β多样性与人类肠道中存在显著差异,并且猫肠道中ARG的丰度显著高于人类肠道中的丰度。
猫肠道和人类肠道中的核心ARG宿主都是肠杆菌科细菌,并且这些核心ARG宿主与生活环境和人类肠道中的不同细菌之间存在水平基因转移的风险。
水平基因转移(HGT)在细菌中抗生素抗性基因的传播中发挥重要作用。抗生素抗性基因是为细菌提供生存能力并抵抗抗生素作用的基因。HGT允许这些抗性基因在不同细菌物种之间转移,甚至不密切相关的细菌物种。
抗生素抗性基因可以通过多种机制水平转移,包括接合、转化和转导。接合涉及通过细菌细胞之间的物理连接直接转移遗传物质,通常是抗生素抗性基因传播的主要机制。在此过程中,携带抗性基因的质粒可以从供体细菌转移到受体细菌。
其中一类容易获得抗生素耐药性的细菌是革兰氏阴性菌,如大肠杆菌、克雷伯菌、沙门氏菌等。转移机制包括共轭传递和自由DNA的吸收。
另一类容易获得抗生素耐药性的细菌是革兰氏阳性菌,如金黄色葡萄球菌、肺炎链球菌等。这些细菌通常通过自由DNA的吸收来获得外源基因。
抗生素抗性基因的HGT,可以发生在各种环境中,包括医院、农场和自然生态系统。抗生素的过度使用和滥用、细菌群体密度高以及移动遗传元件(例如质粒和转座子)的存在等因素导致 HGT 可能性增加。
通过 HGT 传播抗生素耐药性对细菌感染的治疗提出了重大挑战。它使细菌同时获得对多种抗生素的耐药性,使其难以根除。
可以假设,猫肠道中的这些核心抗生素抗性基因(ARG)宿主可以作为瞬时细菌通过不同途径进入人类肠道,并通过基因转移进一步改变主人肠道的耐药组。
令人担忧的是,本研究确定的核心ARG宿主肠杆菌科细菌,还包括人类肠道常见的病原菌如大肠杆菌、沙门氏菌、志贺氏菌等致病菌,可能带来更复杂的抗生素耐药性和致病性风险。一起来详细了解一下。
01
方法和样本
样 本
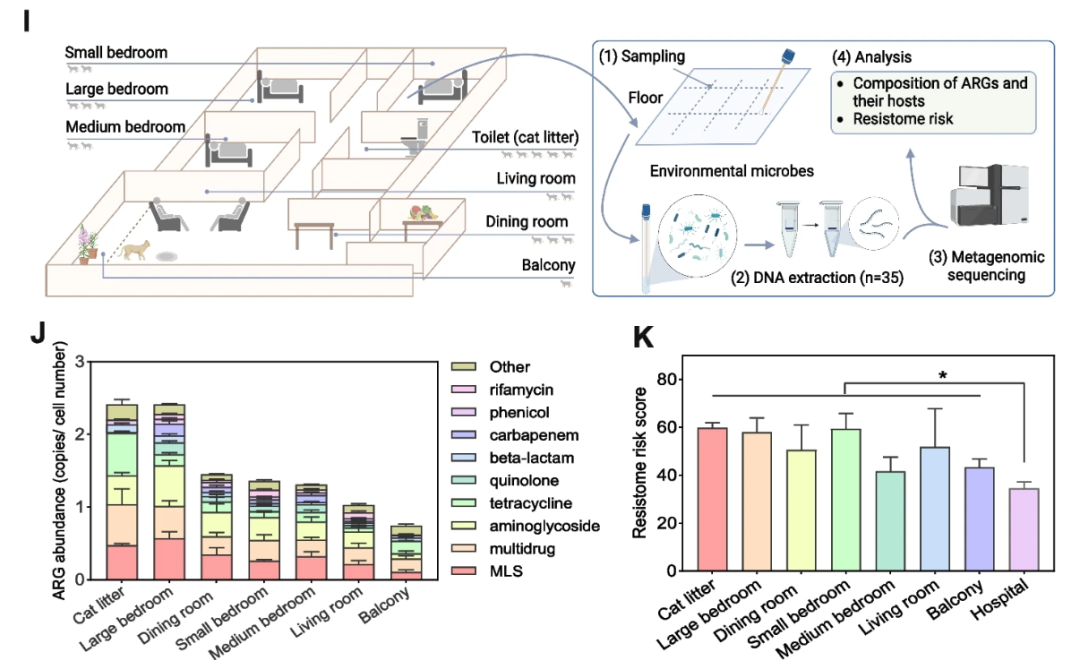
团队从2020 年 8 月从中国广州的 30 只宠物猫和 30 名志愿者采集了共计60份肠道粪便, 选择其中一位猫主人的生活环境采集了养猫环境的样本,包括客厅、餐厅、阳台、小卧室、中卧室、大卧室、猫砂(位于卫生间)等区域菌群,持续采样共计得到35个混合样本生活环境。然后进行宏基因组测序,每个样本获得6~8G的原始数据。
方 法
下载、整理综合抗生素耐药性数据库(CARD v3.2.5,card.mcmaster.ca),并使用 DIAMOND 软件(v2.0.15.153)构建 ARG 数据库。从NCBI网站下载了医院环境中的19个宏基因组测序样本,以比较养猫环境和临床环境中的ARG。
通过将数据与 VFDB_setA 数据库(最后更新:2022 年 10 月 7 日)进行比较,确定了 MAG 中的毒力因子(VF),这些 MAG 是猫、人类以及生活环境中肠道中的细菌病原体。
使用 BLAST 工具将宏基因组组装中的重叠群与 ARG、MGE 和 VF 数据库进行比较,以获得 ARG(ARG-like contigs)、移动相关 ARG(ARG-MGEs like contigs)和移动相关 ARG 的丰度。
02
主 要 结 论
▼
宠物塑造人类肠道中的耐药组
肠道含有大量的微生物,它们由相对恒定的常驻细菌和从外部环境进入的暂存细菌组成。
常驻菌是肠道菌群的主要组成部分,通过促进宿主的营养、免疫、消化等正常生理功能,与环境和宿主保持动态平衡。暂存细菌是通过接触和气溶胶进入肠道的无害或致病性外来细菌。
正常情况下,常驻菌在肠道内粘附、定殖、繁殖,形成屏障,通过拮抗作用抑制和排斥暂住菌,从而保护肠道稳态和宿主健康。
长期环境暴露重塑肠道微生物群,猫肠道ARG高于人类
通过长时间的暴露,生活或工作环境中的微生物也会塑造肠道菌群,而作为抗生素抗性基因(ARG)重要宿主的微生物组成的变化会导致耐药组的变化。
在这项研究中,研究人员发现猫肠道中菌群的组成和多样性与人类肠道中的细菌群落存在显著差异。猫肠道中ARG丰度显著高于人类肠道中的丰度,包括所有类型的ARG。
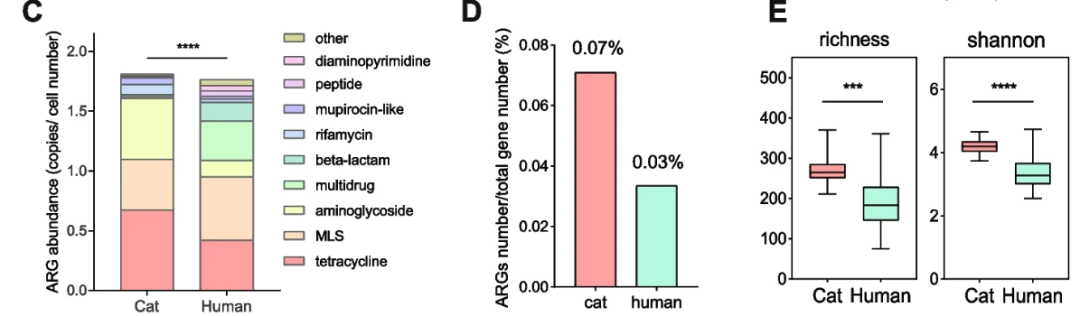
携带高风险mcr-1耐药基因的细菌也已从猫和狗身上分离出来。因此,猫肠道中存在的较高的抗生素耐药性风险不容忽视。
mcr-1基因不是一种新病菌变种,是存在于质粒上的一段基因。mcr-1是一种编码耐药蛋白的基因,它使细菌对一种名为"多粘菌素"(colistin)的抗生素产生耐药性。
多粘菌素是一种被广泛使用于治疗严重感染的最后一线抗生素。mcr-1基因的发现引发了对多粘菌素耐药性传播的担忧。
mcr-1基因的传播主要通过水平基因转移的机制进行,特别是通过共轭传递。共轭传递允许细菌通过直接细胞接触来传递质粒,这些质粒携带mcr-1基因和其他抗生素耐药基因。这种传播方式使得细菌能够快速获取多粘菌素耐药性,并在不同的细菌种群中广泛传播。
此外,该研究发现,猫主人肠道中APH(2''-IIa和ACC(6')-Im抗性基因的丰度明显高于非猫主人。这些耐药基因也是在这些检测的猫中的核心抗药基因。
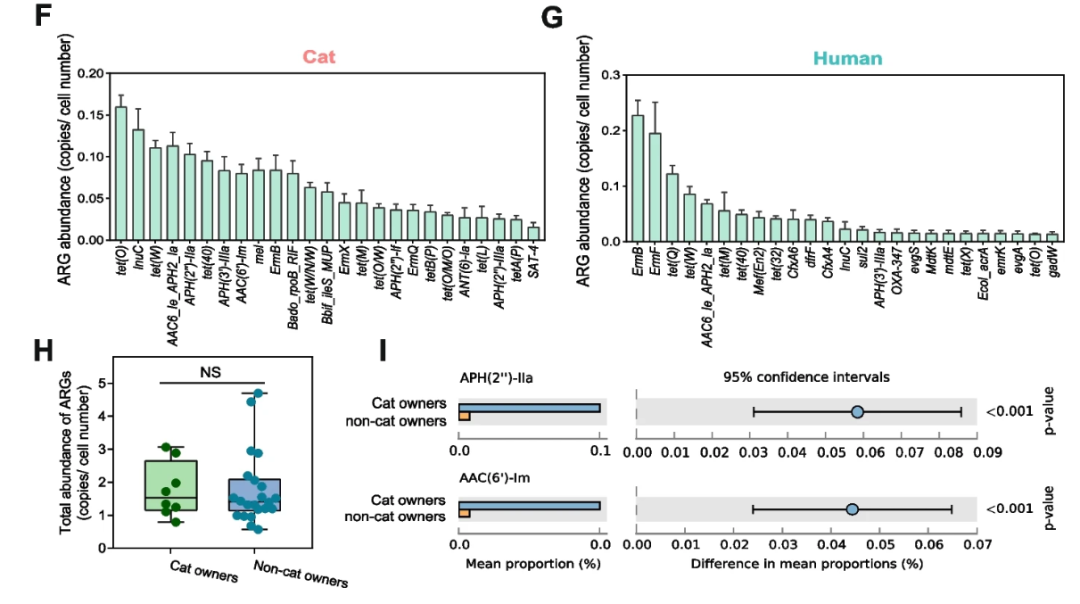
APH(2''-IIa)和ACC(6')-Im是两种常见的抗生素耐药基因,它们分别编码着两种不同的酶。
APH(2''-IIa)是一种磷酸化酶,它能够将氨基糖苷类抗生素中的2''-羟基位点磷酸化。这种酶的作用使得抗生素无法有效地结合到细菌的核糖体上,从而降低了抗生素的杀菌效果。APH(2''-IIa)基因的存在使得细菌对氨基糖苷类抗生素产生耐药性,如庆大霉素、新霉素等。
ACC(6')-Im是一种酰基转移酶,它能够在氨基糖苷类抗生素中的6'-氨基位点上转移酰基基团。这个酰基转移的过程会导致抗生素失去其杀菌活性。ACC(6')-Im基因的存在使得细菌对氨基糖苷类抗生素产生耐药性,如卡那霉素、庆大霉素等。
这两种抗生素耐药基因的存在使得细菌能够通过改变抗生素的结合方式或代谢方式来逃避抗生素的杀菌作用,从而导致抗生素治疗的失败。
宠物抗性基因对主人肠道细菌的影响
之前的研究也表明宠物狗与其主人之间的大环内酯类抗性基因具有很强的相关性。且宠物的抗性基因与人类的抗性基因相似。因此,可以假设宠物在一定程度上塑造了主人的肠道耐药细菌。
猫肠道和人类肠道中的核心ARG宿主都是肠杆菌科细菌,并且这些核心ARG宿主与生活环境和人类肠道中的不同细菌之间存在水平基因转移的风险。当然,这些 ARG 及其宿主也有可能在较长时间内附着并定植于人类肠道。
研究表明,长期在农场工作饲养者的肠道微生物组和耐药组可以被重塑。本研究确定的核心ARG宿主肠杆菌科细菌包括了人类肠道常见的耐药细菌如大肠杆菌、沙门氏菌、志贺氏菌等致病菌,可能带来更复杂的抗生素耐药性和致病性风险。
▼
宠物影响人类耐药性的途径
抗生素抗性基因(ARG)及其宿主在环境中的主要传播途径是通过接触,例如空气和直接接触。
空气是不是宠物影响人类耐药组的重要途径?
由于养猫家庭中存在独特的气味,人们推测猫挥发的抗生素抗性微生物和ARG可能漂浮在养猫环境的空气中。
前期研究也证实环境中的微生物和ARG可以以气溶胶的形式进入人体。不过,该研究结果表明,从猫肠道(粪便)挥发到空气中的微生物和 ARG 极少,这表明空气并不是 ARG 从猫传播给主人的主要途径。
宠物猫活动如何影响人类耐药性?
宠物猫是好奇心旺盛的动物,在其活动范围内几乎会覆盖整个生活空间。因此,该研究收集了生活环境各个区域的地板样本,发现这些区域的ARGs丰度与宠物猫的活动频率呈正相关。研究发现猫肠道、环境和人类肠道之间存在水平基因转移,这使得宠物猫可以通过其在生活环境中的活动影响人类耐药组,并且这种影响大于空气传播的影响。对于猫比较活跃的房间尤其如此。
猫对人类肠道及生活环境的抵抗力形成
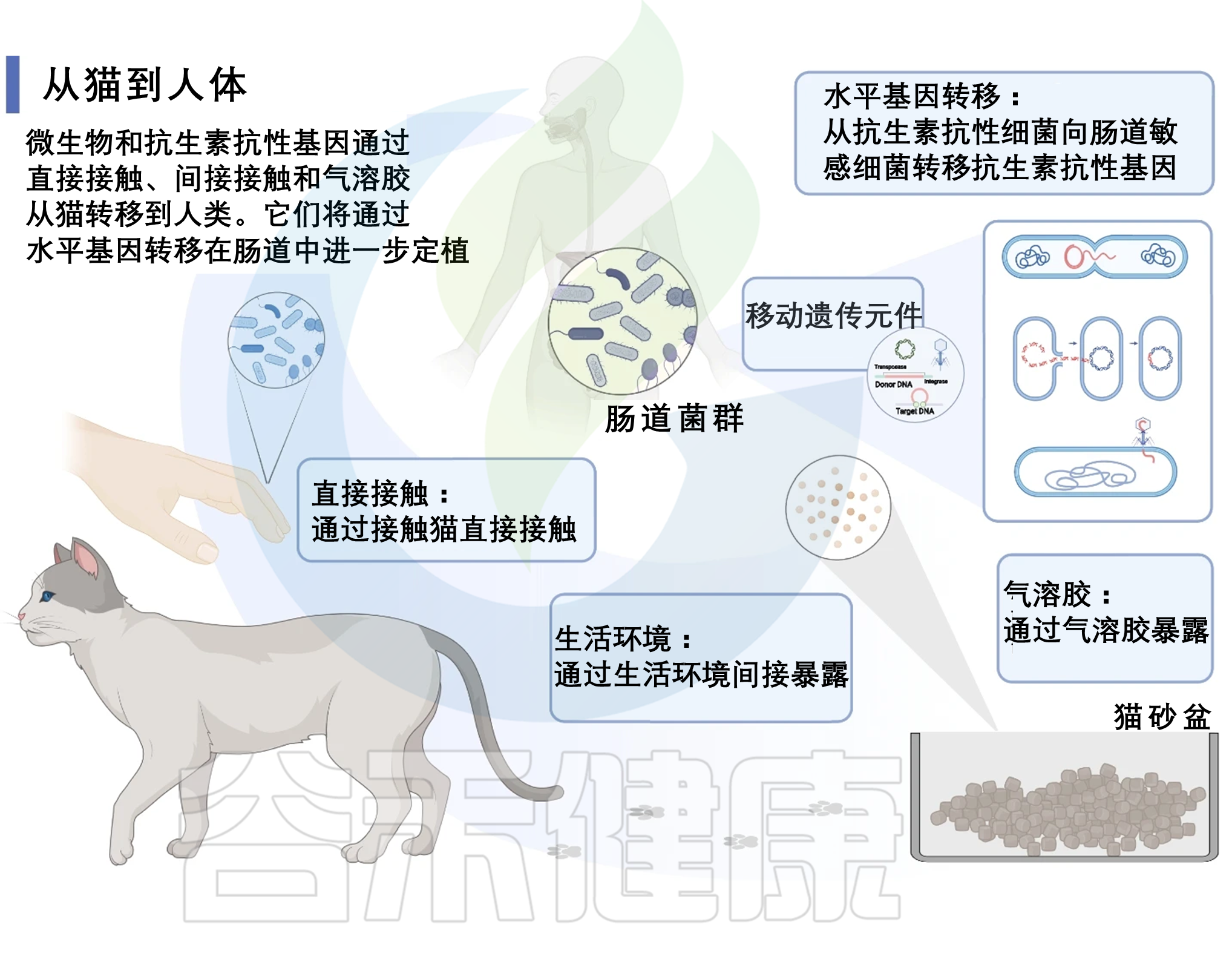
由于肠道的稳态调节,从猫和生活环境进入人类肠道的微生物,包括ARG宿主,通常在人类肠道中是短暂的,很少附着和定植于肠道。这从人类肠道样本中的 MGE 丰度高于猫和环境样本,包括噬菌体、整合子和转座子类型。这些MGE在不同微生物中的ARG水平基因转移中发挥重要作用。这表明人类肠道中 ARG 水平基因转移的风险更大。
注:MGE是指移动遗传元件(Mobile Genetic Elements),它们是存在于细菌和其他微生物中的一类基因组片段,具有自主复制和传递的能力。MGE包括质粒(plasmids)、转座子(transposons)、嵌合子(insertion sequences) 和噬菌体 (bacteriophages)等。
肠道样本中的MGE丰度指该样本中检测到的移动遗传元件的数量或相对含量。通过测量MGE的丰度,可以了解肠道微生物群落中移动遗传元件的存在程度和传播情况。
水平基因转移与微生物群落中的ARG传播
MGE在细菌中起着重要的作用,它们可以携带和传递抗生素耐药基因、毒力因子和其他有益或有害的基因。因此,通过评估肠道样本中MGE的丰度,可以提供有关抗生素耐药性和其他重要基因在微生物群落中传播和演化的信息。
水平基因转移是环境细菌耐药性变异的重要影响因素,MGEs解释了废水中高达10.3%的ARG变异;猪肠道中 ARG变异的13.9%,狗肠道中 ARG 变异的13.76 %。
此外,通过ARG 和 MGE 的重叠群,发现猫肠道和人类肠道中移动 ARG(MGE-ARG 样重叠群)的比例分别占总重叠群的 0.576 ± 0.068 ‰ 和 0.590 ± 0.060 ‰,猫粪便、生活环境和人类肠道中的不同微生物之间也发现了水平基因转移。
▼
来自宠物的耐药风险较低
ARGs 常见于自然环境中,甚至在极端环境中,例如深海和北极永久冻土层。因此,ARG 的存在或 ARG 水平扩散的存在不应被视为高耐药风险。有多种方法可以评估环境的耐药风险。最直接的方法是检测环境中ARG分数的丰度,包括绝对丰度和正常丰度。
一般人们认为环境中 ARG 的丰度越高,抗药性风险就越高。还可以通过结合总 ARG、移动 ARG(MGE-ARG,如重叠群)和与病原菌相关的移动 ARG(MGEs-VFs-ARG,如重叠群)的丰度分析来估计抗药性风险。
在这项研究中,使用这两种方法来评估养猫家庭的耐药组风险,发现养猫和非养猫家庭的 ARGs 丰度没有显着差异。一项有意思的发现是有益细菌双歧杆菌在猫肠道中的丰度明显高于人类肠道中的丰度。而且养猫者肠道中双歧杆菌的丰度显着高于非养猫者。这一证据表明,养猫对于主人肠道有益菌有促进作用。
养猫可以塑造主人肠道和生活环境中的抗药性,但抗药性风险很小。此外,作者也没有找到任何因饲养宠物而导致抗生素耐药性污染的报告。
尽管如此,养猫时清洁很重要。还可以通过调整猫的饮食以及宠物合理使用抗生素来减少ARG,防止ARG富集。
03
结 语
结合本研究初步表明,宠物猫的肠道中抗生素耐药基因(ARG)的丰度显著高于人类肠道。此外,与非养猫者相比,养猫者的肠道中耐药组风险更高,并且生活环境中的ARG丰度与猫的活动频率呈正相关。有趣的是,猫肠道和人类肠道共享相同的核心ARG宿主,即肠杆菌科。
这些发现表明养宠物猫可能对人类肠道中的抗生素耐药性产生影响。然而也发现了一些积极的结果。在猫肠道中,有益菌双歧杆菌的丰度明显高于人类肠道。此外,养猫者的肠道中双歧杆菌的丰度也显着高于非养猫者。这些证据表明,养猫对于可能主人的肠道健康可能具有促进作用。双歧杆菌是一种重要的益生菌,对于维持肠道菌群平衡、增强免疫功能和消化健康至关重要。因此,养猫可能有助于增加人类肠道中有益菌的丰度,提高肠道健康水平。
这样研究结果对于目前养宠物猫的人和相关市场供了一些有趣的见解。人们养猫不仅可以获得宠物的陪伴和快乐,还可能从与猫共享微生物群中的益生菌受益。然而也要认识到养猫可能与抗生素耐药性的传播有关,这需要我们采取措施来合理使用抗生素,清洁卫生,减少耐药性的风险。
未来的研究可以进一步探索养宠物猫与人类肠道微生物群落之间的相互作用,并研究如何最大程度地提高养猫对人类和宠物肠道健康的益处。同时,宠物主人可以关注肠道健康,通过合理的饮食、益生菌补充和定期菌群体检等方式来维护自己和宠物的肠道微生态平衡。
这项研究试验仅对30名志愿者和30只猫进行采样。根据作者描述原本的计划是收集100多个志愿者样本,但COVID-19疫情突然变得严重,一些志愿者不得不退出原计划的研究。尽管研究进展并没有想象中那么顺利,但所获得的结果还是具有重要的参考价值。
参考文献:
Yang Y, Hu X, Cai S, Hu N, Yuan Y, Wu Y, Wang Y, Mi J, Liao X. Pet cats may shape the antibiotic resistome of their owner's gut and living environment. Microbiome. 2023 Oct 23;11(1):235.
本文转自:谷禾健康
https://blog.sciencenet.cn/blog-2040048-1409986.html
上一篇:[转载]拟杆菌在肠道感染中的矛盾作用
下一篇:[转载]微量营养素缺乏引发肠道微生物组改变及抗生素耐药的新启示