博文
FDA批准第100款小分子激酶抑制剂:从格列卫到百花齐放的25年
|
FDA批准第100款小分子激酶抑制剂:从格列卫到百花齐放的25年
2025 年 11 月,美国 FDA 批准了第 100 个小分子激酶抑制剂。这一数字不仅代表了一个里程碑,也象征着一个持续 20 多年的药物研发浪潮——从最初的质疑,到现在成为抗癌药物最重要的药物类别之一。过去 24 年,激酶抑制剂的故事,就是现代精准医学崛起的故事。
一、 从“没人相信”到“彻底改变癌症治疗”:格列卫的诞生
20世纪 80 年代末,Brian Druker 提出了一个当时“非常大胆”的想法:如果找到一种能够抑制 BCR–ABL 激酶的小分子,或许可以让慢性髓系白血病(CML)停下来。然而,当时几乎没有人相信:(1)药化学家觉得“激酶是烂靶点”:人体里 500 多种激酶都要结合 ATP,它们的口袋结构太像了,很难做出足够特异的药物。(2)肿瘤科医生认为“单药不可能治癌症”。(3)制药公司担心市场太小:彼时美国每年只有 5000 例 CML 患者。但 Druker 遇到了关键伙伴 Nick Lydon。Lydon 当时正在做 STI571(后来的格列卫),在筛选中发现它不仅抑制 PDGFR,也抑制 ABL。两人合作,在 1996 年首次证实 STI571 可以清除 BCR–ABL 阳性的细胞。1998 年,他们终于拿到人体试验绿灯。随后发生的事情被写进了肿瘤学史:进入临床 6 个月,反应率接近 100%。
2001 年 4 月,54 名患者中 53 名达成完全血液学缓解(98%),FDA 随即批准。格列卫登上《时代周刊》封面,被称为:“抗癌战争的新弹药。”格列卫不仅成为“神药”,更重要的是,它让整个行业第一次相信——精准靶向药可以改变癌症治疗。
二、25 年、100 款药:激酶抑制剂的“高歌猛进”
截至 2025 年 9 月,随着诺华 BTK 抑制剂 remibrutinib(Rhapsido)获批,FDA 小分子激酶抑制剂正式突破 100 款。
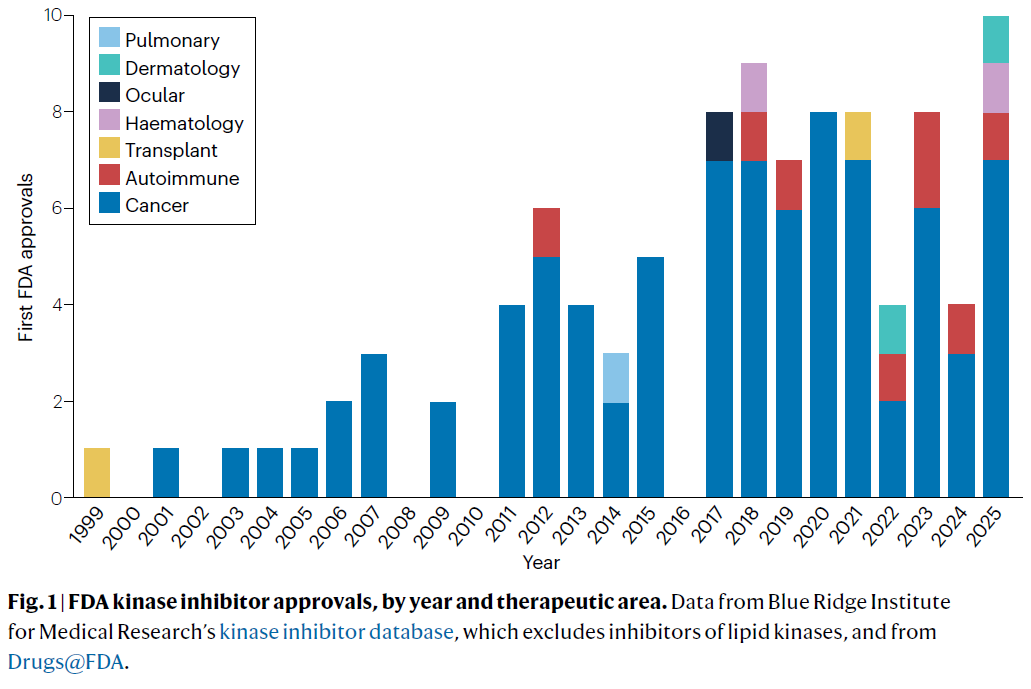
【图 1 | FDA 激酶抑制剂按年份与适应症分布】
根据 Blue Ridge 医学研究所的数据,这些药物主要集中在癌症,但近年来也逐渐扩展到免疫、炎症等疾病。Philip Cohen 曾在 2002 年预言:“激酶将成为 21 世纪最重要的药物靶点。”如今看来,他的判断完全成真。
三、并不是每一个激酶抑制剂都能成为“格列卫”
尽管格列卫的成功点燃了研发热情,但“照着做”并不简单。
EGFR 抑制剂的早期失败与反思
EGFR 因在大量实体瘤中过表达,被视为“天然靶点”。2003 年,阿斯利康的 gefitinib(易瑞沙)获批用于肺癌,但结果令人失望:
肿瘤缩小率只有 10%
与化疗联用也没有获益
2005 年 FDA 限制使用,后来被撤药
直到 2004 年,研究者才发现真正关键的是:只有携带 EGFR 激活突变的患者才对药物敏感。这成为精准医学的重要转折点。随后,第三代 EGFR-TKI osimertinib(泰瑞沙)横空出世,专门抑制耐药突变 T790M,生存期大幅延长:
总生存期:38.6 vs 31.8 个月
术后辅助治疗 5 年生存率:85% vs 73%
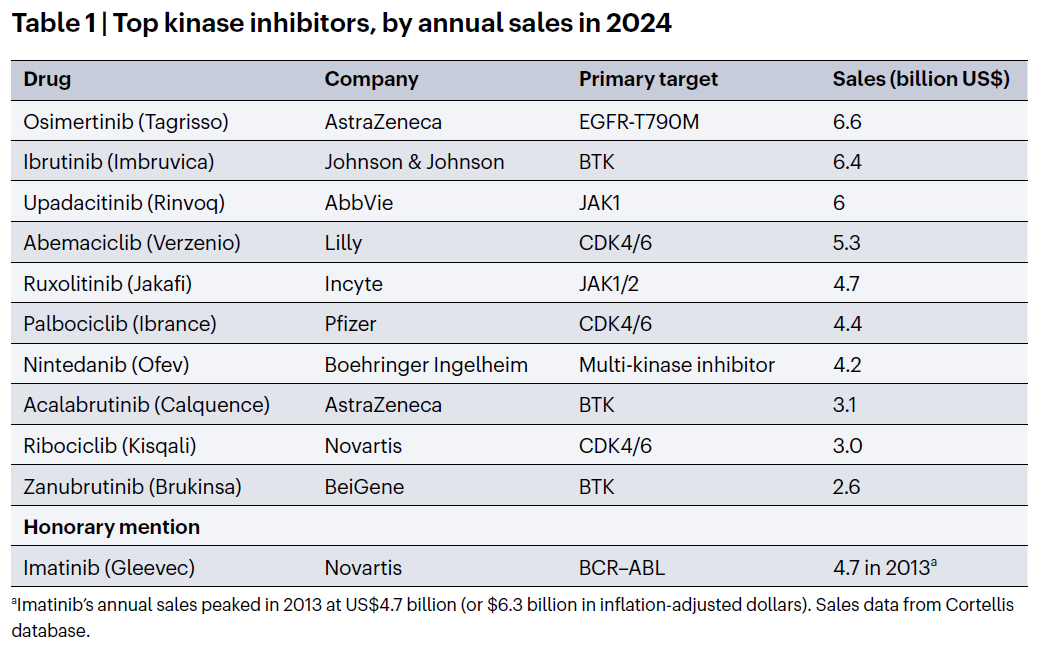
泰瑞沙也成为 2024 年全球销量最高的激酶抑制剂。
四、ALK 体系:从失败到突破的“长跑运动”
ALK 重排仅约占 NSCLC 的 5–7%,但却成为靶向治疗的重要里程碑。Pfizer 原本将 crizotinib(赛可瑞)开发为 MET 抑制剂,后来发现它也能抑制 ALK,于是果断转向。 2011 年赛可瑞获得加速审批。但首代药物耐药快、不能进脑。后来出现的三代 ALK-TKI(如 lorlatinib,劳拉替尼)将 PFS 提高到:超过 5 年(显著优于赛可瑞的 9 个月)这是精准医疗的又一个成功故事。
五、激酶“失败案例”:为什么 IGF1R 药物统统折戟?
IGF1R 过表达被认为是关键致癌机制,因此 2000–2021 年间:
16 个药物进入临床
183 个临床试验
超过 12,000 名受试者
花费 16 亿美元
最终全部失败。核心教训是:仅仅因为靶点“过表达”并不代表它是驱动因素。正如资深研究者所说:“是生物学决定一切,不是表达量。”
六、组合疗法成为主流:单药奇迹其实是“例外”
格列卫的成功让行业一度相信:“找到正确靶点 → 一个药搞定癌症。” 但事实是:
BRAF 抑制剂单用会快速耐药
只有与 MEK 抑制剂联用才能带来更持久疗效
CDK4/6 抑制剂在乳腺癌中必须与内分泌治疗联用
组合已成为绝大多数激酶抑制剂的最佳方式。
七、 激酶药物的争议:有效性、监管与高昂费用
随着加速审批制度的普及,越来越多激酶抑制剂凭借“替代终点”(如缓解率、PFS)上市,但未必都能提供长期生存获益。例如:PI3K 抑制剂 umbralisib 在确认性试验中 反而增加死亡风险,被撤市。德国公共卫生评估发现:50% 的激酶药物无额外临床获益,只有 19% 具有“显著获益。价格也水涨船高:
2001 年格列卫上市价格:$2,200/月
2023 年美国激酶药物平均价格:$17,900/月
最贵的 futibatinib(FGFR2 抑制剂):$44,000/月
这引发了越来越多的政策和伦理讨论。
八、下一代机遇在哪里?
尽管激酶抑制剂已经 100 款,但并未“挖完”:
仍有大量激酶功能未被充分理解
新型突变、耐药机制不断出现
激酶抑制剂正在扩展至自身免疫、纤维化等新领域
新技术(如共价抑制、分子胶、AI 药物设计)正在重新塑造靶点空间
正如 Philip Cohen 所说:“激酶并未被玩坏,它只是进入了新的阶段。”
结语:从格列卫到百款靶向药,精准医学仍在继续加速
从 1980 年代没人相信激酶是好靶点,到 2025 年 FDA 批准第 100 款激酶抑制剂,这 25 年是药物研发史上最精彩的篇章之一。格列卫打开了精准医学的大门,EGFR、ALK、BRAF、CDK4/6 等靶点让行业不断进化。但与此同时,“失败”“高价”“过度审批”等问题也需要严肃面对。百款药只是开始。未来十年,激酶抑制剂仍将是药物研发最重要的战场之一。
本文英文原文发表于:https://www.nature.com/articles/d41573-025-00188-7
中文解读发表于我的公众号“凤凰涅槃之路”
欢迎关注!
https://blog.sciencenet.cn/blog-3592244-1512404.html
上一篇:华人抗体协会Industrial Frontier 第二十二讲:微流控赋能抗体药物发现: 高通量单B细胞筛选和SPR分子
下一篇:苏州沃生获千万美元种子轮融资