博文
Cell Metabolism:当脂肪肝悄悄点燃乳腺癌
||
代谢学人
Cell Metabolism:当脂肪肝悄悄点燃乳腺癌
撰文 | 李悦 郭钰涵 李姿萱 皮婉莹 陈明洁 周文豪 邱瑾
编辑 | 孟美瑶
校对 | 陈明洁

背景介绍
全球约30%的成年人受到非酒精性脂肪性肝病(NAFLD)的影响,且部分患者会进一步发展成肝细胞癌。此外,NAFLD患者中某些类型的肝外肿瘤发病率也显著增加,但其潜在机制尚不明确。主流观点认为,NAFLD伴随的代谢异常(如肥胖和胰岛素抵抗)可促进肝外肿瘤的发生。然而,超过40%的NAFLD患者并不肥胖,而NAFLD本身已被证实为一个独立的肝外肿瘤发病风险因素,其作用机制有别于其他代谢因素。此外,一项大型队列研究显示,在女性中(尤其是在非肥胖个体中),乳腺癌是唯一与NAFLD显著相关的肝外肿瘤。这些临床发现提示,在已知的普遍因素之外,脂肪肝与乳腺癌之间可能存在特定的相互作用。
乳腺组织中的主要细胞类型是脂肪细胞,它们负责储存并释放游离脂肪酸(FFAs)。此外,乳腺癌的发生与发展受到脂肪组织的调控,而乳腺上皮细胞正是嵌于脂肪组织之中。除细胞因子外,脂肪细胞中的脂解作用也能通过释放FFAs,为癌细胞的发生与发展供应能量。
细胞外囊泡(EVs)由微囊泡与外泌体组成,通过其所携带的物质介导不同器官间的交流。EVs还可促进细胞间线粒体的转移,从而调节机体的系统性代谢稳态。循环中的EVs表现出器官趋向性,其分布由跨膜蛋白决定。原发性肿瘤来源的EVs能够重塑远处的转移前微环境,从而为转移性癌细胞的定植创造有利条件。最新研究表明,肿瘤来源的EVs可损害肝脏的代谢功能。然而,远处器官功能障碍是否也能反向诱导原发部位形成促肿瘤环境,目前尚不清楚。
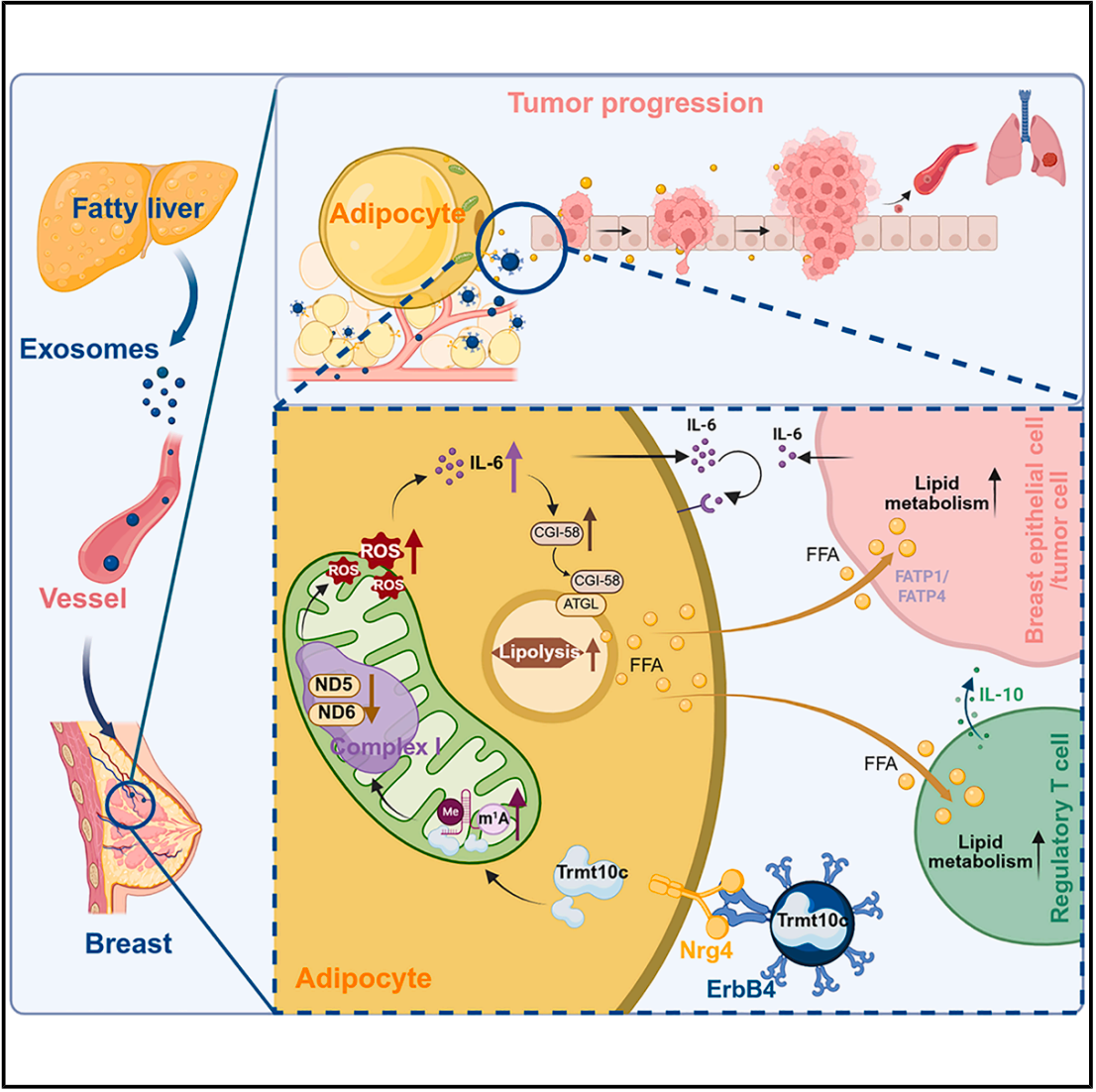
近期,一篇发表在Cell metabolism上的题目为“Liver-breast communication of adipocyte-oriented exosomes drives primary mammary cancer progression”的文章发现,脂肪肝释放的外泌体会优先聚集到乳腺的脂肪细胞中,这些外泌体中富含定位于线粒体的甲基转移酶,将脂质代谢紊乱信号传递至乳腺,从而加速乳腺癌的发生与发展。

敲黑板啦!
1. 脂肪肝通过释放具有乳腺脂肪细胞趋向性的外泌体来促进乳腺癌的发生与进展
2. ErbB4-Nrg4轴决定了脂肪肝来源的外泌体对脂肪细胞的特异趋向性
3. 外泌体中TRMT10C通过对线粒体mRNA的m¹A修饰,诱导脂肪细胞释放游离脂肪酸(FFA)
4. 血浆中ErbB4⁺外泌体可预测患有非酒精性脂肪性肝病(NAFLD)的乳腺癌患者的预后
研究结果
1、NAFLD与人类乳腺癌的发生相关,且这种关联独立于肥胖因素
一项纳入25,947名受试者的历史性队列研究显示,在女性人群中,乳腺癌是唯一与NAFLD显著相关的肝外肿瘤。为了在更广泛的样本中验证NAFLD与乳腺癌之间的关联性,作者在PubMed、Embase、Web of Science和Scopus数据库中进行了系统检索并开展Meta分析。该队列共纳入11项研究,总计141,273名女性受试者,其中5,532例为乳腺癌患者(图S1A)。其中9项研究提供了普通人群中乳腺癌的发病数据,另有2项研究报告了乳腺癌患者的生存数据。Meta分析结果表明,NAFLD与普通人群乳腺癌发病风险显著升高呈正相关(图1A),并且乳腺癌患者的无复发生存期(RFS)更差(图S1B)(小编注:无复发生存期指的是从乳腺癌患者手术后开始计算,到癌症再次复发或者患者因任何原因死亡为止的这段时间。)。
为了进一步验证这一观察结果,作者建立了一个包含357名乳腺非典型增生患者(小编注:乳腺非典型性增生是一种乳腺导管或小叶上皮细胞的异常增殖性病变,属于癌前病变,其特点为细胞形态异常或组织结构紊乱,但尚未达到恶性肿瘤标准)的独立队列。其中有123例(34.45%)被诊断为NAFLD。结果显示,NAFLD患者发展为乳腺癌的风险显著升高(图S1C)。由于NAFLD与肥胖密切相关,而肥胖本身亦可促进肿瘤进展,作者根据体重指数(BMI)将受试者分为肥胖组(BMI ≥ 25 kg/m²)和非肥胖组(BMI < 25 kg/m²)。结果表明,在乳腺非典型增生患者中,无论是肥胖组还是非肥胖组,NAFLD均与乳腺癌发病风险显著增加相关(图1B)。
此外,作者在3,781例乳腺癌患者中评估了NAFLD的预后价值。其中共有942例患者被诊断为NAFLD。与非NAFLD的患者相比,NAFLD患者的无病生存期(DFS)显著缩短,而总体生存期(OS)无显著差异(图S1D和S1E),这一结果与既往研究的报道一致(小编注:无病生存期指的是从患者接受手术结束后开始,到首次发现任何疾病发生迹象(或患者因任何原因死亡)为止的这段时间。)。与乳腺非典型增生患者未来发生乳腺癌的结果相一致,分层分析进一步显示,无论在肥胖组还是非肥胖组中,NAFLD均与更差的DFS显著相关(图1C)。另外,NAFLD患者的空腹血浆葡萄糖(FPG)水平更高。作者根据FPG水平将所有受试者分为三组。结果发现,在所有分组中,NAFLD均与患者较差的DFS相关,且是独立的不良预后因素(表S4)。综上所述,这些临床数据表明,NAFLD与乳腺癌的肿瘤发生发展密切相关。
2、脂肪肝促进乳腺癌
接下来,作者探讨动物模型是否能够重现NAFLD对人类乳腺癌的影响。为排除肥胖这一混淆性因素,作者采用自发性乳腺癌小鼠模型MMTV-PyMT,并给予其高果糖饮食(HFrD),该饮食可诱导NAFLD而不会引起明显体重增加。结果显示,HFrD喂养小鼠出现明显的肝脂肪变性(图S1F),而其体重与对照饮食(CD)组小鼠相当(图S1G)。此外,在8周龄时,两组小鼠的空腹血糖与胰岛素水平也无显著差异(图S1H)。然而,此时HFrD组小鼠乳腺腺体内的早期增生灶覆盖面积明显更大(图1D)。进一步观察发现,HFrD喂养小鼠的首个乳腺肿瘤出现时间更早(图1E),且肺部转移数量显著增加(图1F);在HFrD喂养的C57BL/6小鼠皮下接种同系EO771乳腺癌细胞的乳腺癌模型中也获得了相似结果(图1G与1H)。
NAFLD可导致多系统性代谢紊乱。为探究脂肪肝本身是否能够促进乳腺癌的发展,作者将来源于HFrD或CD饮食小鼠的肝脏移植至CD饮食且原位接种EO771乳腺癌细胞的小鼠体内(图1I和图S1I)。结果显示,与接受正常肝脏移植或未接受移植的小鼠相比,移植脂肪肝的小鼠肿瘤体积显著增大(图1J),但肺转移数量未出现显著差异(图S1J)。值得注意的是,将来源于HFrD喂养小鼠的脂肪肝移植到CD喂养小鼠中后,移植肝脏脂肪变性逐渐减轻,这可能是肺转移差异不显著的原因(图S1K)。为避免该因素对结果的影响,作者进一步将肝组织切片在培养基中培养16小时以获得肝脏条件培养基(CM)。结果显示,与HFrD喂养模型一致,与对照组相比,接受脂肪肝CM处理的EO771荷瘤小鼠肿瘤体积更大(图S1L)且肺转移更严重(图1K)。综上结果表明,脂肪肝本身即可促进乳腺癌的发展。
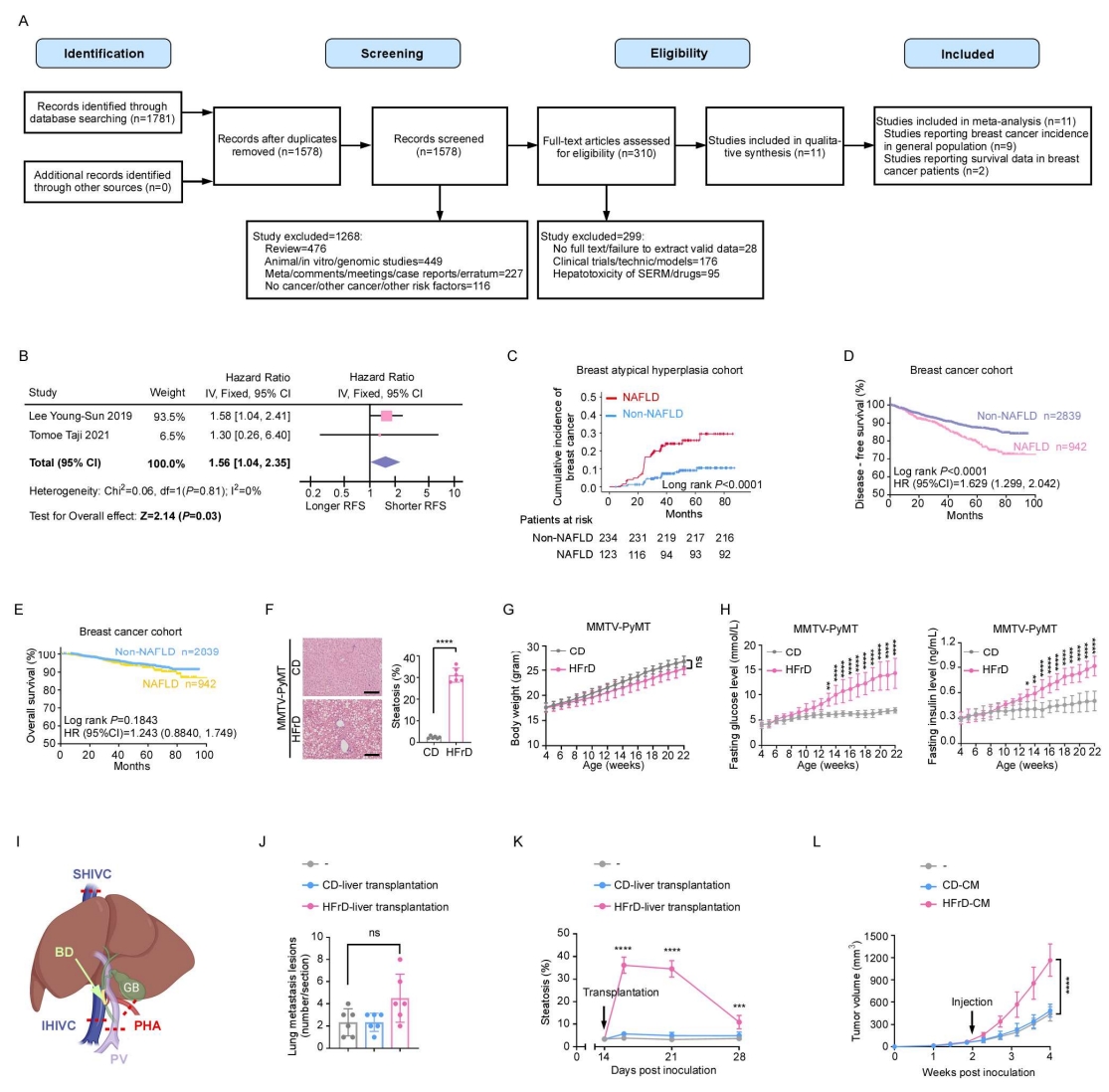
图S1. NAFLD 在人类和小鼠中均增加乳腺癌的风险(对应图1)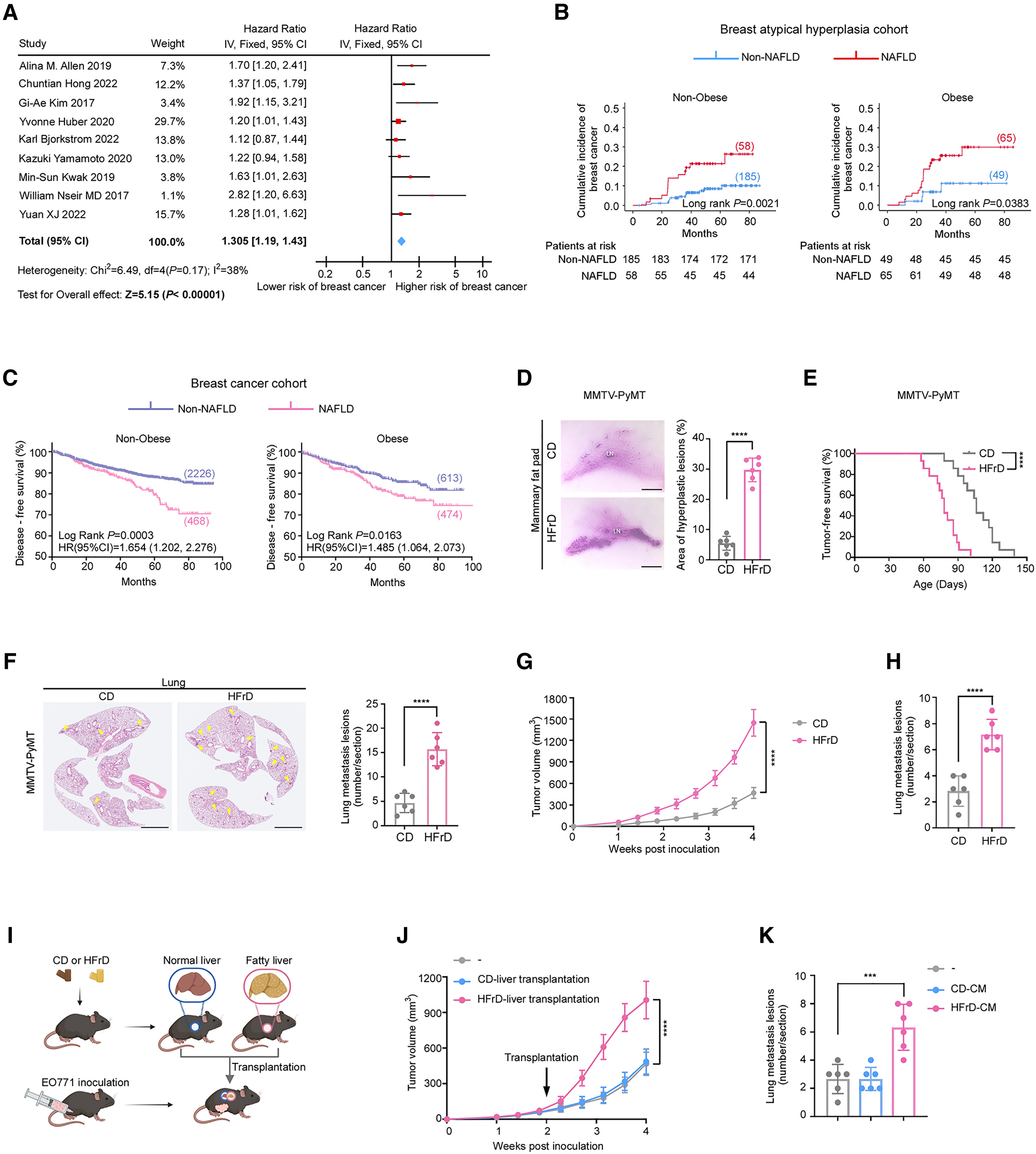
图1. NAFLD 在人类和小鼠中均可增加乳腺癌的发生风险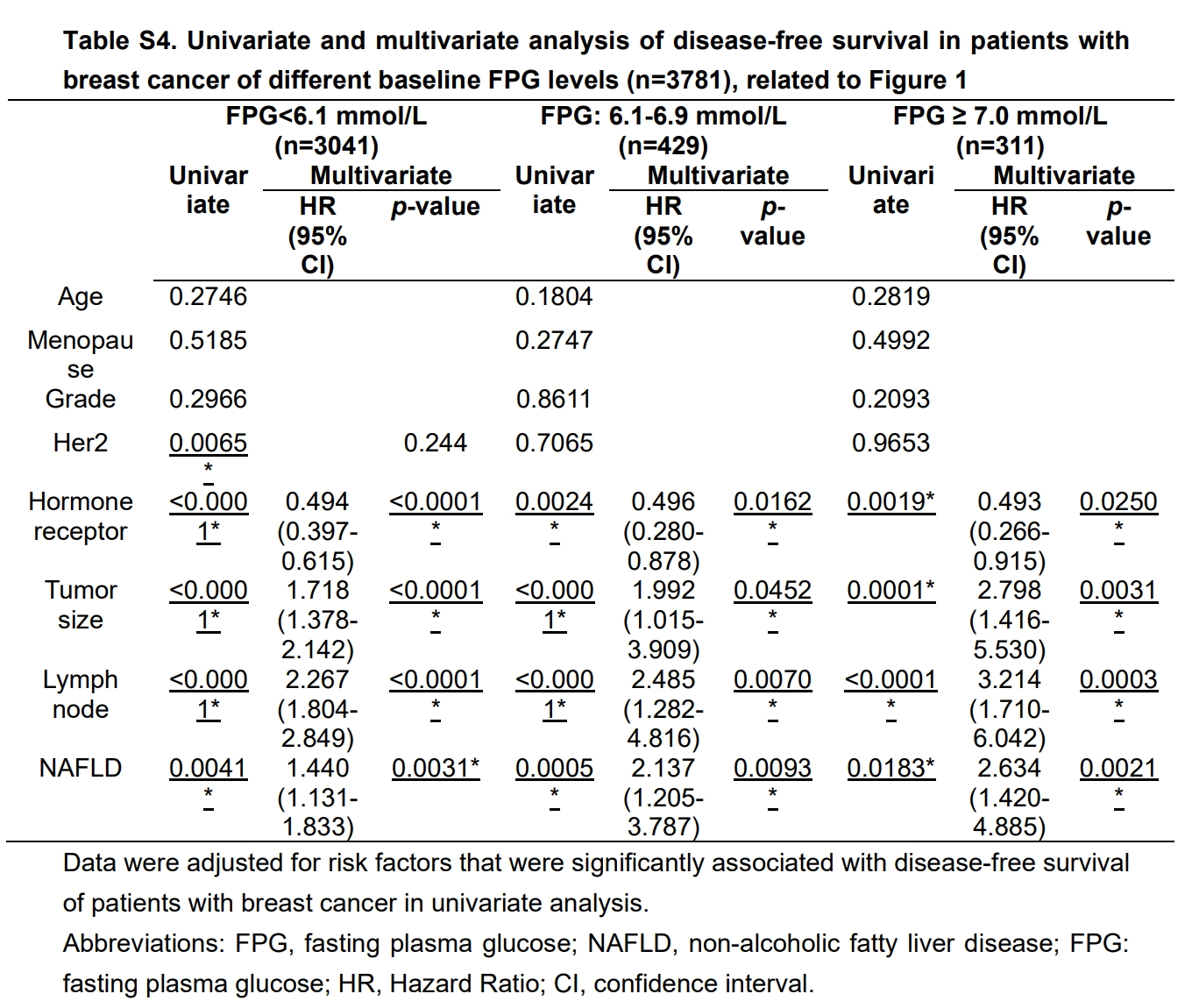
表S4.不同基线FPG水平乳腺癌患者无病生存期的单变量和多变量分析(n=3781)
3、脂肪肝通过靶向乳腺脂肪细胞的外泌体促进乳腺癌的发生发展
为探究脂肪肝中促进乳腺癌发展的关键因子,作者通过超速离心从肝脏条件培养基(CM)中分离得到上清液和沉淀组分(图S2A),并分别将不同组分静脉注射至EO771皮下荷瘤小鼠体内。结果显示,粗颗粒组分可显著加速肿瘤的生长(图2A)。沉淀组分中同时含有外泌体和微囊泡,因此作者进一步将两者分离(图S2A),并通过Western blot进行验证(图S2B)。结果表明,促进肿瘤生长的组分是外泌体而非微囊泡(图S2C)。随后,作者对分离得到的外泌体进行了透射电子显微镜(TEM)观察(图2B)以及纳米颗粒追踪分析(NTA)(图S2D)(小编注:纳米颗粒追踪分析(NTA)是一种基于单颗粒布朗运动(Brownian motion)与光散射原理的动态检测技术,NTA利用激光照射悬浮于液体中的纳米颗粒,这些颗粒会散射光线并被显微镜和高速摄像系统捕捉。系统通过追踪每个颗粒随时间的运动轨迹,根据斯托克斯-爱因斯坦方程计算出扩散系数,从而推算其水合直径,可用于测量纳米级颗粒(通常为10–1000 nm)的粒径分布与浓度。),以确认其形态及粒径分布。外泌体样品中富集了典型外泌体标志蛋白ALIX与CD81,而内质网标志蛋白calnexin及脂蛋白均未被检出(图2B、图S2E、图S2F),表明制备的外泌体纯度较高。NTA结果显示,HFrD喂养小鼠的脂肪肝释放的外泌体数量显著高于正常肝脏(图S2D)。类似地,在另一种由高脂饮食(HFD)诱导的NAFLD小鼠模型中,也观察到肝源性外泌体数量的显著升高(图S2G)。此外,HFrD喂养小鼠血清中外泌体浓度明显增加(图S2H)。作者进一步向小鼠静脉注射不同剂量的HFrD来源的外泌体,结果显示,当注射剂量为30μg时,其血清外泌体浓度最接近HFrD小鼠的生理水平(图S2H)。随后,作者分别在HFrD喂养的MMTV-PyMT小鼠及EO771荷瘤小鼠中应用GW4869和二甲基阿米洛利(DMA)两种临床上常用的外泌体释放抑制剂(小编注:1、GW4869:作用靶点:神经酰胺合成途径(中和鞘磷脂酶2, nSMase2),机制原理:①外泌体主要通过内吞体–多泡体(MVB)–外泌体释放途径生成;②nSMase2可催化鞘磷脂水解生成神经酰胺,而神经酰胺的形成对于MVB膜内陷形成小泡(ILVs)至关重要;GW4869是一种非竞争性nSMase2抑制剂,通过阻断神经酰胺生成,抑制MVB的内陷小泡形成,最终减少外泌体的生成与释放。2、二甲基阿米洛利(DMA):作用靶点:质子交换体(Na⁺/H⁺ exchanger, NHE)与胞内pH调控通路,机制原理:①外泌体的形成依赖内吞体途径和胞内酸化过程,而酸化由Na⁺/H⁺交换系统(NHE)和质子泵共同调控;②DMA通过抑制NHE活性,干扰胞内pH梯度与内吞小泡形成,从而抑制外泌体生物发生与分泌;③同时,DMA还能部分影响细胞膜电位及钙离子稳态,对胞吐作用亦有一定抑制。参考文献:Kim JH, Lee CH, Baek MC. Dissecting exosome inhibitors: therapeutic insights into small-molecule chemicals against cancer. Experimental & Molecular Medicine. 2022;54:1833–1843.)。结果发现,这两种抑制剂均能显著抑制原发性肿瘤的生长(图2C、图S2I)及肺转移(图2D、图S2J)。综上所述,这些结果表明,脂肪肝通过外泌体的释放驱动乳腺癌的发生与发展。
为观察脂肪肝来源的外泌体在体内的分布情况,作者将从肝脏条件培养基(CM)中分离的外泌体用1,1′-二十八烷基-3,3,3′,3′-四甲基吲哚碳氰染料(Dil)标记后(小编注:DiI是一种疏水性碳氰荧光染料,具有两条长链烷基结构,能通过疏水作用稳定嵌入外泌体的脂质双层膜,在水溶液中荧光较弱,而嵌入膜后荧光显著增强,因此可用于对外泌体进行荧光标记与可视化检测。其标记原理在于染料不与蛋白质或核酸结合,而是特异性插入外泌体膜脂,从而赋予外泌体稳定的橙红色荧光信号,可在荧光显微镜、流式细胞术或小动物活体成像系统中直接检测,用于研究外泌体的释放、摄取、胞间转运及体内分布。),经静脉注射至C57BL/6小鼠体内,并利用体内活体成像系统(IVIS)对外泌体在不同器官中的生物分布进行可视化和定量分析。结果显示,来自HFrD喂养小鼠(图2E–2G)及HFD喂养小鼠(图S2K)肝脏的外泌体主要富集于乳腺脂肪。为进一步研究脂肪肝来源的外泌体在不同脂肪组织中的摄取情况,作者分别采集了多种白色脂肪组织(WATs)及肩胛间棕色脂肪组织(BATs)进行分析。虽然在BAT中亦检测到较强的荧光信号(图2H与图S2L),但BAT在成年人体内脂肪组织中仅占极少比例,其生理意义仍存在争议(小编注:目前,对于BAT在人类代谢中的生理意义具有争议。在啮齿类动物中,BAT在全身能量稳态和葡萄糖/脂质代谢中起着核心作用。但hBAT在人体总体重中所占的比例要小得多,且目前对于hBAT质量和活性的精确定量存在限制,因此hBAT在人类代谢活动中的具体功能作用仍有争论,主要有两方观点:1)Yu-Hua Tseng等认为:hBAT与人体的许多代谢活动有显著关联如下: a. BAT活动与BMI之间呈负相关,突出了其在减轻肥胖相关疾病方面的潜在作用; b. 寒冷诱导的BAT活性较高,且与非酒精性脂肪肝疾病的减少有关,在改善肝病中有潜在作用;c. BAT产生的生物活性脂质(如12,13-diHOME,12- HEPE和Maresin 2等),可有效调节葡萄糖代谢和脂肪酸代谢并缓解肥胖症中的炎症。2)Douglas C. Chang和Jonathan Krakoff等认为hBAT对人体生理活动的影响较小: a. 虽然BAT活性可能与EE(Energy Expenditure)变化相关,但hBAT的总体体积小,因 此其产热能力及其对EE的贡献具有争议(例如:研究表明,在已知BAT的参与者中,24小 时加倍热量摄入导致EE增加7.5%,但BAT没有被明显激活); b. 先前的研究表明寒冷暴露能够激活BAT。然而,寒冷暴露会引发多器官反应(例如骨骼 肌代谢产热,以及白色脂肪动员释放FFA被肝脏等代谢器官消耗产热),但这些反应可能与BAT无关。鉴于BAT体积较小,并且在寒冷条件下其他器官/组织也被激活,这些生理变化足以解释代谢改善现象。
因此,关于hBAT的生理作用意义仍需要进一步的研究去明确阐释,尤其是在把hBAT作为直接的代谢器官来评价其能量代谢的绝对水平时(体量太小,导致直接的代谢贡献小);但其间接的代谢贡献仍值得去探讨。 参考文献:[1] Cypess AM, Cannon B, Nedergaard J, et al. Emerging debates and resolutions in brown adipose tissue research. Cell Metab. 2025. [2] Cypess AM. Reassessing Human Adipose Tissue. N Engl J Med. 2022.) 。因此,作者聚焦于更具临床相关性的WATs。结果发现,在所有WATs中,脂肪肝来源的外泌体在乳腺脂肪中的信号最为显著(图2H与图S2L)。相比之下,肿瘤来源的外泌体在乳腺脂肪中并未表现出明显富集(图S2M)。
作者进一步观察了脂肪肝来源的外泌体在乳腺脂肪细胞内的分布情况,结果发现,这些外泌体主要被perilipin 1⁺或ASC-1⁺脂肪细胞摄取,而Ep-CAM⁺或细胞角蛋白(cytokeratin)⁺的上皮细胞、CD31⁺血管内皮细胞、CD45⁺免疫细胞以及vimentin⁺成纤维细胞几乎没有检测到外泌体(图2I、2J及图S2N–S2P)。考虑到肿瘤细胞亦具有摄取外泌体的能力,作者将Dil标记的脂肪肝来源的外泌体注射至EO771荷瘤小鼠体内。结果显示,与脂肪细胞相比,肿瘤细胞对外泌体的摄取极少(图S2Q)。此外,作者将FM1-43FX荧光染料标记(小编注:FM1-43FX是一种亲水性的具有膜选择性的苯乙烯类荧光染料,其原理是通过分子中带正电的亲水头基与疏水烷基尾部结构使染料能够自发插入外泌体的脂质双层膜,在水相中荧光极弱,而当嵌入膜后分子运动受限,量子产率显著提高,荧光强度大幅增强,从而实现对外泌体膜的特异性标记。FM1-43FX的“FX”修饰使其在多聚甲醛固定后仍能保持荧光稳定,可用于固定样本的显微观察或免疫电镜分析。由于该染料不可穿透完整的脂质膜,因此主要标记外泌体的膜表面,在外泌体释放、摄取和膜融合等研究中可通过共聚焦显微镜或活体成像系统实现动态追踪,是一种可靠的外泌体膜标记与检测工具。)的脂肪肝来源的外泌体注射到C57BL/6小鼠体内,通过电子显微镜观察发现,这些外泌体同样主要定位于脂肪细胞中(图2K)。鉴于脂肪肝来源的外泌体具有明显的向乳腺脂肪细胞聚集的特征,作者将EO771细胞皮下注射至小鼠背部脂肪组织稀少的区域,并于两周后进行脂肪肝移植。与未进行肝脏移植和移植CD小鼠肝脏的对照组相比,给背部荷瘤小鼠移植脂肪肝并未显著促进其肿瘤生长(图S2R)。综上结果表明,脂肪肝可分泌外泌体,这些外泌体会选择性迁移至乳腺脂肪,并进一步驱动乳腺癌的发生与发展。
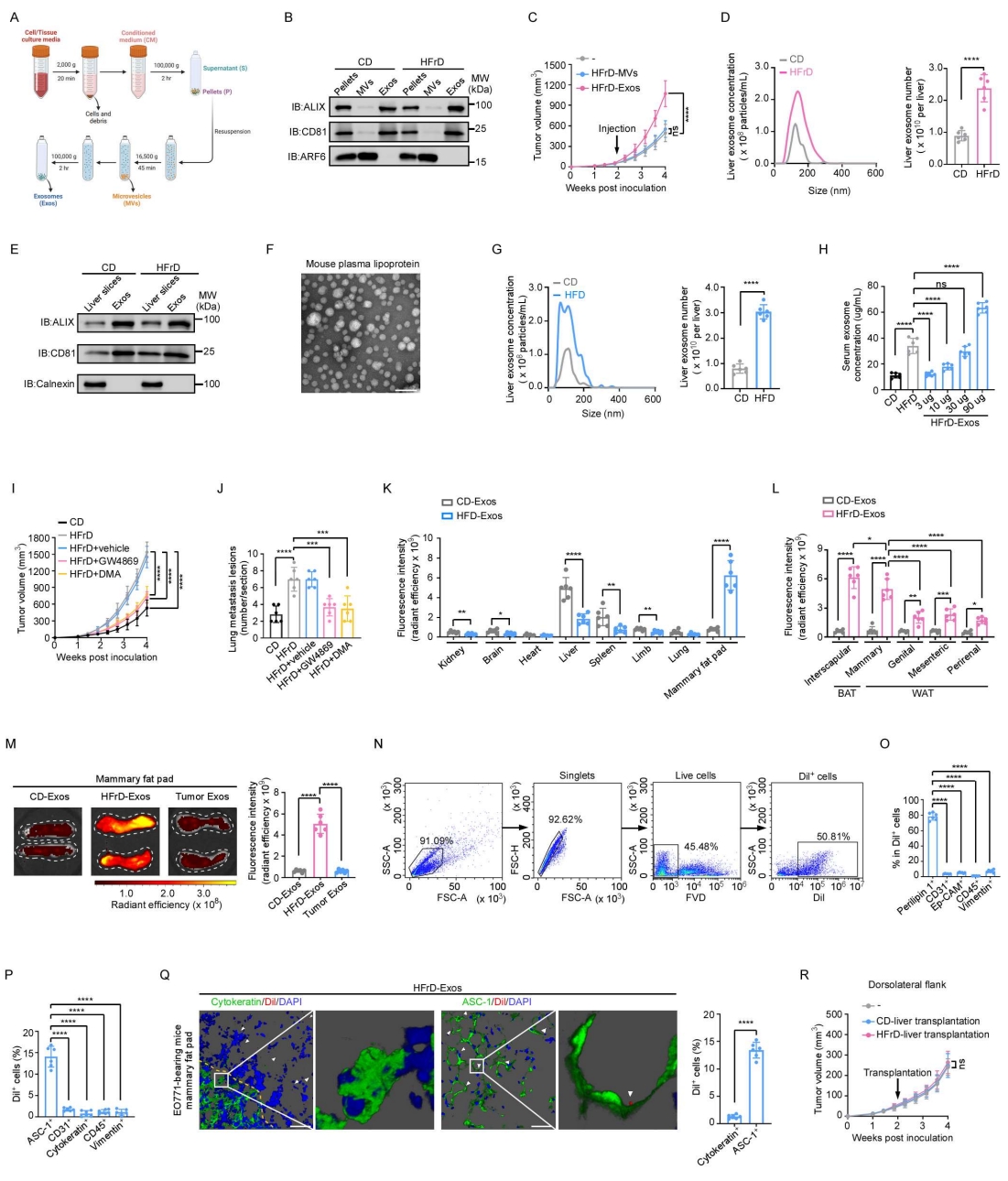
图S2. 脂肪肝通过乳腺脂肪细胞趋向性外泌体促进乳腺癌进展(对应图 2)
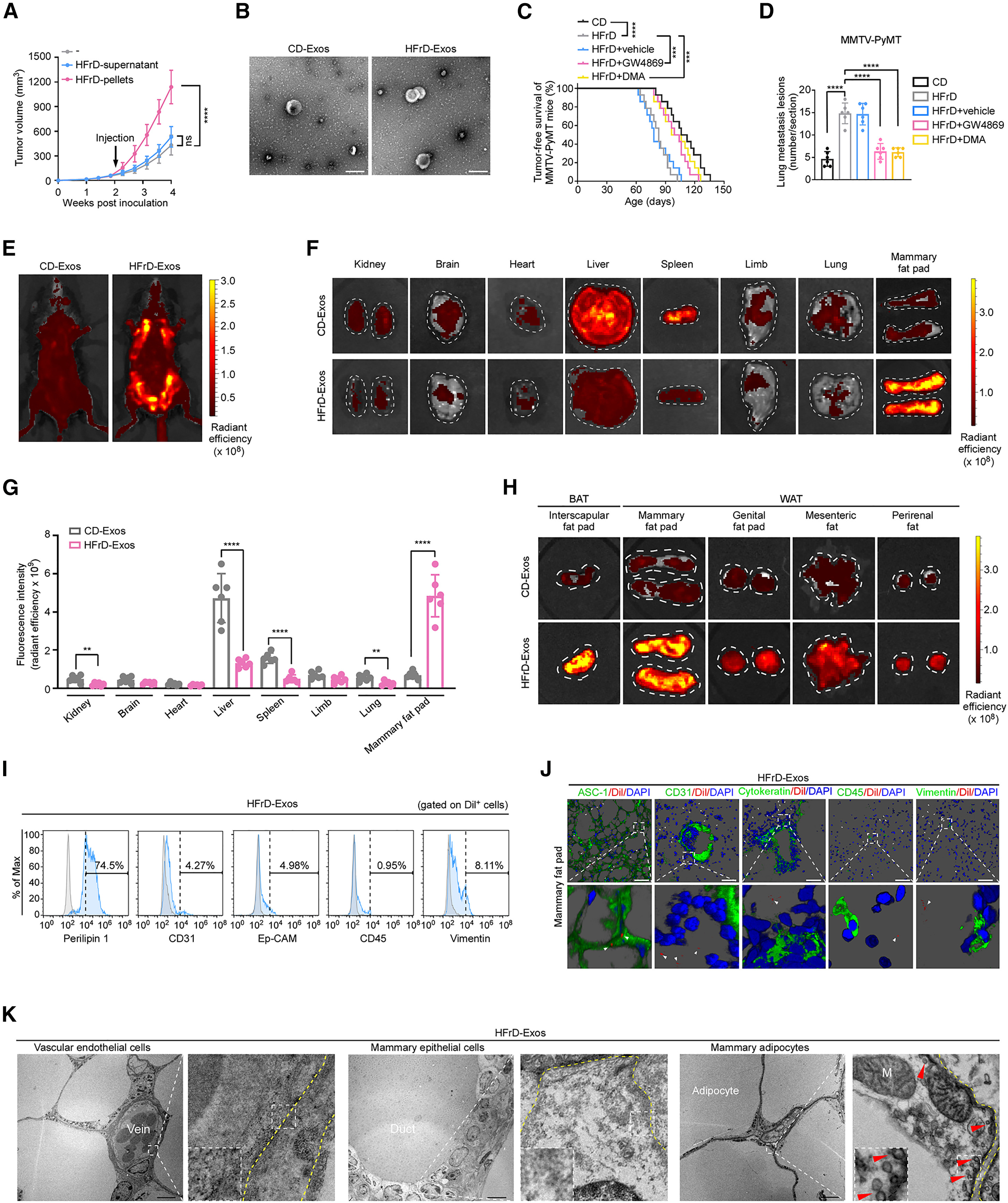
图2. 脂肪肝通过乳腺脂肪细胞趋向性外泌体促进乳腺癌的发生与进展
4、ErbB4–Nrg4轴决定了脂肪肝来源的外泌体在乳腺脂肪细胞中的特异性富集
细胞外囊泡(EVs)携带具有细胞特异性的蛋白质,可反映其来源细胞的特征。作者采用液相色谱-串联质谱(LC-MS/MS)对外泌体进行了蛋白质组学分析(图3A)。结果显示,肝细胞标志蛋白白蛋白(Albumin)在肝源性外泌体中含量极高(图S3A),而脂蛋白几乎未被检测到。随后,作者从脂肪肝中分离出原代肝细胞及其他四种主要细胞类型,并从各自的条件培养基(CM)中提取外泌体,然后将这些外泌体注射到小鼠中,24小时后分离乳腺脂肪,并进行IVIS实验检测其荧光强度。结果显示,只有来源于肝细胞的外泌体可在乳腺脂肪中显著富集,而其他细胞来源的外泌体则未表现出类似分布(图S3B)。这些结果提示,具有乳腺脂肪细胞趋向性的脂肪肝来源的外泌体主要由肝细胞分泌。
外泌体对受体细胞的靶向特异性主要由其膜蛋白介导。为鉴定决定乳腺脂肪组织趋向性的膜蛋白,作者在脂肪肝来源的外泌体中筛选出上调幅度最高的5种膜蛋白(图S3C),并分别在小鼠肝细胞系AML12中敲除这些基因(图S3D)。为在体外模拟肝细胞脂质过载状态,作者使用棕榈酸(PA)处理AML12细胞,并从其条件培养基(CM)中分离外泌体,经Dil荧光标记后静脉注射至小鼠体内。结果显示,PA处理的AML12细胞来源的外泌体在小鼠乳腺脂肪中显著富集(图S3E)。更为重要的是,敲除受体酪氨酸激酶ErbB4(receptor tyrosine-protein kinase, ErbB4)后,该趋向性被完全消除(图3B,图S3F)。进一步采用流式细胞术分析(图S3G),发现HFrD与HFD喂养小鼠的肝源性外泌体中ErbB4⁺外泌体比例显著高于正常肝脏来源的外泌体(图3C与图S3H),这一结果也被酶联免疫吸附实验(ELISA)和免疫印迹实验所证实(图S3I–S3L)。同样地,PA处理的AML12细胞所分泌的外泌体中ErbB4水平也显著升高(图S3M与S3N)。免疫金标透射电镜(immunogold-TEM, IG-TEM)(小编注: IG-TEM检测脂肪肝来源的外泌体表面ErbB4信号的原理,是将免疫学特异性识别与金颗粒高电子密度成像相结合,通过抗原–抗体反应在纳米尺度上精确定位目标蛋白的位置。其基本机制是:首先利用特异性一抗(如抗ErbB4抗体)识别并结合外泌体膜表面的ErbB4蛋白;随后加入带有金纳米颗粒(通常为5-15 nm)标记的二抗,该二抗可与一抗结合,从而使金颗粒精确定位于目标蛋白所在位置。由于金属金(Au)在透射电子显微镜下具有极高的电子密度,可强烈散射电子束,因此在TEM图像中表现为清晰的黑色高对比“金点”信号。通过观察外泌体膜上金颗粒的分布,可直接判断ErbB4是否位于外泌体表面及其丰度变化。与常规免疫印迹相比,IG-TEM不仅提供了定性信息(蛋白存在与否),还可提供空间定位信息,从而揭示脂肪肝来源外泌体表面特征蛋白(如ErbB4)的精确分布)结果进一步显示,脂肪肝来源的外泌体表面的ErbB4信号明显强于正常肝脏来源的外泌体(图3D)。
为验证外泌体中ErbB4在体内的作用,作者将脂肪肝来源的外泌体与ErbB4中和抗体预先孵育。结果显示,ErbB4被中和后,脂肪肝来源的外泌体与乳腺脂肪细胞的共定位消失(图3E和图S3O)(小编注:ErbB4中和抗体是一种能够特异性结合到ErbB4蛋白上,并阻断其正常功能的抗体)。此外,ErbB4的中和处理明显消除了静脉注射脂肪肝来源的外泌体所引起的促肿瘤生长效应(图S3P)及肺转移(图S3Q)。并且,当脂肪肝原代肝细胞来源的外泌体经ErbB4中和处理后,其促进肿瘤生长的作用同样被明显削弱(图S3R)。这些结果表明,脂肪肝来源的外泌体中高表达的ErbB4介导了外泌体在乳腺脂肪细胞中的富集。
ErbB4可与多种神经调节蛋白(Nrgs)结合,包括Nrg1、Nrg2、Nrg3和Nrg4。作者利用在线转录组数据库分析了不同器官中Nrgs的表达谱,结果显示,Nrg4主要在脂肪组织中表达,尤其是在乳腺脂肪组织中最为显著(图S4A)。相比之下,Nrg1–3主要在中枢神经系统中高表达(图S4B),这一结果通过Western blot实验得到了验证(图S4C)。进一步分析发现,除乳腺脂肪组织外,Nrg4在其他白色脂肪组织(WATs)中也有表达,但其水平明显低于乳腺脂肪(图S4D)。尽管棕色脂肪组织(BATs)中也存在一定量的Nrg4表达(图S4D),但在人类中,由于成年人BAT含量极少,因此探究WAT作为Nrg4的主要来源更具生理意义。考虑到外泌体无法穿越血脑屏障(小编注:本文关于“外泌体无法穿过血脑屏障”引用的是2021年的发表在nature上的综述,综述中提到“外泌体可以在TNF-α激活条件下能穿过血脑屏障,但在正常条件下则不能”。该结论引自2016年发表在Cell Mol Bioeng上的文章“Elucidation of Exosome Migration across the Blood-Brain Barrier Model In Vitro”,这篇文章所用的外泌体来源于293T细胞。但近几年,有研究证实,外泌体能穿过血脑屏障。1)2025 年发表在 Cell Reports Medicine上的文章指出:硒修饰的神经干细胞来源外泌体——SeNExo,其能够穿越血脑屏障,具有清除活性氧以及神经保护的能力,并在创伤性脑损伤(TBI)和脊髓损伤(SCI)小鼠模型中表现出显著的治疗效果(参考文献:Wang W, Lu G, Guo P, et al. Selenized neural stem cell-derived exosomes: A neotype therapeutic agent for traumatic injuries of the central nervous system. Cell Rep Med. 2025.)。2)2024年发表在Pharmaceutics上的文章指出:间充质干细胞的鼻内移植外泌体,最早可在1小时迁移到大脑中,并在移植后 24 h 内持续增加,并成功减轻了小胶质细胞炎症和神经损伤,从而恢复了认知功能(参考文献:Ikeda, T.; Kawabori, M.; Zheng, Y.; Yamaguchi, S.; Gotoh, S.; Nakahara, Y.; Yoshie, E.; Fujimura, M. Intranasal Administration of Mesenchymal Stem Cell-Derived Exosome Alleviates Hypoxic-Ischemic Brain Injury.Pharmaceutics. 2024.)。因此,外泌体能否穿越血脑屏障可能与外泌体来源的细胞类型相关,目前外泌体能影响神经系统的文献主要集中在干细胞来源的外泌体。),且脂肪肝来源的外泌体具有乳腺脂肪细胞趋向性,作者将Nrg4作为研究对象。免疫染色结果显示,Nrg4主要在乳腺脂肪组织中的ASC-1⁺脂肪细胞中表达(图3F)。为了研究脂肪细胞中Nrg4的功能,作者构建了脂肪特异性Nrg4敲除小鼠模型(Adipoq-Nrg4Δ)(图S4E、S4F)。结果发现,脂肪细胞特异性Nrg4敲除阻断了注射的脂肪肝来源的外泌体在乳腺脂肪中的富集(图3G)。同时给野生型小鼠和Adipoq-Nrg4Δ小鼠接种EO771肿瘤细胞后发现,与同窝对照小鼠相比,Adipoq-Nrg4Δ小鼠在注射脂肪肝来源的外泌体后其肿瘤生长显著减缓(图S4G),肺转移数量明显减少(图S4H)。此外,作者还构建了脂肪细胞特异性Nrg4敲除的自发乳腺癌模型PyMT-Adipoq-Nrg4Δ小鼠(图3H、S4I)。在HFrD喂养条件下,脂肪细胞特异性敲除Nrg4显著延长了无瘤生存期(图3I),并显著减少了肺转移(图3J);而在正常饮食(CD)条件下未观察到类似变化。综上所述,这些结果表明,脂肪肝来源的外泌体中富集的ErbB4可与Nrg4结合,从而介导乳腺脂肪细胞对外泌体的特异性摄取。
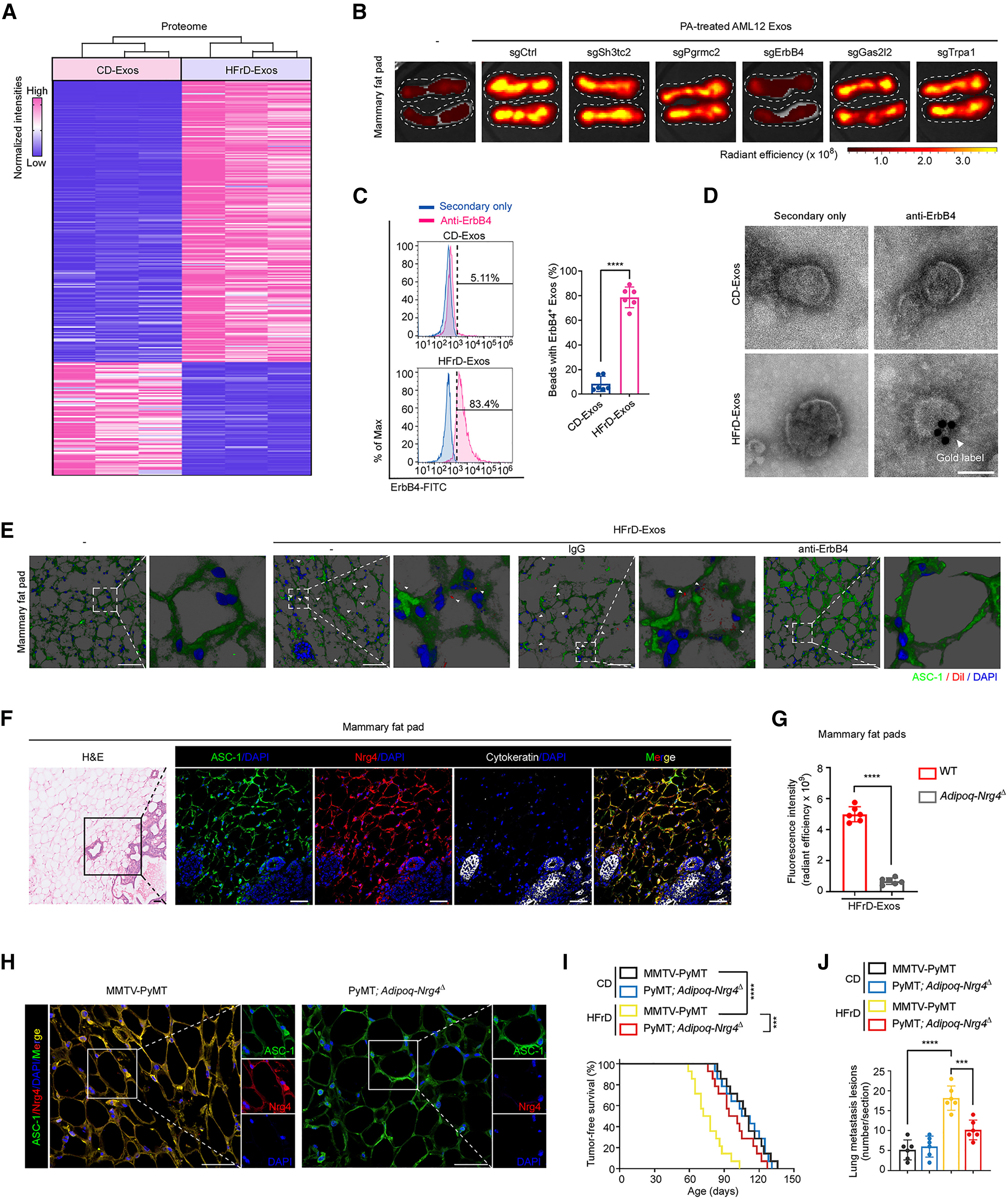
图3. ErbB4–Nrg4 轴决定了脂肪肝来源的外泌体在乳腺脂肪细胞中的特异性富集
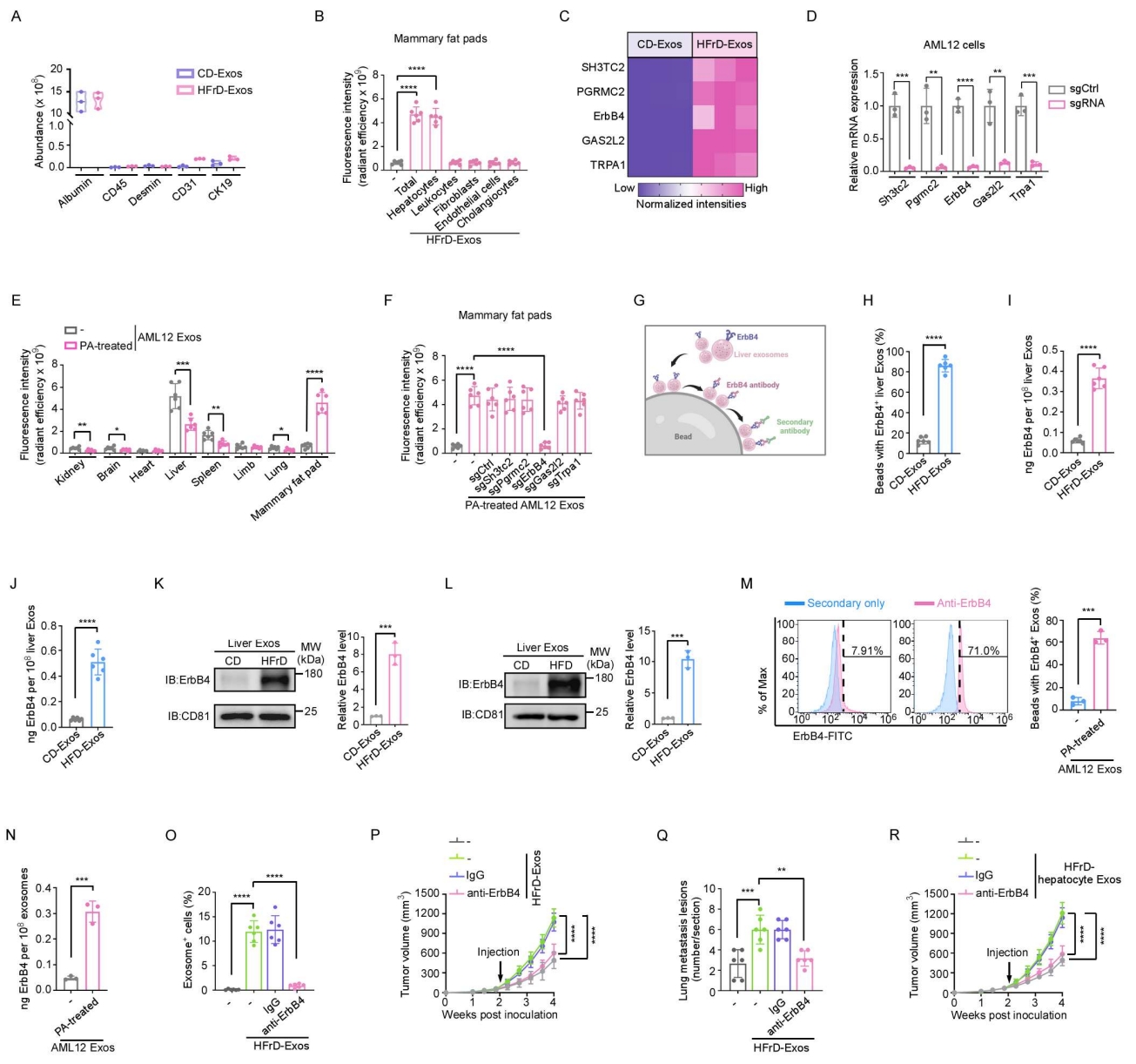
图S3. 脂肪肝来源的外泌体中高表达的ErbB4介导乳腺脂肪细胞对其的选择性摄取(对应图 3)
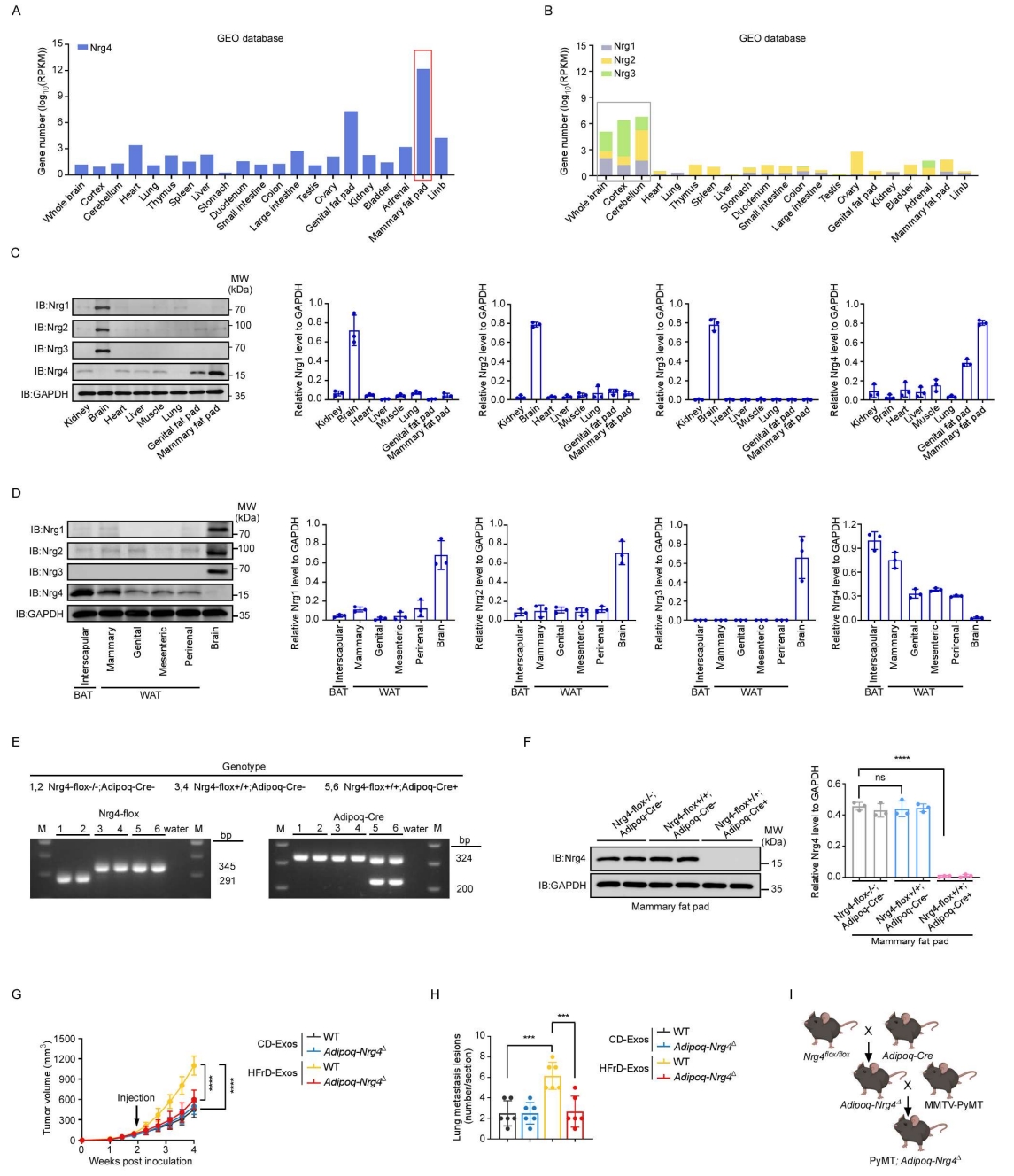
图S4. 外泌体中的ErbB4通过乳腺脂肪Nrg4介导乳腺脂肪对脂肪肝来源的外泌体的特异性摄取(对应图 3)
5、脂肪肝来源的外泌体通过诱导脂肪细胞释放游离脂肪酸(FFA)促进乳腺癌发展
脂肪细胞可通过提供高能量密度的脂质(如FFA)加速肿瘤发展(小编注:1. 骨髓瘤细胞(MM)诱导骨髓脂肪细胞中的脂解;骨髓脂肪细胞释放的FFA通过脂肪酸转运蛋白(以FATP 4为主,因其在所有MM细胞系中始终以高水平表达)被骨髓瘤细胞吸收,促进肿瘤细胞生长。(参考文献:Multiple myeloma cells induce lipolysis in adipocytes and uptake fatty acids through fatty acid transporter proteins. Blood.2022. )2. 腹腔内肿瘤,如卵巢癌倾向于转移到网膜(主要由脂肪细胞组成的器官)。研究显示:网膜脂肪细胞促进卵巢癌细胞的归巢、迁移和侵袭;其中脂肪细胞-卵巢癌细胞共培养引起脂质从脂肪细胞直接转移到卵巢癌细胞,促进体外和体内肿瘤生长。此外,共培养诱导脂肪细胞的脂肪分解和癌细胞的β氧化,表明脂肪细胞是癌细胞的能量来源,并促进其生长。 (参考文献:Adipocytes promote ovarian cancer metastasis and provide energy for rapid tumor growth. Nat. Med. 2011. )3. 间质脂肪细胞是介导黑色素瘤进展的脂质供体。研究表明,脂肪细胞衍生的脂质被在黑色素瘤中异常表达的FATP蛋白所吸收;而抑制FATPs可减少黑色素瘤脂质摄取、侵袭和生长。本研究提供了间质脂肪细胞如何驱动肿瘤进展的机制,并展示了一种新的微环境治疗靶点。 (参考文献:Adipocyte-derived lipids mediate melanoma progression via FATP proteins. Cancer Discov. 2018. ))。接下来,作者通过BODIPY染色,观察到给MMTV-PyMT小鼠注射脂肪肝来源的外泌体后,乳腺脂肪内的异常导管和肿瘤细胞中的脂质积累明显增加(图4A)。与之相一致,HFrD喂养小鼠中的异常导管数量及肿瘤细胞中的脂质含量均显著高于对照饮食(CD)组(图S5A和S5B),而这种脂质升高现象在ErbB4中和处理(图S5A)或脂肪细胞Nrg4敲除(图S5B)后被显著消除。同样,在接受脂肪肝来源的外泌体注射(图4B)或HFrD喂养(图S5C和S5D)的EO771荷瘤小鼠的肿瘤细胞中,也观察到了类似的脂质积累增加现象。
在脂解过程中释放的FFAs是脂肪组织向肿瘤细胞进行脂质转运的主要形式。作者发现,脂肪肝来源的外泌体处理可诱导来自不同白色脂肪组织(WATs)的脂肪细胞分泌FFAs,其中乳腺脂肪细胞释放的FFAs水平最高(图4C)。此外,接受外泌体注射小鼠的血清FFAs水平略有升高(图S5E)。为探究这种血清FFAs的轻度升高是否会增强肿瘤细胞的迁移能力,作者给小鼠静脉注射脂肪肝外泌体4周(对照组不注射),然后静脉注射EO771肿瘤细胞,结果显示,注射脂肪肝来源的外泌体并未显著影响肺转移(图S5F)。鉴于脂肪肝来源的外泌体也可增加肠系膜脂肪细胞的FFA释放,作者进一步使用Apc-L850X自发结直肠癌小鼠进行实验,结果发现,注射脂肪肝来源的外泌体并不影响结直肠癌小鼠的肿瘤数量和体积(图S5G)。
在MMTV-PyMT小鼠中,注射脂肪肝来源的外泌体显著促进了乳腺脂肪细胞的FFAs释放(图4D)。然而,对HFrD喂养小鼠进行ErbB4中和抗体处理(图S5H、S5I)或敲除脂肪细胞中的Nrg4(图S5J、S5K)后,FFA释放增强的效果被显著逆转。值得注意的是,脂肪肝来源的外泌体对小鼠的空腹血糖与胰岛素水平均未产生显著影响(图S5L、S5M)。
为验证脂肪肝来源的外泌体在介导脂肪细胞向乳腺癌细胞转运脂质中的作用,作者分离原代脂肪细胞并用BODIPY进行荧光标记。结果显示,与对照小鼠的乳腺脂肪细胞相比,用脂肪肝来源的外泌体注射小鼠的乳腺脂肪细胞与EO771细胞共培养时,肿瘤细胞内的荧光脂质显著增加(图S5N)。然而,当敲除脂肪细胞中的Nrg4后,该效应被明显消除(图S5N)。介导细胞间脂质转运的膜蛋白主要包括脂肪酸转运蛋白(FATPs)和CD36。作者发现,在MMTV-PyMT小鼠的肿瘤细胞(图S5O)及EO771细胞(图S5P、S5Q)中,Fatp4和Fatp1表达水平较高,而其他FATPs及CD36几乎未检测到。为进一步验证Fatp4与Fatp1的功能作用,作者分别构建了Fatp4和Fatp1缺失的EO771细胞,并与预先用正常肝源外泌体或脂肪肝来源的外泌体处理的BODIPY标记的3T3-L1脂肪细胞进行共培养(图S5R–S5V)。结果表明,与正常肝源外泌体处理组相比,脂肪肝来源的外泌体处理组的EO771细胞中脂质水平显著升高(图S5V);更为重要的是,当同时敲除EO771细胞Fatp1与Fatp4后,这种现象被完全消除(图S5V)。作者构建了两个模型:一是将同时敲除Fatp1和Fatp4的EO771细胞或者WT对照组细胞接种到喂食CD或HFrD的小鼠中(图4E、G和H),二是将双敲的EO771细胞或WT细胞接种到注射了脂肪肝来源的外泌体的小鼠中(图4F和I-K),结果发现,在接种了WT细胞的HFrD喂养小鼠(图4E)和注射了脂肪肝来源的外泌体的EO771荷瘤小鼠(图4F)中,肿瘤细胞的脂质摄取显著增加,而敲除EO771细胞中的Fatp1和Fatp4可以逆转这一现象。此外,敲除Fatp1和Fatp4后,在HFrD喂养或接受脂肪肝来源的外泌体注射的EO771荷瘤小鼠的肿瘤生长(图4G、4I)及肺转移(图4H、4J)被显著抑制。
FFAs可通过上调肿瘤细胞的脂质代谢来促进肿瘤发展。作者发现,接受脂肪肝来源的外泌体注射的小鼠,其肿瘤细胞中FFA代谢相关基因(如肉碱棕榈酰转移酶1A,CPT1A;过氧化物酶体增殖物激活受体α,PPARα;以及PPARγ)的表达水平均显著升高(图4K)。而敲除EO771细胞中的FATP1与FATP4后,这种代谢基因上调效应被完全消除(图4K)。此外,肿瘤浸润性调节性T细胞(Treg)可摄取FFAs以增强其脂质代谢和免疫抑制功能。作者观察到,在注射脂肪肝来源的外泌体的小鼠肿瘤组织中,Treg细胞在总CD4⁺ T细胞以及CD8⁺ T细胞中所占比例显著升高(图4L、4M、S5W)。同时,注射脂肪肝来源的外泌体的小鼠的Treg细胞脂质含量也会显著增加(图4N),FFA代谢相关基因(图4O)以及IL-10表达增强(图4P)。综上所述,这些结果表明,脂肪肝来源的外泌体通过诱导乳腺脂肪细胞释放FFAs,使其被肿瘤细胞和Treg细胞摄取,从而促进乳腺癌的发展。
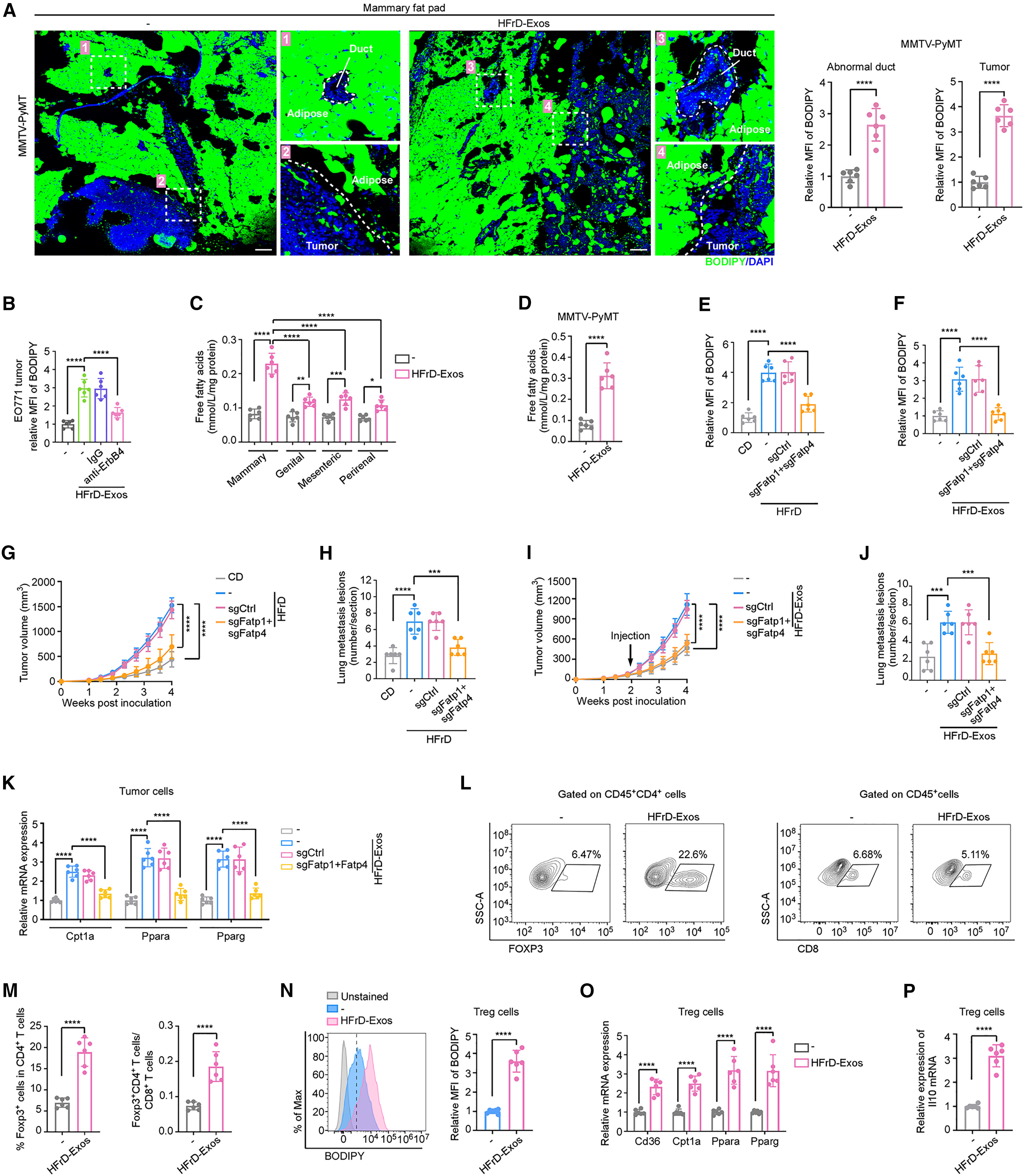
图4. 脂肪肝来源的外泌体通过诱导脂肪细胞释放游离脂肪酸(FFA)促进乳腺癌的进展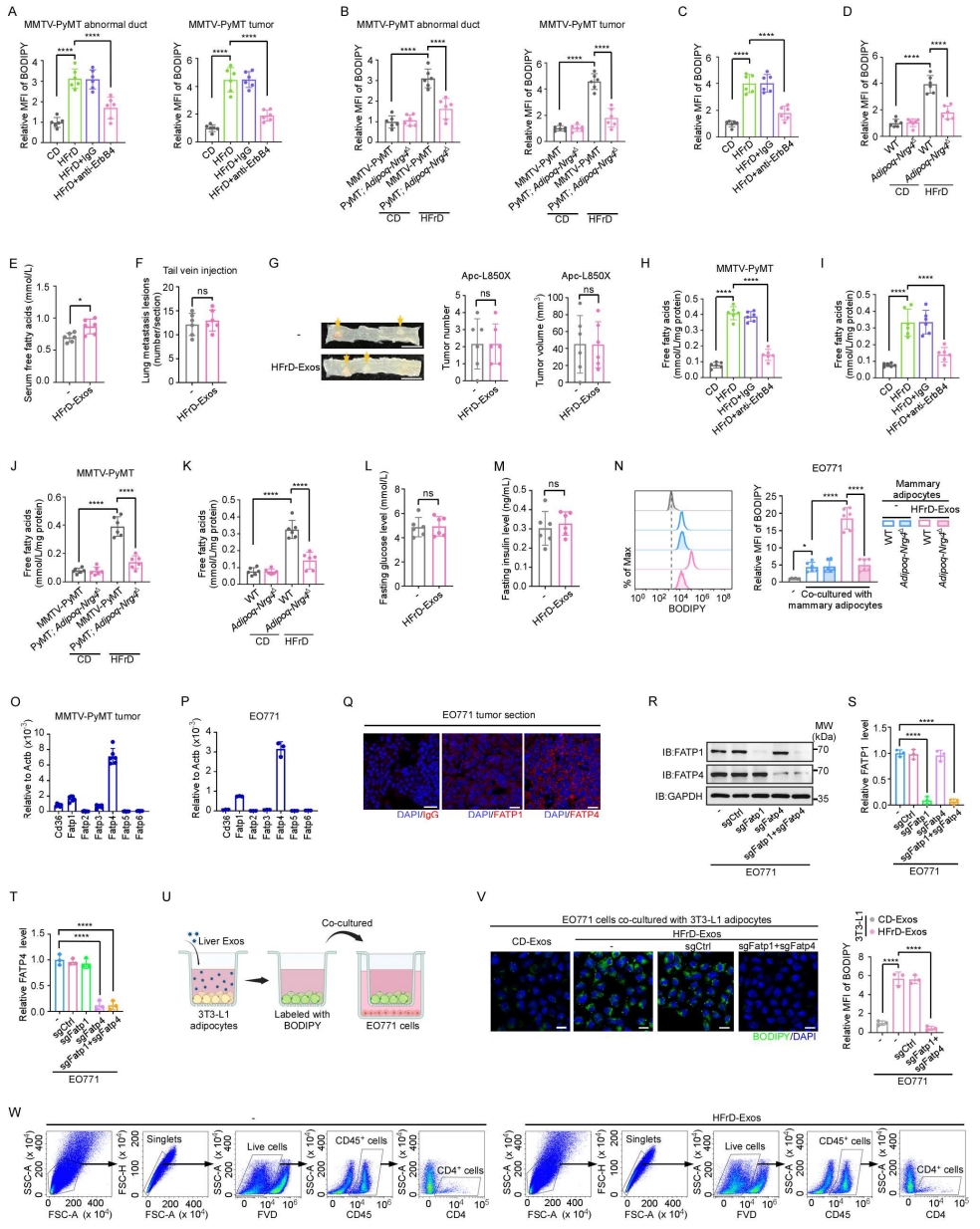
图S5. 脂肪肝来源的外泌体促进脂肪细胞释放游离脂肪酸(FFA)(对应图 4)
6、脂肪肝来源的外泌体通过TRMT10C增强乳腺脂肪细胞的脂解作用
鉴于脂肪肝来源的外泌体可增强脂肪细胞的FFA释放,作者首先进行了全面的脂质组学分析。结果显示,正常肝源外泌体与脂肪肝来源的外泌体在总脂质含量及脂质类别分布上差异不大(图5A、5B)。外泌体通过其所携带的物质来介导受体细胞的功能变化。为确定导致脂肪细胞脂解增强的关键外泌体成分,作者回溯分析了外泌体蛋白质组数据。根据差异蛋白分析(图5C)筛选出了五个显著富集蛋白,在AML12肝细胞中分别敲除这些基因(图S6A)。结果显示,来自棕榈酸(PA)处理的AML12细胞来源的外泌体能显著诱导3T3-L1脂肪细胞释放FFA,敲除AML12细胞中线粒体tRNA甲基转移酶同源物C(Trmt10c)后,该效应被显著逆转,而敲除其他4个差异表达的基因则无影响(图S6B)。此外,在TRMT10C过表达的AML12细胞中(图S6C),其分泌的外泌体可显著增强3T3-L1脂肪细胞的FFA释放(图S6D)。进一步检测发现,TRMT10C在HFrD与HFD喂养小鼠的肝脏CM及原代肝细胞CM来源的外泌体中显著富集(图S6E–S6H)。TRMT10C是线粒体甲基转移酶复合物的催化亚基,其在细胞中与线粒体标志蛋白Tom20共定位(图5D)。共定位分析显示,无论是否向小鼠体内注射脂肪肝来源的外泌体,小鼠脂肪细胞中TRMT10C与Tom20之间的Pearson相关系数均较高(图S6I)。此外,注射脂肪肝来源的外泌体的小鼠脂肪细胞中TRMT10C蛋白水平显著升高(图5E),这些蛋白主要分布在线粒体而非胞质组分中(图S6J)。值得注意的是,两组小鼠的脂肪细胞中Trmt10c的mRNA水平并无显著差异(图S6K)。Western blot结果进一步证实,在Trmt10c敲除的AML12细胞及其分泌的外泌体中,TRMT10C蛋白水平显著下降(图S6L、S6M),但外泌体的总蛋白含量未受影响(图S6N)。与对照组相比,PA处理的AML12细胞来源的外泌体可显著增强3T3-L1脂肪细胞与EO771肿瘤细胞共培养时的脂质水平(图S6O);而敲除Trmt10c虽未影响外泌体自身的脂质组成(图S6P),却完全消除了该效应(图S6O)。
拓展阅读
TRMT10C属于Trm10家族,是在古细菌和真核生物中发现的tRNA甲基转移酶(MTases),其核心功能是通过对线粒体RNA的甲基化修饰,调控线粒体基因表达和能量代谢,TRMT10C的N端含有线粒体靶向序列,在正常生理条件下,TRMT10C定位于线粒体基质。
1. 线粒体tRNA甲基化与成熟调控
线粒体前体tRNA的成熟的步骤包括:①由PRORP(mt-RNase P)去除5'-端,②由ELAC2(mt-RNase Z)进行3'-端加工,③由TRNT1添加3'-CCA基团,以及转录后修饰。TRMT10C能够与其配体SDR5C1(短链脱氢酶/还原酶家族蛋白)形成稳定的复合物,催化线粒体tRNA第9位嘌呤(A或G)的N¹-甲基化(m¹A9/m¹G9),然后TRMT10C-SDR5C1复合物将mt-pre-tRNA呈递给PRORP,启动5'-端切割,随后招募ELAC2进行3'-端加工,最后通过TRNT1添加3'-CCA 序列[1]。
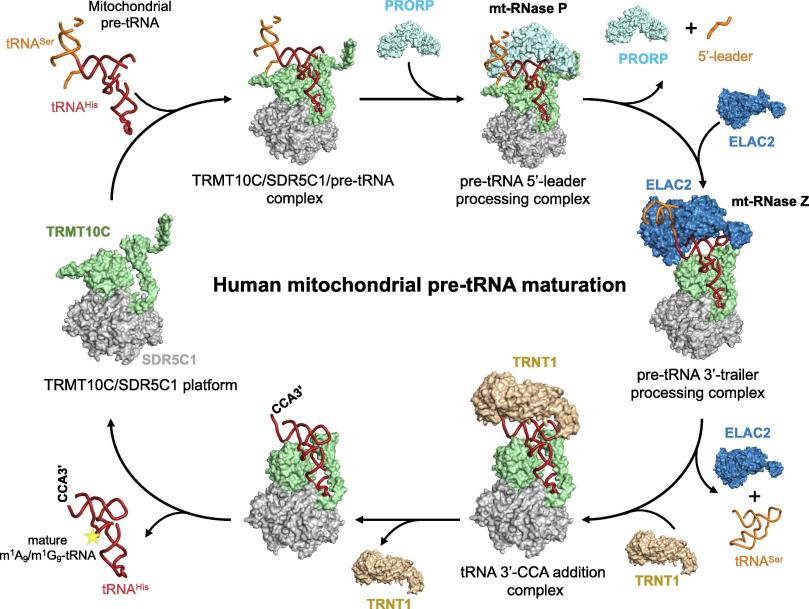

人类线粒体tRNA加工和成熟
2. 线粒体mRNA甲基化
有文献证明,在阿尔茨海默病模型中,TRMT10C通过催化ND5 mRNA(ND5是呼吸链复合物I的亚基)的m¹A甲基化,抑制ND5的翻译,导致呼吸链复合体I功能障碍和线粒体功能异常[2]。
目前的研究显示TRMT10C定位于线粒体,主要在线粒体中发挥功能作用。
参考文献:
[1] Sikarwar J, Meynier V, Tisné C. Advances in Human Pre-tRNA Maturation: TRMT10C and ELAC2 in Focus. J Mol Biol. 2025
[2] Jörg M, Plehn JE, Kristen M, et al. N1-methylation of adenosine (m1A) in ND5 mRNA leads to complex I dysfunction in Alzheimer's disease. Mol Psychiatry. 2024
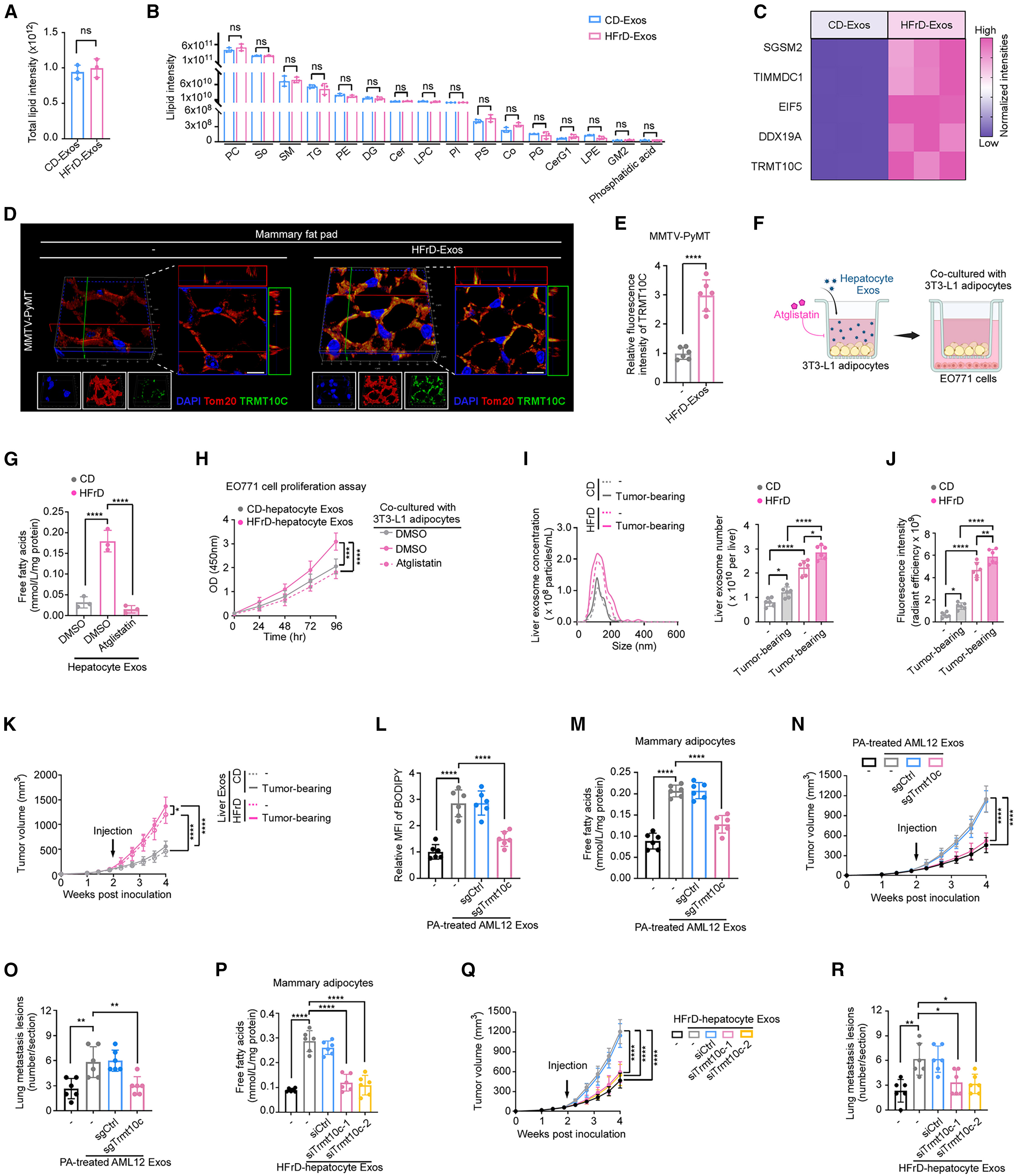
图5. 脂肪肝来源的外泌体通过TRMT10C增强乳腺脂肪细胞的脂解作用
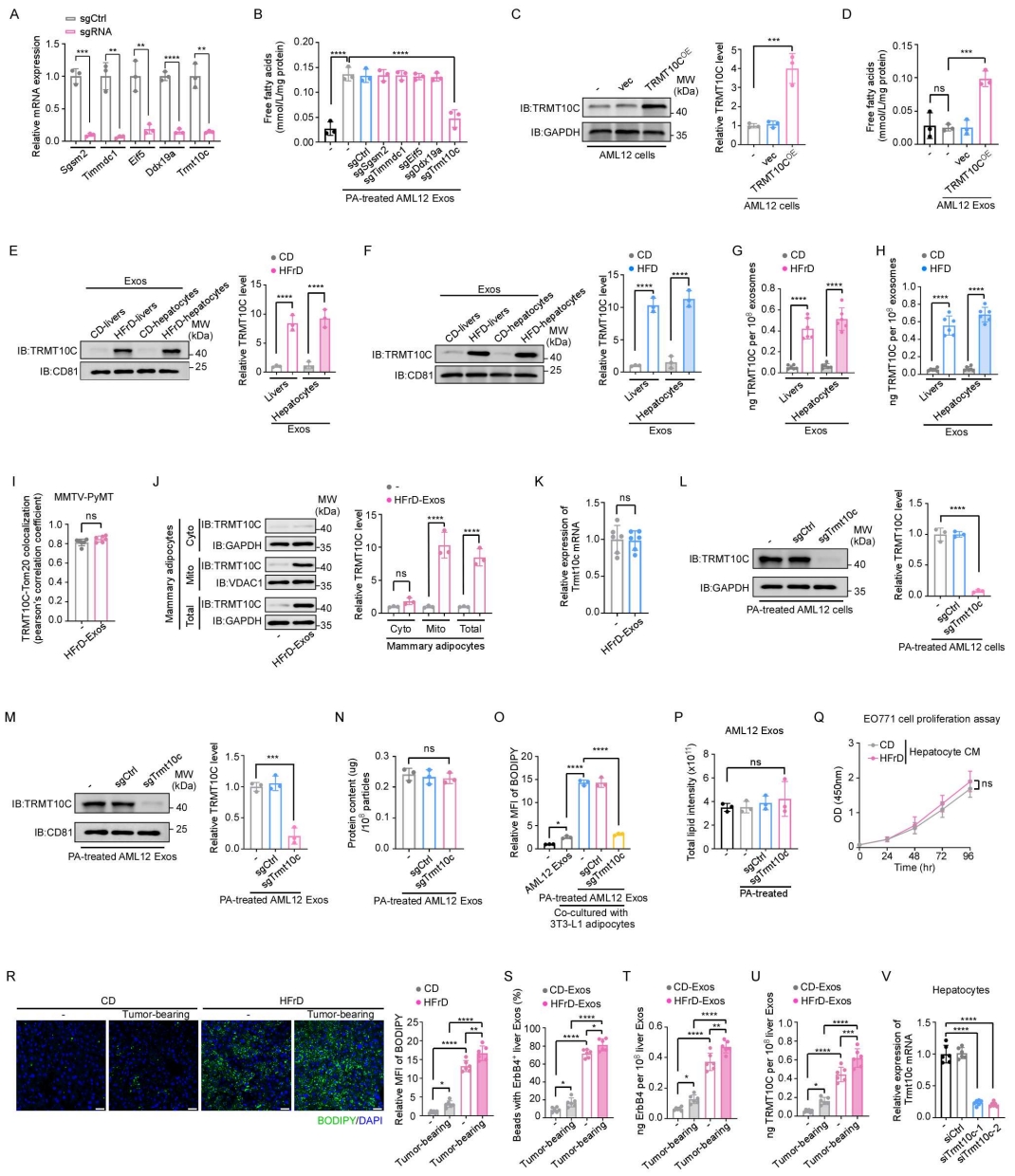
图S6. 外泌体中 TRMT10C 通过诱导乳腺脂肪细胞释放游离脂肪酸(FFA)促进乳腺癌的发展(对应图 5)
7、外泌体中的TRMT10C通过调控线粒体mRNA的m¹A修饰介导脂肪细胞的游离脂肪酸(FFA)释放
TRMT10C可介导线粒体内mRNAs和tRNAs中鸟嘌呤(m¹G)与腺嘌呤(m¹A)的N1-甲基化。作者利用超高效液相色谱–串联质谱(UPLC–MS/MS)检测发现,在注射PA处理的AML12细胞来源外泌体的小鼠的脂肪细胞中,线粒体mRNA的m¹A水平显著升高,而m¹G水平无明显变化;当敲除AML12细胞中的Trmt10c后,这种m¹A升高被完全消除(图6A)。相比之下,线粒体tRNA中的m¹A和m¹G水平均无显著改变(图6B)。通过m¹A RNA免疫共沉淀结合qPCR(m¹A-RIP-qPCR)实验发现,在PA处理的AML12细胞来源的外泌体注射的小鼠脂肪细胞中,Nd5和Nd6 mRNA的m¹A富集显著增加(图6C),而其他线粒体mRNA无明显差异(图S7A)。为验证TRMT10C是否直接介导Nd5与Nd6 mRNA的m¹A甲基化,作者分别在3T3-L1脂肪细胞中敲除或过表达TRMT10C(图S7B)。结果显示,Trmt10c敲除完全消除了线粒体Nd5与Nd6 mRNA的甲基化,而TRMT10C过表达显著增强了甲基化水平(图S7C)。既往研究表明,线粒体复合物I亚基ND5与ND6的下调可增加线粒体活性氧(ROS)水平。作者观察到,注射PA处理AML12细胞来源外泌体的小鼠乳腺脂肪细胞中ROS显著升高,而敲除供体AML12细胞中的Trmt10c后,这种现象被完全逆转(图6D)。与此一致的是,外泌体处理后的3T3-L1脂肪细胞的耗氧率(OCR)显著下降,而敲除供体AML12细胞中Trmt10c,可逆转这一效应(图6E)。为了验证外泌体TRMT10C是否通过调控ND5和ND6导致线粒体ROS升高,作者在3T3-L1脂肪细胞中过表达含线粒体靶向序列的核表达型Nd5与Nd6基因(图S7D–S7F)。结果显示,由外泌体TRMT10C诱导的线粒体ROS升高在同时过表达ND5和ND6后被完全消除(图S7G)。综上所述,这些结果表明:外泌体中的TRMT10C通过催化脂肪细胞线粒体Nd5和Nd6 mRNA的m¹A修饰,抑制其蛋白表达,进而升高线粒体ROS水平。
m¹A修饰位于mRNA编码序列(CDS)区域时,可影响mRNA稳定性并抑制其翻译。为验证外泌体TRMT10C是否调控Nd5与Nd6的mRNA水平,作者检测了3T3-L1脂肪细胞在有无PA处理的AML12细胞来源的外泌体作用下的Nd5与Nd6转录水平,结果显示两者mRNA含量无显著差异(图S7H)。为进一步评估RNA翻译效率,作者进行了线粒体核糖体谱分析,将线粒体核糖体分为非翻译部分(<28S)、翻译起始部分(<55S,包含28S与39S核糖体及55S单体核糖体)和翻译活跃多核糖体部分(>55S)(图S7I、S7J)。结果显示,在3T3-L1脂肪细胞中,PA处理的AML12细胞来源的外泌体显著降低了Nd5与Nd6 mRNA在高翻译效率的多核糖体组分中的丰度(图6F),提示其翻译活性受到抑制。而敲除供体AML12细胞中的Trmt10c后,该效应被完全消除(图6F),说明外泌体TRMT10C可抑制Nd5与Nd6 mRNA的翻译。在3T3-L1脂肪细胞中过表达TRMT10C显著降低了ND5与ND6蛋白水平(图S7K)。一致地,在接受PA处理AML12细胞分泌的外泌体注射的小鼠乳腺脂肪细胞中,ND5与ND6蛋白表达下调,而敲除AML12细胞中的Trmt10c后,该现象被逆转(图6G)。综上结果表明,外泌体中的TRMT10C通过诱导脂肪细胞线粒体mRNA(Nd5与Nd6)的m¹A修饰,抑制其翻译,从而增加线粒体ROS生成。
线粒体ROS可诱导白细胞介素-6(IL-6)的产生,而IL-6又可促进脂肪细胞的脂解作用。由于外泌体中的TRMT10C能够促进ROS生成并诱导脂肪细胞释放FFA,作者进一步探究TRMT10C是否通过上调IL-6实现这一过程。结果显示,来自注射PA处理AML12细胞来源外泌体的小鼠脂肪细胞中,IL-6的mRNA表达水平显著上调;而敲除供体AML12细胞中的Trmt10c后,这一上调效应被完全消除(图6H)。
接下来,作者探究了外泌体TRMT10C是否通过增加线粒体ROS来促进IL-6的产生。结果显示,PA处理的AML12细胞分泌的外泌体可显著上调3T3-L1脂肪细胞中的IL-6表达,而这种上调效应可被抗氧化剂N-乙酰-L-半胱氨酸(NAC)显著削弱(图6I)。相反,来自PA处理的Trmt10c敲除AML12细胞的外泌体并不能诱导3T3-L1脂肪细胞IL-6上调,但当同时给予H₂O₂(外源性ROS供体)处理时,该效应被恢复(图6I)。与此一致,PA处理AML12细胞来源的外泌体诱导的FFA释放增加同样被NAC抑制(图6J);而在PA处理的Trmt10c敲除AML12细胞来源的外泌体处理的3T3-L1脂肪细胞中,H₂O₂能显著恢复FFA的释放(图6J)。
IL-6可通过上调CGI-58的表达来激活脂肪甘油三酯脂肪酶(ATGL),从而促进脂肪细胞脂解。作者发现,注射PA处理的AML12细胞来源的外泌体的小鼠乳腺脂肪细胞中,CGI-58水平显著升高(图6K),同时伴随ATGL酶活性增强(图6L)。在体外实验中,将3T3-L1脂肪细胞与PA处理的AML12细胞来源的外泌体共培养,同样观察到CGI-58表达上调与ATGL活性增强(图6M、6N)。然而,敲除供体AML12细胞中的Trmt10c后,上述外泌体诱导的3T3-L1脂肪细胞中CGI-58升高、ATGL活化及FFA释放增强效应均被消除;而当在脂肪细胞中过表达IL-6时,这些效应被恢复(图6M–6O及图S7L)。此外,使用ATGL特异性抑制剂atglistatin处理后,完全阻断了IL-6介导的FFA释放增强作用(图6O)。
肿瘤细胞自身也可通过分泌IL-6来刺激脂肪细胞的脂解作用。作者观察到,在注射脂肪肝来源的外泌体的EO771荷瘤小鼠中,乳腺脂肪细胞的FFA释放在肿瘤细胞敲除Il6后部分被削弱(图S7M、S7N)。综上所述,这些结果表明,外泌体中的TRMT10C通过催化脂肪细胞线粒体Nd5和Nd6 mRNA的m¹A修饰,增加线粒体ROS生成,从而诱导IL-6的表达。随后,由外泌体TRMT10C诱导的脂肪细胞IL-6与肿瘤细胞来源的IL-6协同作用,通过激活CGI-58–ATGL通路促进脂肪细胞脂解和FFA释放,从而形成促肿瘤代谢循环,推动乳腺癌进展。
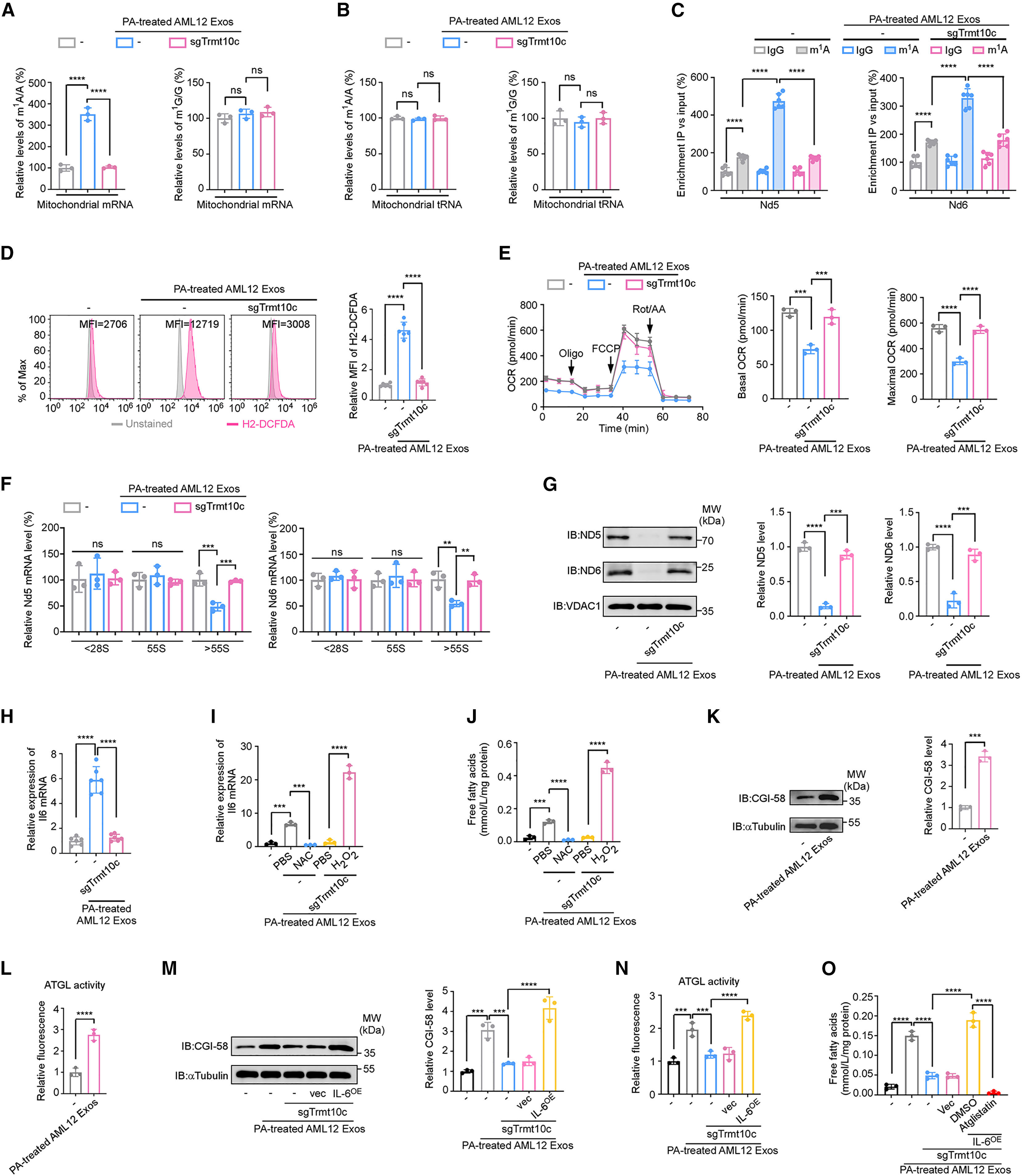
图6. 外泌体中TRMT10C通过线粒体mRNA的m¹A修饰介导脂肪细胞的游离脂肪酸(FFA)释放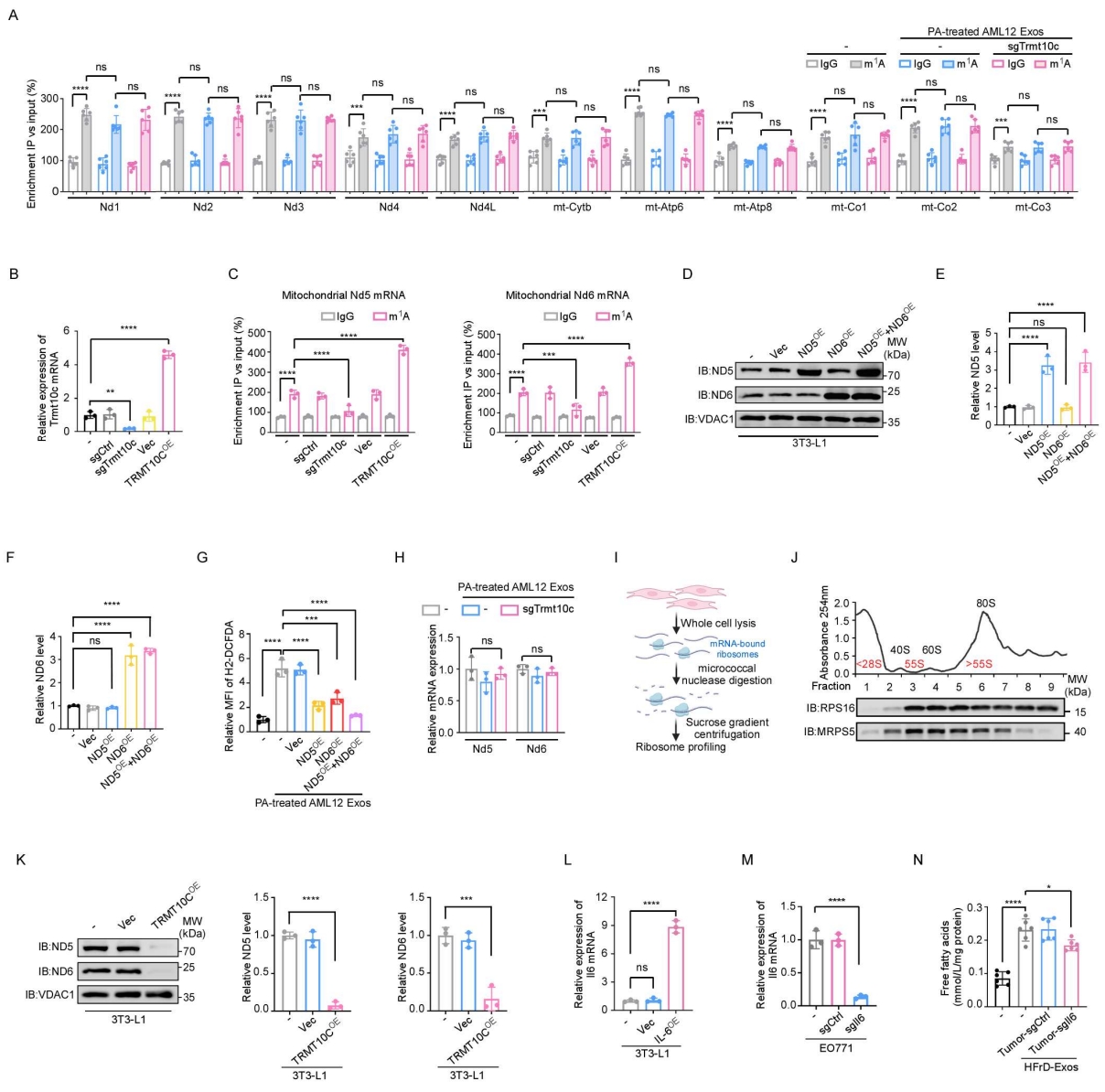
图S7. 外泌体中的TRMT10C通过催化线粒体mRNA中腺苷的N¹-甲基化(m¹A)介导脂肪细胞的游离脂肪酸(FFA)释放(对应图 6)
8、ErbB4⁺外泌体可用于预测伴有NAFLD的乳腺癌患者的预后
为探讨ErbB4⁺外泌体的临床意义,作者收集了3,013例乳腺癌患者的血浆样本,其中包括731例NAFLD患者和2,282例非NAFLD患者。结果显示,与非NAFLD患者相比,患有NAFLD的乳腺癌患者循环外泌体(crExos)中ErbB4水平显著升高(图7A)。此外,血浆ErbB4⁺外泌体水平与NAFLD的严重程度呈正相关,即NAFLD病情越重,ErbB4⁺外泌体水平越高(图7B)。此外,作者进一步评估了ErbB4⁺ crExos在患有NAFLD的乳腺癌患者中的预后相关性。在患有NAFLD的乳腺癌患者中,ErbB4⁺ crExos高表达组(ErbB4⁺ crExoshigh)的患者在所有乳腺癌分型中均表现出更低的无病生存期(DFS)和总体生存期(OS)(图7C–7F)。多因素回归分析进一步证实,ErbB4⁺ crExos水平是患有NAFLD的乳腺癌患者生存率的独立预后指标。综上所述,这些研究结果表明,血浆中ErbB4⁺ crExos可作为一种潜在的无创性预后生物标志物,用于评估患有NAFLD的乳腺癌患者的疾病进展与生存预后。
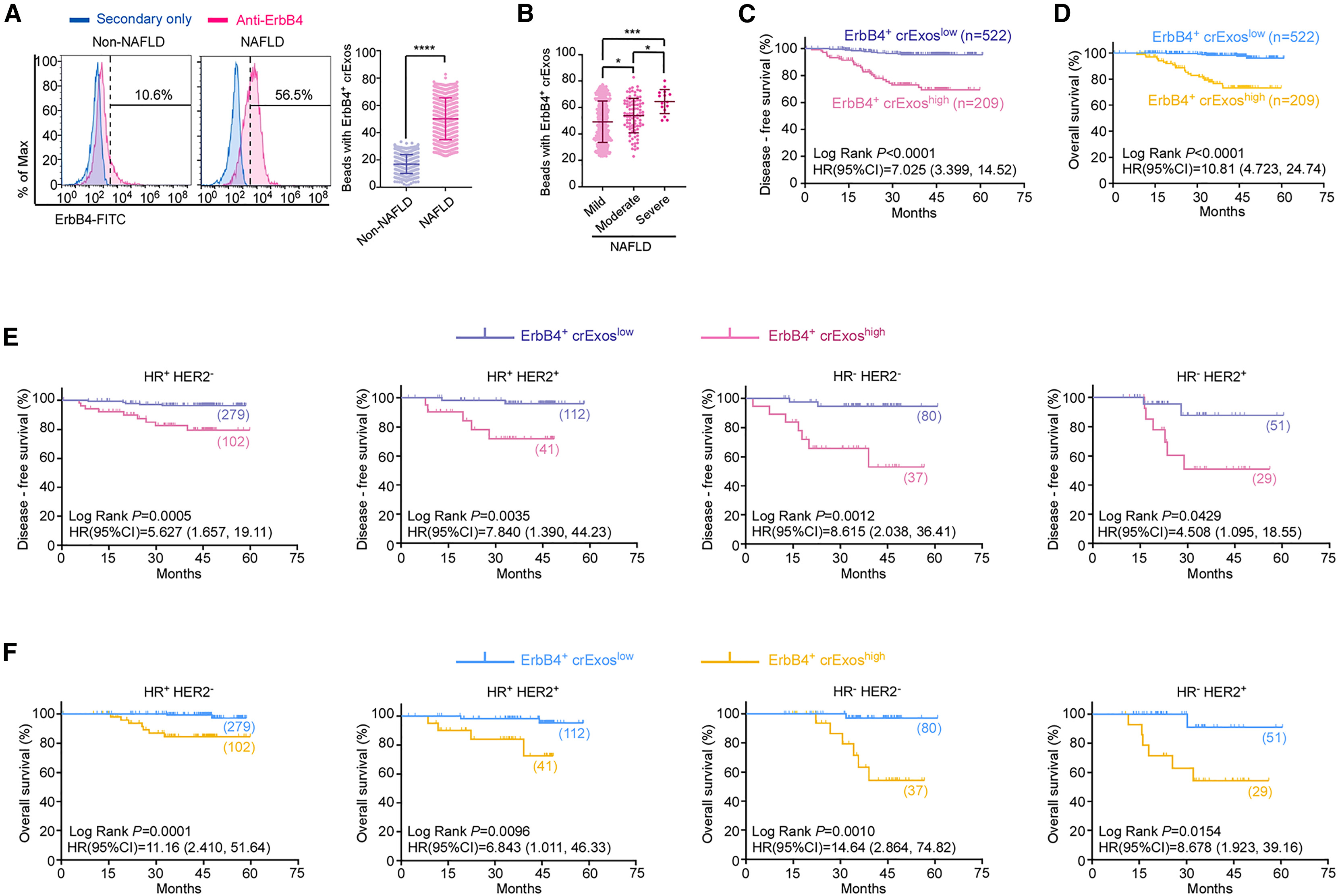
图7. ErbB4⁺外泌体可预测伴有NAFLD的乳腺癌患者的预后
总结
本研究揭示了脂肪肝与乳腺癌之间存在代谢性远程通讯机制:脂肪肝细胞分泌的ErbB4⁺外泌体特异性靶向乳腺脂肪细胞,经TRMT10C介导的线粒体m¹A修饰,上调ROS与IL-6水平,激活CGI-58–ATGL通路促进脂解和FFA释放,从而形成促肿瘤微环境。血浆ErbB4⁺外泌体可作为患有NAFLD的乳腺癌患者的潜在预后生物标志物。
原文链接:https://www.sciencedirect.com/science/article/pii/S1550413125003857?via%3Dihub
8
https://blog.sciencenet.cn/blog-3483272-1511568.html
上一篇:Nature:哺乳动物整合应激反应的B面人生
下一篇:Nature Metabolism:线粒体应激转变脂肪身份