博文
应该提出“负抗原”的新概念?
|
大脑髓鞘蛋白的片段训练T细胞抵御自身免疫攻击
生物体系是一种稳态系统,稳态的产生需要负反馈调节,这种系统一定存在加速和减速控制系统。在生物体系,这种加速和减速机制往往是多层次多维度的,既有快速控制,也有慢速控制。血压,体温,血糖,心率等都是在多种控制机制下的最终表现。免疫系统也存在类似机制,我们过去知道有免疫激活因子,也有免疫抑制因子。即使同一细胞如巨噬细胞也通过极化调节产生M1M2两类细胞,分别具有促进炎症和抑制炎症的作用。最新这一研究则发现另外一个维度的免疫调节模式,即所谓抗原也有抑制炎症反应的情况,这是脑内神经髓鞘蛋白的结构,我不了解是否这种现象在外周其他组织也有发现,但我认为这绝对不是特例,应该普遍存在。这种具有抑制炎症的抗原,将给未来解决炎症这一重要病理核心基础带来重要影响。就是通过分子层面的免疫调节治疗某些自身免疫疾病。只需要用某些抗原给人进行免疫,类似疫苗一样,就可以实现控制疾病的目的。当然这也是一种生物核心现象的发现,抗原的含义也将有新的内涵。这种能抑制免疫反应的抗原,是否应该成为负抗原?
研究发现,大脑中髓鞘蛋白的肽段帮助免疫系统的T细胞抑制自身免疫反应,这可能为开发炎症性脑疾病的疗法铺平道路。
德国免疫学家保罗·埃利希1提出的“Horror autotoxicus”(自体毒性恐怖)一词,描述了当免疫系统从保护我们免受微生物和癌症侵害转变为攻击健康组织时发生的严重后果。当免疫细胞入侵大脑,引发炎症并最终破坏复杂且脆弱的局部组织时,这种攻击变得尤为“可怕”。Kim等人在《自然》杂志上发表文章2,描述了一个此前被忽视的过程,该过程有助于将自身免疫性脑病保持在最低限度。
作者研究了一系列来自与大脑相关组织的肽段,这些肽段(抗原)如果被免疫细胞识别,可能会触发免疫反应。Kim和同事发现了一组抗原,它们使免疫系统中的大脑自身反应性T细胞沉默而非激活(图1)。作者推测,这些抑制性交互作用不仅保护了健康人的神经组织,还可能导致炎症性脑疾病的治疗。
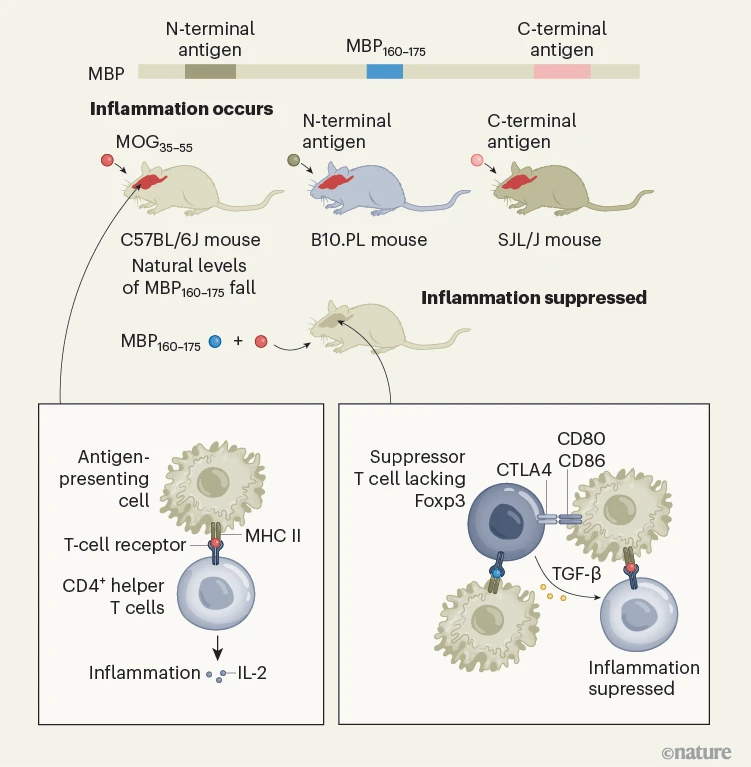
图1 | 一个抑制大脑自身免疫的系统。被称为CD4+辅助T细胞的免疫细胞可以通过它们的T细胞受体识别特定的肽片段,称为抗原。抗原结合到II型主要组织相容性复合物(MHC II)蛋白上,后者位于被称为抗原呈递细胞的免疫细胞表面。当针对抗原MOG35–55特异的CD4+辅助T细胞在C57BL/6J小鼠中识别它时,细胞释放分子IL-2,触发炎症和自身免疫(红色大脑)。Kim等人2发现,来自大脑蛋白MBP的一个抗原MBP160–175可以在这些小鼠接受MOG35−55时防止炎症。然而,仅给予MOG35–55抗原时,现有的MBP160–175抗原水平下降,阻止其抑制炎症。当作者给C57BL/6J小鼠MBP160–175和MOG35–55抗原时,MBP160–175抑制了炎症。MBP160–175被一种不表达蛋白质Foxp3的免疫细胞类型称为抑制性T细胞所识别。这种抑制性T细胞通过表达与抗原呈递细胞上的CD80和CD86受体结合的蛋白CTLA4以及释放分子TGF-β来减弱炎症。不同的小鼠品系对不同MBP抗原的反应各不相同。在B10.PL品系的小鼠中,MBP的一个区域(N端抗原)驱动炎症,而在SJL/J品系的小鼠中,MBP的不同片段(C端抗原)发生炎症。在这些由MBP引起的炎症模型中,MBP160–175的作用尚不清楚。
Kim及其同事开始绘制大脑免疫“景观”,正如免疫细胞称为CD4+辅助T细胞所遇到的一样,这是已知包括可能具有自身免疫侵略性的侵入大脑的T细胞亚群,可以针对自身的组织。作者通过检查与主要组织相容性复合物(MHC)II类蛋白结合在称为抗原呈递细胞的细胞表面的特定自身抗原肽片段来识别特定的自身抗原。Kim等人收集了未处理小鼠的大脑(脑实质和软脑膜组织)以及与大脑相连的组织(硬脑膜和引流深颈淋巴结)3中的携带MHC II类蛋白的细胞。使用一套复杂的提取和蛋白质测序方法,附着在MHC II类蛋白上的肽段——那些被特定T细胞受体识别的结构——被编目并按组织来源和功能属性进行分类。
值得注意的是,一组主要的肽段来源于蛋白质MBP,该蛋白存在于包裹神经元并隔离电活动神经过程(称为轴突)的髓鞘膜中。MBP肽段在蛋白质的两个片段上聚集,并且在大脑及与大脑相关的组织中发现,但在与大脑不相连的淋巴组织中未发现。
这些MBP肽段中有导致自身免疫反应的吗?MBP蛋白在测试的小鼠品系(C57BL/6J)中不引起自身免疫,并且不出所料,包括一个称为MBP160−175的代表性肽段,在主动免疫后的大脑炎症模型——实验性自身免疫性脑脊髓炎(EAE)中基本上未能诱导症状。实际上,这个肽段在大脑引流(深颈)淋巴结中显著减少了免疫活性。确实,MBP160−175在两个已建立的EAE模型中充当了炎症抑制剂。将通常促进炎症的MOG35−55肽段与MBP160−175一同免疫C57BL/6J小鼠,显著减轻了疾病迹象(图1)。在另一种EAE模型中也观察到类似的缓解作用,即用不同的髓鞘蛋白PLP免疫的SJL/J小鼠。这种自身免疫抑制被MBP160−175的化学修饰所抵消。
MBP160−175干扰了针对MOG肽段的CD4+辅助T细胞(也称为Th细胞)在疾病迹象出现前激活。对从免疫部位引流的淋巴结取样进行的基因表达分析显示,称为调节性CD4+ T细胞(也称为Tregs)的免疫细胞池增加。
此外,后来,第二种不同的调节性T细胞类型随着EAE在中枢神经系统和大脑引流的深颈淋巴结中的发作而出现。这些细胞表达了免疫抑制基因,包括编码CTLA4和TGF-β的基因,但缺乏Foxp3蛋白的表达,这是Tregs细胞的经典标志。这些抑制性T细胞是针对髓鞘特异性的还是非特异性旁观者?一种专门结合其匹配T细胞受体的诊断性MBP肽特异性荧光剂将这些缺乏Foxp3的抑制性细胞标记为MBP特异性。
作者令人信服地鉴定了一个引发抑制性而非自体攻击性T细胞反应的MBP抗原。但应当注意,这个特定的小鼠品系(C57BL/6J)是一个特例。与其他近交系的大鼠和小鼠相比,C57BL/6J对MBP的自身免疫具有抵抗力。在对MBP有反应的品系中,如SJL/J小鼠,在用炎症性MBP抗原如C端MBP免疫后,类似的抑制性肽段也会起作用吗?(图1)?MBP160−175也在SJL/J小鼠中发现,尽管只是作为其他肽段广泛谱中的一个次要成分。
另一个值得考虑的例子是,与C57BL/6J品系相同的小鼠对MBP的反应,除了具有不同类型的MHC。例如,B10.PL小鼠,它们具有H-2u型MHC而不是C57BL/6J小鼠中的H-2b型,在用MBP抗原(N端抗原)免疫后容易发展成EAE——这与Kim及其同事测试的抗原不同。在这些小鼠中,自然存在的MBP160−175如何被克服?
每当神经免疫学家在EAE模型中发现某种现象时,他们都会探索将其转化为人类自身免疫性脑病治疗的方法。当Kim及其同事继续绘制正在进行MOG诱导的EAE小鼠的MBP肽段图谱时,这一前景获得了动力。作者注意到,与非炎症组织相比,在发炎的中枢神经系统相关组织中,包括MBP160−175在内的抑制性肽段大量丢失。Kim等人提出,这可能是由于炎症性髓样细胞的入侵。这些入侵的髓样细胞用于蛋白质切割的机制(蛋白酶)与常驻细胞明显不同,因此在将MBP切割成抗原时会产生不同的切割模式。
这种抑制性肽段的丢失是否助长了大脑炎症,补充丢失的肽段是否会减轻持续的疾病?因此,抑制性肽段是否提供了一种半特异性治疗的基础,作为自身免疫疾病治疗的试验?为了尝试治疗性地补偿抑制性MBP160–175的丢失,Kim及其同事研究了给正在发展MOG诱导的EAE的C57BL/6J小鼠施用MBP160–175的效果。
作者使用由小鼠免疫细胞称为树突状细胞分泌的纳米囊泡将肽段输送到发炎的中枢神经系统。纳米囊泡可以轻易穿过包括细胞屏障在内的细胞膜,并且当装载小分子时,它们会将货物沉积在最终目的地。Kim及其同事直接将装有MBP160–175的纳米囊泡注入充满大脑脑池的脑脊液中,从而绕过血脑屏障。这种治疗显著缓解了EAE,并增强了缺乏Foxp3的T抑制细胞群体的增殖和持久性,而对经典Tregs没有影响。
针对大脑自身免疫性疾病的抗原特异性治疗——一种去除致病因子但不影响其余免疫系统的治疗方法,长期以来一直是临床神经学的关键目标。不幸的是,以往针对多发性硬化症自我抗原特异性免疫细胞的策略令人失望。实际上,对于这些致病免疫反应的自我抗原或抗原并没有通用的目标。在患有多发性硬化症的人中很容易找到MBP特异性T细胞,但在健康个体中也能找到它们。中枢神经系统的少数其他蛋白质与多发性硬化症有关,但这些仅限于一小部分多发性硬化症患者。
然而,Kim及其同事提出的使用MBP衍生的抑制性肽段的方法,可能会为新的调查提供新动力。通过治疗来抑制由与MBP无关的自身抗原MOG和PLP触发的EAE,可能会克服多发性硬化症中以往自我抗原特异性治疗的一个主要问题——不了解致病目标自身抗原。然而,将描述的EAE模型小鼠中的疗法直接转化为临床应用是不现实的。向大脑输注载有肽段的纳米囊泡在伦理和实际操作上存在问题。需要考虑的副作用包括治疗相关的感染引入和通过肽介导的免疫抑制“唤醒”休眠的致病因子。后者在使用抗体那他珠单抗的治疗中发生过。
Kim及其同事这项吸引人的研究将引起神经免疫学家的兴趣并激发辩论。它将复兴免疫系统在健康身体中的有益作用的概念,这是由先驱性的免疫全息理论预测的。该理论提出,器官特异性自身抗原的宇宙反映在免疫细胞库中,并且自身反应性免疫细胞可能引发保护而非攻击具有相应抗原的细胞的免疫反应。显然,Kim及其同事的工作将加深对中枢神经系统免疫反应性的理解。然而,通往临床应用的道路可能是漫长而曲折的。
https://blog.sciencenet.cn/blog-41174-1462983.html
上一篇:肝脏将果糖转化为脂质以供肿瘤生长
下一篇:应激如何导致快感丧失?