博文
《自然—光子学》:程继新团队发明高分辨深穿透短波红外光热显微镜
|
美国波士顿大学程继新课题组发明了短波红外光热显微镜。该技术实现了同时具有毫米穿透深度和微米空间分辨率的化学键振动成像,成功拍摄到深层生物组织内的高分辨脂质信息,为无创伤精准医学诊断提供了新的途径。
北京时间2024年6月25日17时,该成果以“Millimeter-deep micrometer-resolution vibrational imaging by shortwave infrared photothermal microscopy”为题发表于Nature Photonics。博士生倪虹丽和博士后袁玉昊为文章的共同第一作者。

在完整组织中探测细胞活动和功能对于癌症病理学和药物发现等生物医学应用至关重要。振动显微镜通过提供营养物质、代谢产物和其他生物分子的化学对比度来研究细胞功能。然而,目前振动显微镜的成像深度不足以在不改变样品的情况下分析出完好的类器官或组织中的化学成分。具体而言,基于红外光谱的方法受限于水的强吸收,穿透深度被限制在数十微米内。自发或相干拉曼显微镜使用可见光或近红外激发,但该波段组织散射较强,成像深度同样被限制在约100微米。
通过探测漫反射光子,空间偏移拉曼光谱和自发拉曼断层扫描可以获取超过毫米深度的化学信息。然而,这些方法的空间分辨率在毫米级,并不能够监测细胞级别大小的化学信息。短波红外(波长从1000到2000纳米)为深层组织成像打开了一个新的窗口,与可见光相比,其组织中的散射更弱,与中红外相比,其水吸收更低。重要的是,分子振动基频的倍频信号正位于此窗口中,让深层振动成像成为可能。
各种短波红外模式中,漫射光学断层扫描可以在毫米级深度成像,但空间分辨率为毫米级。光声成像因声波在组织中弱散射而实现更高的空间分辨率。短波红外光声显微镜能够对动脉组织和果蝇胚胎中的脂质进行振动成像。在短波红外光声显微镜中,因换能器放置于离信号源一定距离之外,声信号在传播过程中的损失降低了检测灵敏度,并导致其只能检测数十微米的目标。此外,声耦合使光路设计复杂化,让其不适用于如患者伤口之类的对接触敏感的样品。光学探测光声显微镜可远程感测目标,其激发波长已涵盖短波红外窗口。然而,光声远程感测的灵敏度不足以进行亚细胞化学成像。
近日,波士顿大学程继新课题组发明了短波红外光热(SWIP)显微镜用于亚细胞分辨率和毫米深度的组织成像。通过光学感测直接来自光吸收点的折射率变化,SWIP避免了传播过程中的信号损失,消除了样品接触的必要性。通过泵浦探测方案,SWIP在强散射介质中达到了亚细胞空间分辨率和毫米级成像深度,即使透过800微米厚的散射假体依然能成像单个1微米的聚苯乙烯(PS)小球。此外,光热衰减信号能够在时间上区分周围介质背景从而检测到小物体。凭借这些进展,研究员展示了完整肿瘤球、厚动物组织切片和人类乳腺活检中的细胞内脂质的SWIP三维成像。
1.SWIP显微镜
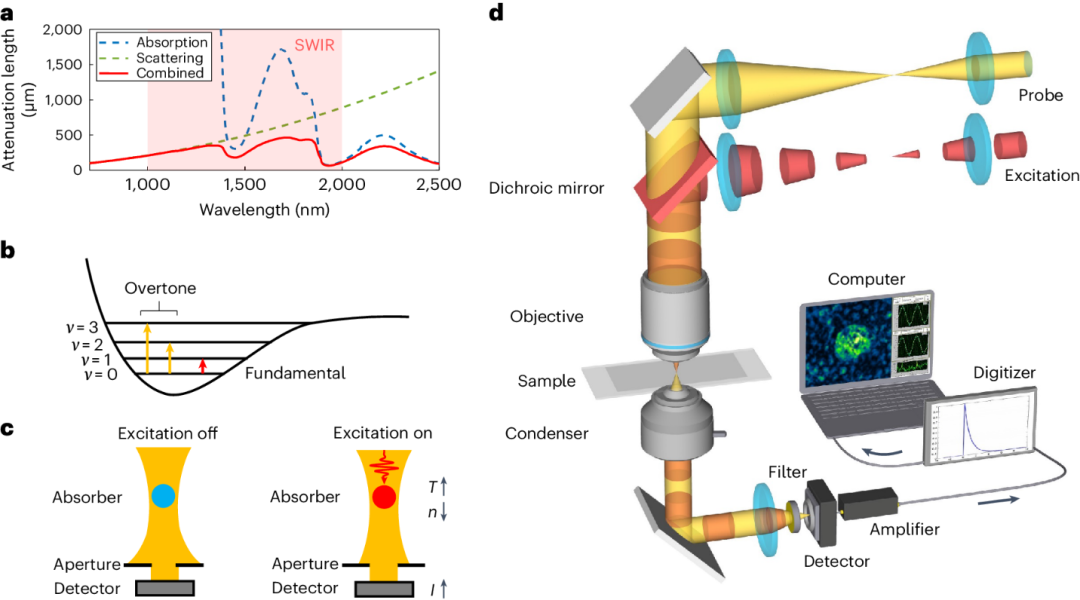
图1. SWIP显微镜原理和示意图。(a) 根据水吸收和脑组织散射系数计算的脑组织中波长依赖的衰减长度。(b) 倍频吸收能量图。(c) 光热对比度的原理。(d) 短波红外光热显微镜示意图。
如图1所示的泵浦探测显微镜,SWIP使用1725纳米脉冲激光用于泵浦碳氢键振动的二倍频吸收和1310纳米连续激光用于探测。泵浦光和探测光合束聚焦到样品上以测得吸收引起的光热效应,即SWIP信号。其原理为热调制的折射率形成一个微透镜,进而改变探测激光的传播,随后通过改变收光镜内光圈大小收集被调制的光强。
2. SWIP显微镜的空间分辨率、化学选择性及成像深度

图2. SWIP显微镜性能。(a, b) 单个500纳米PS小球SWIP三维图像的横向和轴向截面。比例尺:1微米。(c, d) 单个500纳米PS小球对应(a, b)中虚线的横向和轴向轮廓。(e) 二甲基亚砜、脂质、蛋白质和DNA的SWIP光谱。(f) SWIP信号对激发功率的依赖性。(g) SWIP信号的浓度依赖性。(h) 透过散射假体成像的示意图。(i) SWIP在不同散射介质中对1.0微米PS小球成像的结果。比例尺:10微米。(j) SRS在不同散射介质中对1.0微米PS小球成像的结果。比例尺:10微米。(k) (i)中红色虚线指示的单个1.0微米PS小球的横向轮廓。(l) (j)中红色虚线指示的单个1.0微米PS小球的横向轮廓。
如图2所示,研究者使用SWIP显微镜成像单个500纳米小球,提示SWIP的高灵敏度。系统的横向和轴向分辨率分别为0.77微米和3.5微米。这样的分辨率足以解析亚细胞特征。SWIP光谱与文献中报道的短波红外吸收光谱相符,表明SWIP具有化学选择性。SWIP信号对激发功率和分子浓度呈现出线性依赖性。这些数据表明SWIP显微镜具有良好的灵敏度和线性分析能力。通过散射假体,研究者表征了SWIP显微镜的深度穿透和高分辨率成像能力。相比之下,使用相同条件的近红外受激拉曼(SRS)成像,SRS图像质量迅速下降。
3. SWIP在完整肿瘤球中的脂质成像
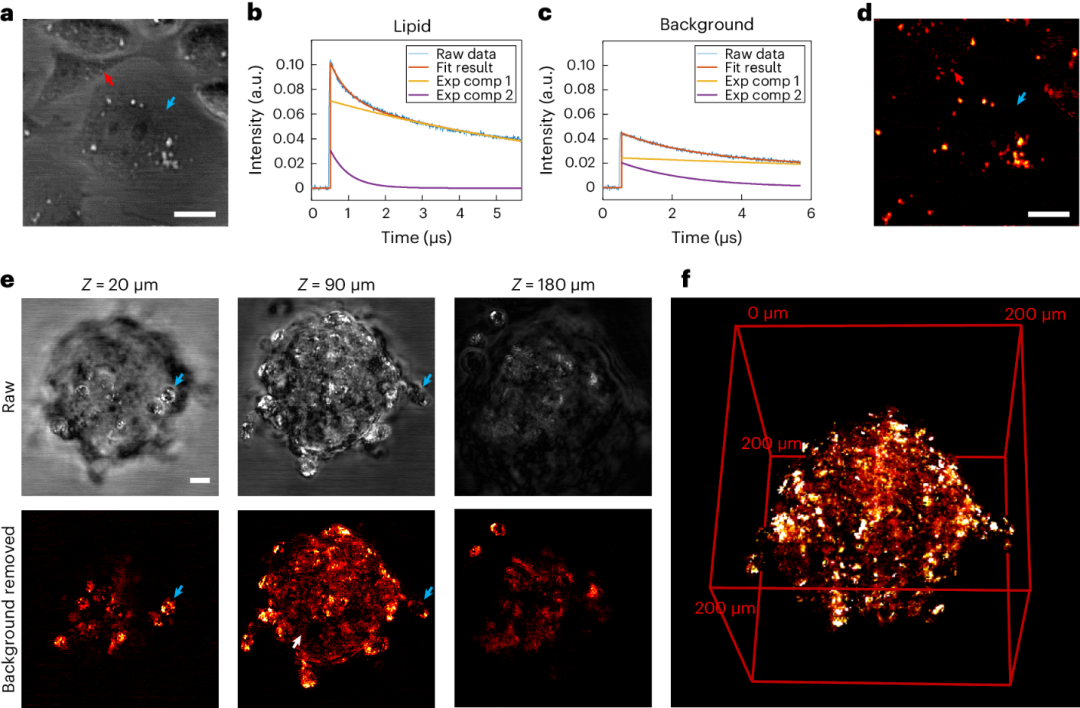
图3. SWIP成像癌细胞和肿瘤球。(a) 单层细胞的原始SWIP图像。(b) 红色箭头指示的脂质区域的单像素SWIP信号轨迹。(c) 蓝色箭头指示的背景区域的单像素SWIP信号轨迹。(d) 使用热衰减特性对(a)去除背景的结果。(e) 不同层的肿瘤球SWIP成像。比例尺:20微米。(f) 背景去除后的肿瘤球的SWIP三维成像。
肿瘤球是比二维细胞培养更好的再现肿瘤生理的体外癌症模型。由于癌症的发展与脂质代谢的改变密切相关,细胞内脂质的成像有助于理解癌症进展和测试药物的有效性。然而,由于细胞密集排列导致的强散射,成像球内细胞成分十分具有挑战性。为了克服强散射问题,传统振动成像方法通常采取切片或组织透明化技术。然而,这些方法改变了球体的代谢状态,无法用于活体样品研究。深度穿透的多光子或光片荧光显微镜可以对活体球体进行成像,但荧光标记对脂质小分子有明显干扰。
SWIP克服了上述挑战。研究者首先验证了SWIP在单层细胞中的化学对比度。SWIP能很好地反映细胞内脂质分布,并能显示细胞的形态。利用脂质和散射背景的不同热衰减系数,图中的水背景能被去除,从而增强了细胞内脂质的对比度。研究者展示了SWIP能成像一个直径约200微米的完整肿瘤球。
4. SWIP在生物组织中的脂质成像
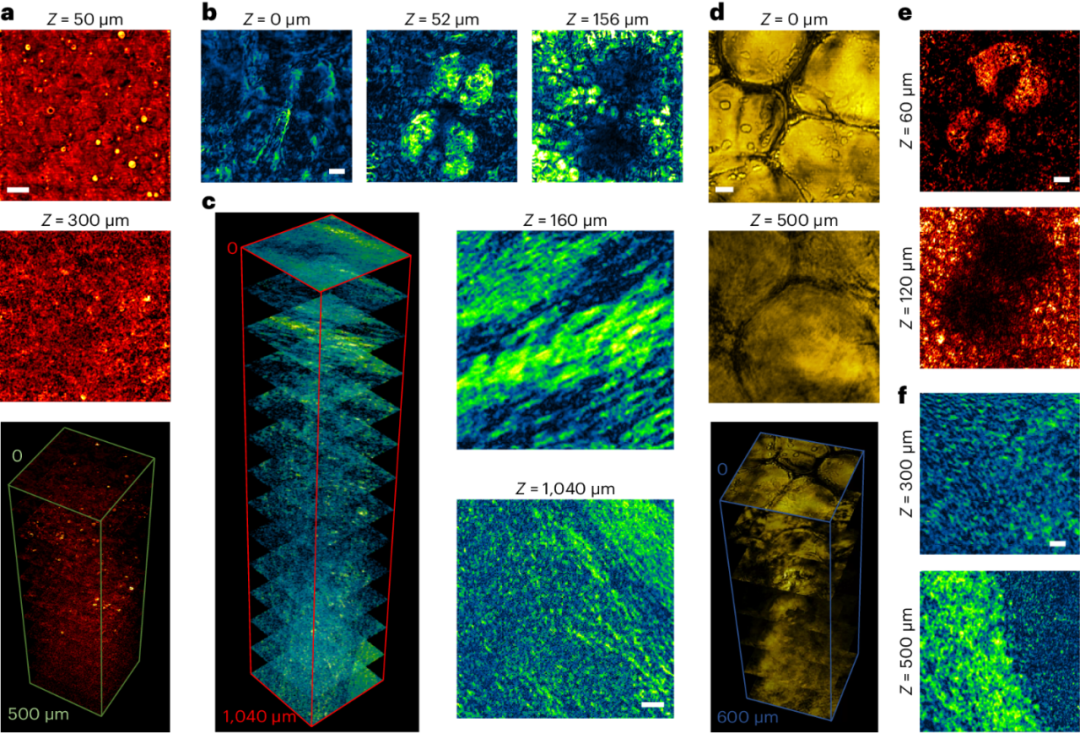
图4. SWIP检测生物组织中脂质。(a) 新鲜猪肝切片的SWIP成像。(b) 小鼠耳朵的SWIP成像。(c) 小鼠大脑切片的SWIP成像。(d) 健康人类乳腺活检的SWIP成像。(e)小鼠耳朵的背向探测SWIP成像。(f)小鼠大脑的背向探测SWIP成像。比例尺:20微米。
脂质在生物组织中起着重要作用,包括能量存储、信号传递和脂溶性营养物质的运输。成像组织内部的脂质含量及其分布使得各种应用成为可能。由于荧光标记对脂质分子有扰动,振动成像被广泛用于脂质研究。然而,目前的振动成像技术无法在深层组织中实现高分辨率脂质成像。通常通过组织切片进行高分辨率的逐层成像,但切片过程通常会引入形态学伪影并导致脂质丢失。
研究者展示SWIP在各种类型组织中的脂质成像。包括新鲜的猪肝切片,小鼠耳朵,小鼠大脑和健康人的乳腺活检。即使在富含血液的新鲜肝脏中,SWIP也能够分辨出小至1.0微米的脂肪滴。通过对小鼠大脑成像,SWIP成功探测到深达一毫米的微小脂类信号。这些深层组织的微小信号无法通过现有技术实现。研究者还展示了背向探测的SWIP成像结果,表明在体SWIP成像是可以实现的。
5. SWIP与现有的振动成像方法的对比
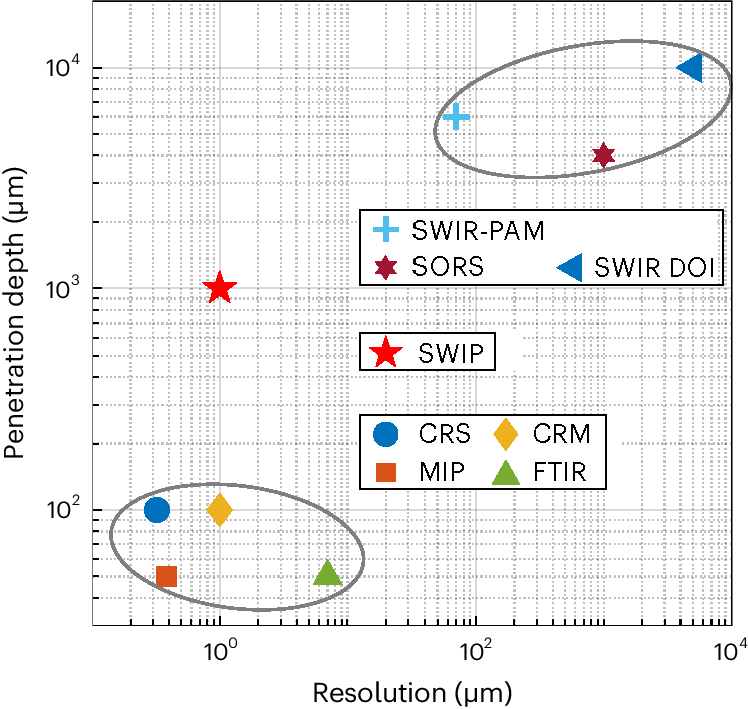
图5. 振动成像方法的穿透深度与空间分辨率比较。CRS:相干拉曼散射,MIP:中红外光热成像,CRM:共聚焦拉曼显微镜,FTIR:傅里叶变换红外光谱,SWIR PAM:短波红外光声显微镜,SWIR DOI:短波红外漫射光学成像,SORS:空间偏移拉曼光谱,SWIP:短波红外光热成像。
SWIP与现有振动成像技术在穿透深度和空间分辨率上的比较如图5所示。这些技术可以分为三组。第一组(左下方)具有亚细胞分辨率和灵敏度,但成像深度有限,最多为100微米。第二组(右上方)具有较深的穿透深度,但空间分辨率相对较差,最佳情况下为数百微米。尽管短波红外光声显微镜可以通过更好的光学聚焦实现更高的空间分辨率,但由于信号损失大,导致其检测灵敏度低,进而限制了其对细胞内小成分的探测。显然,振动成像在深穿透深度和亚细胞分辨率之间存在一个空白。该研究表明,SWIP成功填补了这一空白。SWIP提供的毫米深度、微米空间分辨率、高灵敏度振动成像能力为许多应用提供机会,包括活体类器官研究、无切片组织病理学、动态胚胎成像等。
相关论文信息:
https://www.nature.com/articles/s41566-024-01463-6
编辑 |张可
排版|夏天
欲知更多内容,敬请围观小柯机器人频道:http://paper.sciencenet.cn/AInews/

“小柯物理”是“小柯”系列学术公众号之一,主要介绍物理领域顶级学术期刊最新论文信息。“小柯”是一个科学新闻写作机器人,由中国科学报社联合北大团队研发而成。新闻由“小柯”独立完成,经领域专家和科学编辑双重人工审校。
https://blog.sciencenet.cn/blog-3607469-1439793.html
上一篇:《自然》:李听昕/刘晓雪/吴冯成课题组首次在单晶石墨烯中观测到电子掺杂下的超导态
下一篇:《自然》:中国科学院近代物理研究所仇浩团队发现迄今最重反物质超核